Uma meta-análise de metronidazol e vancomicina para o tratamento da infecção por Clostridium difficile, estratificada pela gravidade da doença | The Brazilian Journal of Infectious Diseases
On Janeiro 20, 2022 by adminIntrodução
Infecção por Clostridium difficile (CDI) é prevalente no ambiente de saúde em todo o mundo desenvolvido1 e pode resultar em sérias complicações, maior permanência hospitalar e custos médicos adicionais.2 Houve um aumento acentuado na incidência e na taxa de mortalidade por CDI na Europa, Canadá e Estados Unidos durante os últimos 15 anos. O aumento foi atribuído principalmente ao surgimento de uma nova cepa hipervirulenta de BI/NAP1/027, que surgiu em 2003 na América do Norte e em 2005 na Europa, respectivamente. Os dados de 28 hospitais comunitários no sul dos Estados Unidos sugeriram que C. difficile tinha substituído o Staphylococcus aureus resistente à meticilina como a etiologia mais comum das infecções associadas aos cuidados de saúde.3 Metronidazol e vancomicina são os antibióticos mais comumente usados para o CDI, que historicamente se pensava serem semelhantes em eficácia.4,5 Em 1995, os Centros de Controle e Prevenção de Doenças dos Estados Unidos recomendaram a redução do uso da vancomicina em hospitais, pois ela poderia contribuir para aumentar a prevalência de Enterococcus resistente à vancomicina (VRE).6 Desde então, o metronidazol era comumente usado como tratamento de primeira linha para o CDI. Com o surgimento e prevalência da estirpe hipervirulenta de C. difficile (BI/NAP1/027), as infecções tornaram-se mais graves e a comparação do metronidazol e da vancomicina foi reavaliada,7,8 especialmente quando usado no tratamento de pacientes com CDI grave. Zar et al. realizaram o primeiro estudo prospectivo, randomizado, duplo-cego, controlado por placebo e de centro único, comparando metronidazol e vancomicina para CDI. Os resultados mostraram que metronidazol e vancomicina foram igualmente eficazes, mas a vancomicina foi superior para pacientes com CDI grave.9 Seus achados foram de enorme importância e fizeram sugestões para atualizar as diretrizes da prática clínica. A orientação recomendou que o metronidazol fosse utilizado para CDI leve a moderado e a vancomicina para CDI grave, o que foi determinado pela gravidade dos sintomas.10-13 Entretanto, em um estudo de Zar et al, 22 participantes foram excluídos da análise e pela análise rigorosa do ITT de todos os 82 pacientes com doença grave aleatoriamente atribuídos, a taxa de cura inicial não foi significativamente diferente entre vancomicina e metronidazol (79% vs. 66%, p=0,22).3,14 Em seguida, Le et al. relataram maior taxa de resposta clínica em pacientes com doença grave com vancomicina, mas apenas uma minoria de pacientes tinha recebido vancomicina (n=8).15 Recentemente, Johnson et al. relataram taxas semelhantes de sucesso clínico em pacientes com CDI grave em pacientes tratados com vancomicina ou metronidazol, mas o metronidazol foi inferior à vancomicina para todos os pacientes com CDI.16 Além disso, Pepin et al. sugeriram que a perda de superioridade da vancomicina sobre o metronidazol coincidiu com o surgimento do NAP1/027.17 Portanto, realizamos uma meta-análise estratificando os pacientes de acordo com a gravidade da doença, para investigar a eficácia do metronidazol em relação à vancomicina e para investigar qual agente era superior para o tratamento de doenças leves ou graves.
Materiais e métodosFontes de dados
Uma pesquisa sistemática da literatura em MEDLINE via Pubmed (1978 a 31 de outubro de 2014), Embase (1978 a 31 de outubro de 2014) e o Registro Central de Ensaios Controlados da Cochrane (Cochrane library) foi conduzida para identificar os estudos relevantes. Os principais termos de pesquisa foram “metronidazol e vancomicina e clostridium difficile”; “metronidazol e vancomicina e colite pseudomembranosa”; “metronidazol e vancomicina e diarréia associada a antibióticos”. Todas as referências dos artigos inicialmente identificados, incluindo os artigos de revisão relevantes, foram pesquisadas e revistas à mão. Os resumos apresentados em conferências científicas que não estavam disponíveis para nós não foram pesquisados.
Seleção do estudo
Dois revisores (X.ZH.D e N.B.) pesquisaram independentemente os artigos e examinaram os estudos relevantes para avaliação posterior. Um estudo foi considerado elegível se fosse um TCR ou estudo de coorte prospectivo, se envolvesse pacientes adultos com CDI incluindo doença leve e/ou grave; se estudasse a segurança ou eficácia do metronidazol e da vancomicina; se relatasse dados específicos sobre cura clínica e microbiológica, mortalidade e eventos adversos. Foram incluídos estudos cegos ou não cegos e desenhos randomizados ou não randomizados. Estudos experimentais baseados em variáveis farmacocinéticas ou farmacodinâmicas foram excluídos. Estudos clínicos envolvendo terapia de combinação de fármacos também foram excluídos.
Avaliação qualitativa
Avaliação da qualidade metodológica dos TCR e estudos de coorte incluídos na meta-análise foram realizados independentemente por dois revisores (X.ZH.D e N.B.) de acordo com a lista de verificação desenvolvida por Downs e Black.18 Esta ferramenta avaliou tanto estudos randomizados quanto não randomizados, fornecendo tanto uma pontuação geral da qualidade do estudo quanto um perfil de pontuação para avaliar a qualidade do relato, validade externa, validade interna (viés, confuso) e poder. Estudos de alta qualidade obtiveram 15 ou mais pontos, enquanto estudos de baixa qualidade obtiveram 14 ou menos pontos.
Exploração de dados
Dois revisores extraíram dados independentemente de cada estudo com formulário de revisão pré-desenhado. Em caso de qualquer desacordo entre os dois revisores, um terceiro revisor extraiu os dados até chegar a um consenso. Os dados extraídos de cada estudo foram: (i) ano de publicação; (ii) população de pacientes; (iii) número de pacientes; (iv) agentes antimicrobianos e dosagens utilizadas; (v) resultados clínicos e microbiológicos; e (vi) mortalidade por todas as causas. Utilizamos a análise ITT, definida como incluindo todos os pacientes designados aleatoriamente.
Desfechos analisados
Cura clínica inicial, cura sustentada, cura microbiológica, recorrência e mortalidade por todas as causas foram utilizadas como medidas de desfecho para esta meta-análise. Utilizamos a definição de cura clínica inicial e recorrência relatada nos estudos individuais e registramos diferenças entre estudos. Os resultados também foram analisados com base nas seguintes populações: (i) todos os pacientes incluindo CDI leve e grave; (ii) pacientes com CDI leve; (iii) pacientes com CDI grave; e (iv) pacientes com colite pseudomembranosa (PMC).
Análises de dados e métodos estatísticos
Análises estatísticas foram feitas com o programa Review Manager, versão 5.2 (Cochrane Collaboration). A heterogeneidade entre os estudos foi avaliada pelo teste χ2 de heterogeneidade (p
0,05 foi definido para indicar heterogeneidade significativa) e a medida I2 de inconsistência. Taxas de risco combinadas (RRs) e intervalos de confiança (ICs) de 95% para resultados foram calculados pelo modelo de efeito fixo (MEF) se não houvesse heterogeneidade estatisticamente significativa entre os estudos incluídos. Caso contrário, seria utilizado o modelo de efeito aleatório (REM). As análises dos subgrupos foram realizadas com base na gravidade da doença. ResultadosEstudos clínicos selecionados
O fluxograma (Fig. 1) mostra o processo detalhado de triagem e seleção para os estudos incluídos nesta meta-análise. A pesquisa bibliográfica identificou 2945 resumos. Obtivemos 47 artigos completos para avaliação detalhada. Dos 41 estudos excluídos, três artigos foram excluídos por serem partes de RCTs já incluídos nesta meta-análise, um estudo foi excluído por ser um estudo farmacocinético,19 outros estudos foram excluídos por causa de diferentes desenhos de estudo, como falta de regime de controle, combinação com outros antibióticos,20,21 resultados diferentes,22 ou tipos diferentes de pacientes,23 etc. Assim, seis estudos foram incluídos nesta meta-análise: dois estudos de coorte15,24 e quatro RCTs.4,5,9,16
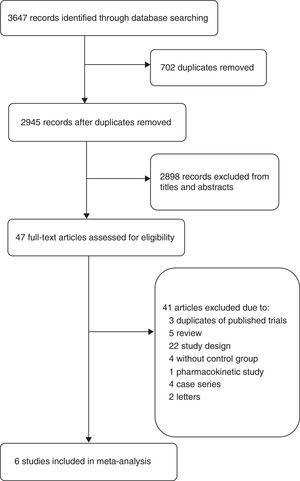
Digrama de estudos incluídos.
>
Características do estudo
As principais características dos estudos analisados são mostradas na Tabela 1. Os estudos incluídos foram de alta qualidade (dois RCTs tiveram pontuação de 23, dois de 20 e dois de coorte, pontuação de 17). Dois ECTs foram realizados utilizando desenhos randomizados, duplo-cegos e placebo-controlados,9,16 enquanto os outros dois utilizando apenas randomização.4,5 Três estudos foram realizados nos Estados Unidos,4,9,15 dois estudos foram realizados na Áustria,5,24 enquanto um único estudo, incluindo dois ECTs realizados nos Estados Unidos e na Europa, respectivamente.16 A definição de CDI, cura clínica inicial e recorrência são mostradas na Tabela 1 suplementar. A definição de CDI invariavelmente incluía um teste para toxina C. difficile, microorganismos ou PMC combinados com diarréia. Entretanto, as definições de diarréia variaram ligeiramente, mas a maioria dos estudos referiu-se à diarréia como fezes não formadas pelo menos três vezes em um período de 24h.5,9,15,16 Os resultados da cura clínica inicial e da recorrência foram relatados em todos os estudos com definições ligeiramente diferentes. Por exemplo, cinco estudos4,5,9,15,16 consideraram a cura clínica inicial se a diarréia fosse resolvida em 6-8 dias de tratamento, enquanto Zar9 e Wenisch5 incorporam um resultado negativo de uma medida de toxina C. difficile ou proteína C reativa. A maioria considerou recorrência quando os sintomas reapareceram e/ou os resultados dos testes microbiológicos positivos foram confirmados durante o seguimento de 21-30 dias após a resolução inicial dos sintomas.4,5,9,15,16 A cura sustentada foi definida como cura clínica na ausência de qualquer recorrência durante o seguimento, que foi calculada como cura clínica inicial menos as recorrências. A recuperação relatada por Wenisch24 foi considerada como cura sustentada. Os pacientes com CDI moderado no estudo de Johnson et al. foram considerados como doença grave, enquanto todos os pacientes incluídos no estudo de Wenisch et al. foram considerados como doença leve com base na avaliação da gravidade do CDI utilizada nos estudos de Zar9 e nas diretrizes.11 Além disso, Wenisch et al. não indicaram a alocação do tratamento de sete desistências de todos os grupos,5 Johnson et al. relataram que a análise incluiu todos os pacientes randomizados que receberam pelo menos uma dose de antibióticos e tiveram qualquer avaliação pós-dose,16 o que poderia ter influenciado os resultados do ITT.
Uma tabela suplementar relacionada a este artigo pode ser encontrada, na versão online, em http://dx.doi.org/10.1016/j.bjid.2015.03.006.
>Cura clínica inicial
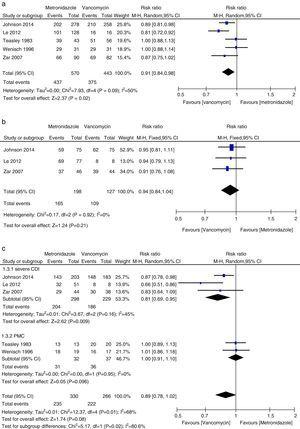
>
Análise das taxas iniciais de cura clínica comparando metronidazol e vancomicina para todos os CDI, CDI leve, CDI grave e PMC.
>
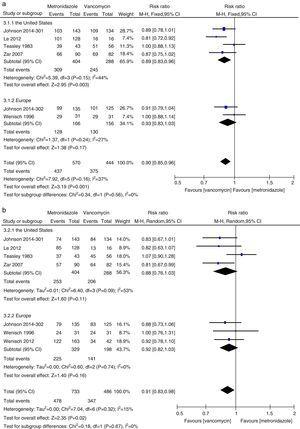
>
Análise da cura clínica inicial e taxas de cura sustentada comparando metronidazol com vancomicina para todos os pacientes com CDI dos Estados Unidos e Europa.
>
Cura sustentada Taxa de recorrência Cura microbiológica
Duas TCRs relevantes forneceram taxas de cura microbiológica, definidas como resultados negativos de cultura de fezes após tratamento e ensaio de citotoxina para C. difficile em pacientes tratados sem sintomas clínicos.4,5 Em relação à cura microbiológica, a terapia com metronidazol foi tão eficaz quanto a vancomicina (161 pacientes, FEM, RR=0,88, 95% CI=0,64-1,21, p=0,43, Fig. 6).

Análise de cura microbiológica comparando metronidazol com vancomicina para CDI.
>
> Taxa de mortalidade por todas as causas
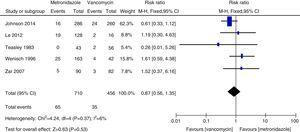
>
Análise da taxa de mortalidade por todas as causas comparando metronidazol com vancomicina para CDI.
>
Discussão
CDI é um problema sério no sistema de saúde com uma incidência crescente em todo o mundo que pode causar morbidade e mortalidade significativas.25 As taxas de mortalidade relatadas para pacientes com CDI grave variam de 9% a 25%; mais da metade dessas mortes está relacionada ao CDI.14,26 É especialmente importante tratar pacientes com CDI grave usando terapia antimicrobiana apropriada.
Nesta meta-análise descobrimos que a vancomicina era superior ao metronidazol em termos de cura clínica inicial e cura sustentada em pacientes com CDI. As taxas de cura microbiológica, foi numericamente menor com metronidazol do que com vancomicina, embora a diferença não tenha sido significativa. Os autores de um artigo de posição de 2011 em sua análise conjunta encontraram taxas equivalentes de cura clínica inicial com metronidazol e vancomicina, os agentes mais utilizados.27,28 Essa inconsistência se deveu principalmente aos diferentes estudos incluídos em cada revisão sistemática. Foram incluídos mais três estudos na meta-análise atual.15,16,24 Quando os dados foram analisados de acordo com a gravidade do CDI, o tratamento com vancomicina ou metronidazol não diferiu para pacientes com doença leve. Entretanto, a cura clínica e as taxas de cura sustentada com vancomicina em pacientes com CDI grave foi significativamente maior do que as taxas do grupo metronidazol. Encontramos evidências insuficientes de que a vancomicina e o metronidazol foram igualmente eficazes em pacientes com CMP, devido ao pequeno número de pacientes avaliados. O CDI tem sido utilizado como marcador de doença grave.12 Quando pacientes com CDI grave incluíam pacientes com CDI, não foi encontrada diferença significativa entre o metronidazol e a terapia com vancomicina. Embora não tenha sido observada diferença estatística, foi observada uma forte tendência a maiores taxas iniciais de cura clínica e de cura sustentada no grupo da vancomicina, enquanto que a mesma tendência foi observada para pacientes com CDI leve. Assim, para pacientes com CDI grave, a vancomicina foi superior ao metronidazol. Venugopal et al. demonstraram que pacientes com CDI grave eram mais propensos a mudar para vancomicina, sugerindo que estes pacientes estavam respondendo mal ao metronidazol.29 Estes resultados foram confirmados na meta-análise atual. Os resultados do tratamento com metronidazol foram pobres porque o fluxo sanguíneo para o cólon em pacientes com doença grave poderia ter diminuído, resultando em menos transudação do metronidazol para o lúmen.30,31 Além disso, a fidaxomicina foi recentemente aprovada para tratamento do CDI e pode ser usada como agente secundário em caso de falha com vancomicina ou metronidazol porque a fidaxomicina permaneceu detectável em amostras de fezes coletadas até cinco dias após uma dose única.32 Em um estudo de meta-análise, a fidaxomicina demonstrou taxas de cura clínica semelhantes à vancomicina, com diminuição significativa na taxa de recorrência em pacientes com CDI grave e não grave.33 Portanto, para o tratamento inicial de CDI grave, a vancomicina oral é a droga de primeira linha; Alternativamente, a fidaxomicina oral pode ser utilizada.
As taxas de recorrência de vancomicina e metronidazol foram, em geral, de acordo com dados anteriores e não foi encontrada diferença significativa.27,28 Entretanto, a vancomicina foi associada a taxas de recorrência menores que o metronidazol, tanto em todos os pacientes com CDI quanto naqueles com CDI grave. Nosso estudo sugere que a taxa de mortalidade por todas as causas não foi significativamente diferente entre vancomicina e metronidazol em todos os pacientes com CDI. A taxa de mortalidade por todas as causas de todos os pacientes com CDI foi de 100/1166 (8,5%), o que é inferior a um estudo europeu que mostra uma taxa de mortalidade para todos os casos de 101/455 (22%) após três meses.1
Os resultados da presente meta-análise devem ser vistos no contexto de potenciais limitações. Em primeiro lugar, a epidemiologia de C. difficile mudou rapidamente com uma grande proporção de casos graves e recorrentes ocorrendo nesses países do que os relatados anteriormente.1 Isso pode resultar em diferenças entre as populações estudadas. Em segundo lugar, novos métodos de diagnóstico de CDI surgiram durante a última década. A utilização de testes mais sensíveis e rápidos para o diagnóstico de CDI é fundamental para o manejo clínico dos pacientes. Embora os critérios diagnósticos não tenham sido tão rigorosos em alguns casos, a resposta ao tratamento não diferiu substancialmente dentro de um único regime medicamentoso ou entre medicamentos.4 Em terceiro lugar, como esta meta-análise incluiu um número relativamente pequeno de estudos, especialmente TCLE, a precisão das estimativas pode ter sido comprometida. Em quarto lugar, os investigadores não foram cegos à alocação do tratamento nos quatro estudos, o que pode ter introduzido um viés nos resultados relatados de eficácia. Quinto, a maioria dos estudos incluídos não garantiu que todos os casos de diarréia dos pacientes incluídos fossem causados por C. difficile, pois estes não excluíram a presença de outros patógenos nas fezes como causa de diarréia.4,5 Sexto, o escore de gravidade ainda não está suficientemente validado e científico e precisa melhorar não apenas para a padronização de estudos futuros, mas também para uso na prática clínica.27,34 Portanto, os resultados atuais precisam ser confirmados.
Em conclusão, apesar das limitações da meta-análise atual, estas análises indicam que a vancomicina oferece benefícios significativos no tratamento do CDI em comparação com o metronidazol. Os pacientes toleraram bem os dois medicamentos e as taxas de recidivas foram semelhantes. Para pacientes com CDI leve, a terapia com metronidazol foi tão clinicamente eficaz quanto a vancomicina; para pacientes com CDI grave, a vancomicina foi mais eficaz que o metronidazol. Esta diferença de eficácia foi mais evidente no subgrupo de CDI grave e apoiou as recomendações recentes para o uso da vancomicina como terapia de primeira linha para CDI grave.
Conflitos de interesse
Os autores declaram não haver conflitos de interesse.
Financiamento
Este estudo foi apoiado pelos Principais Projetos Especiais Nacionais de Ciência e Tecnologia para Novos Medicamentos (No. 2012ZX09303004) e pela Fundação Municipal de Ciências Naturais de Beijing (No. 7132168).
Deixe uma resposta