Reaktioner på bensylkarboner: Bromering och oxidering
On oktober 12, 2021 by adminKolet i anslutning till en aromatisk ring – bensylkarbonet – kan delta i flera användbara och intressanta reaktioner. Idag ska vi ge exempel och mekanismer för två viktiga exempel: bensylisk bromering och bensylisk oxidation. Här är en snabb sammanfattning:
Innehållsförteckning
- Alkylgrupper = ”Roughage”
- Det är något speciellt med alkylgrupper som gränsar till en bensenring
- ”Fenyl” vs ”Benzyl” : Vad är skillnaden?
- Benzylradikalerna stabiliseras av resonans; fenylradikalerna stabiliseras inte.
- Benzyliska (och allyliska) C-H-bindningar är svaga i förhållande till andra alkyl-C-H-bindningar
- Benzylisk brominering
- När fungerar inte ”benzylisk brominering”?
- Användningar av bensylisk brominering
- Bensylisk oxidation med KMnO4 (eller H2CrO4)
- Bensylisk oxidation kräver en bensylisk C-H-bindning
- Varför är detta viktigt?
- Noter
- Quiz Yourself!
- (Avancerad) Referenser och vidare läsning
Alkylgrupper = ”Grovfoder”
Inom näringslära är ”grovfoder” vad man kallar all cellulosa och alla fibrer som finns i livsmedel och som bara skjuter genom kroppen utan att faktiskt smältas.
Detta beskriver i stort sett alkylgruppernas beteende i de allra flesta av de reaktioner i organisk kemi som vi har lärt oss. Deras kemi är ”tråkig”. De kan utgöra molekylens ryggrad och övergripande struktur, men deras C-H-bindningar är inerta i de flesta reaktionsförhållanden.
Om man inte räknar med förbränning är faktiskt i stort sett den enda reaktion med alkylgrupper som vi behandlar i introduktionskursen i organisk kemi friradikal substitution. Och även den reaktionen tenderar att vara ganska oselektiv, särskilt om man har att göra med klorering med fria radikaler.
Vi har sett att ett undantag från detta ”tråkiga” beteende kan hittas i den fria radikala bromeringen av så kallade ”allyliska” C-H-bindningar . Den ”allyliska” positionen är ett kol som ligger intill en dubbelbindning (inte ett C-H på själva dubbelbindningen! det är ett ”vinylikt” C-H).
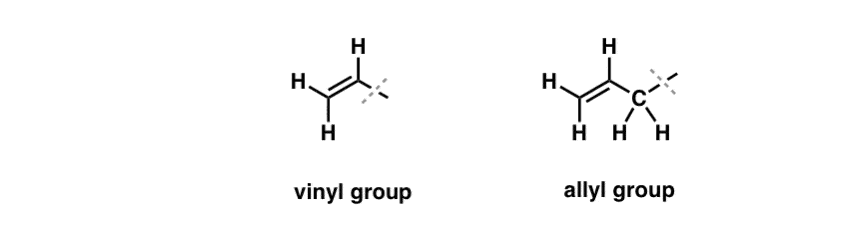
Vad gör den ”allyliska” positionen så speciell? Allyliska radikaler, karbokationer och anjoner är avsevärt stabiliserade genom resonans. Orbitalet hos den allyliska radikalen, karbokationen eller anjonen kan anpassa sig till p-orbitalerna i den intilliggande pi-bindningen, vilket resulterar i ett större ”pi-system” och sprider ut laddningen över ett större område.
Det är något speciellt med alkylgrupper intill en bensenring
Vad är anledningen till denna lilla resa i minnet? Tja, vi har nyligen ägnat en liten stund åt att gå igenom Friedel-Crafts alkyleringsreaktion, och jag vill inte ge dig intrycket att det är en syntetisk återvändsgränd att sätta en alkylgrupp på en bensenring.
Alkylgrupper behöver inte vara inerta! Liksom allyliska kolväten är alkylgrupper som gränsar till bensenringar särskilt reaktiva, och detta kan ha alla möjliga viktiga tillämpningar.
Det finns två viktiga reaktioner som vi kommer att behandla i det här inlägget:
- Bensylbromering – radikalbromering av alkylgruppen intill en aromatisk ring
- Bensyloxidation – fullständig oxidation av en alkylgrupp intill bensen till en karboxylsyra.
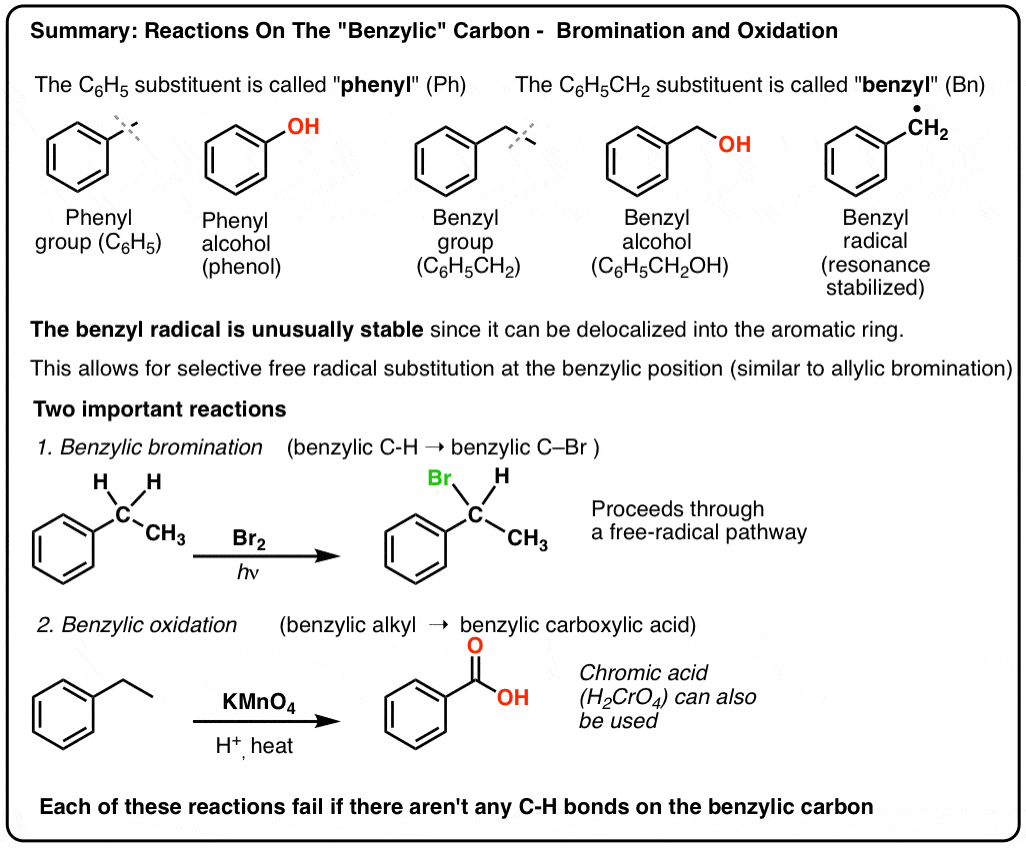
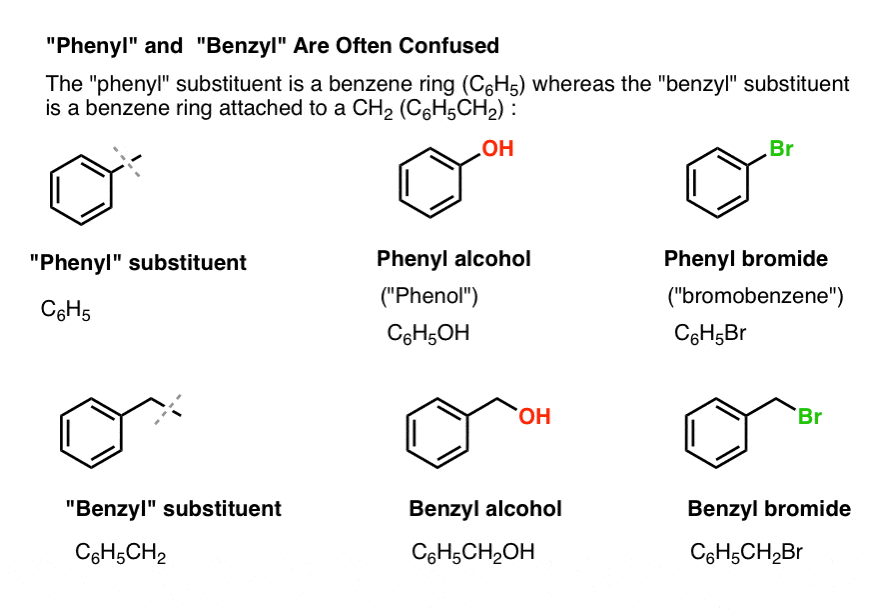
3. ”Fenyl” vs ”bensyl” : Vad är skillnaden?
Först en snabb fråga. Låt oss få bort en viktig nomenklatur, eftersom ”fenyl” och ”bensyl” orsakar en hel del förvirring:
- En fenylgrupp (eller fenylsubstituent) är bensen minus ett väte: C6H5 . Kolvätena i ringen är fenylkolväten, och de väteämnen som är knutna till fenylkolvätena är fenyl-C-H-bindningar. Det är analogt med vinyl (se ovan).
- En bensylgrupp är metylbensen minus ett väte: C6H5CH2 . Kolet som gränsar till ringen är bensylkolet, och de väteämnen som är knutna till bensylkolet kallas bensylväteämnen. Det är analogt med allyl (ovan).
4. Bensylradikalerna stabiliseras av resonans; fenylradikalerna är det inte.
Analogin mellan fenyl och vinyl och bensyl och allyl gäller även stabiliteten hos deras radikaler (liksom deras karbokationer och anjoner).
- Fenylradikaler stabiliseras inte av resonans, eftersom den orbital som innehåller radikalen står i rät vinkel mot pi-systemets orbitaler, och det finns ingen överlappning mellan dem. Radikaler på sp2-hybridiserade kolväten är i allmänhet mindre stabila än radikaler på alkylkolväten. (Se inlägg: Tre faktorer som destabiliserar fria radikaler )
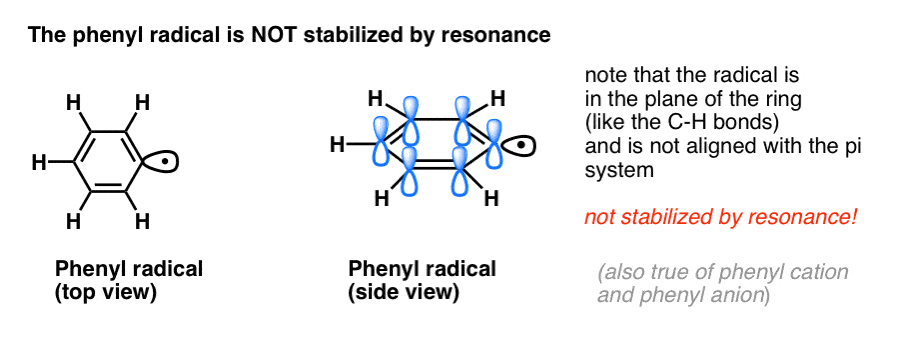
- Bensylradikaler är ovanligt stabila eftersom den orbital som innehåller radikalen kan ligga i linje med bensenringens pi-system, precis som hos deras allyliska kusiner (detta gäller även för bensylkatjoner och -anjoner).
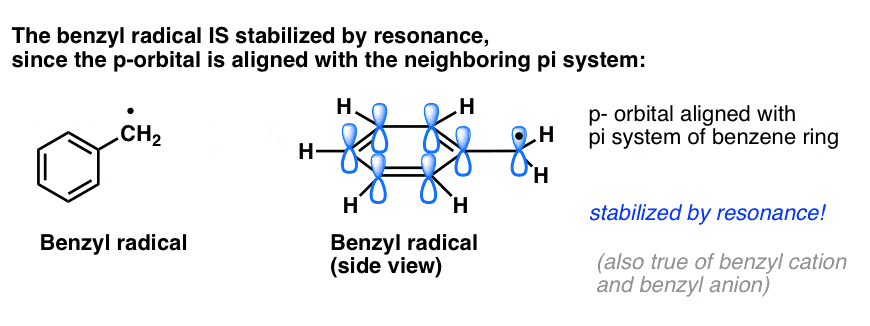
Benzyliska (och allyliska) C-H-bindningar är svaga i förhållande till andra alkyl-C-H-bindningar
Benzyliska C-H-bindningar har bindningsstyrkor (även kallade BDE, eller bindningsdissociationsenergier) på cirka 90 kcal/mol, vilket är betydligt svagare än tertiära C-H-bindningar (bindningsstyrka 93 kcal/mol), sekundära C-H-bindningar (96 kcal/mol) och primära C-H-bindningar (100 kcal/mol). (Fenyl C-H-bindningar har en bindningsstyrka på cirka 113 kcal/mol, vilket återigen återspeglar instabiliteten hos fenylradikalerna).
Då bindningsdissokationsenergier återspeglar hur lätt det är att homolytiskt klyva C-H-bindningen (dvs. hur lätt det är att dissociera bindningen till två fria radikaler) är detta ett annat sätt att säga att bensylradikaler är särskilt lätta att bilda, i förhållande till andra alkylradikaler.
Vi har tidigare sett att samma sak gäller för allyliska C-H-bindningar . Vid ”allylisk bromering” omvandlas en av C-H-bindningarna på alkylgruppen intill en dubbelbindning till en C-Br-bindning med hjälp av N-bromosuccinimid (NBS) och ljus (hν) :
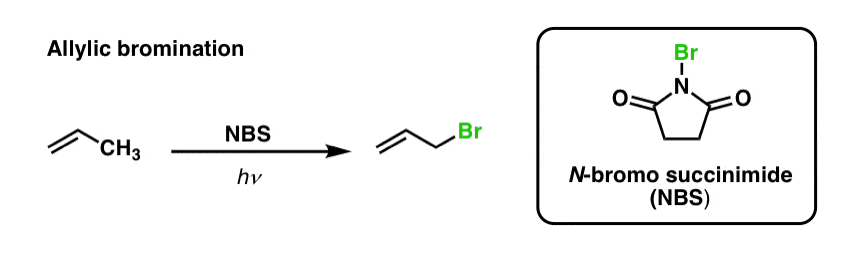
Reaktionen är selektiv för allylisk C-H i närvaro av primära, sekundära och tertiära C-H-bindningar på grund av den svagare styrkan hos den allyliska C-H-bindningen (89 kcal/mol).
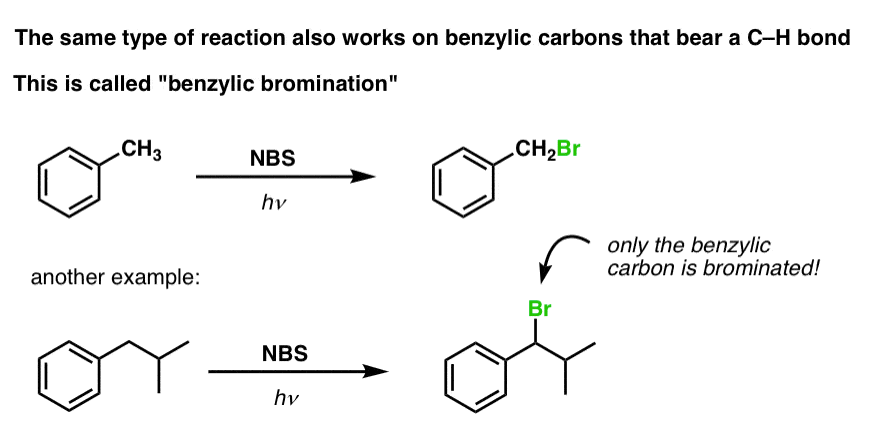
Benzylisk bromering
En liknande process fungerar för ”bensyliska” kolväten. Vi kan använda NBS (som ovan) eller helt enkelt bara Br2, eftersom aromatiska ringar inte är lika reaktiva med Br2 som dubbelbindningar är.
När den väl har bildats (genom ”värme” eller ”ljus”, vilket initierar reaktionen genom homolytisk dissociation av Br-Br), kan bromradikalen Br- bryta de svagare bensyliska C-H-bindningarna utan att röra starkare alkyl-C-H-bindningar.
Här är t.ex. produkterna av dess reaktion med toluen, och även isopropylbensen. Observera att BARA det bensyliska kolet är bromerat. Allt annat lämnas i fred!
Mekanismen för benzylisk bromering är i huvudsak identisk med allylisk bromering, med initierings-, fortplantnings- och avslutningssteg. (Klicka här för att se en popup-bild av mekanismen.)
(För mer diskussion, se det här inlägget: Allylisk brominering )
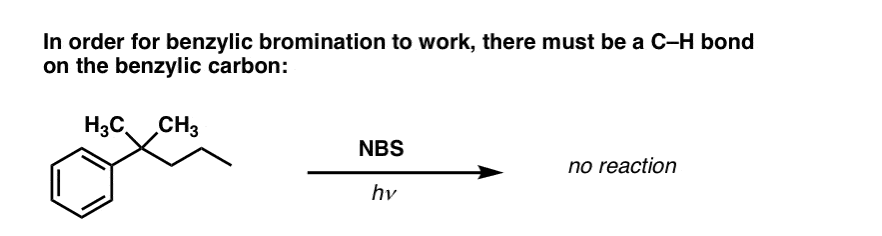
När fungerar ”benzylisk brominering” INTE?
Då nyckeln till denna reaktion är bildandet av den (relativt stabila) bensoyliska radikalen, kommer bensoylisk bromering att misslyckas på substrat där det är omöjligt att generera denna radikal genom att bryta en C-H-bindning.
Se till exempel på exemplet nedan. Hur kan en benzylisk radikal möjligen genereras när det benzyliska kolet har tre alkylgrupper knutna till sig? Det kan den inte – och reaktionen misslyckas.
Användningsområden för bensylbromering
Så varför kan bensylbromering vara användbar?
Ja, det gör det möjligt för oss att använda alla de reaktioner av alkylhalogenider som vi behandlade i Org 1 – främst substitution och eliminering – för att ge produkter som skulle vara svåra att installera direkt på en aromatisk ring genom Friedel-Crafts-reaktioner.
Till exempel kan man använda benzylbromering för att sätta igång en SN2-reaktion, t.ex. efter en Friedel-Crafts alkylering:
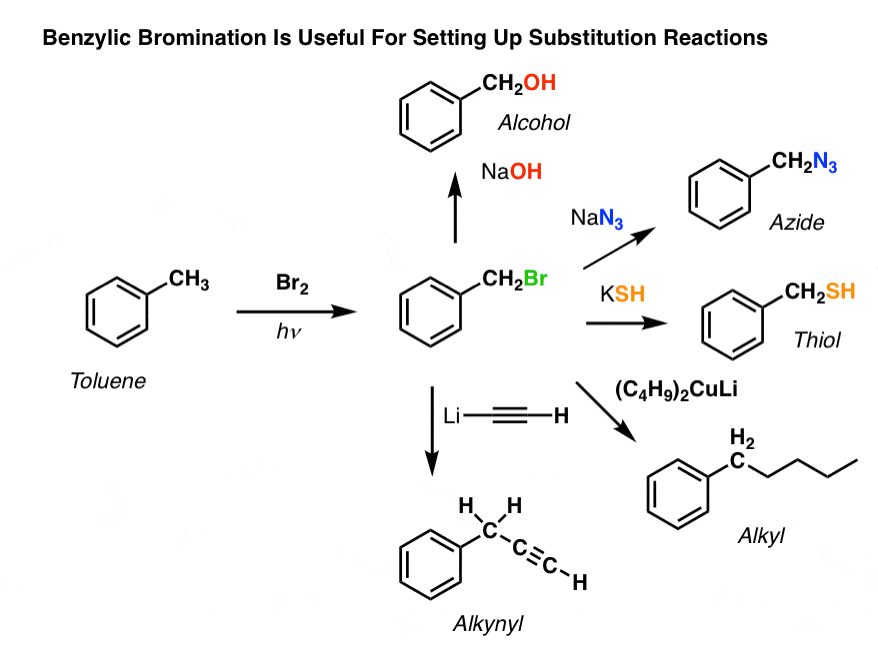
Se hur man genom att installera en bra avgångsgrupp vid bensylpositionen ger oss alla möjliga alternativ för att installera olika funktionella grupper?
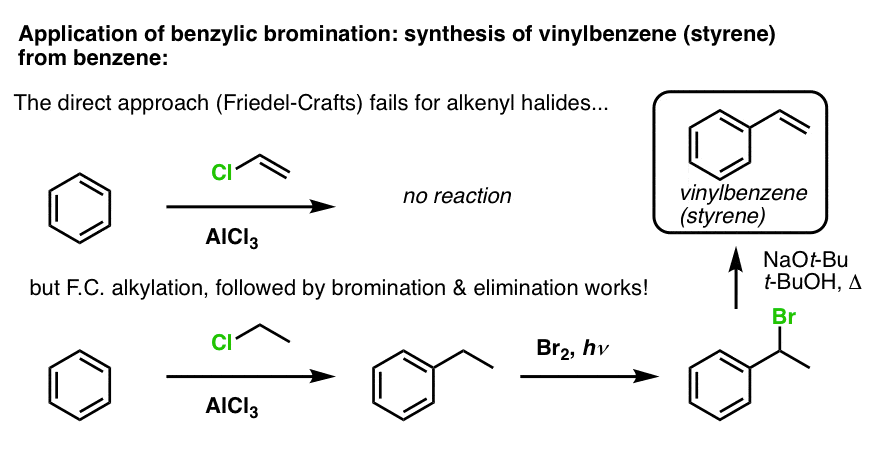
Ett annat exempel är syntesen av styren från bensen. Vid första anblicken kan det mest direkta tillvägagångssättet tyckas vara Friedel-Crafts reaktion av vinylklorid med bensen. Men Friedel-Crafts fungerar inte för alkenylhalogenider (även kallade vinylhalogenider)! (Vinylkarbokationer är mindre stabila än alkylkarbokationer).
Vi kan komma runt denna vägspärr genom att utföra en Friedel-Crafts alkylering med etylklorid, följt av bensylbromering och sedan eliminering (via E2, med något som NaOtBu/t-BuOH) för att ge alkenet:
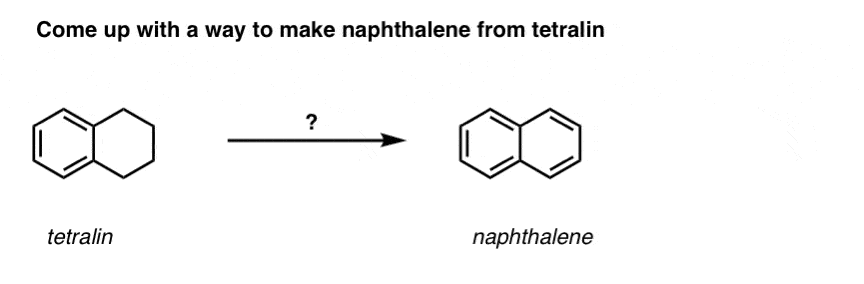
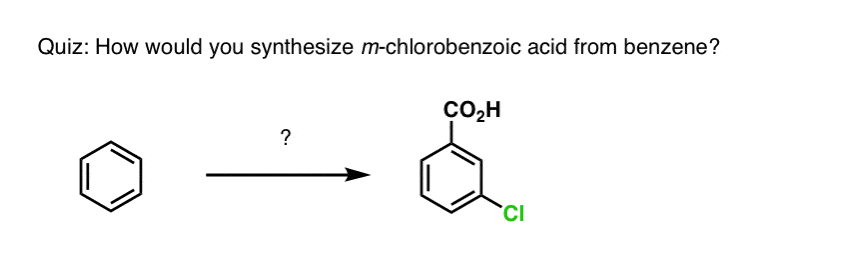
Med utgångspunkt i ovanstående kommer här en snabb frågesport för dig. Hur skulle du kunna omvandla tetralin (nedan till vänster) till naftalen (nedan till höger)? Svara i fotnoterna.
9. Bensylisk oxidation Med KMnO4 (eller H2CrO4)
Då den bensyliska C-H-bindningen är relativt svag kan man med rätta fråga sig om andra typer av reaktioner (förutom bromering) kan utföras i denna position.
Det kan de absolut! Ett utmärkt exempel är bensylisk oxidation – där en bensylisk C-H-bindning bryts och en bensylisk C-O-bindning bildas.
Nu: Det finns ganska skonsamma reagenser för bensylisk oxidation som är den kemiska motsvarigheten till att kittla bort C-H-bindningen med en fjäder, vilket resulterar i en bensylisk aldehyd eller keton .
Det är inte den typ av bensylisk oxidation som behandlas i en typisk introduktionskurs i organisk kemi!
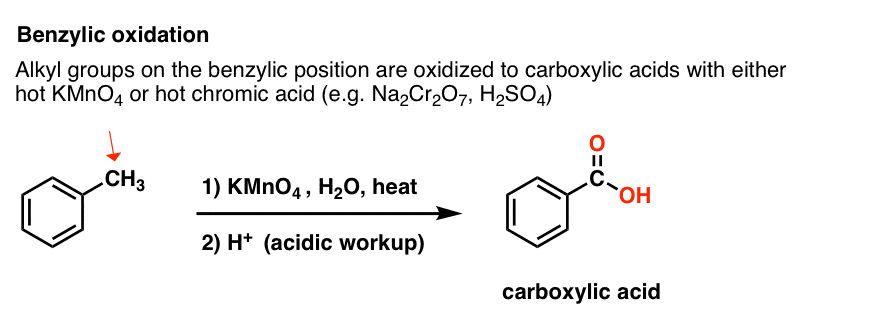
Istället är det viktigaste reagenset för bensylisk oxidation som behandlas i de flesta introduktionsböcker varmt kaliumpermanganat (KMnO4). Varm kromsyra (H2CrO4, som bildas genom att kombinera ett dikromatsalt som Na2Cr2O7 med en stark syra som H2SO4) kan också användas för dessa ändamål.
KMnO4 är inte subtilt. KMnO4 är inte mild. KMnO4 är inte snäll.
En lösning av varm KMnO4 är som en påse full av arga piranhas som kommer att slita allt kött från din molekyl och bara lämna benen kvar. (När jag tänker efter är det ungefär som din lever! )
Hett KMnO4 kommer att bryta varje bensylisk C-H-bindning och omvandla den till en C-O-bindning. Från toluen är produkten till exempel bensoesyra (en karboxylsyra).
Men den bryter inte bara de bensyliska C-H-bindningarna. Åh nej. Den går också på C-C-bindningar; åtminstone de som inte är direkt knutna till en fenylring. Till exempel omvandlas para-dietylbensen till para-benzen-dikarboxylsyra.
Bemärk att alkyl-C-C-bindningen måste klyvas för att denna oxidation ska kunna ske! (Den oxideras sannolikt hela vägen upp till koldioxidgas).
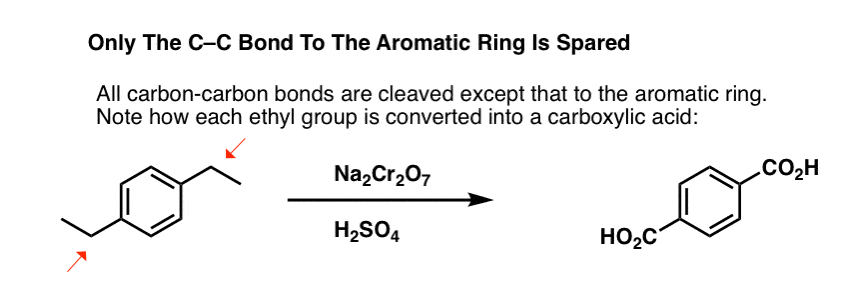
En intressant variant är på en cyklisk molekyl som tetralin; resultatet är dikarboxylsyra.
Denna dikarboxylsyra kallas ftalsyra.
10. Bensylisk oxidation kräver en bensylisk C-H-bindning
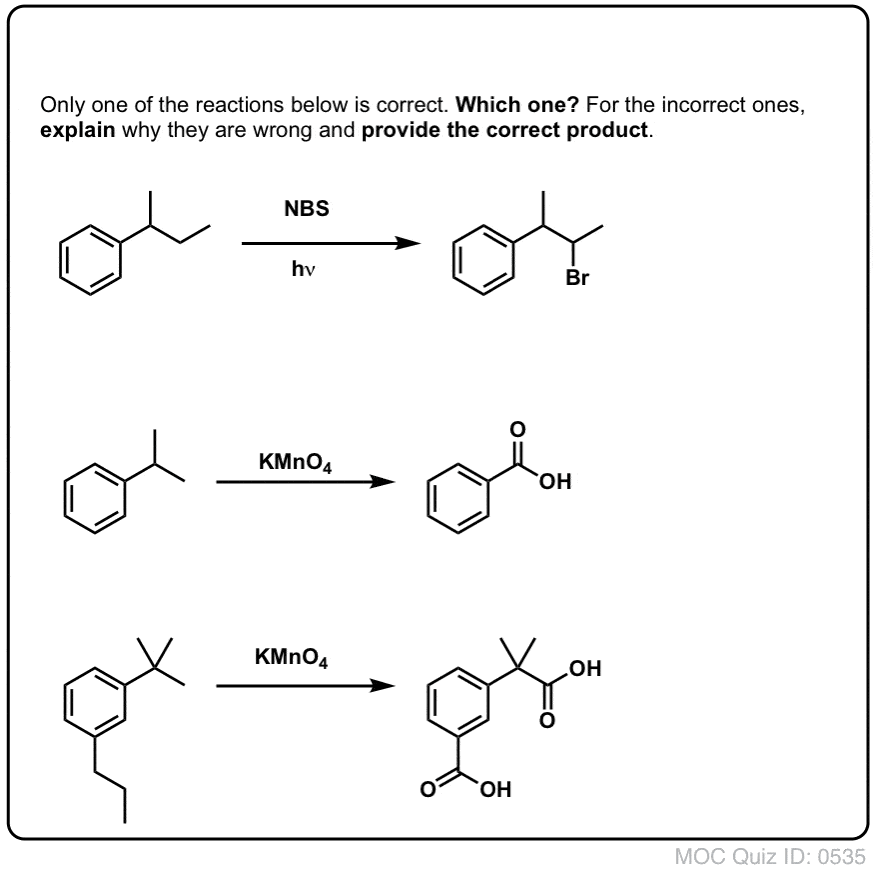
Som vid bensylisk bromering sker ingen reaktion om det inte finns en C-H-bindning på den bensyliska positionen. Till exempel misslyckas reaktionen helt med t-butylbensen:
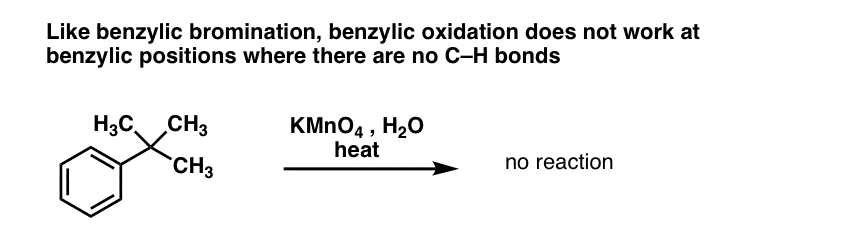
Den fullständiga mekanismen för benzylisk oxidation är för komplex, långvarig och osäker för att kunna visas här, men det första steget är med största sannolikhet homolytisk klyvning av C-H-bindningen av Mn=O för att bilda den benzyliska radikalen.
Varför är detta viktigt?
Benzylisk oxidation med KMnO4 är en hård reaktion, men den kan ha sina användningsområden. Den fungerar bäst med enkla molekyler som inte har känsliga funktionella grupper och som tål en mycket grov behandling.
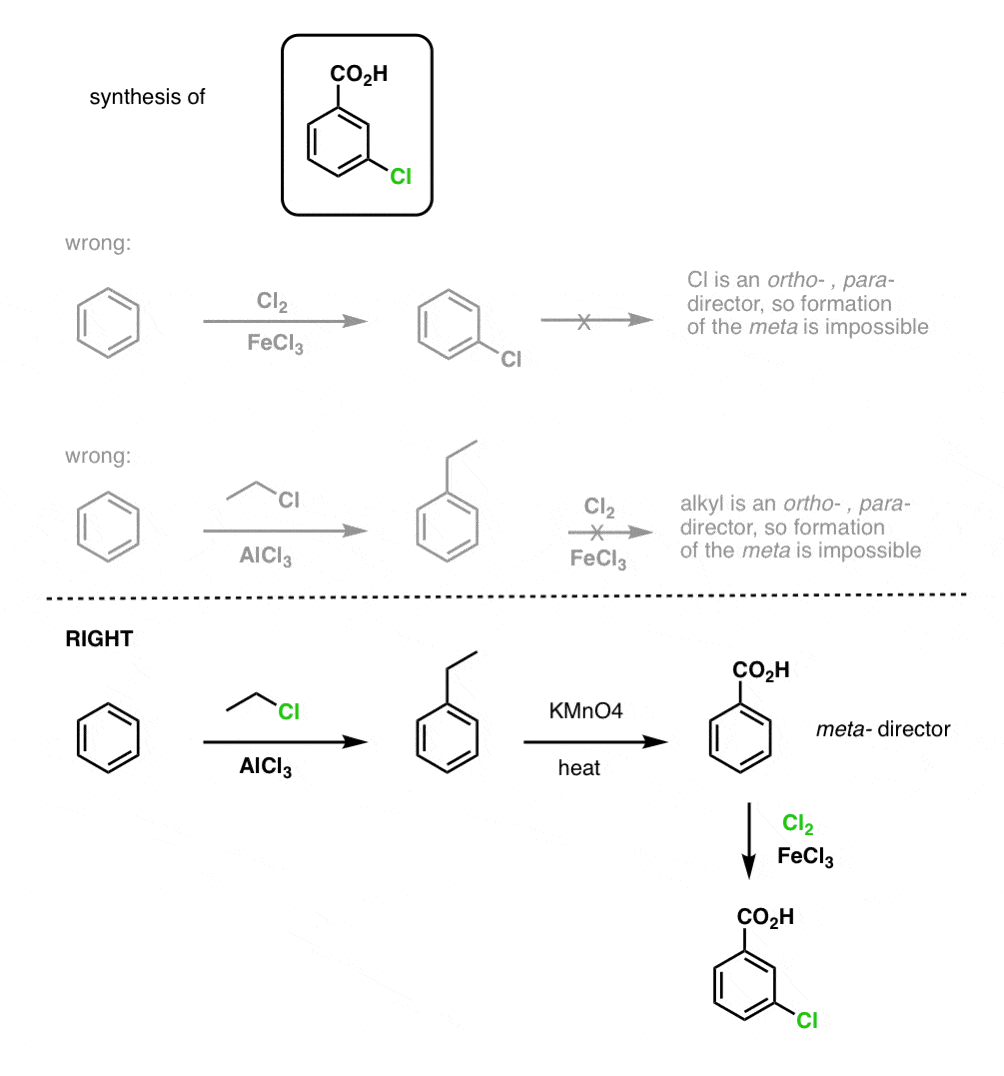
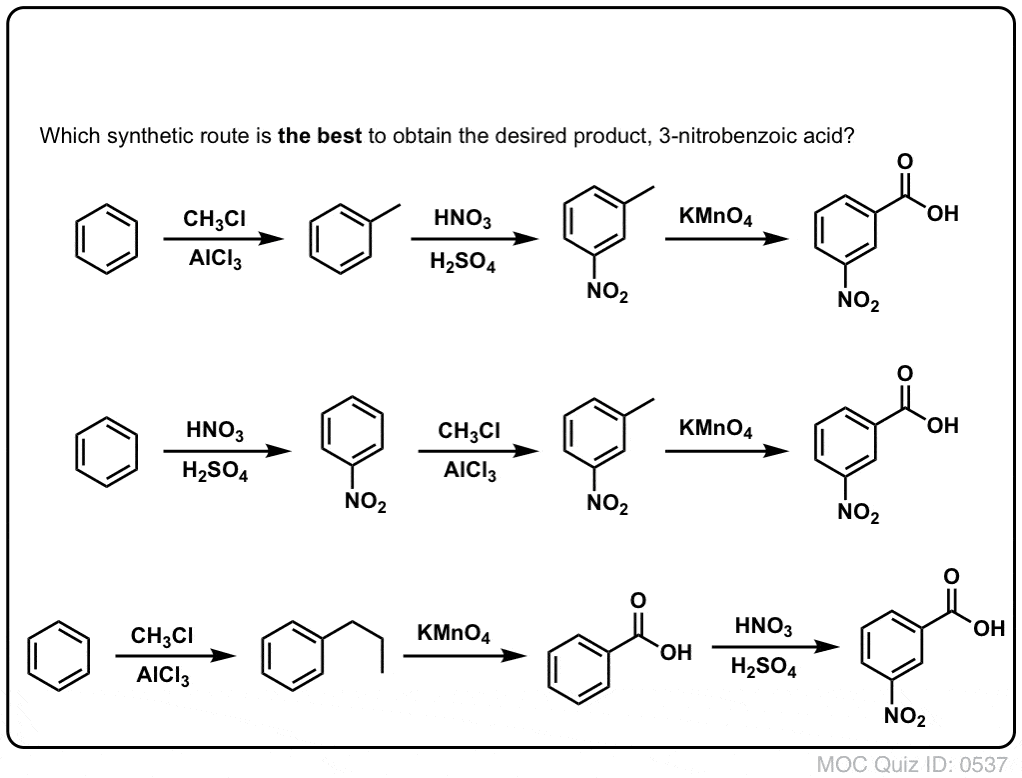
Det första man bör notera är att karboxylsyror inte kan placeras direkt på en bensenring via Friedel-Crafts acylering, så alkylering följt av oxidation är en användbar lösning.
Den andra användbara funktionen i syntesen är det faktum att benzylisk oxidation omvandlar en o- p-direktör (en alkylgrupp) till en metadirektör.
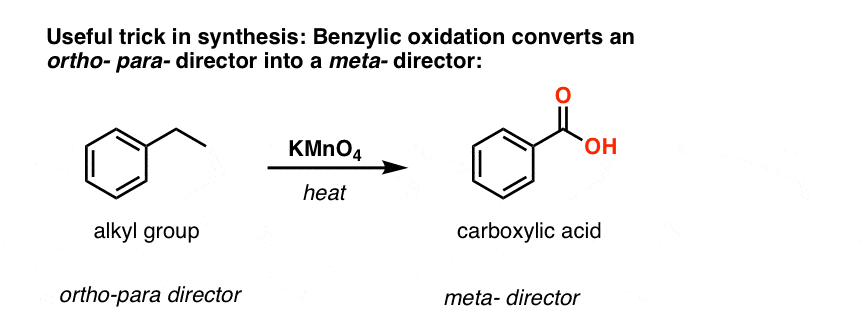
Till exempel, konfronterad med syntesen av följande molekyl, hur går du tillväga? (Tips: det innebär en benzylisk oxidation vid något tillfälle).
Vi kommer att ha mycket mer att säga om syntesen av aromatiska föreningar i ytterligare några inlägg.
Nästa: Reduktion av bensylkarbonyls – Clemmensen- och Wolff-Kishner-reduktionerna
Anteckningar
”Kål” kan också användas som en slangterm inom kemin för ”allt det där på molekylen som man säkert kan ignorera” av någon anledning. Bryostatin är till exempel ett odjur av en molekyl som visar sig lovande som cancerbekämpningsmedel. Problemet är att det krävs ett ton av en sällsynt bryozoan för att få en anständig mängd bryostatin, och det räcker inte för en klinisk prövning på människor. Så flera grupper har arbetat med att göra enklare, lättare att syntetisera ”bryologer” där man gör sig av med den ”kål” som inte är nödvändig för antitumöraktiviteten.
Br2 reagerar i allmänhet inte med aromatiska ringar utan en Lewis-syrakatalysator. Men om en stark aktiverande grupp är närvarande (t.ex. OH, NR2 osv.) kan en viss brominering av ringen ske, särskilt vid förhöjda temperaturer.
Roligt faktum: ”Benzylisk oxidation” är svaret på pusslet varför metylbensen (toluen) inte är en nästan lika potent cancerframkallande substans som bensen. Det beror på att levern har cytokrom p450-enzymer (som innehåller järnarter med högt oxidationstillstånd) som kan oxidera den benzyliska CH3-gruppen till den mer vattenlösliga karboxylsyran, vilket gör att den kan rensas bort av njurarna.
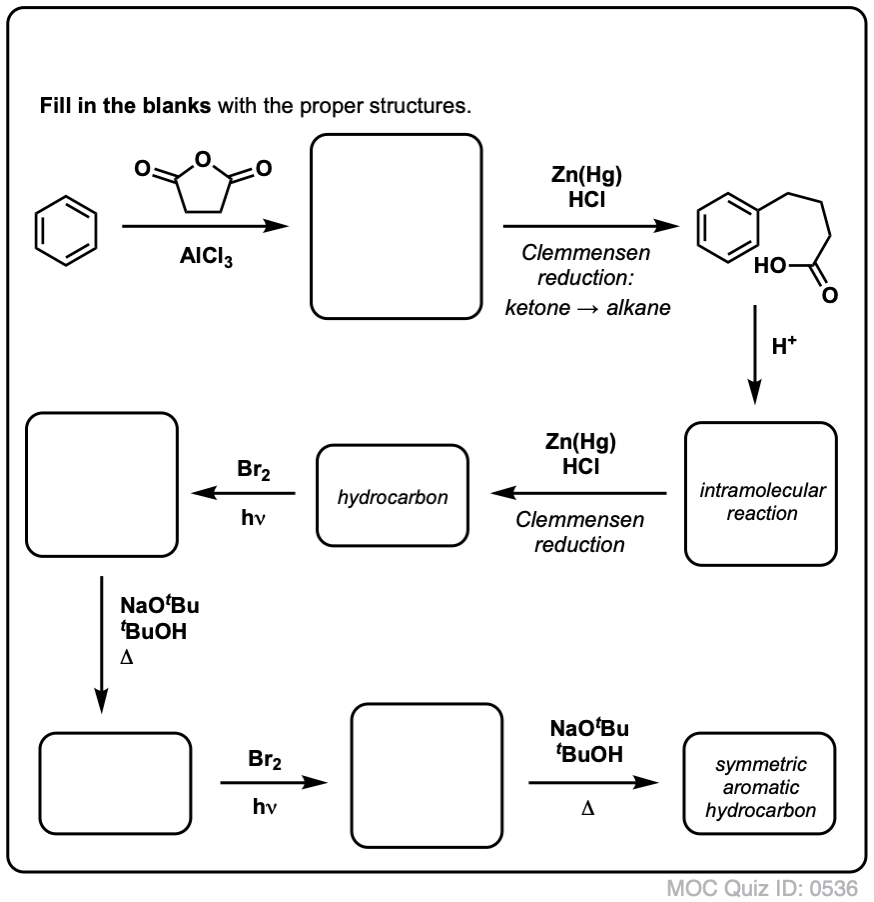
Detta kräver två oxidationer och två elimineringar. Ett försiktigt sätt att göra det är att oxidera (dvs. bromera) en gång och sedan eliminera för att ge en alken. Alkenet skulle sedan kunna genomgå bromering igen (med NBS, för att undvika bromering av dubbelbindningen) för att ge en annan bromering (benzylisk bromeringsprodukt visas här, men allylisk är också möjlig) som skulle kunna behandlas med bas för att ge aromatisk naftalen.
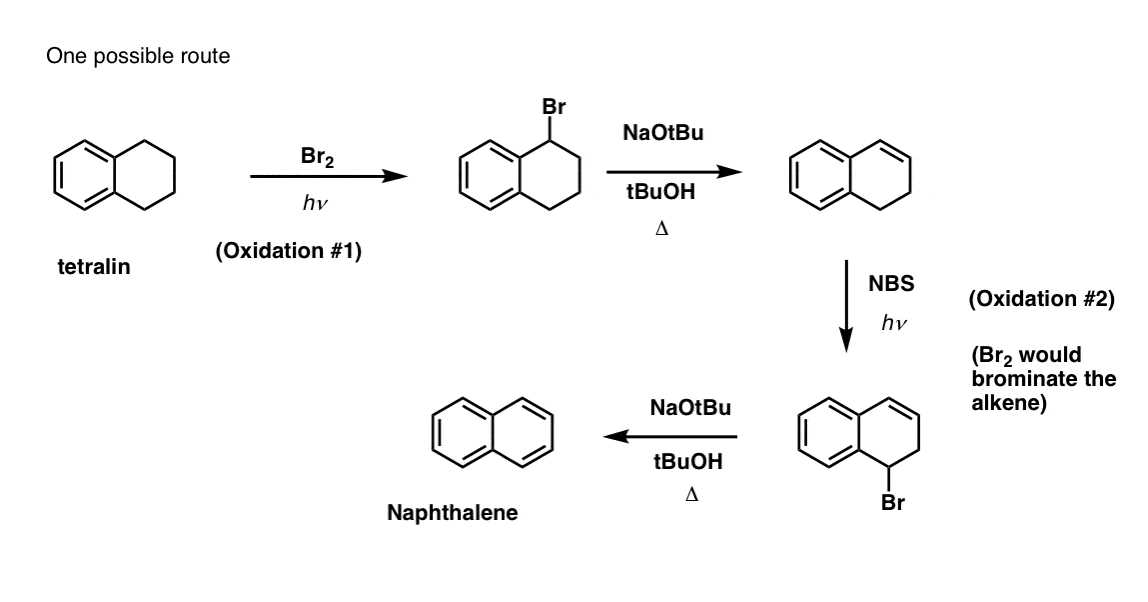
(I praktiken visar det sig att båda bromeringarna kan göras samtidigt med hjälp av Br2 vid hög temperatur. Behandling med bas kan sedan ge naftalen).
Svar på frågesportfråga 2.
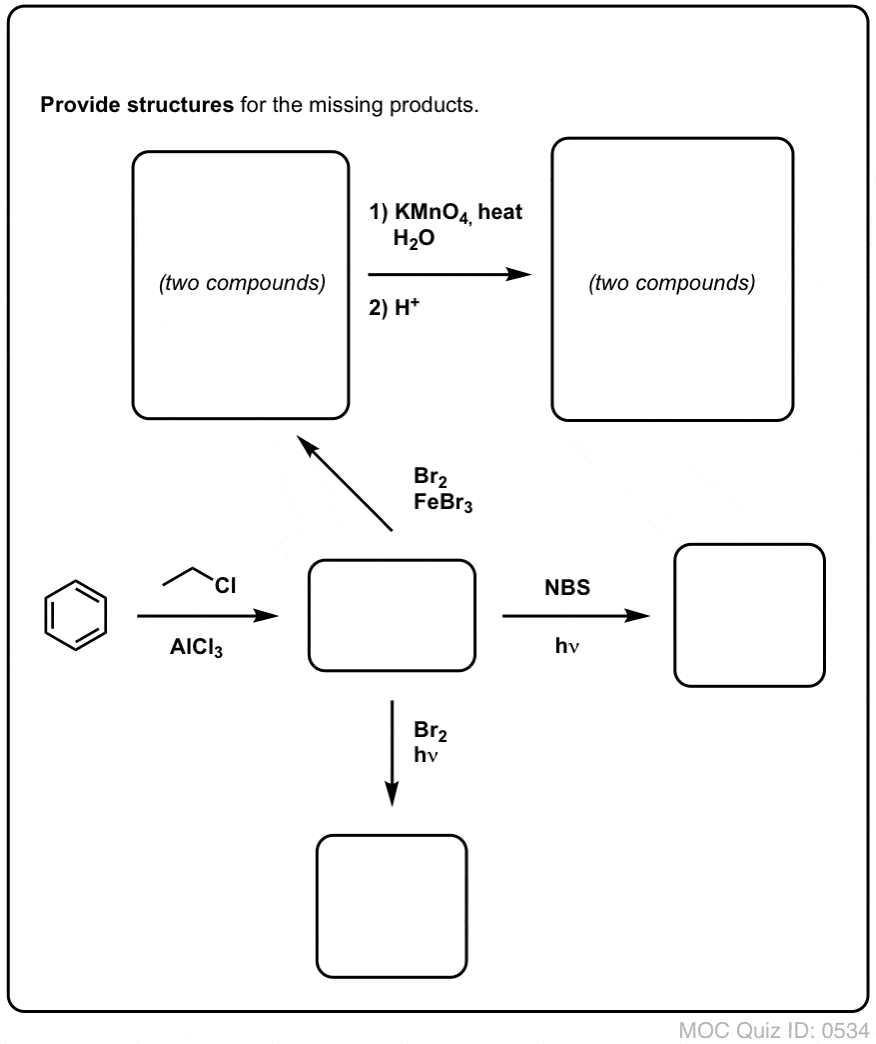
Quiz dig själv!
 Klicka för att vända
Klicka för att vända 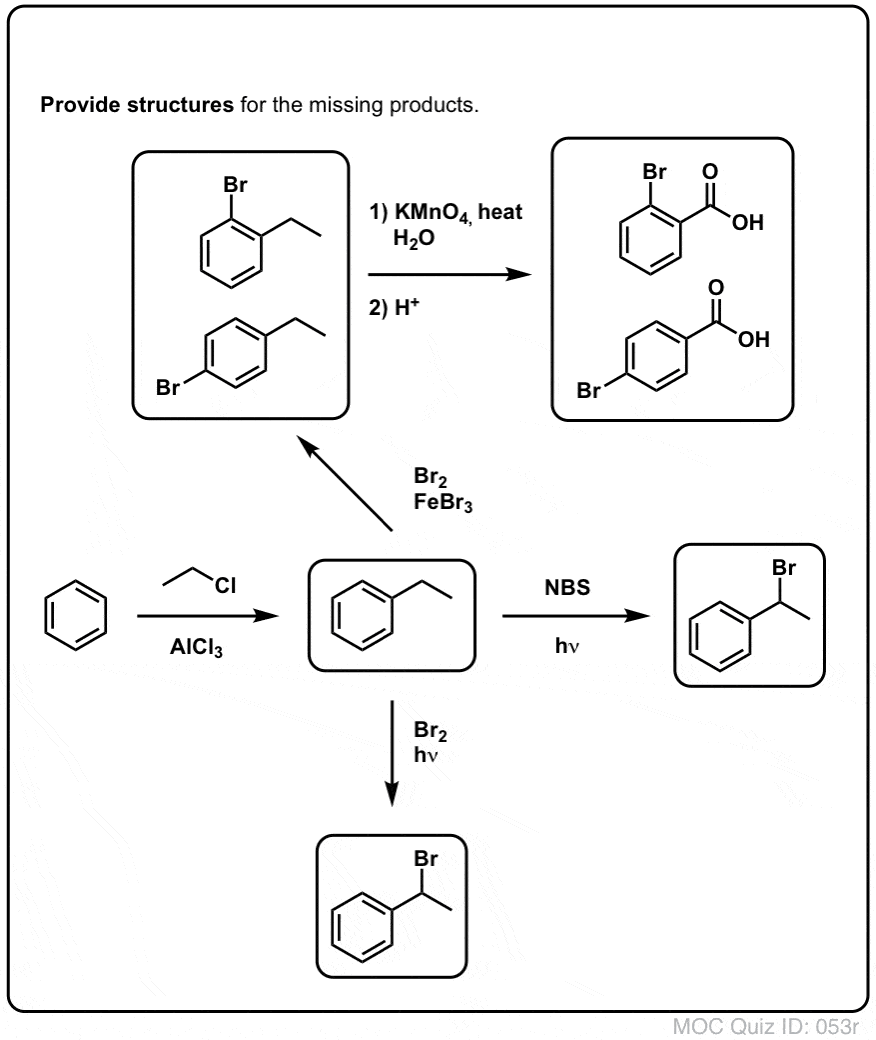
 Klicka för att vända
Klicka för att vända 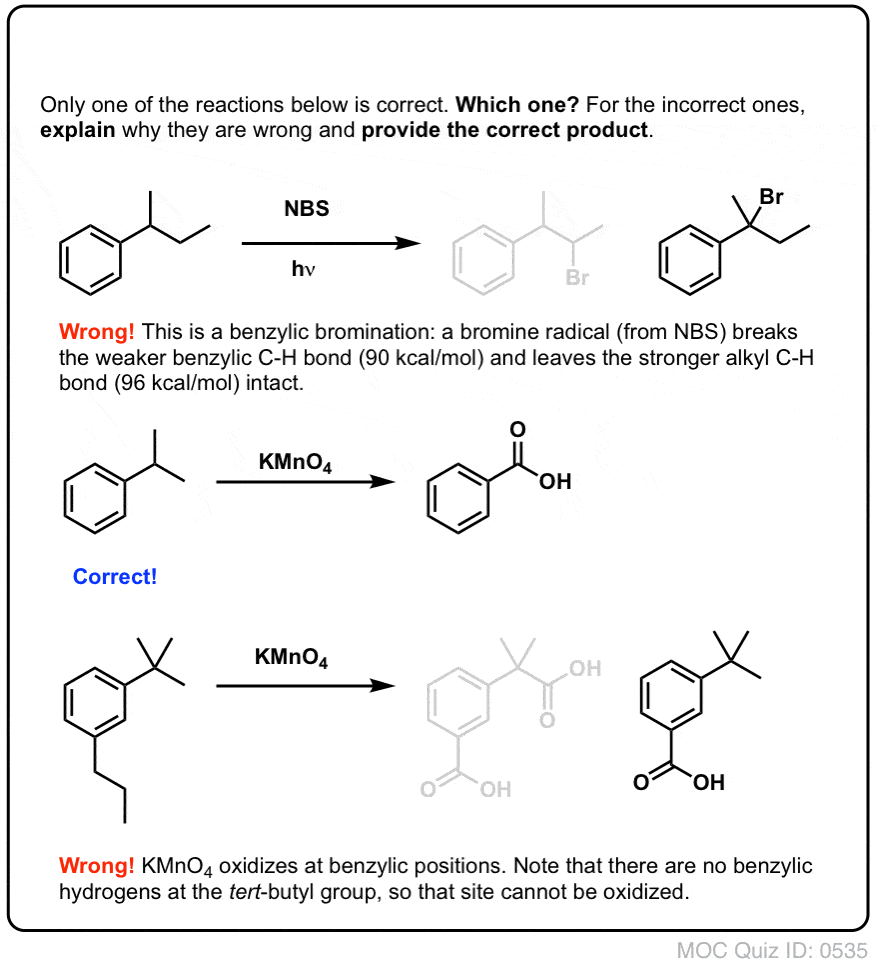
 Klicka för att vända
Klicka för att vända 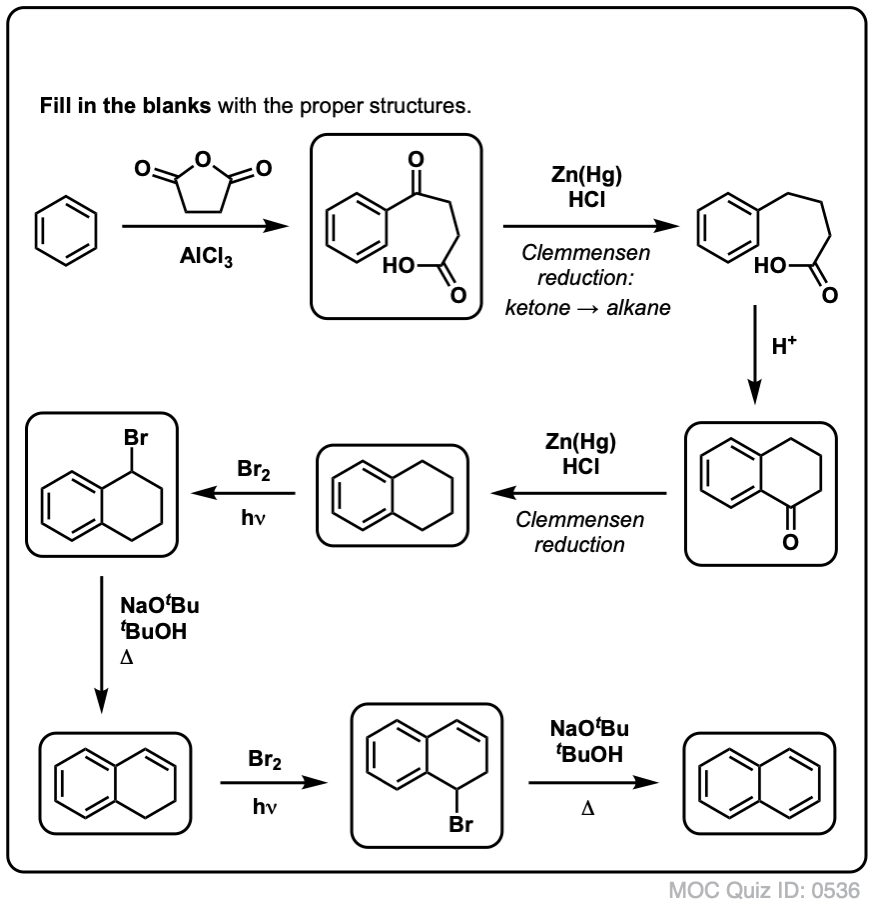
>
 Klicka för att bläddra
Klicka för att bläddra 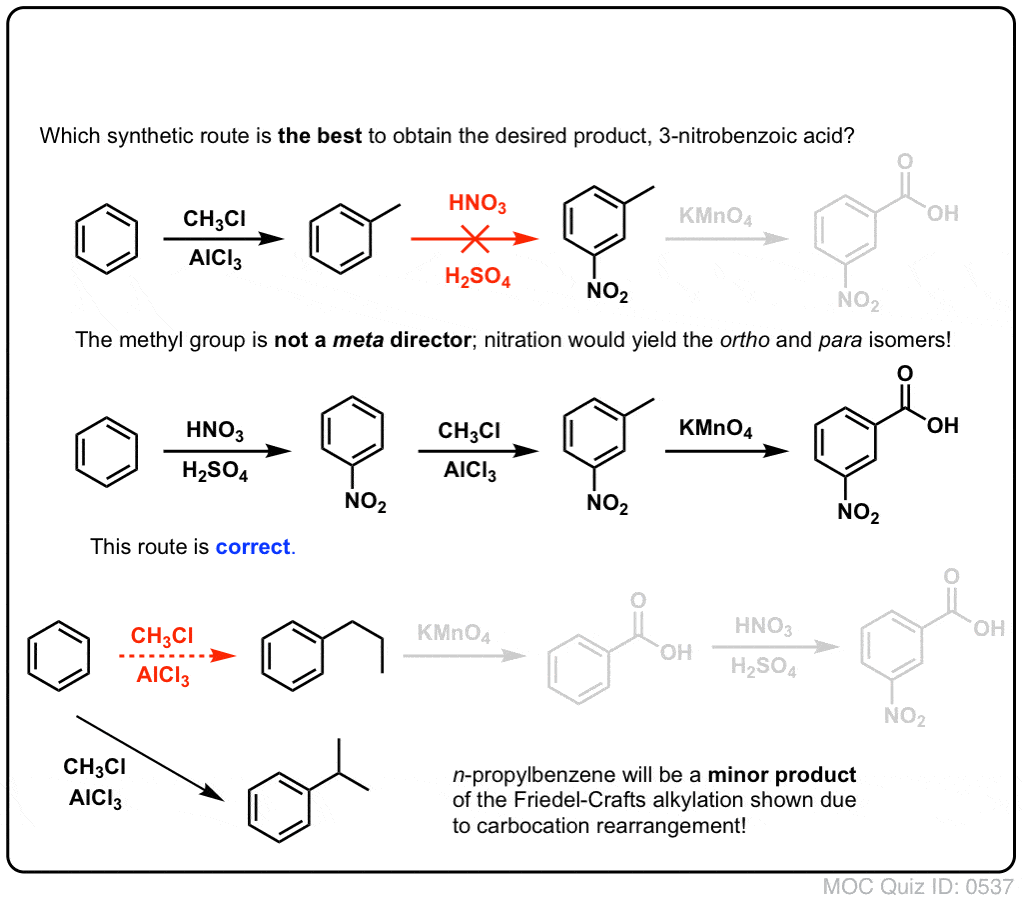
(Avancerat) Referenser och vidare läsning
Benzylbromering:
Denna reaktion är också känd som Wohl-Ziegler-reaktionen.
- Bromering ungesättigter Verbindungen mit N-Brom-acetamid, ein Beitrag zur Lehre vom Verlauf chemischer Vorgänge
Wohl
Chem. Ber. 1919, 52 (1), 51-63
DOI: 10.1002/cber.19190520109 - Die Halogenierung ungesättigter Substanzen in der Allylstellung
Ziegler, A. Späth, E. Schaaf, W. Schumann, E. Winkelmann
Just. Lieb. Ann. Chem. 1942, 551 (1), 80-119
DOI: 10.1002/jlac.19425510103
De två första publikationerna om denna reaktion. Wohl använde N-bromoacetamid som bromeringsmedel, inte NBS. Ziegler utförde sedan en detaljerad studie och rapporterade att NBS kunde användas som ett bekvämt bromeringsmedel för allylisk bromering. - Dibenzocycloocten: Multi-gram syntes av en bidentatligand
Géraldine Franck, Marcel Brill och Günter Helmchen
Org. Synth. 2012, 89, 55-65
DOI: 10.15227/orgsyn.089.0055 - Bensylbromeringar med N-bromsuccinimid i (trifluormetyl)bensen
Diana Suarez, Gilles Laval, Shang-Min Tu, Dong Jiang, Claire L. Robinson, Richard Scott, Bernard T. Golding
Synthesis 2009 (11): 1807-1810
DOI: 1055/s-0029-1216793
Reference #3 visar en typisk bensylbromering med hjälp av NBS i CCl4, som till stor del har fasats ut på grund av toxicitetsproblem. Referens #4 visar att PhCF3 kan användas som lösningsmedel i stället för CCl4 för benzylisk bromering. - Bromeringar med N-bromsuccinimid och relaterade föreningar. The Wohl-Ziegler Reaction.
Carl Djerassi
Chemical Reviews 1948, 43 (2), 271-317
DOI: 10.1021/cr60135a004
En gammal översikt om denna reaktion av den kände kemisten Carl Djerassi, vars viktigaste bidrag till den globala hälsan var utvecklingen av norethindron – det första kvinnliga preventivmedlet. - N-bromsuccinimid. III. Stereokemiskt förlopp av benzylisk bromering
H. J. Dauben Jr. och Layton L. McCoy
Journal of the American Chemical Society 1959, 81 (20), 5404-5409
DOI: 10.1021/ja01529a038
En mekanistisk studie av stereokeminering av benzylisk bromering. Genom att observera bildandet av racemiska bensylbromider från prochirala substrat stärks radikaler som intermediärer i denna reaktion ytterligare.Samma referenser från allylisk brominering kan återanvändas här: - Mekanismer för bensylbrominering
Glen A. Russell, Charles. DeBoer, and Kathleen M. Desmond
Journal of the American Chemical Society 1963 85 (3), 365-366
DOI: 1021/ja00886a040
Benzylisk brominering följer samma mekanism som allylisk brominering, vilket förklaras i denna artikel.NBS (N-Bromosuccinimid) är en lämplig reagens för friradikal brominering, och följande artiklar är mekanistiska studier som involverar NBS: - The Mechanism of Benzylic Bromination with N-Bromosuccinimide
R. E. Pearson and J. C. Martin
Journal of the American Chemical Society 1963 85 (3), 354-355
DOI: 10.1021/ja00886a029
Dessa artiklar av professor J. C. Martin (UIUC) var i början av hans karriär, innan han utförde det arbete som han är mest känd för (studier av ”hypervalenta” molekyler, inklusive utvecklingen av ”Dess-Martin Periodinane”). - Identiteten hos den kedjebärande arten i bromeringar med N-bromosuccinimid: Selektivitet hos substituerade N-bromosuccinimider mot substituerade toluener
R. E. Pearson and J. C. Martin
Journal of the American Chemical Society 1963, 85 (20), 3142-3146
DOI: 10.1021/ja00903a021 - N-bromosuccinimid. Mekanismer för allylbromering och relaterade reaktioner
J. H. Incremona och James Cullen Martin
Journal of the American Chemical Society 1970, 92 (3), 627-634
DOI: 10.1021/ja00706a034 - Succinimidylradikal som kedjebärare. Mekanism för allylbromering
J. C. Day, M. J. Lindstrom och P. S. Skell
Journal of the American Chemical Society 1974, 96 (17), 5616-5617
DOI: 10.1021/ja00824a074 - Radikal bromering av cyklohexen i CCl4 med brom: Addition kontra substitution
D. W. McMillen och John B. Grutzner
The Journal of Organic Chemistry 1994, 59 (16), 4516-4528
DOI: 10.1021/jo00095a029
Denna artikel beskriver noggranna kinetiska studier som visar att en låg koncentration av Br2 (som den som tillhandahålls av oren NBS) kommer att gynna radikal substitution framför en polär additionsreaktion. - o-XYLYLENE DIBROMIDE
Emily F. M. Stephenson
Org. Synth. Vol. 34, s.100 (1954)
DOI: 10.15227/orgsyn.034.0100
A reliable procedure for benzylic bromination with Br2 in Organic Syntheses. - Bromering av tetralin. Kort och effektiv syntes av 1,4-dibromonaftalen
Osman Çakmak, Ismail Kahveci, Íbrahim Demirtaş, Tuncer Hökelek och Keith Smith
Czech. Chem. Commun. 2000, 65, 1791-1804
DOI: 10.1135/cccccc20001791
En bekväm syntes av 1,4-dibromonaftalen från tetralin, via benzylisk brominering.Bensylisk oxidation:
Det finns många strategier för bensylisk oxidation, bland annat genom användning av koncentrerade lösningar av KMnO4 eller kromsyra. - Kinetiska studier av oxidation av aromatiska föreningar med kaliumpermanganat. Del IV. n- och isopropylbensen
C. F. Cullis och J. W. Ladbury
J. Chem. Soc. 1955, 4186-4190
DOI: 10.1039/JR9550004186 - PIPERIDIN DERIVATIVER X. PHENYLPIPERIDYLCARBINOLERNA
Kenneth E. Crook och S. M. McElvain
Journal of the American Chemical Society 1930, 52 (10), 4006-4011
DOI: 1021/ja01373a035
Om det finns en annan substituent på bensylpositionen ger oxidationen en keton i stället för en karboxylsyra. - Heterogena permanganatoxidationer. 7. Oxidation av alifatiska sidokedjor
Nazih A. Noureldin, Dongyuan Zhao och Donald G. Lee
The Journal of Organic Chemistry 1997, 62 (25), 8767-8772
DOI: 1021/jo971168e
Reagenser kan adsorberas på fasta bärare för att göra reaktionerna lättare att genomföra och minska avfallet. I det här fallet, genom att göra KMnO4-reagenset heterogent, förändras reaktiviteten något, och detta kan utnyttjas för vissa kemoselektiva oxidationer.Många andra reagenser kan användas för bensyloxidation, här är ett urval: - Selektiv oxidation vid kol intill aromatiska system med IBX
K. C. Nicolaou, Phil S. Baran, and Yong-Li Zhong
Journal of the American Chemical Society 2001, 123 (13), 3183-3185
DOI: 10.1021/ja004218x
En tidig artikel från (numera totalsyntesens rockstjärna) Prof. Phil Baran (The Scripps Research Institute, La Jolla, CA) medan han fortfarande var doktorand i Prof. Nicolaous grupp. Här används IBX (en hypervalent I(V)-reagens) för att göra bensyloxideringar, som sker via en radikal mekanism. Detta är en användbar reaktion med ett brett substratområde, vilket exemplifieras av 25 exempel i artikeln. - Direkt och selektiv bensylisk oxidation av alkylarener via C-H-abstraktion med hjälp av alkalimetallbromider
Katsuhiko Moriyama, Misato Takemura och Hideo Togo
Organic Letters 2012, 14 (9), 2414-2417
DOI: 10.1021/ol300853z
Detta använder Oxone som terminalt oxidationsmedel för benzylisk oxidation. - Synthesis of Benzylic Alcohols by C-H Oxidation
Lalita Tanwar, Jonas Börgel, and Tobias Ritter
J. Am. Chem. Soc. 2019, 141, 17983-17988
DOI: 10.1021/jacs.9b09496
Detta använder mesylperoxid som oxidationsmedel för selektiv oxidation av bensylpositioner till alkoholer. Bensylmesylat bildas, som kan hydrolyseras till alkoholen. - Elektrokemisk bensyloxidation av C-H-bindningar
Jason A. Marko, Anthony Durgham, Stacey Lowery Bretz och Wei Liu
Chem. Commun, 2019, 55, 937-940
DOI: 10.1039/C8CC08768G
Bensylisk oxidation kan också åstadkommas genom elektrokemi. - Allyliska och bensyliska oxidationsreaktioner med natriumklorit
Samuel M. Silvestre, Jorge A. R. Salvador
Tetrahedron 2007, 63 (11), 2439-2445
DOI: 10.1016/j.tet.2007.01.012
NaClO2 är billigt och kan även användas som oxidationsmedel.
Lämna ett svar