Kombination av Ledipasvir och Sofosbuvir för behandling av infektion med hepatit C-virus av genotyp 1: Annals of Hepatology
On januari 20, 2022 by adminIntroduktion
Av de cirka 80 miljoner individer i världen med kronisk hepatit C-virusinfektion (HCV) är cirka 46 % infekterade med HCV-genotyp 1, den som är svårast att behandla med interferonbaserade regimer.1 På grund av den låga graden av behandlingsframgång och förväntade biverkningar av pegylerat interferon (PegIFN) och riba-virin (RBV) för behandling av HCV-infekterade patienter har ansträngningar gjorts för att utveckla IFN-fria behandlingsregimer.2,3
Proteashämmare (PI)-innehållande regimer för patienter med HCV-genotyp 1-infektion introducerades 2011. Det har dock förekommit en del läkemedelsinteraktioner i samband med PI-innehållande regimer och de bör också användas tillsammans med PegIFN och hade många biverkningar.4 Behandlingen av patienter med HCV-genotyp 1-infektion har revolutionerats genom introduktionen av nya direktverkande antivirala medel (DAA), inklusive Sofosbuvir (SOF), en uridinnukleotidanalog hämmare av HCV:s NS5B-polymeras och Ledipasvir (LDV), en hämmare av HCV-kodade NS5A-protein.5,6 Det bästa behandlingsalternativet är det som har den högsta andelen sustained virologic response (SVR) med minimala biverkningar under den kortaste behandlingstiden. Kombinationen SOF/LDV i 12 eller 24 veckor med eller utan RBV har förbättrat SVR-frekvensen med upp till 95-100 % hos behandlingsnaiva och IFN-erfarna patienter med HCV-genotyp 1-infektion.7 Det finns ett behov av att fastställa den exakta SVR-frekvensen för behandling med SOF/LDV i kombination med eller utan RBV under 12 eller 24 veckor. Dessutom bör effekten av vissa faktorer som cirros, tidigare behandlingshistoria och NS5A-resistensassocierade substitutioner (RAS) på SVR-frekvensen med den nämnda regimen utvärderas.
En metaanalys av de för närvarande tillgängliga studierna genomfördes i syfte att utvärdera den antivirala effekten av SOF/LDV-kombinationsbehandling i 12 eller 24 veckor med eller utan RBV hos patienter med HCV-genotyp 1-infektion.
Material och metoderDatabasresurser och sökstrategier
I denna metaanalys gjorde vi en omfattande och systematisk sökning i elektroniska databaser inklusive PubMed, Scopus, Science Direct och Web of Science med hjälp av lämpliga sökstrategier för varje databas. Fokus för nyckelorden i våra sökstrategier var på behandlingsprotokoll; SOF, LDV och deras lämpliga alternativ. För att hitta eventuell befintlig grå litteratur gjorde vi dessutom en sökning på Google Scholar och efter att ha hittat relaterade titlar fortsatte vi vår sökning tills vi hittade 200 orelaterade titlar. Dessutom sökte vi också i referenserna till de hämtade publikationerna för att identifiera eventuella missade publikationer i den elektroniska sökningen. Vår sista sökning utfördes den 2 september 2015 och ingen språkbegränsning beaktades. En uppdatering av vår sökning utfördes den 16 mars 2016.
Ansvarskriterier
Alla artiklar som utvärderade effekten av kombinationsbehandling med SOF/LDV med eller utan RBV i 12 eller 24 veckor på SVR, 12 veckor efter avslutad behandling (SVR12) bland patienter med HCV-genotyp 1-infektion inkluderades i denna metaanalys. Studier med data för intention-to-treat-analys inkluderades, annars exkluderades uppsatsen. Följande punkter betraktades som våra uteslutningskriterier; patienter på hemodialys, patienter med tidigare historia av SOF-baserad behandling, patienter med samtidig infektion med humant immunbristvirus (HIV), patienter med dekompenserad cirros (Child-Pugh B och C8) och historia av lever- eller njurtransplantation.
Studieurval, kvalitetsbedömning och dataextraktion
Med utgångspunkt i PRISMA-riktlinjerna för rapportering av systematiska granskningar9 granskades alla artiklar från sökresultaten oberoende av varandra av två personer (MSR-Z och KH) på varje granskningsnivå (titel, abstrakt och fulltext). I slutet av varje granskningsnivå löstes eventuella meningsskiljaktigheter mellan dessa två författare genom ömsesidig diskussion. Återstående meningsskiljaktigheter löstes dock genom konsensus och diskussion med andra kollegor (BB, SMA och HS).
Cochrane’s risk of bias assessment tool användes för kvalitetsbedömning av varje inkluderad artikel10 och följande biasrisker utvärderades: slumpmässig sekvensgenerering (selektionsbias), döljande av allokering (selektionsbias), blindning av deltagare och personal (prestationsbias), blindning av utfallsbedömning (upptäcktsbias), saminterventioner, ofullständiga utfallsdata (bortfall), selektiv rapportering (rapporteringsbias), avsiktsanalys (intention-to-treat analysis), likhet i grupperna vid baslinjen, följsamhet, tidpunkt för utfallsbedömningar och andra bias. På grundval av denna bedömning bedömdes varje risk för bias för varje artikel som hög, oklar och låg. Hög och oklar risk värderades som noll och låg risk som ett. Artiklar med en poäng på mer än 6 kategoriserades som studier med låg risk. Återigen löstes eventuella skillnader eller meningsskiljaktigheter genom ömsesidig diskussion.
Följande data för deltagare i varje arm i de inkluderade studierna extraherades; kön, HCV-genotyp, cirros, polymorfismer nära IFNL3 (rs12979860), historia av tidigare behandling, behandlingstid, ålder, kroppsmasseindex (BMI) och HCV RNA-nivå före behandling. Dessutom samlades vissa data för varje studie in, inklusive publiceringsår, urvalsstorlek och landsnamn.
Dataanalys
Konfidensintervallet (CI) för SVR-frekvens i varje studie beräknades baserat på jeffreys-metoden och genomsnittligt belopp av CI:s övre och nedre gränser betraktades som punktuppskattning för SVR.11 Heterogenitetstestet utfördes med hjälp av χ2 och I-kvadrat (intervall från 0 % till 100 %). P-värde mindre än 0,1 ansågs vara statistiskt signifikant för χ2. Enligt resultatet av heterogenitetstestet använde vi modeller med fast eller slumpmässig effekt för att bestämma poolad SVR12, 95 % konfidensintervall och P-värde. Trim and fill-metoden tillämpades för att överbrygga eventuell befintlig publikationsbias.12 STATA 10 användes för att utföra alla delar av dataanalysen.
ResultatStudiescreening
Totalt 606 artiklar identifierades via databassökning. Efter att ha tagit bort dubbletter återstod 459 artiklar för screening. Figur 1 visar antalet artiklar på varje nivå av screening. Två andra artiklar hittades också genom uppdateringssökning. Tjugo av artiklarna i fulltext bedömdes för att avgöra om de var lämpliga och slutligen inkluderades tio artiklar i vår kvantitativa syntes (metaanalys).
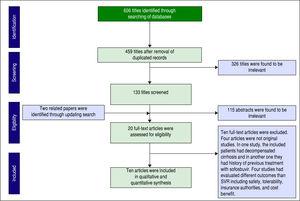
Screening av artiklar baserat på PRISMA-statement.
Risk of bias assessment
Med tanke på tabell 1 kategoriserades alla inkluderade studier som lågrisk (med att ta en poäng på mer än 7) och därför exkluderades inga studier baserat på kvalitetsbedömningen.
Risk of bias assessment for the included studies.
| Förste författare (Referens) | Lokal sekvensgenerering (selektionsbias) | Dekludering av allokering (selektionsbias) | Blindning av deltagare och personal (Perfomance bias) | Blindning av resultatbedömning (Detektion bias) | Inkompletta resultatdata (Attrition) | Selektiv rapportering (Reporting bias) | Co-interventioner | Intention to treat-analys | Gruppslikhet vid baslinjen | Compliance | Timing of outcome assesments | Other biases | Score | Score | Slutsats |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Afdhal, N.31 | ? | ? | + | + | – | – | – | – | – | – | – | – | 8 | Low | |
| Afdhal, N. 7 | ? | ? | + | + | – | – | – | – | – | – | – | – | 8 | Low | |
| Gane, E.J.13 | + | ? | + | + | – | – | – | – | – | – | – | – | 8 | Low | |
| Lawitz, E.19 | – | – | + | + | – | – | – | + | – | – | – | – | 9 | Low | |
| Kowdley, K.6 | ? | ? | + | + | – | – | – | – | – | – | – | – | 8 | Low | |
| Bourliere, M.21 | – | – | – | – | – | – | – | + | – | – | – | – | 11 | Low | |
| Mizokami, M.20 | – | – | + | + | – | – | – | – | – | – | – | – | 10 | Low | |
| Stedman, C.A.M.14 | + | + | + | + | – | – | – | – | – | – | – | – | 8 | Low | |
| Kohli, M.15 | ? | ? | + | + | – | – | – | – | – | – | – | – | 8 | Low | |
| Chuang W.L.22 | ? | ? | + | + | – | – | – | – | – | – | – | – | 8 | Låg |
Kännetecken för de inkluderade studierna
Baserat på målet med denna studie, visade vi egenskaper för varje arm i de inkluderade artiklarna i tabell 2 (kombination av SOF/LDV) och tabell 3 (kombination av SOF/LDV/RBV).
Karakteristika för de inkluderade studierna för kombination av Sofosbuvir plus Ledipasvir.
| Första författare (referens) | Historia av tidigare behandling | Publikationsår | Land | . | Sampelstorlek | Medelålder (SD eller intervall) | Manligt kön (%) | Medel BMI (SD eller intervall) | Behandlingstid (veckor) | Medel HCV RNA, Log IU/mL (SD) | Cirrhos (%) | rs12979860 CC/CT+TTa | HCV Genotyp 1a/1bb |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Afdhal, N.31 | TE | 2014 | USA | 109 | 56 (24-67) | 74 (68) | 29 (19-47) | 12 | 6.5 (0.44) | 22 (20) | 0.1 | 3.73 | |
| Afdhal, N.7 | TN | 2014 | USA | 214 | 52 (18-75) | 127 (59) | 27 (18-41) | 12 | 6.4 (0.69) | 34 (16) | 0.34 | 2.18 | |
| Gane, E.J.13 | TE | 2014 | Nya Zeeland | 10 | 61 (4.9) | 10 (100) | 31 (6.8) | 12 | 6.5 (0.6) | 10 (100) | 0.11 | 4 | |
| Kowdley, K.6 | TN | 2014 | USA | 216 | 53 (20-71) | 128 (59) | 28 (19-45) | 12 | 6.4 (0.8) | 0 (0) | 0.35 | 3.9 | |
| Lawitz, E.19 | TN | 2014 | USA | 19 | 46 (11.6) | 11 (58) | 28.1 (5.8) | 12 | 6.1 (0.8) | 0 (0) | 0.05 | 8.5 | |
| Lawitz, E.19 | TE | 2014 | USA | 19 | 54 (6.6) | 15 (79) | 31.4 (4.7) | 12 | 6.3 (0.5) | 11 (58) | 0.11 | 18 | |
| Kohli, A.15 | TN | 2015 | USA | 20 | 57 (8) | 14 (70) | 25 (4) | 12 | NA | upp till 20% | 0.33 | 1.22 | |
| Mizokami, M.20 | MIX | 2015 | Japan | 171 | 60 (9.2) | 69 (40) | 23.3 (3.6) | 12 | 6.6 (0.5) | 41 (24) | 1.011 | 0.042 | |
| Chuang, W.L.22 | TN | 2016 | Taiwan | 42 | 54 (30-75) | 13 (31) | 24 (19-36) | 12 | 6.6 (0.68) | 5 (12) | 5 | 0.10 | |
| Chuang, W.L.22 | TE | 2016 | Taiwan | 43 | 55 (33-7) | 23 (55) | 24 (20-30) | 12 | 6.6 (0.55) | 4 (9) | 1.26 | 0.16 | |
| Afdhal, N.31 | TE | 2014 | USA | 109 | 56 (25-68) | 74 (68) | 28 (19-41) | 24 | 6.4 (0.57) | 22 (20) | 0.17 | 3.54 | |
| Afdhal, N.7 | TN | 2014 | USA | 217 | 53 (22-80) | 139 (64) | 27 (18-48) | 24 | 6.3 (0.68) | 33 (15) | 0.31 | 2.14 | |
| Bourliere, M.21 | TE | 2015 | Frankrike | 78 | 57 (10.7) | 56 (72) | 26.3 (4.2) | 24 | 6,5 (0,6) | 77 (100) | 0,08 | 1,85 |
Karakteristika för de inkluderade studierna för kombinationen av sofosbuvir plus ledipasvir och ribavirin.
| Första författare (referens) | Historia av tidigare behandling | Publikationsår | Land | . | Sampelstorlek | Medelålder (SD eller intervall) | Manligt kön (%) | Medel BMI (SD eller intervall) | Behandlingstid (veckor) | Medel HCV RNA, Log IU/mL (SD) | Cirrhos (%) | rs12979860 CC/CT+TT* | HCV-genotyp 1a/1b** |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Afdhal,N.31 | TE | 2014 | USA | 111 | 57 (27-75) | 71 (64) | 28 (19-45) | 12 | 6.4 (0.54) | 22 (20) | 0.11 | 3.82 | |
| Afdhal,N.7 | TN | 2014 | USA | 217 | 52 (18-78) | 128 (59) | 27 (18-42) | 12 | 6.4 (0.64) | 33 (15) | 0.53 | 2.55 | |
| Gane, E.J.13 | TN | 2014 | New Zealand | 25 | 45 (9.2) | 8 (32) | 25.2 (4.3) | 12 | 5.9 (0.9) | 0 (0) | 0.56 | 4 | |
| Gane, E.J.13 | TE | 2014 | Nya Zeeland | 9 | 50 (13) | 7 (78) | 25.6 (2.3) | 12 | 25.6 (2.3) | 0 (0) | 0 | 8 | |
| Gane, E.J.13 | TE | 2014 | New Zealand | 9 | 57 (5.2) | 8 (89) | 27.3 (0.5) | 12 | 27.3 (0.5) | 9 (100) | 0.2 | 3.5 | |
| Lawitz, E.19 | TE | 2014 | USA | 21 | 52 (9.8) | 14 (67) | 31.5 (7.3) | 12 | 6.2 (0.4) | 11 (52) | 0.05 | 3.2 | |
| Mizokami, M.20 | MIX | 2015 | Japan | 170 | 59 (9,5) | 73 (43) | 23,3 (3.1) | 12 | 6,6 (0,5) | 35 (21) | 0,86 | 0,024 | |
| Stedman, C.A.M.14 | MIX | 2015 | Nya Zeeland | 14 | 54 (NA) | 12 (86) | 27 (34-20) | 12 | 6.5 (5,6-7,5) | 1 (7) | 0,4 | 2,5 | |
| Bourliere, M.21 | TE | 2015 | Frankrike | 77 | 56 (7,4) | 58 (75) | 27,9 (5.5) | 12 | 6.5 (0.5) | 76 (98.7) | 0.05 | 1.71 | |
| Afdhal, N.31 | TE | 2014 | USA | 111 | 55 (28-70) | 68 (61) | 29 (19-50) | 24 | 6.5 (0.60) | 22 (20) | 0.19 | 3.82 | |
| Afdhal, N.7 | TN | 2014 | USA | 217 | 53 (24-77) | 119 (54) | 26 (18-48) | 24 | 6.3 (0,65) | 36 (17) | 0,5 | 2,01 |
Utvärdering av behandlingsresultat
Vi beräknade poolad SVR12 för fyra HCV-behandlingsregimer inklusive 12 veckors SOF/LDV (A), 24 veckors SOF/LDV (B), 12 veckors SOF/LDV/RBV (C) och 24 veckors SOF/LDV/RBV (D). En sammanfattning av resultaten av dessa metaanalyser visas i tabell 4.
- –
Behandlingsregim A (12 veckors sofosbuvir plus ledipasvir). Tio armar i åtta studier hittades som utvärderade regim A (tabell 2). Det fanns en betydande heterogenitet mellan resultaten från studiearmarna (χ2 = 35,01, P Figur 2A). Både Beggs test (P = 0,074) och Eggers linjära regressionstest (P
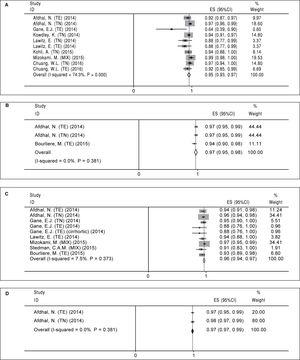 Figur 2.
Figur 2.Poolad SVR12 för Sofosbuvir plus Ledipasvir-regimen efter behandlingstid och tillägg av ribavirin. A. Poolad SVR12 för 12 veckors behandling med sofosbuvir plus ledipasvir. B. Poolad SVR12 för 24 veckors behandling med sofosbuvir plus ledipasvir. C. Poolad SVR12 för 12 veckors behandling med sofosbuvir plus ledipasvir och ribavirin. D. Poolad SVR12 för 24 veckors behandling med sofosbuvir plus ledipasvir och ribavirin. TE: behandlingserfarenhet. TN: treatment naïve.
(0,39MB). - –
Bearbetningsregim B (24 veckors sofosbuvir plus ledipasvir). För behandlingsregim B hittade vi endast tre armar i tre artiklar (tabell 2). Ingen signifikant heterogenitet hittades när det gäller relaterade studier till denna regim (χ2 = 1,92, P = 0,38, I-squared = 0 %). Baserat på en modell med fast effekt var poolad SVR12 för regim B 97 % (95 %CI = 95 %-98 %) (figur 2B). Med tanke på att antalet inkluderade studier var litet (n = 3) utförde vi inga relaterade tester för publikationsbias.
- –
Behandlingsregim C (12 veckors sofosbuvir plus ledipasvir och ribavirin). Nio studiearmar i sju artiklar hittades för denna typ av regim (tabell 3). Eftersom ingen signifikant heterogenitet hittades (χ2 = 8,64, P = 0,37, I-kvadrat = 7,5 %) användes modellen med fast effekt och den sammanlagda SVR12 beräknades till 96 % (95 % KI = 94 %-97 %) (figur 2C). Det fanns publikationsbias baserat på både Beggs (P = 0,009) och Eggers linjära regressionstester (P = 0,001). Baserat på trim- och fyllnadsmetoden beräknades poolad SVR12 till 96 % (95 %CI = 94 %-97 %).
- –
Behandlingsregim D (24 veckors sofosbuvir plus ledipasvir och ribavirin). Som tabell 3 visar fanns det två studiearmar i två artiklar för denna regim. Det fanns ingen signifikant heterogenitet när det gäller resultaten från dessa två studier (χ2 = 0,77, P = 0,38, I-kvadrat = 0 %) och enligt modellen med fast effekt beräknades den poolade SVR12 till 98 % (95 %CI = 97 %-99 %) (figur 2D). På grund av det lilla antalet inkluderade studier (n = 2) kunde vi inte köra de relaterade testerna för publikationsbias.
Sammanfattning av metaanalyser av den uthålliga virologiska svarsfrekvensen för kombinationen av sofosbuvir och ledipasvir.
| Regimen | Ribavirinanvändning | Behandlingstid (veckor) | SVR-frekvens (%) | 95%CI (%) |
|---|---|---|---|---|
| A | No | 12 | 95 | 93-97 |
| B | Nej | 24 | 97 | 95-98 |
| C | Ja | 12 | 96 | 94-97 |
| D | Ja | 24 | 98 | 97-99 |
Effekt av baselineparametrar på uthålligt virologiskt svar
- –
Cirrhos. I de flesta studiearmar för dessa fyra nämnda behandlingsregimer var alla patienter cirrhotiska eller icke-cirrhotiska och därför kunde vi inte göra en metaanalys av oddskvoten (OR). Vi kombinerade dock data från varje arm för varje behandlingsregim och beräknade slutligen OR för effekten av cirros på SVR12 med hjälp av Peto-metoden. Med tanke på figur 3A var det endast i behandlingsregim A som cirros hade en signifikant effekt på SVR12 (OR = 0,21, 95 %CI = 0,07-0,66).
 Figur 3.
Figur 3.Effekt av cirros och tidigare behandlingshistoria på det uthålliga virologiska svaret för sofosbuvir plus ledipasvir-regimen. A. Effekten av cirros på det uthålliga virologiska svaret. B. Effekten av tidigare behandlingshistoria på det uthålliga virologiska svaret.
(0,17MB).- –
Precedent behandlingshistoria. Vi utvärderade effekten av tidigare behandlingshistoria på SVR12. Figur 3B visar kombinerade data relaterade till varje behandlingsregim och ORs (enligt Peto-metoden) relaterade till effekten av tidigare behandlingshistoria. Baserat på denna analys hade tidigare behandlingshistoria ingen signifikant effekt på SVR12 i alla regimer.
- –
NS5A-resistensassocierade substitutioner. Uppgifter om NS5A RAS-substitutioner extraherades från de inkluderade studierna som utvärderade RAS-substitutioner vid baslinjen. Eftersom uppgifter om denna fråga inte fanns tillgängliga för utvärdering av varje regim (A, B, C och D), undersökte vi oundvikligen effekten av RASs på huvudregimen SOF/ LDV med eller utan RBV i 12 eller 24 veckor. Data från tre artiklar ingick inte i denna analys; Gane, et al.13 på grund av att ytterligare ett läkemedel (GS-9669) lades till SOF/LDV-regimen i två studiearmar, Stedman, et al.14 på grund av otillgängliga data om utvärdering av RAS på SVR och Kohli, et al.15 på grund av att de rapporterade otillräckliga data om antalet patienter med SVR och NS5A RAS. Dessutom utvärderade Kowdley och medarbetare6 effekten av SOF/LDV i 8 veckor i en arm i sin studie, och eftersom vi inte kunde separera rapporterade data om NS5A RAS och SVR från denna arm, extraherade vi alla data från denna studie och inkluderade dem i denna metaanalys. Enligt figur 4 hade NS5A RASs en signifikant minskande effekt på SVR i SOF/LDV-regimen (OR = 0,31, 95 % CI = 0,2-0,5). Det fanns ingen heterogenitet mellan resultaten av studierna när det gäller upptäckt av NS5A RASs vid baslinjen och behandlingssvar. Baserat på Beggs (P = 0,65) och Eggers (P = 0,67) test hittades inte heller någon publikationsbias.
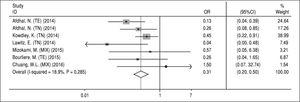 Figur 4.
Figur 4.Effekt av NS5A-resistensassocierade substitutioner på det uthålliga virologiska svaret för sofosbuvir plus ledipasvir-regimen.
(0,12MB).Diskussion
Den aktuella metaanalysen visade den höga effekten av SOF/LDV-kombinationsbehandling hos patienter med kronisk hepatit C genotyp 1-infektion. Den tidigare vårdstandarden för behandling av HCV-genotyp 1-infektion var PegIFN och RBV med mindre än 60 % SVR-frekvens hos patienter med HCV-genotyp 1-infektion och behandlingen åtföljdes av många biverkningar.16
Upptäckten av nyckelproteiner i HCV:s replikationscykel gav möjlighet att rikta in sig på dessa proteiner och hämma produktionen av virioner.17 HCV-behandlingsregimerna har haft en lång historia från IFN-baserade till IFN-fria regimer. Detta gav en behandlingsregim med hög SVR-frekvens, kort behandlingstid och få biverkningar. Målet att ha en IFN-fri behandlingsregim för HCV-genotyp 1-infektion uppnåddes med införandet och godkännandet av SOF/LDV-regimen 2014.18
SOF/LDV kan användas med eller utan RBV och i olika behandlingslängder (12 eller 24 veckor).7 Vissa viktiga faktorer kan beaktas för att välja lämplig regim, t.ex. förekomst av cirros och RBV-kontraindikation. Kostnaden för denna regim är dock en annan betydande faktor för valet av behandlingstid. Intressant nog har det i den aktuella studien visats att SVR i alla regimer på 12 eller 24 veckor med eller utan RBV var lika och mer än 95 %, inklusive 95 % för 12 veckors behandling med SOF/LDV, 97 % för 24 veckors behandling med SOF/LDV, 96 % för 12 veckors behandling med SOF/LDV/RBV och 98 % för 24 veckors behandling med SOF/LDV/RBV. Det stämmer att tillägg av RBV till SOF/LDV eller förlängning av SOF/LDV till 24 veckor kan leda till en liten ökning av SVR12 från 95 % till 96 %. I den aktuella studien observerades dock att cirros (Child-Pugh A) kan påverka (OR = 0,21) SVR12 bara vid 12 veckors behandling med SOF/LDV. Därför rekommenderar vi att cirrotiska patienter (Child-Pugh A) behandlas med SOF/LDV/RBV i 12 veckor eller med SOF/LDV i 24 veckor på grund av RBV-kontraindikation och prisfrågan, medan det verkar som om behandling av icke-cirrhotiska patienter med SOF/LDV i 12 veckor är acceptabel. I denna metaanalys observerades effekten av tidigare behandlingshistorik (andra än SOF-baserade regimer) på behandlingsframgången i ingen av de fyra regimerna med SOF/LDV. Följaktligen rekommenderas inte val av behandlingslängd eller tillägg av RBV till SOF/LDV-regimen baserat på anamnesen av tidigare behandling med PegIFN/RBV eller PI-innehållande regimer.
I denna studie samlade vi in data för bedömning av inverkan av baseline NS5A RAS på behandlingsframgång men i ingen av dessa studier stratifierades data för resistensbedömning med avseende på behandlingsregimen. Därför inkluderades data för alla armar i varje studie i denna metaanalys. I denna metaanalys konstaterades att baseline RASs i NS5A-genen för HCV som parameter påverkade behandlingssvaret. Det är värt att notera att de flesta patienter med behandlingssvikt hade NS5A RASs vid tidpunkten för behandlingssvikten, vilket visar att NS5A RASs spelar en viktig roll för behandlingssvikt hos patienter som behandlas med LDV6,7,19-22. Den kliniska nyttan av bedömningen av NS5A RASs innan behandlingen inleds har dock ännu inte definierats, kanske på grund av den höga behandlingssvarfrekvensen för SOF/LDV och den mycket låga specificiteten hos bedömningen av NS5A RASs för att förutsäga behandlingssvikt.
Introduktionen av andra DAAs och IFN-fria regimer och godkännandet av dessa för behandling av patienter med HCV-genotyp 1-infektion fortsatte efter godkännandet av SOF/LDV. I december 2014 godkändes kombinationen av Ombitas-vir/Paritaprevir-r/Dasabuvir (3 direktverkande antivirala; 3D) för HCV-genotyp 1-infektion med mer än 95 % effekt.23 I januari 2016 godkändes kombinationsbehandlingen med Grazoprevir/Elbasvir (GZR/EBR) med cirka 95 % SVR-frekvens.24 Eftersom SOF har njurmetabolism kan detta antivirala medel inte administreras vid kronisk njursjukdom (kreatininclearance 2) och 3D och GZR/EBR är alternativen för behandling av patienter med kronisk njursjukdom och HCV-genotyp 1-infektion.25,26 Dessutom har andra kombinationer av DAAs såsom SOF/Daclatasvir (27) och SOF/ Velpatasvir28 funnits tillgängliga som pangenotypiska behandlingsregimer.
Slutsatsen är att behandlingen av HCV-genotyp 1 med SOF/LDV-kombinationen ger ett högt (≥ 95 %) behandlingssvar. Beslutet att lägga RBV till SOF/LDV och/eller förlänga SOF/LDV kan fattas baserat på förekomst av cirros, kontraindikation för RBV och kostnadsfrågan. Mer identifiering av HCV-infekterade personer och ökad tillgång till behandling för dem kan bidra till eliminering av HCV.29 Nästa mål inom HCV-behandlingen är utveckling av nya HCV-terapeutiska regimer utan RBV med lovande 100 % behandlingssvar och utan läkemedelsreaktioner.30
Acknowledgements
Författarnas bidrag: Författarnas bidrag: Studiens koncept och utformning: Moyed Saeid Rezaee-Zavareh, Bita Behnava, Seyed Moayed Alavian och Heidar Sharafi, insamling av data: Mohammad Saeid Rezaee-Zavareh, Bita Behnava, Seyed Moayed Alavian och Heidar Sharafi: Mohammad Saeid Rezaee-Zavareh och Khashayar Hesa-mizadeh; analys och tolkning av data: Mohammad Saeid Rezaee-Zavareh, Mohammad Gholami-Fesharaki och Heidar Sharafi: Mohammad Saeid Rezaee-Zavareh, Khashayar Hesamizadeh, Mohammad Gholami-Fesharaki och Heidar Sharafi; kritisk granskning av manuskriptet med avseende på viktigt intellektuellt innehåll: Bita Behnava och Seyed Moayed Alavian.
Författarnas deklaration av personliga intressen
Inget deklarerat.
Deklaration av finansieringsintressen
Inget deklarerat.
- –
Lämna ett svar