” Hur stor är en E. coli-cell och vad är dess massa?
On december 3, 2021 by adminHur stor är en E. coli-cell och vad är dess massa?
Läsarläge
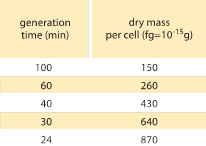
Tabell 1: Samband mellan bakteriemassa och delningstid. Torrmassan per cell anges som en funktion av generationstiden (fördubblingstiden). Massan föreslås öka ungefär exponentiellt med tillväxthastigheten, vilket ursprungligen observerades av M. Schaechter et al J. Gen. Microbiol., 19:592, 1958. Cellens torrvikt beräknades med hjälp av ett värde på 173 µg per OD460-enhet på 1 mL (BNID 106437). Den stam som användes är B/r, en stam som ofta används i tidiga bakteriefysiologiska studier. Värden hämtade från F. C. Neidhardt, ”Escherichia coli and Salmonella: Cellular and Molecular Biology”, Vol. 1., Chapter 3, ASM Press, 1996.
Storleken på en typisk bakterie, t.ex. E. coli, tjänar som en praktisk standardlinjal för att karakterisera längdskalor inom molekylär- och cellbiologi. En ”tumregel” baserad på generationer av ljus- och elektronmikroskopiska mätningar för dimensionerna hos en E. coli-cell är att tilldela den en diameter på ca ≈1µm, en längd på ≈2µm och en volym på ≈1µm3 (1 fL) (BNID 101788). Formen kan approximeras som en sfärocylinder, dvs. en cylinder med halvsfäriska lock. Med tanke på den angivna diametern och längden kan vi beräkna en mer raffinerad uppskattning av volymen på ≈1,3 µm3 (5π/12 för att vara exakt). Skillnaden mellan detta värde och det tumregelvärde som anges ovan visar på den grad av inkonsekvens som vi bekvämt lever med när vi använder tumregler. En av de enklaste vägarna till en uppskattning av massan hos en bakterie är att utnyttja volymen ≈1 µm3 hos en E. coli-cell och anta att den har samma densitet som vatten. Denna naiva uppskattning resulterar i ett annat standardvärde, nämligen att en bakterie som E. coli har en massa på ≈1 pg (pico=10-12). Eftersom de flesta celler består av ungefär 2/3 vatten (BNID 100044, 105482) och de andra komponenterna, som proteiner, har en karakteristisk densitet på ungefär 1,3 gånger vattnets densitet (BNID 101502, 104272) är omräkningen från cellvolym till massa noggrann till ungefär 10 %.
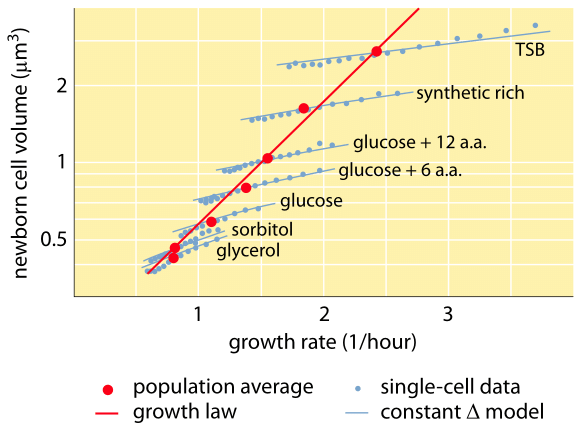
Fig. 1: Samband mellan cellvolym och tillväxthastighet. Med hjälp av mikroskopi och mikrofluidiska anordningar kan cellvolymen mätas på encellnivå under olika förhållanden, vilket bekräftar att den genomsnittliga cellvolymen växer exponentiellt med tillväxthastigheten. Däremot varierar variationen mellan celler för ett givet tillstånd på olika sätt. Variationen i enstaka cellers beteende används för att testa modeller för reglering av cellstorlek. (Anpassat från S. Taheri-Araghi et al., Curr. Biol. 25:385, 2015.)
Ett av de klassiska resultaten inom bakteriefysiologin betonar att plasticiteten i cellernas egenskaper härrör från cellmassans beroende av tillväxthastigheten. Enkelt uttryckt är snabbare tillväxthastighet förknippad med större celler. Denna observation avser fysiologiska förändringar där medier som ökar tillväxthastigheten också ger större celler, vilket visas i figur 1. Detta visade sig också gälla genetiskt där långsiktiga experimentella utvecklingsstudier som ledde till snabbare tillväxthastighet visade större cellvolymer (BNID 110462). Sådana observationer hjälper oss att avliva myten om ”cellen” – där människor, ofta omedvetet, använder mätningar om en cell för att dra slutsatser om andra celltyper eller samma celltyp under andra förhållanden. Klassiska studier av Dennis och Bremer systematiserade dessa mätningar och fann att torrmassan varierar enligt tabell 1 från ett genomsnittligt värde på 148 fg för celler som delar sig var 100:e minut till 865 fg för celler som delar sig var 24:e minut, vilket visar på en mer än femfaldig skillnad beroende på tillväxthastigheten. En liknande trend har setts i andra organismer (t.ex. för knoppande jäst, BNID 105103). Vid ca 70 % vattenhalt motsvarar dessa värden ett intervall mellan ca 0,4 och 2,5 µm3 när det gäller volym. Hur kan vi rationalisera de större storlekarna för celler som växer i snabbare takt? Denna fråga diskuteras än i dag (Molenaar D. et al. MSB 5:323, 2009; Amir, A., Phys. Rev, Let., 112:208102, 2014). Förklaringarna varierar från att föreslå att den har en fördel i det sätt på vilket resursfördelningen sker till att hävda att det faktiskt bara är en bieffekt av att ha en inbyggd period på cirka 60 minuter från det att en cell bestämmer sig för att den har ackumulerat tillräckligt med massa för att påbörja förberedelserna för delning och fram till dess att den avslutar DNA-replikationen och delningsakten. Denna i stort sett konstanta ”fördröjningsperiod” leder till ett exponentiellt beroende av den genomsnittliga cellmassan av tillväxthastigheten i detta resonemang (Amir, A., Phys. Rev, Let, 112:208102, 2014).
Metoder för att mäta cellvolym sträcker sig från användning av en Coulter Counter ((BNID 100004), som härleder volym baserat på förändringar i motståndet i en liten öppning när en cell passerar i den, till mer direkta mätningar med hjälp av fluorescensmikroskopi som mäter celllängder och diametrar under olika förhållanden (figur 1 och BNID 106577, 111480). Det faktum att olika laboratorier inte alltid kommer fram till samma värden kan överraskande nog bero på skillnader i kalibreringsmetoder eller exakta stammar och tillväxtförhållanden. En oöverträffad förmåga att mäta cellmassan uppnås genom att effektivt väga celler på en mikroskopisk cantilever. Som illustreras i figur 2A används vätskeflöde för att tvinga en cell fram och tillbaka i den urholkade klyftan. Mätningen utnyttjar det faktum att cellmassan påverkar svängningsfrekvensen hos klyftan. Denna frekvens kan mätas med en fenomenal noggrannhet och användas för att härleda massor med femtograms precision. Genom att ändra vätskeflödets riktning fångas cellen i minuter eller mer och dess massans ackumulationshastighet mäts kontinuerligt på encellnivå. Vid den första tillämpningen av denna teknik visade det sig att enskilda celler som är större också ackumulerar massa snabbare, vilket kastar ljus över en gammal fråga: Är celltillväxt linjär med tiden eller beskrivs den lämpligare av en ungefärlig exponentiell trend? Skillnaderna kan vara mycket små, men med dessa revolutionerande möjligheter kunde man tydligt se att det senare scenariot bättre representerar situationen i flera testade celltyper, vilket visas i figur 2B.
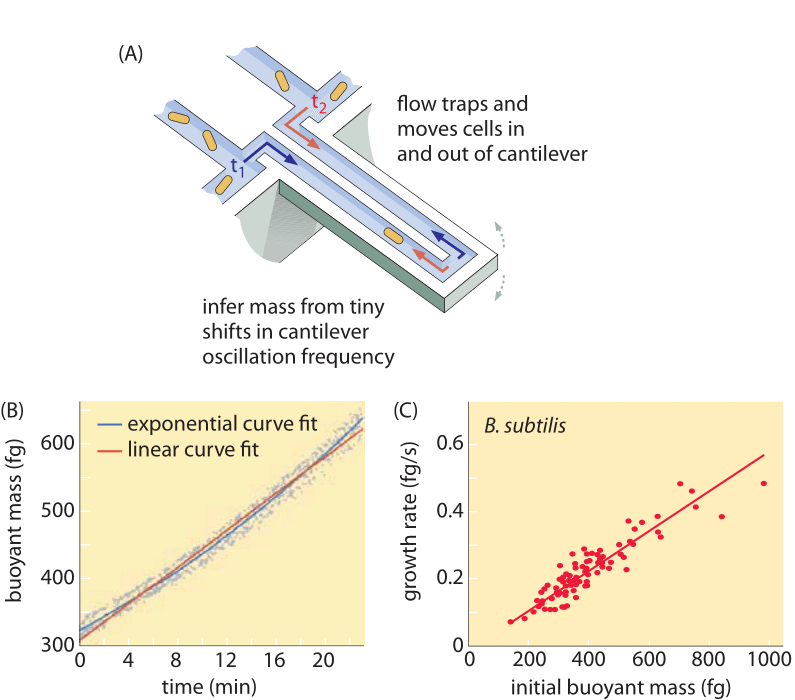
Fig. 2: Användning av flytmassa för att mäta tillväxten hos enskilda celler. (A) En cantilever i mikronskala oscillerar med hög frekvens och cellernas massa kan bestämmas utifrån förändringar i oscillationsfrekvensen. (B) Mätt över tiden resulterar detta i en kurva för ackumulering av massan av en enskild cell enligt bilden. (C) Här visas B. subtilis-celler. En jämförelse mellan förutsägelserna av linjära och exponentiella tillväxtmodeller visas som bästa anpassning. Likheten visar hur nära de två modellerna ligger varandra över ett område med endast tvåfaldig ökning under cellcykelns gång. Cellens torrvikt är ungefär fyra gånger den flytande massan. (Anpassat från M. Godin et al., Nature Meth. 7:387, 2010.)





Lämna ett svar