Bedömning av cellhälsa: Viabilitet och proliferation
On oktober 11, 2021 by adminDel I: Test av viabilitet och proliferation
Viabilitet och proliferation
Viabilitet och proliferation är två olika egenskaper hos celler. Livskraft är ett mått på antalet levande celler i en population medan proliferation är ett mått på celldelning. Det bör noteras att inte alla livskraftiga celler delar sig. Även om proliferation lätt kan tolkas som livskraft bör avsaknad av proliferation inte automatiskt tas som ett tecken på celldöd.
Bedömning av livskraft och proliferation
1. Membranpermeabilitet
Ett kännetecken för döda och döende celler är nedbrytningen av cell- och kärnmembran. Många tester av livsduglighet använder denna egenskap hos celldöd för att skilja livskraftiga från icke livskraftiga celler.
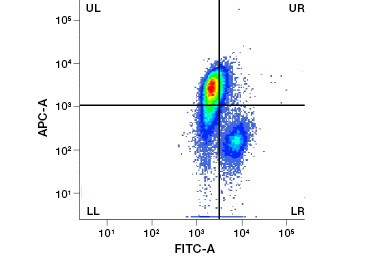
Polära, cellimpermeabla nukleinsyrafärgningar som DAPI, propidiumjodid (PI) och 7-AAD färgar döda celler, eftersom dessa färgningar endast kan tränga in i celler med skadade membran. PI binder både RNA och DNA, medan 7-AAD och DAPI endast interagerar med DNA. Dessa färgämnen kan användas i kombination med analyser som påvisar enzymatisk aktivitet, t.ex. esterassubstrat som diskuteras i nästa avsnitt, eller med cellpermeabla viabilitetsindikatorer för att märka levande och döda celler samtidigt. PI-, DAPI- och 7-AAD-analyser kan avläsas med hjälp av ett fluorescensmikroskop, en flödescytometer (figur 1) eller en mikroplattavläsare.
A.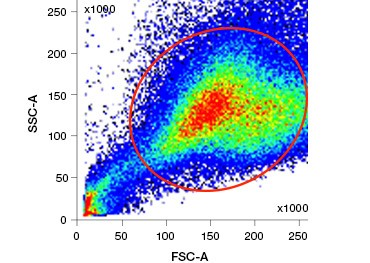
B.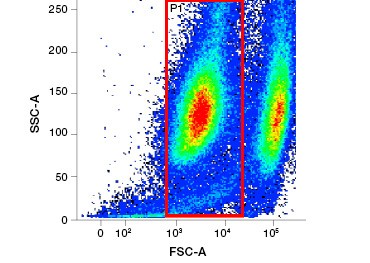
Figur 1. Propidiumjodidfärgning förbättrar identifieringen av intressanta celler. Gating av levande celler med hjälp av framåt- och sidospridning är kanske inte tillräckligt för att avlägsna döda celler och ospecifik bindning kan fortfarande förekomma (A). Användning av livsduglighetsfärgämnen som propidiumjodid kan hjälpa till att eliminera ospecifik bindning (B). J774-makrofager färgades för CD11b och CD3, där den röda cirkeln och rektangeln anger gatingstrategin för levande celler.
Timing är kritisk vid användning av dessa färgämnen eftersom fraktionen färgade celler ökar under färgningen eftersom cellerna fortsätter att dö. Det bör noteras att inget av dessa färgämnen är fixerbart. För tillämpningar som kräver fixering är ethidiummonoazider eller aminreaktiva proteinfärgningar ett utmärkt val.
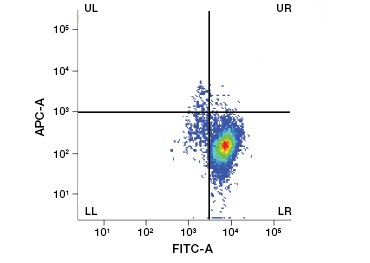
Cellimpermeabla proteinfärgningar är ett utmärkt alternativ till nukleinsyrafärgningar, eftersom de är mindre giftiga. Aminreaktiva färgämnen finns i ett brett spektrum av excitations- och emissionsspektrum och ger därför större flexibilitet i utformningen av flödescytometri- och mikroskopipaneler än DNA-färgämnen. En annan fördel med dessa proteinfärgningar är att de är fixerbara (figur 2).
A.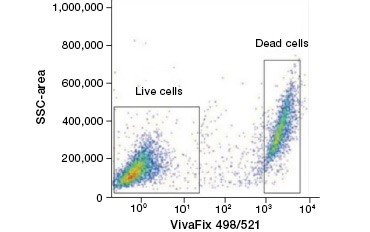
B.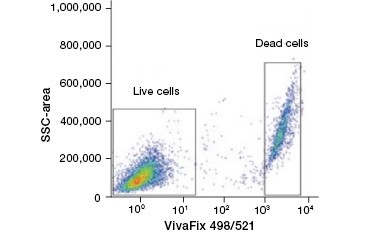
Figur 2. Proteinfärgningar skiljer levande från döda celler. Med hjälp av VivaFix™ Cell Viability Assays kan levande och döda cellpopulationer identifieras och därefter analyseras i fixerade (A) och ofixerade (B) celler med hjälp av flödescytometri.
Ett särskilt övervägande vid användning av den vanliga proteinfärgningen trypanblått är att detta färgämne kommer att färga livskraftiga celler över tiden på ett cellspecifikt sätt. Det är därför viktigt att optimera protokollen för trypanblått för varje celltyp och experiment.
Alla dessa färgämnen kan användas på enskilda celler och vävnader och utvärderas med hjälp av fluorescensmikroskopi eller flödescytometri, även om trypanblått-färgningen vanligen utvärderas genom att man räknar cellerna manuellt med hjälp av en hemocytometer och ett mikroskop.
Till skillnad från cellimpermeabla nukleinsyrafärgningar diffunderar cellpermeabla nukleinsyrafärgningar, t.ex. acridinorange, lätt genom cellmembraner och färgar därmed DNA i livskraftiga celler. Icke livskraftiga celler färgas inte effektivt eftersom deras skadade membran låter färgämnet lätt diffundera ut ur dem. Acridinorange är ett färgämne med dubbel fluorescens som avger grön fluorescens när det är bundet till dsDNA och röd fluorescens när det är bundet till ssDNA och RNA. När man använder acridinorange som DNA-bindningsfärgämne ska man komma ihåg att det inte binder kondenserat kromatin på ett effektivt sätt. Som diskuteras i avsnitt 6 kan detta färgämne också användas för att bedöma cellernas förmåga att bibehålla surt pH i lysosomerna, vilket är en annan indikator på cellens livskraft. Cellpermeabla nukleinsyrafärgningar kan användas för att identifiera och kvantifiera livskraftiga cellpopulationer genom mikroskopi, flödescytometri eller mikroplattaanalys.
Cellimpermeabla och permeabla färgämnen kan användas i kombination med fluorescerande märkta antikroppar mot proteiner av intresse, vilket gör det enkelt att inkludera viktiga kontroller av livskraften i varje experiment. Ett viktigt övervägande när man använder dessa färgämnen för att bedöma membranintegriteten är att olika celltyper har olika egenskaper för membranpermeabilitet. Till exempel färgar vissa cellimpermeabla DNA-färger lätt döda eukaryota celler, men kan inte färga prokaryoter med skadade membran.
Membranintegritet kan också bedömas med hjälp av enzymatiska analyser. Ett populärt val är att bedöma läckage av det cytoplasmatiska enzymet laktatdehydrogenas (LDH) till kulturmediet vid celldöd. LDH-kolorimetriska analyser kan utföras i mikroplattformat och avläsas med hjälp av en ELISA-mikroplattläsare.
Membranens sönderfall kan också mätas med hjälp av analyser för frisättning av krom. Här är cellerna förmärkta med 51Cr före experimentell behandling. Krom binds till cellulära proteiner och frigörs i kulturmediet vid celldöd. Genom att bestämma mängden fritt respektive bundet 51Cr med hjälp av en scintillationsräknare kan celldöd mätas kvantitativt. Cellerna kan också förmärkas med fluorescerande färgämnen. Dessa metoder lider ibland av hög bakgrund på grund av spontan frisättning av märken; de är användbara endast för tillämpningar som tillåter förmärkning av celler av intresse.
2. Enzymatisk aktivitet
En annan viktig distinktion mellan livskraftiga och icke livskraftiga celler är att livskraftiga celler är enzymatiskt aktiva. Esterasaktivitet, som mäts med hjälp av substrat som karboxyfluoresceindiacetat (CFDA), används vanligen som en indikator på den totala enzymatiska aktiviteten. CFDA är ett icke-fluorescerande, cellpermeabelt färgämne som hydrolyseras för att bilda den fluorescerande molekylen karboxyfluorescein av icke-specifika intracellulära esteraser som endast finns i livskraftiga celler. Eftersom karboxifluorescein är negativt laddat behålls det icke-kovalent i livskraftiga celler, vilket resulterar i grön fluorescens.
CFDA-SE är ett derivat av CFDA som behålls bättre vid hydrolys. Dess produkt, CFSE, har succinimidylestergrupper som bildar kovalenta bindningar med primära aminer i intracellulära proteiner, vilket möjliggör långsiktig spårning av cellens livskraft. Eftersom CFSE behålls kovalent i cellerna är det en mer tillförlitlig indikator på cellens livskraft och ett populärt mått på cellproliferation, eftersom dess fluorescens halveras vid varje celldelning (figur 3). Förbättringar av CFDA-SE har gjorts med proliferationsfärgämnen som har större cellretention, ger högre upplösning av celldelning och finns tillgängliga i ett brett spektrum av excitations- och emissionsspektrum för att möjliggöra inkorporering i flerfärgsfluorescenstillämpningar som flödescytometri.
A.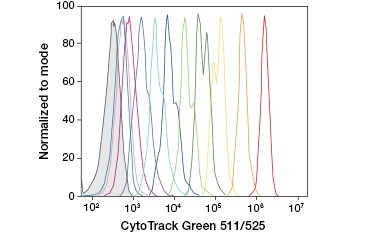
B.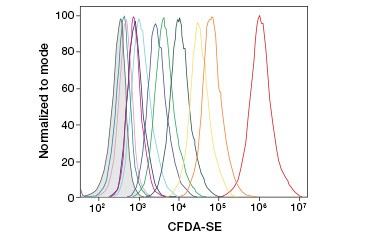
Figur 3. Spårning av cellgenerationer med hjälp av flödescytometri. Tio cellgenerationer kan lösas upp med hjälp av CytoTrack™ Green 511/525 Cell Proliferation Assay (A) och upp till åtta med hjälp av CFDA-SE (B).
Många andra fluorescerande esterasubstrat, t.ex. kalceinderivat och BCECF, finns tillgängliga med varierande egenskaper, inklusive skillnader i excitations-/emissionsspektra. Eftersom BCECF:s fluorescens är pH-känslig kan den också spåra förändringar i cytosoliskt pH.
Med hjälp av cellpermeabla esterassubstrat kan livskraften bedömas genom fluorescensmikroskopi och flödescytometri. Dessa substrat kan också appliceras på vävnadsprover eller användas i mikroplattaanalyser med hög genomströmning.
3. Metabolisk aktivitet
Ett annat vanligt mått på cellens livskraft är metabolisk aktivitet, som kan utvärderas med hjälp av oxiderbara och reducerbara prober.
Resazurin är en populär oxidation-reduktion (redox)-indikator. Detta cellpermeabla färgämne kan tillsättas direkt till cellodlingsmedier, vilket gör det till en snabb och bekväm analys. I metaboliskt aktiva celler reduceras blått och svagt fluorescerande resazurin till resorufin, en rosa och starkt fluorescerande molekyl. Denna förändring kan övervakas med hjälp av både fluorescerande och kolorimetriska tester. Eftersom mängden fluorescens är direkt proportionell mot antalet levande, respirerande celler används resazurin ofta för att kvantitativt mäta cellens livskraft. Resazurin är ett bekvämt, känsligare, stabilare och giftfritt alternativ till andra redoxindikatorer, t.ex. tetrazoliumsalterna MTT och XTT. Till skillnad från tetrazoliumsaltbaserade tester, som är kolorimetriska och endast kan avläsas med hjälp av en mikroplattavläsare, kan resazurin-viabilitetsanalyser avläsas med hjälp av flödescytometri eller fluorescensmikroskopi. Resazurin och tetrazoliumsalter är särskilt användbara för tillämpningar med hög genomströmning eftersom viabiliteten kan bedömas i mikroplattor med hjälp av en mikroplattläsare (figur 4). XTT väljs ofta framför MTT för tillämpningar med högre genomströmning eftersom det till skillnad från MTT ger ett vattenlösligt färgämne, vilket eliminerar ett solubiliseringssteg som är avgörande för MTT-analyser. Resazurin- och tetrazoliumsalter används oftast för att bedöma livsdugligheten hos adherenta celler och celler i lösning.
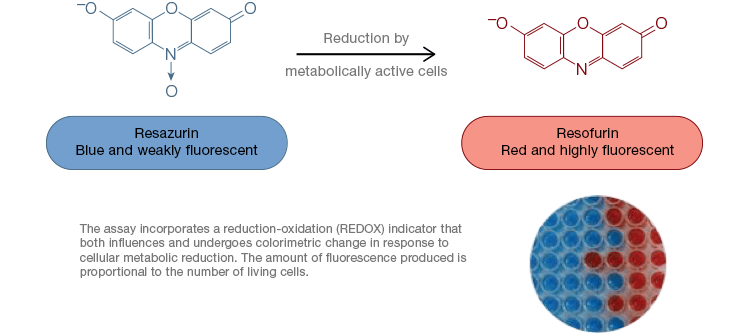
Fig. 4. Icke-toxiska resazurinoxidationsanalyser är lätt skalbara för tillämpningar med hög genomströmning. Oxidation av alamarBlue i metaboliskt aktiva celler resulterar i en kolorimetrisk förändring från blått till rött samt en ökning av fluorescensen.
Dihydrorhodaminer, -kalceiner och -fluoresceiner är reducerade rhodamin-, -kalcein- och -fluoresceinderivat som är cellpermeanta och färglösa. Dessa föreningar oxideras lätt till sitt fluorescerande moderfärgämne av reaktiva syrearter som finns i levande celler och vävnader.
En annan klass av viabilitetsanalyser som mäter metabolisk aktivitet är luminescerande ATP-analyser. Dessa kvantifierar ATP som frigörs av celler vid lysis. De kräver inga långa inkubationsperioder, är extremt känsliga och avläses vanligen med hjälp av en mikroplattläsare.
En faktor att ta hänsyn till när man använder tester som mäter metabolisk aktivitet är att den metaboliska aktiviteten kan skilja sig åt under olika cellodlingsförhållanden. Korrekta kontroller måste därför inkluderas för att ta hänsyn till dessa skillnader.
4. DNA-syntes/replikation
Ett annat mått på livsduglighet, och en populär metod för att bedöma proliferation, är kvantifiering av BrdU-inkorporering i nysyntetiserat DNA. BrdU-innehållande DNA identifieras med hjälp av konjugerade BrdU-antikroppar eller BrdU-antikroppar i kombination med en konjugerad sekundär antikropp (figur 5). Dessa analyser möjliggör en mängd olika avläsningar eftersom antikroppar kan kopplas till olika typer av indikatorer (fluorophorer, peroxidaser osv.). Antikroppsmärkning av specifika cellmarkörer gör det också möjligt att särskilja specifika proliferationspopulationer. Proverna fixeras efter inkubationen och analyseras sedan med hjälp av flödescytometri, fluorescensmikroskopi, immunohistokemi eller mikroplattavläsare. Med hjälp av flödescytometri kan cellerna hänföras till G0/G1-, S- eller G2/M-fasen i cellcykeln baserat på deras totala DNA-innehåll. Genom att använda kromogena peroxidasubstrat kan analyser avläsas utan en fluorometer. Och genom att använda -TdR i stället för BrdU kan dessa analyser omvandlas till en avläsning med radiomärkning.
A.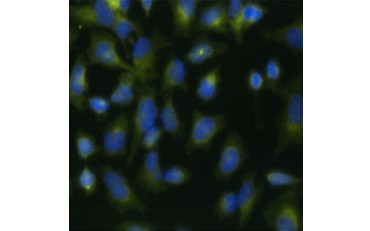
B.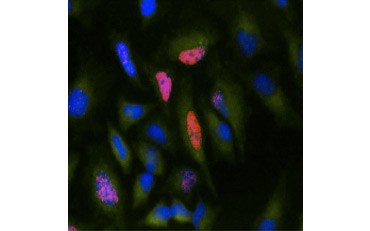
Fig. 5. Visualisering av BrdU-inkorporering. HeLa-celler behandlades med 10 µg BrdU i 1 timme (B) eller lämnades obehandlade (A). Cellerna färgades med mus-anti-BrdU-antikropp, klon Bu20a (MCA2483; 1:25 spädning) och get-anti-mus-IgG (H/L) DyLight 549-konjugerad antikropp (röd) (STAR117D549GA; 1:50 spädning) användes som sekundär antikropp. Cytoplasman färgades med antikropp mot GAPDH från kanin (AHP1628; 1:100 utspädning) och antikropp mot får-havre-IgG DyLight 488-konjugerad antikropp (grön) (STAR36D488GA; 1:50 utspädning) användes som sekundär antikropp. PureBlu™ DAPI (1351303) användes som nukleär motfärgning.
5. Proliferationsmarkörernas uttryck
Det är känt att vissa proteiner ökar i uttryck under cellproliferation. Ki-67, till exempel, uttrycks i cellkärnan hos celler som delar sig men kan inte påvisas under G0 och G1 (figur 6). På samma sätt kan histon H3-fosforylering användas för att identifiera celler i M-fasen. Andra vanliga proliferationsmarkörer är PCNA (proliferating cell nuclear antigen) och MCM2 (minichromosome maintenance 2). Med hjälp av antikroppar mot dessa, andra viktiga proliferationsmarkörer eller cellinformationsmarkörer kan man bedöma dem med hjälp av ELISA, flödescytometri, immunohistokemi, fluorescensmikroskopi och Western blotting.
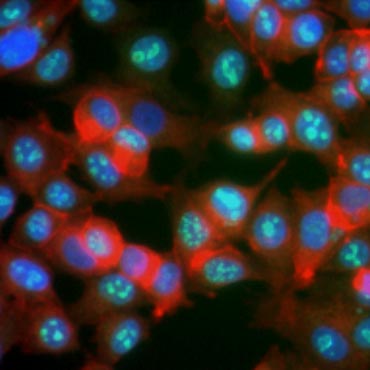
Fig. 6. Antikroppar mot Ki-67 identifierar prolifererande celler. Färgning av MCF-7-celler med humant anti Ki-67 (HCA006, grönt) motfärgat med phalloidin (rött) och Hoechst (blått).
6. Membranpotential och pH
Livande celler upprätthåller aktivt jongradienter över sina membran, vilket genererar transmembranpotential. När en cell dör störs dessa jongradienter. Detta kan bedömas med hjälp av potentiometriska färgämnen. JC-1 är ett vanligt potentiometriskt färgämne. I friska celler lokaliseras JC-1 till mitokondrierna, där det bildar röda fluorescerande aggregat. Vid nedbrytning av mitokondriernas membranpotential diffunderar JC-1 genom hela cellen och existerar som en grön fluorescerande monomer. Tetrametylrhodaminetylestrar (TMRE) och tetrametylrhodaminmetylestrar (TMRM) lokaliseras liksom JC-1 till mitokondrier i friska celler och till cytoplasman i döende celler. Till skillnad från JC-1 uppvisar dessa färgämnen ingen förskjutning i sina emissionsspektrum. I stället leder permeabilisering av mitokondriernas yttre membran till en minskning av TMRM/TMRE:s röda fluorescens.
Viabla celler kan generera och bibehålla ett lågt pH i cellens sura organeller, t.ex. lysosomen. Detta kan mätas med hjälp av acidotropa färgämnen som acridinorange och neutralt rött. Ett övervägande när man använder acridinorange är att detta färgämne också binder DNA och RNA. När det är bundet till enkelsträngade nukleotider fluorescerar acridinorange rött, när det är bundet till dubbelsträngat DNA fluorescerar det grönt och när det är bundet till DNA i lysosomen fluorescerar det orange.
Oavsett vilken metod som väljs är det ytterst viktigt att inkludera lämpliga kontroller vid utförandet av någon av de analyser som beskrivs här, eftersom försöksförhållanden och celltyp kan förändra resultatet av vissa analyser. Ta alltid med positiva och negativa kontroller. Vid användning av sonder i lösningsmedel ska du även inkludera fordonbehandlade kontroller för att ta hänsyn till effekterna av lösningsmedlet. Använd applikationsspecifika kontroller för att kontrollera faktorer som autofluorescens i immunofluorescens- och flödescytometriexperiment och laddningskontroller för Western Blotting.
För information om Bio-Rads cellviabilitets- och proliferationsanalyser, besök vår sida om cellhälsosortimentet.
Läs del II Bedömning av cellhälsa: Apoptosis
alamarBlue är ett varumärke som tillhör Trek Diagnostic Systems. DyLight är ett varumärke som tillhör Thermo Fisher Scientific.
Lämna ett svar