Reacții asupra carbonului „benzilic”: bromurare și oxidare
On octombrie 12, 2021 by adminCarbonul adiacent unui inel aromatic – carbonul „benzilic” – poate participa la mai multe reacții utile și interesante. Astăzi vom oferi exemple și mecanisme pentru două exemple cheie: bromurarea benzilică și oxidarea benzilică. Iată rezumatul rapid:
Tabloul cuprinsului
- Grupuri alchilice = „rugozitate”
- Există ceva special în legătură cu grupurile alchilice adiacente unui inel benzenic
- „Fenil” vs „benzil” : Care este diferența?
- Radicalii benzilici sunt stabilizați prin rezonanță; radicalii fenilici nu sunt.
- Legăturile C-H benzilice (și alilice) sunt slabe, în raport cu alte legături C-H alchilice
- Bromurarea benzilică
- Când NU funcționează „bromurarea benzilică”?
- Aplicații ale bromării benzilice
- Oxidarea benzilică cu KMnO4 (sau H2CrO4)
- Oxidarea benzilică necesită o legătură C-H benzilică
- De ce este acest lucru important?
- Note
- Întrebați-vă!
- (Avansat) Referințe și lecturi suplimentare
Grupuri alchilice = „furaje grosiere”
În nutriție, „furaje grosiere” este modul în care se numește toată celuloza și fibrele prezente în produsele alimentare care pur și simplu trec prin corpul dumneavoastră fără a fi efectiv digerate.
Acest lucru descrie destul de bine comportamentul grupărilor alchil în marea majoritate a reacțiilor de chimie organică pe care le-am învățat. Chimia lor este „plictisitoare”. Ele pot cuprinde coloana vertebrală și structura generală a moleculei, dar legăturile lor C-H sunt inerte la majoritatea condițiilor de reacție.
De fapt, dacă nu puneți la socoteală combustia, cam singura reacție a grupărilor alchil pe care o acoperim în chimia organică introductivă este substituția radicalică liberă. Și chiar și această reacție tinde să fie destul de puțin selectivă, în special dacă aveți de-a face cu clorurarea radicalică liberă.
Am văzut că o excepție de la acest comportament „plictisitor” poate fi găsită în bromurarea radicalară liberă a așa-numitelor legături C-H „alilice” . Poziția „alilică” este un carbon care este adiacent unei duble legături (nu un C-H pe dubla legătură însăși! acela este un C-H „vinilic”).
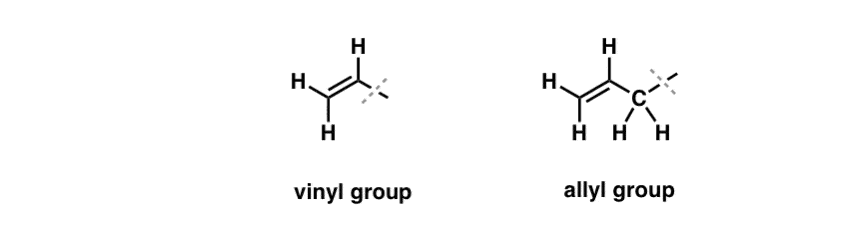
Ce face ca poziția „alilică” să fie atât de specială? Radicalii, carbocationii și anionii alilici sunt considerabil stabilizați prin rezonanță. Orbitalul radicalului, carbocationului sau anionului alilic se poate alinia cu orbitalii p din legătura pi adiacentă, rezultând un „sistem pi” mai mare și împrăștiind sarcina pe o suprafață mai mare.
Există ceva special în legătură cu grupurile alchilice adiacente unui inel benzenic
Care este motivul acestei mici călătorii pe calea memoriei? Ei bine, am petrecut recent puțin timp trecând în revistă reacția de alchilare Friedel-Crafts și nu vreau să vă dau impresia că punerea unei grupări alchil pe un inel benzenic este o fundătură sintetică.
Grupările alchil nu trebuie să fie inerte! La fel ca și carburile alilice, grupările alchil care sunt adiacente inelelor benzenice sunt deosebit de reactive, iar acest lucru poate avea tot felul de aplicații importante.
Există două reacții importante pe care le vom aborda în această postare:
- Bromurarea benzilică – bromurarea radicalară a grupării alchil adiacente unui inel aromatic
- Oxidarea benzilică – oxidarea completă a unei grupări alchilice adiacente benzenului la un acid carboxilic.
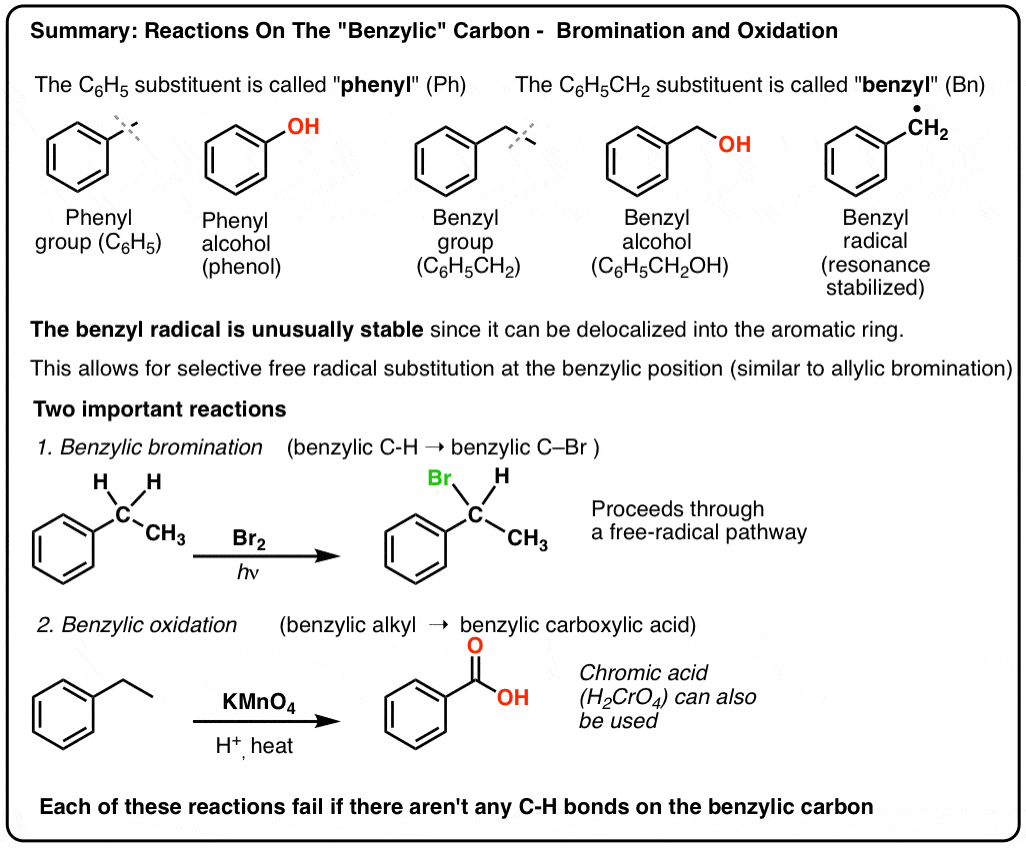
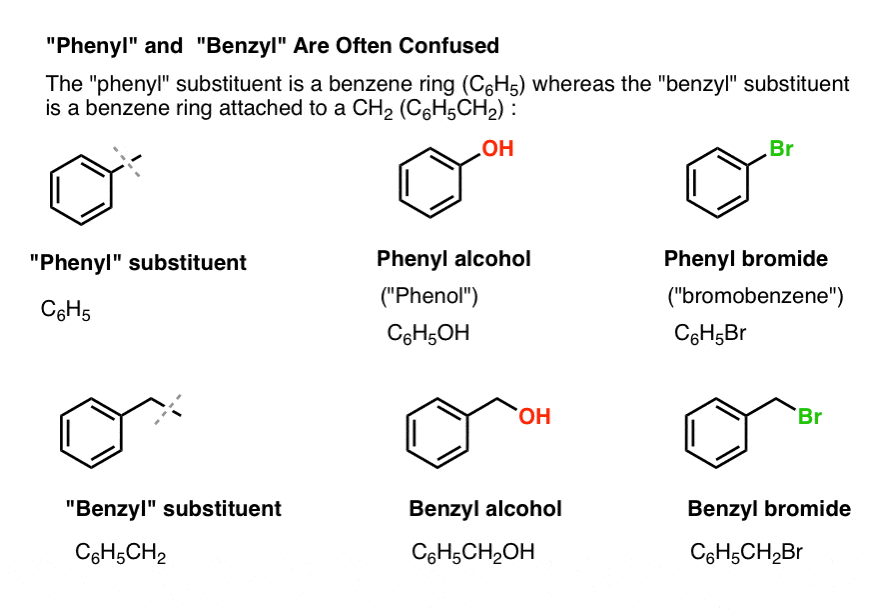
3. „Fenil” vs. „Benzil” : Care este diferența?
În primul rând, o scurtă ordine de zi. Să eliminăm câteva elemente importante de nomenclatură, deoarece „fenil” și „benzil” provoacă multă confuzie:
- O grupare fenil (sau substituent fenil) este benzenul minus un hidrogen: C6H5 . Carbonații din inel sunt carboni fenilici, iar hidrogenii atașați la carbonații fenilici sunt legături fenil C-H. Este analog cu vinilul (vezi mai sus).
- O grupare benzilică este metilbenzenul minus un hidrogen: C6H5CH2 . Carbonul adiacent inelului este carbonul benzilic, iar hidrogenii atașați de carbonul benzilic se numesc hidrogeni benzilici. Este analog cu alilul (de mai sus).
4. Radicalii benzilici sunt stabilizați prin rezonanță; radicalii fenilici nu sunt.
Analogia fenilului cu vinilul și a benzilului cu alilul se extinde și la stabilitatea radicalilor lor (precum și a carbocationilor și anionilor lor).
- Radicalii fenilici nu sunt stabilizați prin rezonanță, deoarece orbitalul care conține radicalul este în unghi drept față de orbitalii sistemului pi și nu există suprapunere între ei. Radicalii de pe carboni hibridizați sp2 sunt, în general, mai puțin stabili decât radicalii de pe carboni alchilici. (Vezi postarea: Trei factori care destabilizează radicalii liberi )
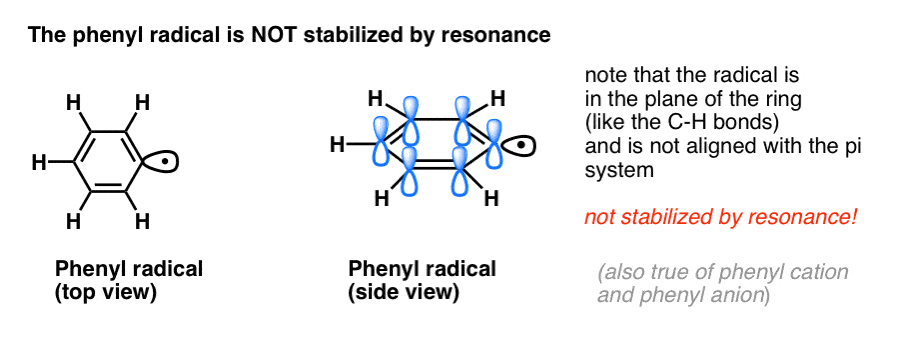
- Radicalii benzilici sunt neobișnuit de stabili, deoarece orbitalul care conține radicalul se poate alinia cu sistemul pi al inelului benzenic, la fel ca la verii lor alilici (acest lucru este valabil și pentru cationii și anionii benzilici).
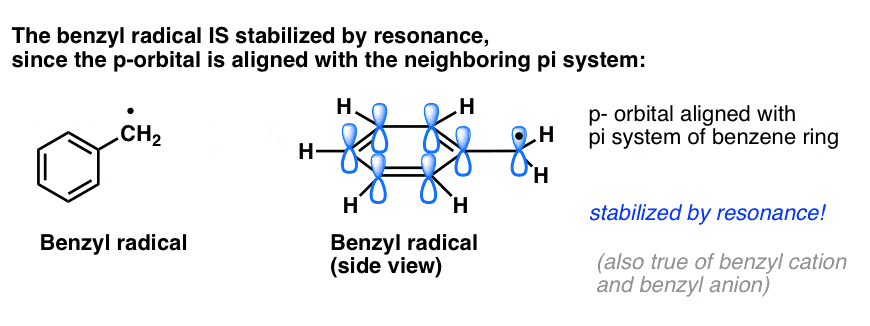
Legăturile C-H benzilice (și alilice) sunt slabe, în raport cu alte legături C-H alechilice
Legăturile C-H benzilice au rezistențe de legătură (aka BDE-uri, sau energiile de disociere a legăturilor) de aproximativ 90 kcal/mol, ceea ce este considerabil mai slab decât legăturile C-H terțiare (puterea legăturii 93 kcal/mol), C-H secundare (96 kcal/mol) și C-H primare (100 kcal/mol). (Legăturile C-H fenilice sunt de aproximativ 113 kcal/mol, reflectând din nou instabilitatea radicalilor fenilici ).
Din moment ce energiile de disociere a legăturii reflectă ușurința scindării omolitice a legăturii C-H (adică cât de ușor este de disociat legătura în doi radicali liberi) acesta este un alt mod de a spune că radicalii benzilici sunt deosebit de ușor de format, în raport cu alți radicali alchilici.
Am văzut anterior că același lucru este valabil și pentru legăturile C-H alilice . În „bromurarea alilică”, una dintre legăturile C-H de pe gruparea alchilă adiacentă unei duble legături este transformată într-o legătură C-Br, folosind N-bromosuccinimidă (NBS) și lumină (hν) :
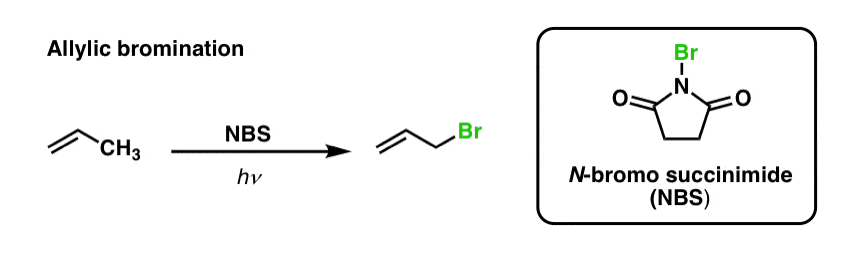
Reacția este selectivă pentru C-H alilică în prezența legăturilor C-H primare, secundare și terțiare, datorită rezistenței mai slabe a legăturii C-H alilice (89 kcal/mol).
Bromurarea benzilică
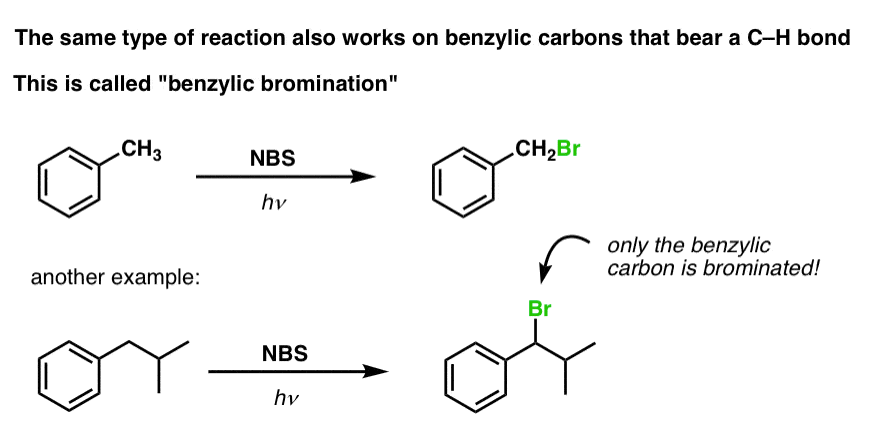
Un proces similar funcționează pentru carboni „benzilici”. Putem folosi NBS (ca mai sus) sau pur și simplu doar Br2, deoarece inelele aromatice nu sunt nici pe departe atât de reactive cu Br2 cum sunt legăturile duble.
După ce s-a format (prin „căldură” sau „lumină”, care inițiază reacția prin disocierea homolitică a Br-Br), radicalul de brom, Br- poate rupe legăturile C-H benzilice mai slabe fără a atinge legăturile C-H alchilice mai puternice.
De exemplu, iată produsele reacției sale cu toluenul, dar și cu izopropilbenzenul. Observați că NUMAI carbonul benzilic este bromat. Restul este lăsat în pace!
Mecanismul de bromurare benzilică este în esență identic cu cel al bromurării alilice, cu etape de inițiere, propagare și terminare. (Faceți clic aici pentru a vedea o imagine pop-up a mecanismului.)
(Pentru mai multe discuții, consultați această postare: Bromurarea alilică )
Când NU funcționează „bromurarea benzilică”?
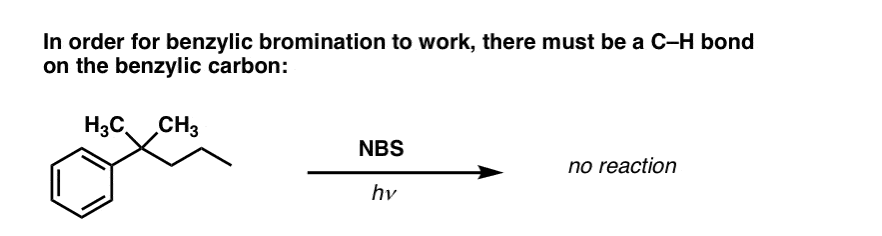
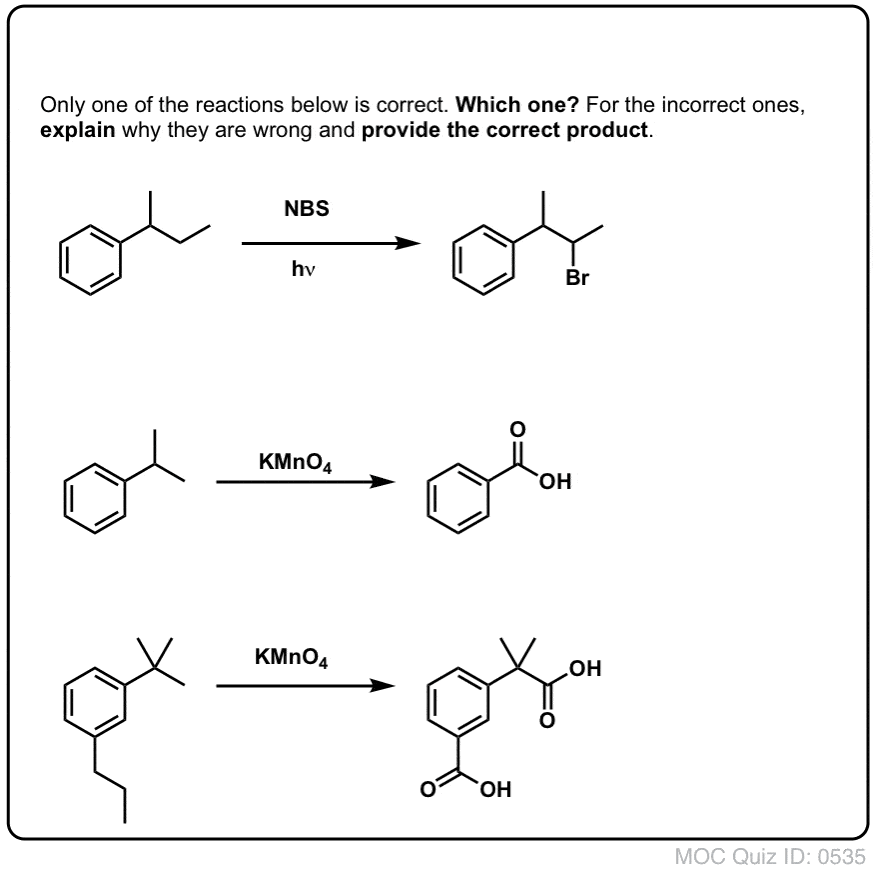
Din moment ce cheia acestei reacții este formarea radicalului benzilic (relativ stabil), bromurarea benzilică va eșua pe substraturile în care generarea acestui radical prin ruperea unei legături C-H este imposibilă.
De exemplu, priviți exemplul de mai jos. Cum este posibil să se genereze un radical benzilic atunci când carbonul benzilic are atașate trei grupe alchil? Nu se poate – și reacția eșuează.
Aplicații ale bromurării benzilice
Atunci, de ce ar putea fi utilă bromurarea benzilică?
Ei bine, ne permite să folosim toate reacțiile halogenurilor de alchil pe care le-am abordat în Org 1 – în principal substituția și eliminarea – pentru a obține produse care ar fi dificil de instalat direct pe un inel aromatic prin reacții Friedel-Crafts.
De exemplu, se poate folosi bromurarea benzilică pentru a instala o reacție SN2, de exemplu după o alchilare Friedel-Crafts:
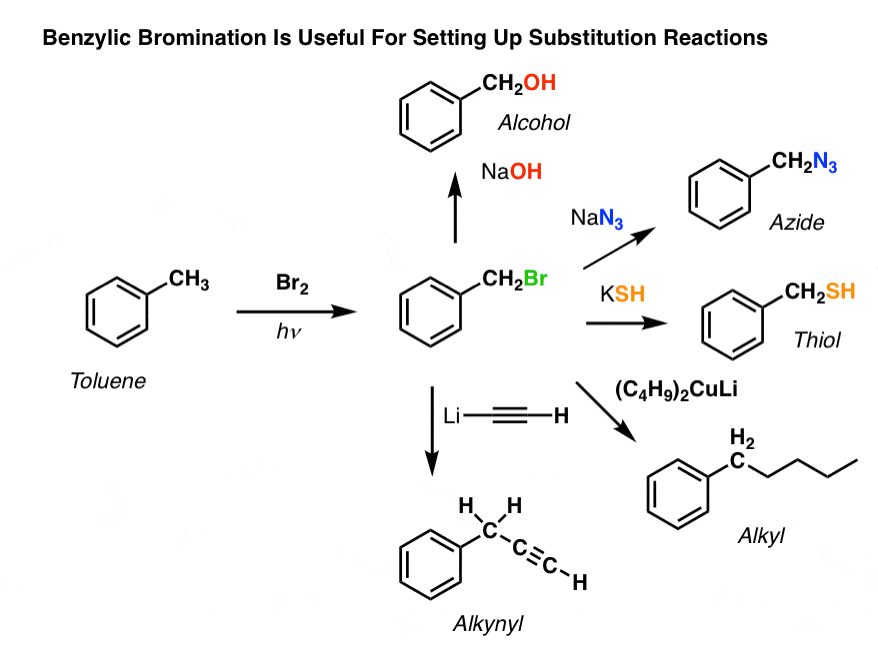
Vezi cum instalarea unei bune grupări de plecare în poziția benzilică ne oferă tot felul de opțiuni pentru instalarea diferitelor grupări funcționale?
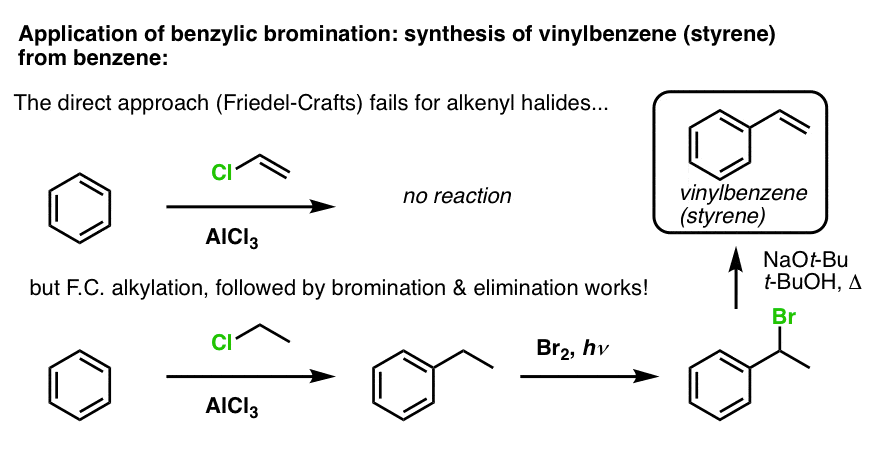
Un alt exemplu este sinteza stirenului din benzen. La prima vedere, cea mai directă abordare ar putea părea a fi reacția Friedel-Crafts a clorurii de vinil cu benzenul. Dar reacția Friedel-Crafts nu funcționează pentru halogenurile de alchenil (aka halogenuri de vinil)! (carbocationii de vinil sunt mai puțin stabili decât carbocationii de alchil).
Potem ocoli acest blocaj realizând o alchilare Friedel-Crafts cu clorură de etil, urmată de o bromurare benzilică și apoi de eliminare (prin E2, cu ceva de genul NaOtBu/t-BuOH) pentru a obține alchena:
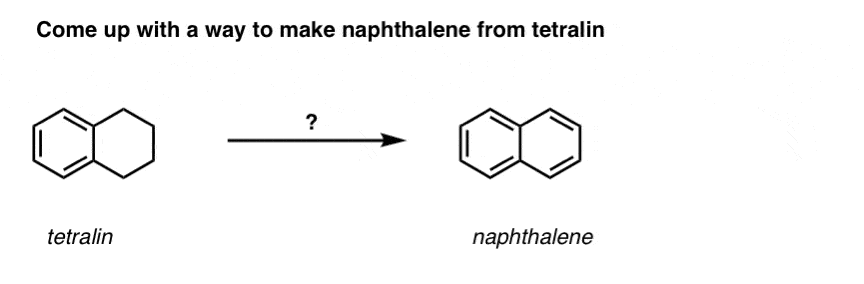
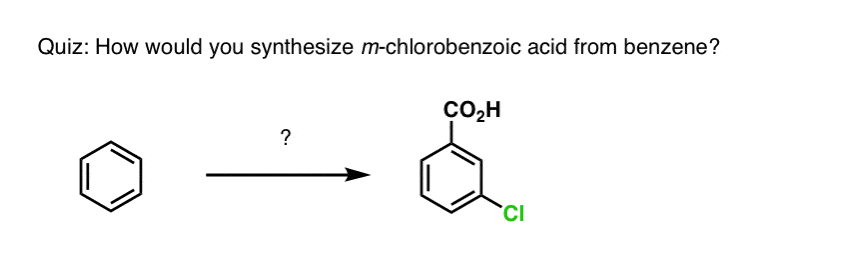
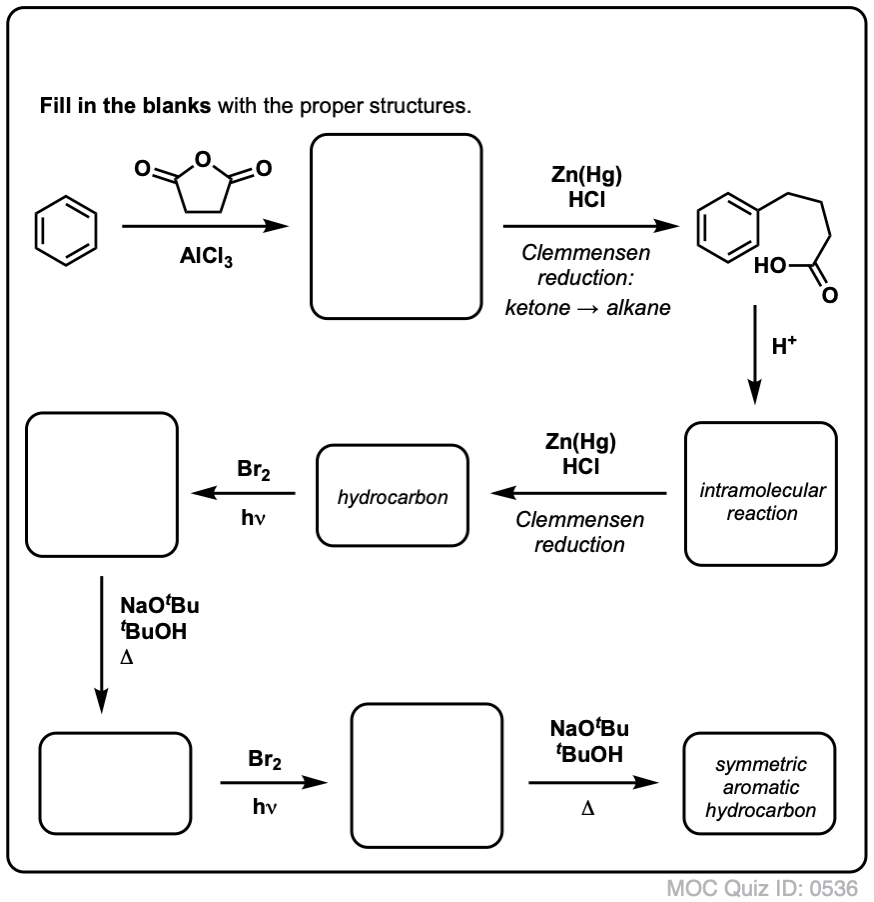
Pe baza celor de mai sus, iată un test rapid pentru voi. Cum ați putea transforma tetralina (mai jos în stânga) în naftalină (mai jos în dreapta)? Răspundeți în notele de subsol.
9. Oxidarea benzilică Cu KMnO4 (sau H2CrO4)
Din moment ce legătura C-H benzilică este relativ slabă, v-ați putea întreba, pe bună dreptate, dacă în această poziție se pot realiza și alte tipuri de reacții (în afară de bromurare).
Cu siguranță se pot realiza! Un prim exemplu este oxidarea benzilică – unde se rupe o legătură C-H benzilică și se formează o legătură C-O benzilică.
Acum: există reactivi destul de blânzi pentru oxidarea benzilică, care sunt echivalentul chimic al gâdilării legăturii C-H cu o pană, rezultând o aldehidă sau cetonă benzilică .
Acesta nu este tipul de oxidare benzilică care este abordat într-un curs introductiv tipic de chimie organică!
În schimb, principalul reactiv pentru oxidarea benzilică abordat în majoritatea manualelor de introducere este permanganatul de potasiu fierbinte (KMnO4). Acidul cromic fierbinte (H2CrO4, care se formează prin combinarea unei săruri de dicromat, cum ar fi Na2Cr2O7, cu un acid puternic, cum ar fi H2SO4) poate fi, de asemenea, utilizat în aceste scopuri.
KMnO4 nu este subtil. KMnO4 nu este delicat. KMnO4 nu este blând.
O soluție de KMnO4 fierbinte este ca o pungă plină de piranha furioși care îți va smulge toată carnea de pe moleculă și va lăsa în urmă doar oase. (Dacă stau să mă gândesc bine, este un fel de ficat! )
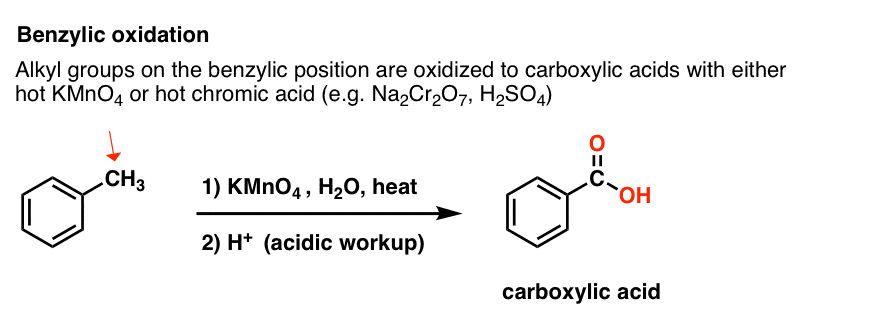
KMnO4 fierbinte va rupe fiecare legătură C-H benzilică și o va transforma într-o legătură C-O. Din toluen, de exemplu, produsul este acidul benzoic (un acid carboxilic).
Dar nu rupe doar legăturile C-H benzilice. O, nu. Se duce și după legăturile C-C; cel puțin cele care nu sunt atașate direct la un inel fenilic. De exemplu, para-dietilbenzenul este transformat în acid para-benzen-dicarboxilic.
Rețineți că legătura C-C a alchilului trebuie să fie desprinsă pentru ca această oxidare să aibă loc! (probabil că se oxidează până la CO2 gazos).
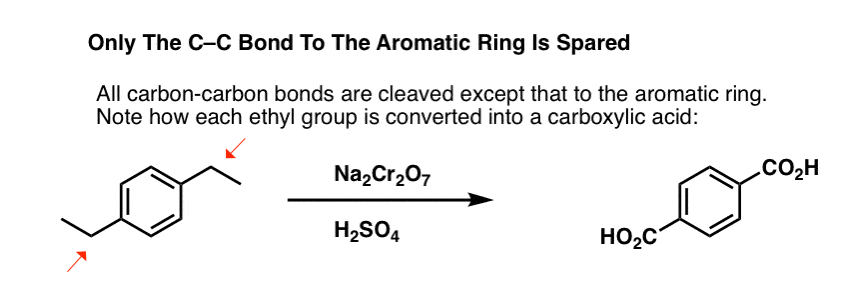
O variantă interesantă este pe o moleculă ciclică ca tetralina; rezultatul este acidul dicarboxilic.
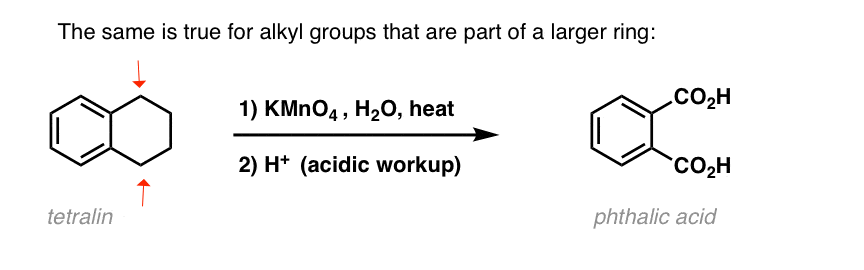
acest acid dicarboxilic se numește acid ftalic.
10. Oxidarea benzilică necesită o legătură C-H benzilică
Ca și în cazul bromurării benzilice, nu are loc nici o reacție dacă nu există o legătură C-H pe poziția benzilică. De exemplu, reacția eșuează complet cu t-butilbenzenul:
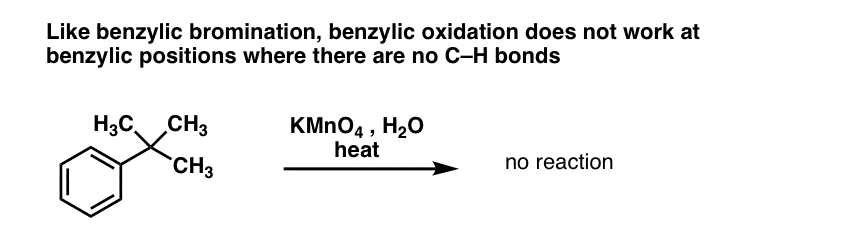
Mecanismul complet al oxidării benzilice este prea complex, îndelungat și nesigur pentru a fi prezentat aici, dar primul pas este aproape sigur clivarea omolitică a legăturii C-H de către Mn=O pentru a forma radicalul benzilic.
De ce este acest lucru important?
Oxidarea benzilică cu KMnO4 este o reacție dură, dar poate avea utilizările sale. Funcționează cel mai bine cu molecule simple care nu au grupări funcționale delicate și care pot suporta un tratament foarte dur.
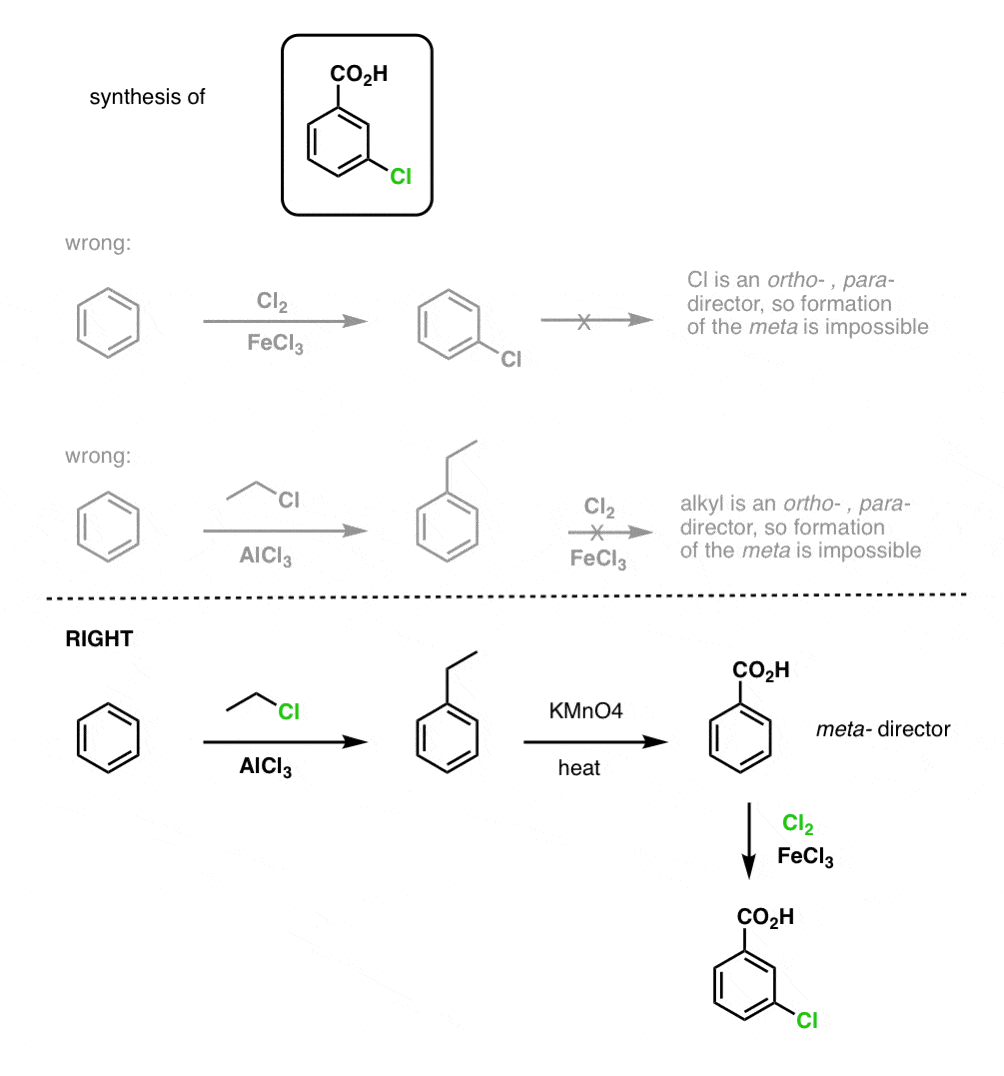
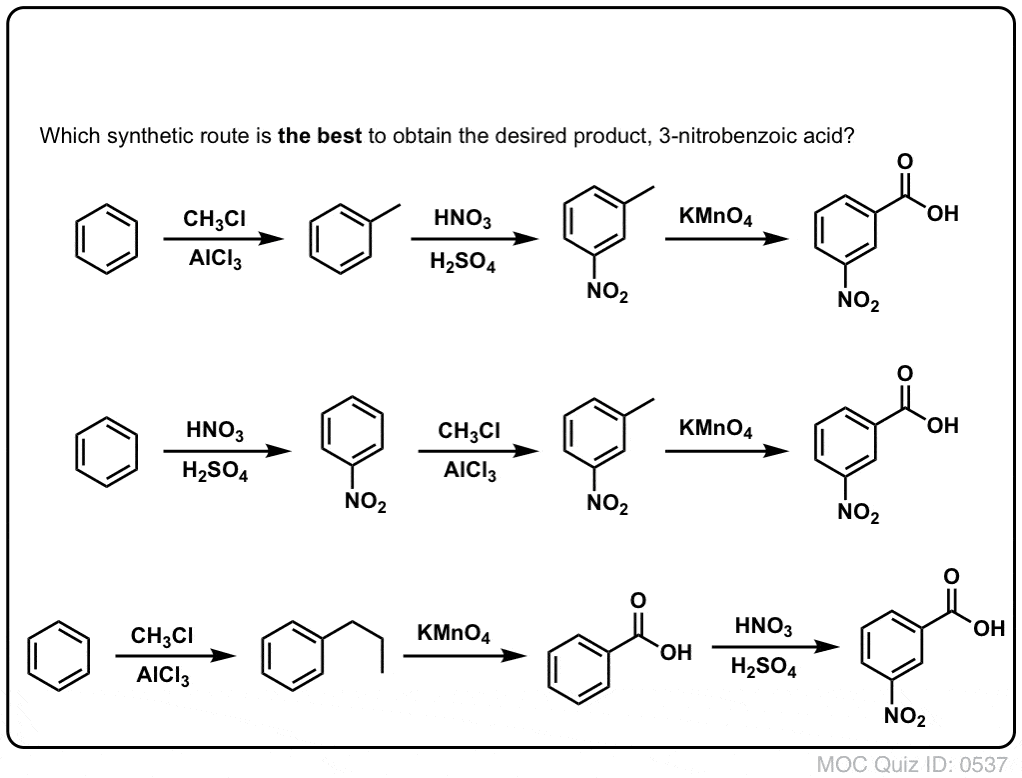
Primul lucru de reținut este că acizii carboxilici nu pot fi plasați direct pe un inel benzenic prin acilarea Friedel-Crafts, astfel încât alchilarea urmată de oxidare este o soluție de avarie utilă.
A doua funcție utilă în sinteză este faptul că oxidarea benzilică transformă un director o- p- (o grupare alchil) într-un meta-director.
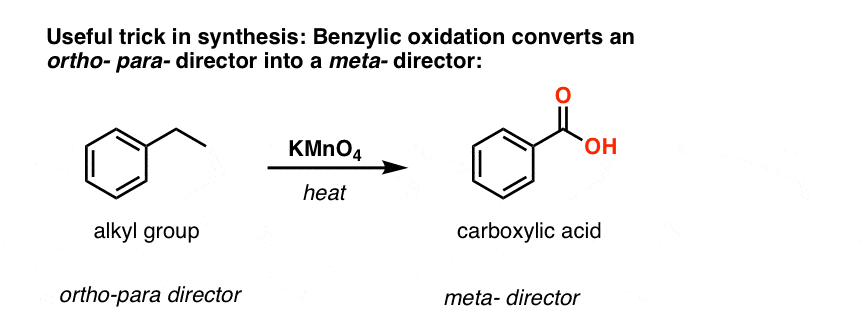
De exemplu, confruntat cu sinteza următoarei molecule, cum procedați? (indiciu: implică la un moment dat o oxidare benzilică).
Vom mai avea multe de spus despre sinteza compușilor aromatici în alte câteva postări.
În continuare: Reducerea carbonililor benzilici – reducerile Clemmensen și Wolff-Kishner
Note
„Varză” poate fi, de asemenea, folosit ca un termen de argou în chimie pentru „toate acele lucruri de pe moleculă pe care le poți ignora în siguranță”, indiferent de motiv. De exemplu, briostatina este o bestie de moleculă care se arată promițătoare ca agent anticancerigen. Problema este că este nevoie de o tonă dintr-un briozoar rar pentru a obține o cantitate decentă de briostatină, iar acest lucru nu este suficient pentru un studiu clinic pe oameni. Așa că mai multe grupuri au lucrat la realizarea unor „bryologs” mai simple și mai ușor de sintetizat, în care se elimină „varza” care nu este esențială pentru activitatea antitumorală.
În general, Br2 nu va reacționa cu inelele aromatice fără un catalizator de tip acid Lewis. Cu toate acestea, dacă este prezentă o grupare activatoare puternică (cum ar fi OH, NR2, etc.) poate avea loc o anumită bromurare a inelului, în special la temperaturi ridicate.
Fapt amuzant: „oxidarea benzilică” este răspunsul la enigma de ce metilbenzenul (toluenul) nu este nici pe departe un carcinogen la fel de puternic ca benzenul. Acest lucru se datorează faptului că ficatul dumneavoastră are enzimele citocromului p450 (care conțin specii de fier cu stare de oxidare ridicată) care pot oxida gruparea benzilică CH3 în acidul carboxilic mai solubil în apă, permițându-i să fie eliminat de rinichi.
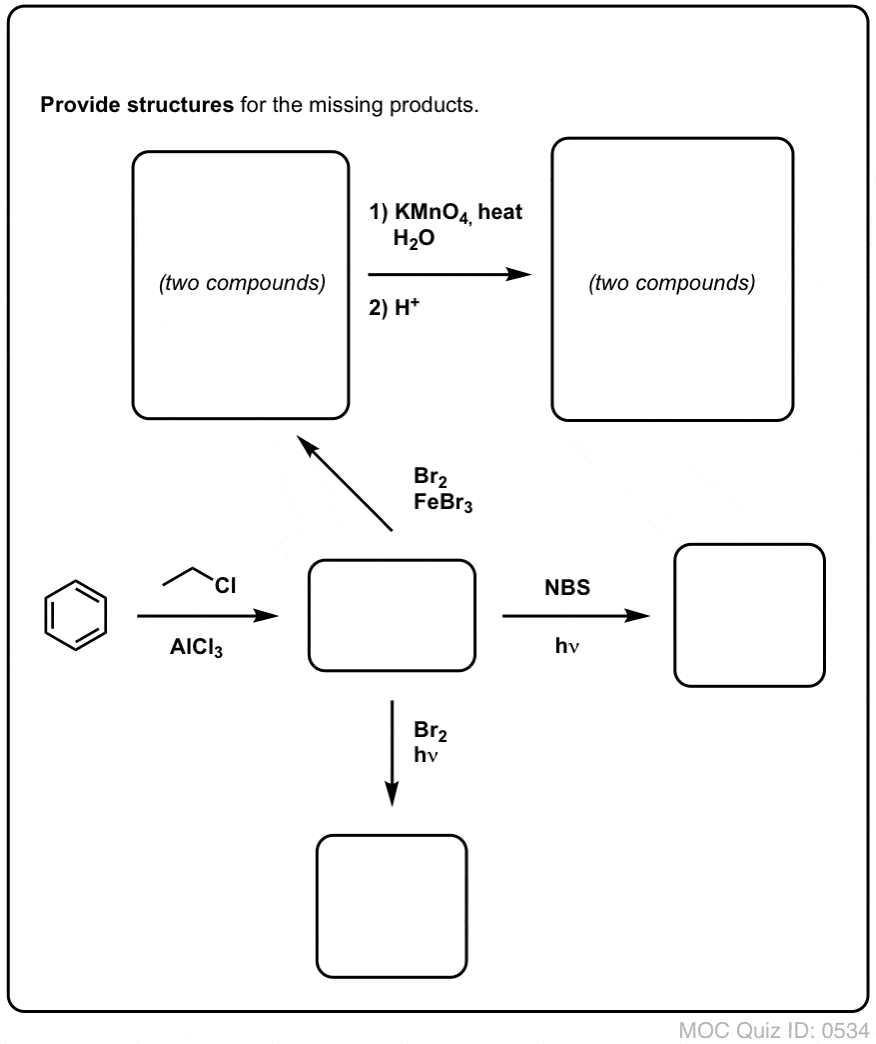
Acest lucru necesită două oxidări și două eliminări. Un mod prudent de a face acest lucru este să oxidați (adică să bromurați) o dată și apoi să eliminați pentru a da o alcană. Alchena ar putea fi apoi supusă din nou la bromurare (folosind NBS, pentru a evita bromurarea dublei legături) pentru a da o altă bromurare (produsul de bromurare benzilic arătat aici, dar și alilic este fezabil) care ar putea fi tratat cu o bază pentru a da naftalină aromatică.
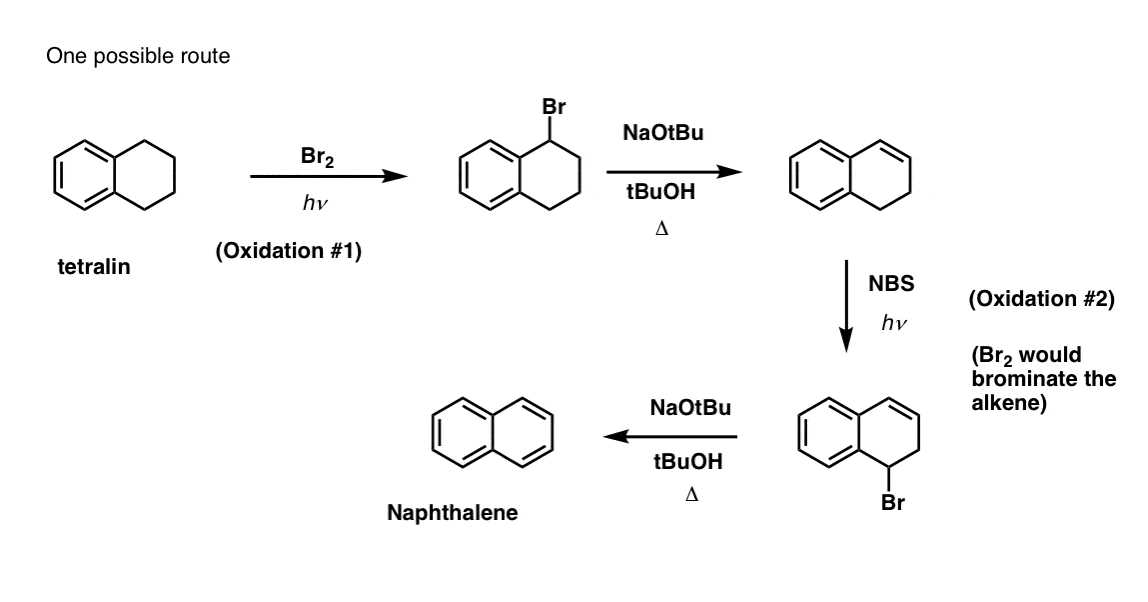
(în practică, se pare că ambele bromări pot fi făcute în același timp folosind Br2 la temperatură ridicată. Tratarea cu o bază poate da apoi naftalină).
Răspuns la întrebarea 2.
Întreabă-te pe tine însuți!
 Click to Flip
Click to Flip 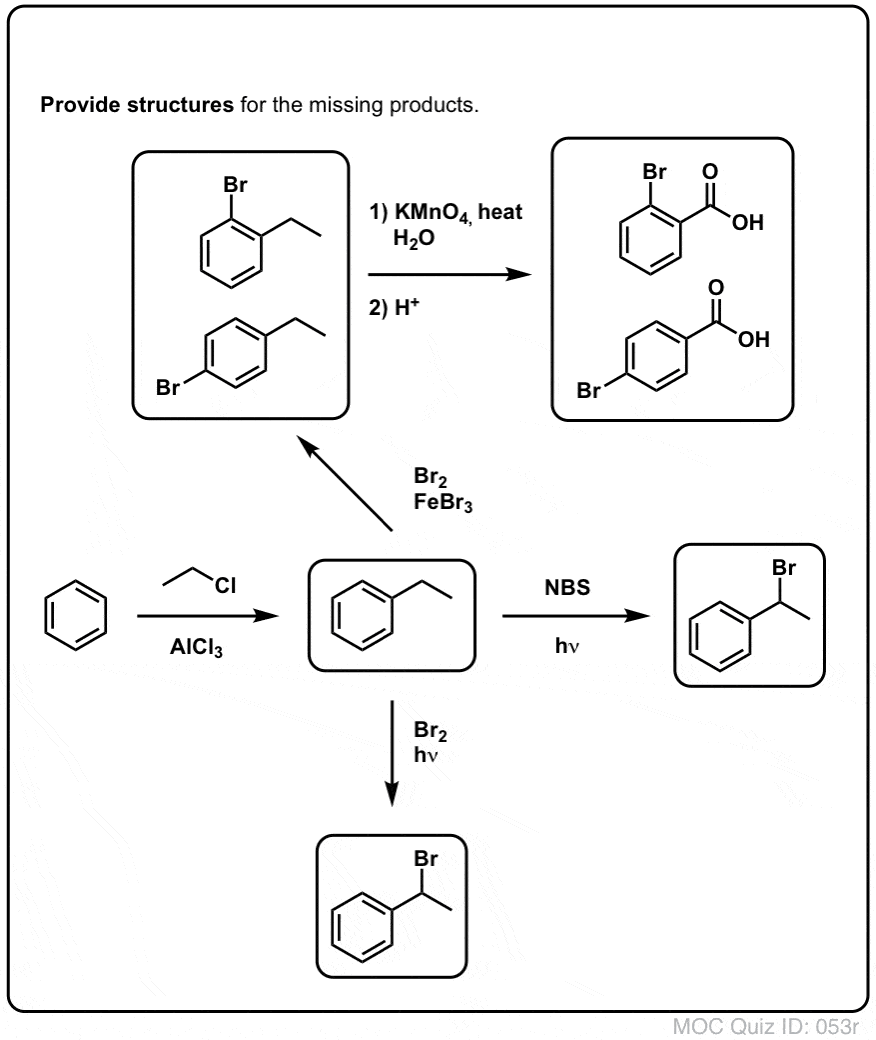
 Click to Flip
Click to Flip 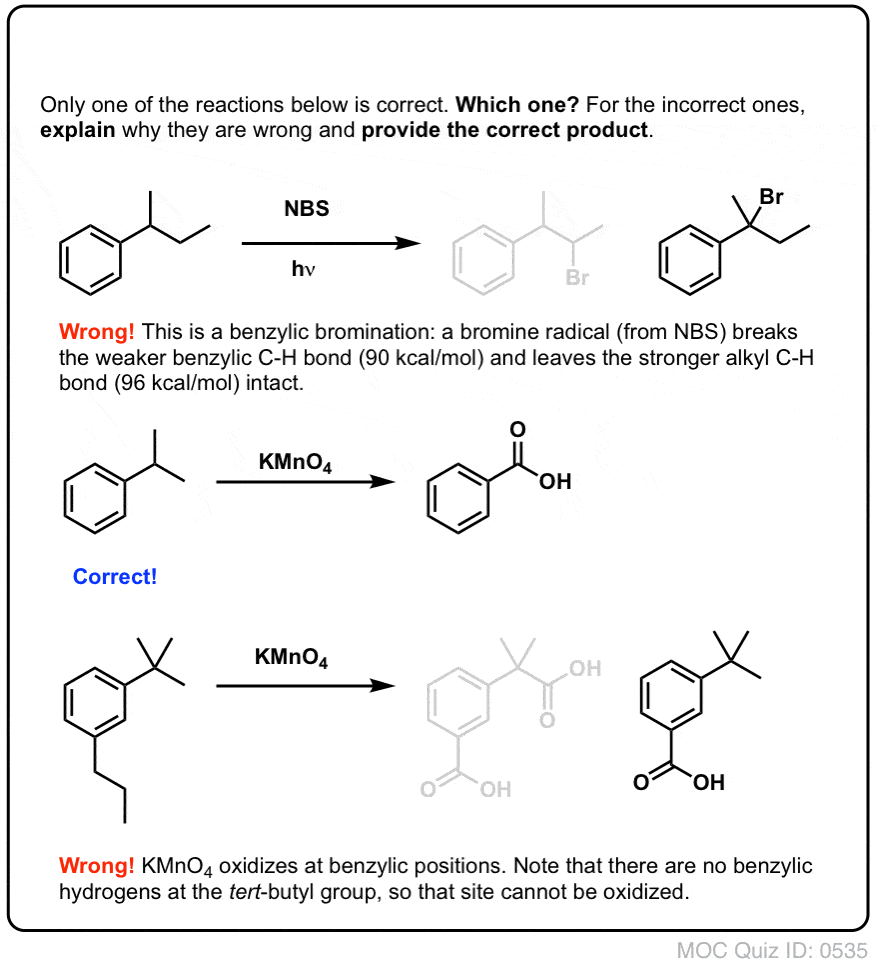
 Click to Flip
Click to Flip 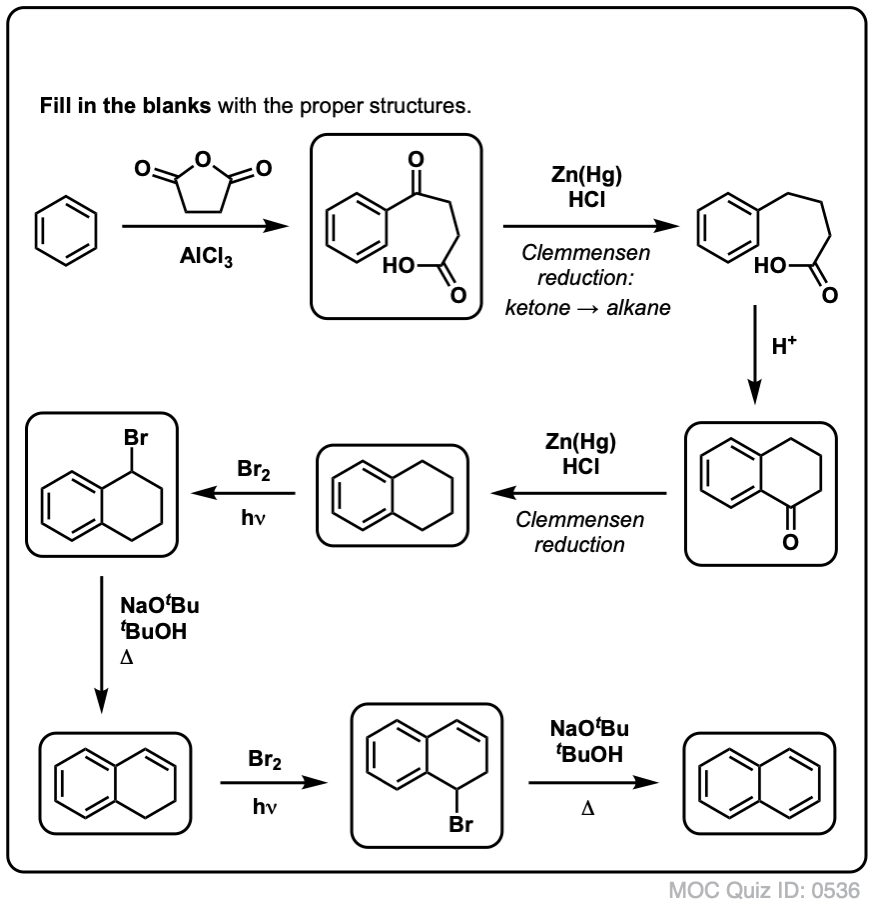
.
 Click to Flip
Click to Flip 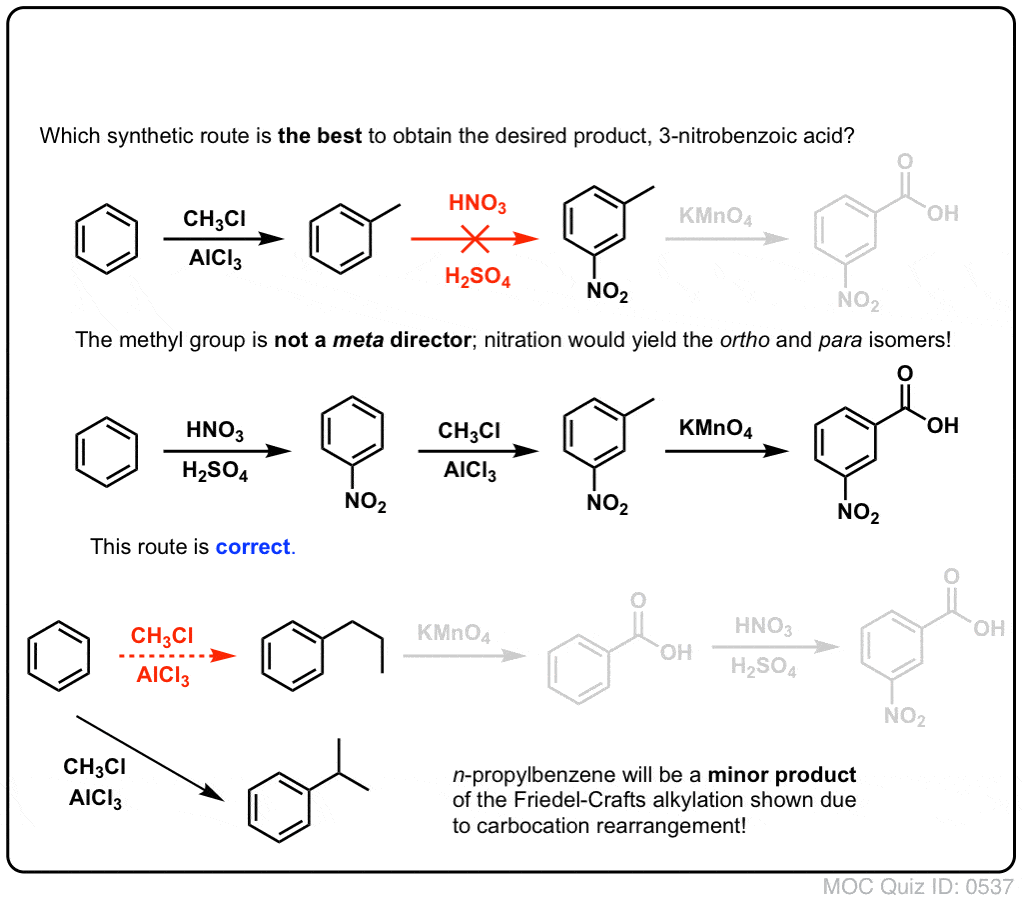
(Avansat) Referințe și lecturi suplimentare
Benzil bromurare:
Această reacție este cunoscută și sub numele de reacția Wohl-Ziegler.
- Bromierung ungesättigter Verbindungen mit N-Brom-acetamid, ein Beitrag zur Lehre vom Verlauf chemischer Vorgänge
Wohl
Chem. Ber. 1919, 52 (1), 51-63
DOI: 10.1002/cber.19190520109 - Die Halogenierung ungesättigter Substanzen in der Allylstellung
Ziegler, A. Späth, E. Schaaf, W. Schumann, E. Winkelmann
Just. Lieb. Ann. Chem. 1942, 551 (1), 80-119
DOI: 10.1002/jlac.19425510103
Primele două publicații despre această reacție. Wohl a folosit N-bromoacetamida ca agent de bromurare, nu NBS. Ziegler a efectuat apoi un studiu detaliat și a raportat că NBS poate fi folosit ca agent de bromurare convenabil pentru bromurarea alilică. - Dibenzociclooctene: Sinteza multigramă a unui ligand bidentat
Géraldine Franck, Marcel Brill și Günter Helmchen
Org. Synth. 2012, 89, 55-65
DOI: 10.15227/orgsyn.089.0055 - Brominații benzilice cu N-Bromosuccinimidă în (Trifluorometil)benzen
Diana Suarez, Gilles Laval, Shang-Min Tu, Dong Jiang, Claire L. Robinson, Richard Scott, Bernard T. Golding
Synthesis 2009 (11): 1807-1810
DOI: 1055/s-0029-1216793
Referința #3 prezintă o bromurare benzilică tipică folosind NBS în CCl4, care a fost în mare parte eliminată din cauza preocupărilor legate de toxicitate. Referința #4 arată că PhCF3 poate fi utilizat ca solvent în locul CCl4 pentru bromurarea benzilică. - Bromări cu N-Bromosuccinimidă și compuși înrudiți. The Wohl-Ziegler Reaction.
Carl Djerassi
Chemical Reviews 1948, 43 (2), 271-317
DOI: 10.1021/cr60135a004
O recenzie veche a acestei reacții de către renumitul chimist Carl Djerassi, a cărui contribuție majoră la sănătatea mondială a fost dezvoltarea norethindronei – primul contraceptiv feminin. - N-Bromosuccinimida. III. Cursul stereochimic al bromării benzilice
H. J. Dauben Jr. și Layton L. McCoy
Journal of the American Chemical Society 1959, 81 (20), 5404-5409
DOI: 10.1021/ja01529a038
Un studiu mecanicist asupra stereochimiei bromurării benzilice. Prin observarea formării de bromuri benzilice racemice din substraturi prochirale, se întărește și mai mult intermedierea radicalilor în această reacție.Aceleași referințe din bromurarea alilică pot fi reproduse aici: - Mechanisms of Benzylic Bromination
Glen A. Russell, Charles. DeBoer, and Kathleen M. Desmond
Journal of the American Chemical Society 1963 85 (3), 365-366
DOI: 1021/ja00886a040
Bromurarea benzilică urmează același mecanism ca și bromurarea alilică, după cum explică această lucrare.NBS (N-Bromosuccinimida) este un reactiv convenabil pentru bromurarea radicalară, iar următoarele lucrări sunt studii mecaniciste care implică NBS: - The Mechanism of Benzylic Bromination with N-Bromosuccinimide
R. E. Pearson și J. C. Martin
Journal of the American Chemical Society 1963 85 (3), 354-355
DOI: 10.1021/ja00886a029
Aceste lucrări ale profesorului J. C. Martin (UIUC) au fost realizate la începutul carierei sale, înainte de a face lucrările pentru care este cel mai bine cunoscut (studii asupra moleculelor „hipervalente”, inclusiv dezvoltarea „Dess-Martin Periodinanului”). - Identitatea speciei purtătoare de catenă în bromările cu N-Bromosuccinimidă: Selectivitatea N-Bromosuccinimidelor substituite față de toluenurile substituite
R. E. Pearson și J. C. Martin
Journal of the American Chemical Society 1963, 85 (20), 3142-3146
DOI: 10.1021/ja00903a021 - N-bromosuccinimidă. Mecanisme de bromurare alilică și reacții înrudite
J. H. Incremona și James Cullen Martin
Journal of the American Chemical Society 1970, 92 (3), 627-634
DOI: 10.1021/ja00706a034 - Radicalul succinimidil ca purtător de lanț. Mecanismul de bromurare alilică
J. C. Day, M. J. Lindstrom și P. S. Skell
Journal of the American Chemical Society 1974, 96 (17), 5616-5617
DOI: 10.1021/ja00824a074 - Bromurarea radicalară a ciclohexenei în CCl4 de către brom: Addition versus Substitution
D. W. McMillen și John B. Grutzner
The Journal of Organic Chemistry 1994, 59 (16), 4516-4528
DOI: 10.1021/jo00095a029
Acest articol descrie studii cinetice atente care demonstrează că o concentrație scăzută de Br2 (cum ar fi cea furnizată de NBS impur) va favoriza substituția radicalară în detrimentul unei reacții de adiție polară. - o-XILILENE DIBROMIDĂ
Emily F. M. M. Stephenson
Org. Synth. Vol. 34, p.100 (1954)
DOI: 10.15227/orgsyn.034.0100
A reliable procedure for benzylic bromination with Br2 în Organic Syntheses. - Bromurarea tetralinei. Sinteza scurtă și eficientă a 1,4-Dibromonaftalinei
Osman Çakmak, Ismail Kahveci, Íbrahim Demirtaș, Tuncer Hökelek și Keith Smith
Czech. Chem. Commun. 2000, 65, 1791-1804
DOI: 10.1135/cccc20001791
O sinteză convenabilă a 1,4-dibromonaftalinei din tetralină, prin bromurare benzilică.Oxidarea benzilică:
Există o mulțime de strategii pentru oxidarea benzilică, inclusiv utilizarea de soluții concentrate de KMnO4 sau acid cromic. - Studii cinetice ale oxidării compușilor aromatici de către permanganatul de potasiu. Partea a IV-a. n- și izopropilbenzenul
C. F. Cullis și J. W. Ladbury
J. Chem. Soc. 1955, 4186-4190
DOI: 10.1039/JR9550004186 - DERIVAȚI DE PIPERIDINĂ X. PHENYLPIPERIDYLCARBINOLS
Kenneth E. Crook și S. M. McElvain
Journal of the American Chemical Society 1930, 52 (10), 4006-4011
DOI: 1021/ja01373a035
Dacă există un alt substituent pe poziția benzilică, atunci prin oxidare se obține o cetonă în loc de un acid carboxilic. - Oxidări eterogene cu permanganat. 7. The Oxidation of Aliphatic Side Chains
Nazih A. Noureldin, Dongyuan Zhao și Donald G. Lee
The Journal of Organic Chemistry 1997, 62 (25), 8767-8772
DOI: 1021/jo971168e
Reagenții pot fi adsorbiți pe suporturi solide pentru a face reacțiile mai ușor de realizat și pentru a reduce deșeurile. În acest caz, făcând reactivul KMnO4 eterogen, reactivitatea se schimbă ușor, iar acest lucru poate fi exploatat pentru unele oxidări chemoelective. o mulțime de alți reactivi pot fi utilizați pentru oxidarea benzilică, iată o selecție: - Oxidare selectivă la carbonul adiacent sistemelor aromatice cu IBX
K. C. Nicolaou, Phil S. Baran și Yong-Li Zhong
Journal of the American Chemical Society 2001, 123 (13), 3183-3185
DOI: 10.1021/ja004218x
O lucrare timpurie a (acum rockstar al sintezei totale) profesorului Phil Baran (The Scripps Research Institute, La Jolla, CA), în timp ce era încă doctorand în grupul profesorului Nicolaou. Acesta folosește IBX (un reactiv I(V) hipervalent) pentru a face oxidări benzilice, care au loc prin intermediul unui mecanism radicalar. Aceasta este o reacție utilă cu o gamă largă de substraturi, așa cum este exemplificată de 25 de exemple din lucrare. - Direct and Selective Benzylic Oxidation of Alkylarenes via C-H Abstraction Using Alkali Metal Bromides
Katsuhiko Moriyama, Misato Takemura, and Hideo Togo
Organic Letters 2012, 14 (9), 2414-2417
DOI: 10.1021/ol300853z
Aceasta folosește Oxone ca oxidant terminal pentru oxidarea benzilică. - Synthesis of Benzylic Alcohols by C-H Oxidation
Lalita Tanwar, Jonas Börgel, and Tobias Ritter
J. Am. Chem. Soc. 2019, 141, 141, 17983-17988
DOI: 10.1021/jacs.9b09496
Aceasta folosește peroxidul de mesil ca oxidant pentru oxidarea selectivă a pozițiilor benzilice la alcooli. Se formează mezilatul de benzil, care poate fi hidrolizat la alcool. - Oxidarea electrochimică benzilică a legăturilor C-H
Jason A. Marko, Anthony Durgham, Stacey Lowery Bretz și Wei Liu
Chem. Commun, 2019, 55, 937-940
DOI: 10.1039/C8CC08768G
Oxidarea benzilică poate fi efectuată, de asemenea, prin electrochimie. - Reacții de oxidare alilică și benzilică cu clorit de sodiu
Samuel M. Silvestre, Jorge A. R. Salvador
Tetrahedron 2007, 63 (11), 2439-2445
DOI: 10.1016/j.tet.2007.01.012NaClO2 este ieftin și poate fi folosit și ca oxidant.
.
Lasă un răspuns