Evaluarea sănătății celulelor: Viabilitate și proliferare
On octombrie 11, 2021 by adminPartea I: Teste de viabilitate și proliferare
Viabilitate și proliferare
Viabilitatea și proliferarea sunt două caracteristici distincte ale celulelor. Viabilitatea este o măsură a numărului de celule vii dintr-o populație, în timp ce proliferarea este o măsură a diviziunii celulare. Trebuie remarcat faptul că nu toate celulele viabile se divid. Deși proliferarea poate fi ușor interpretată ca viabilitate, absența proliferării nu trebuie luată automat ca un semn de moarte celulară.
Evaluarea viabilității și a proliferării
1. Permeabilitatea membranară
Un semn distinctiv al celulelor moarte și muribunde este distrugerea membranelor celulare și nucleare. Multe teste de viabilitate folosesc această caracteristică a morții celulare pentru a distinge celulele viabile de cele neviabile.
Corele de acid nucleic polare, impenetrabile la nivel celular, cum ar fi DAPI, iodura de propidiu (PI) și 7-AAD, colorează celulele moarte, deoarece aceste coloranți pot intra numai în celulele cu membranele compromise. PI se leagă atât de ARN, cât și de ADN, în timp ce 7-AAD și DAPI interacționează numai cu ADN. Acești coloranți pot fi utilizați în combinație cu teste care detectează activitatea enzimatică, cum ar fi substraturile de esterază discutate în secțiunea următoare, sau cu indicatori de viabilitate permeabili la celule pentru a marca simultan celule vii și moarte. Testele PI, DAPI și 7-AAD pot fi citite cu ajutorul unui microscop cu fluorescență, al unui citometru în flux (figura 1) sau al unui cititor de microplăci.
A.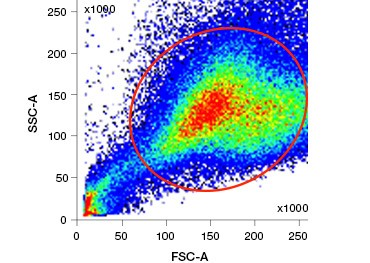
B.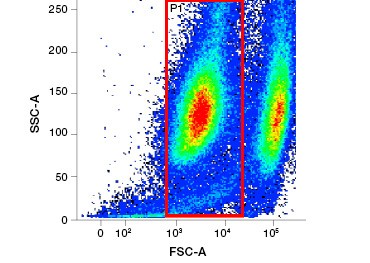
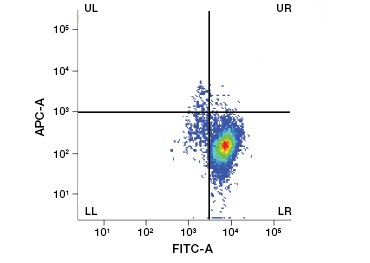
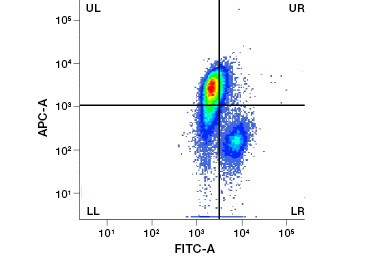
Figura 1. Colorația cu iodură de propidiu îmbunătățește identificarea celulelor de interes. Gating-ul celulelor vii folosind împrăștierea înainte și laterală poate să nu fie suficient pentru a elimina celulele moarte, iar legarea nespecifică poate fi încă prezentă (A). Utilizarea coloranților de viabilitate, cum ar fi iodura de propidiu, poate ajuta la eliminarea legăturilor nespecifice (B). Macrofagele J774 au fost colorate pentru CD11b și CD3, cu cercul roșu și dreptunghiul indicând strategia de portare pentru celulele vii.
Timparea este critică atunci când se utilizează acești coloranți, deoarece fracțiunea de celule colorate crește în timpul colorării, deoarece celulele continuă să moară. Trebuie remarcat faptul că niciunul dintre acești coloranți nu este fixabil. Pentru aplicațiile care necesită fixare, monoazidele de etidiu sau coloranții proteici reactivi la amine sunt o alegere excelentă.
Coranții proteici impermeabili la celule sunt o alternativă excelentă la coloranții de acizi nucleici, deoarece sunt mai puțin toxici. Coloranții amină-reactivi vin într-o gamă largă de spectre de excitație și emisie și, astfel, permit o mai mare flexibilitate în proiectarea panourilor de citometrie în flux și microscopie decât coloranții ADN. Un alt avantaj al acestor coloranți proteici este că sunt fixabili (figura 2).
A.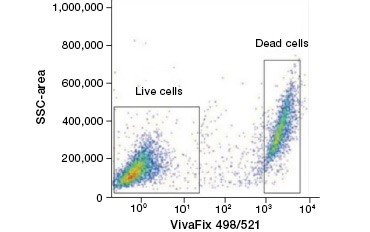
B.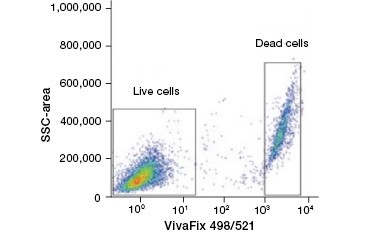
Fig. 2. Colorațiile proteice disting celulele vii de cele moarte. Folosind VivaFix™ Cell Viability Assays, populațiile de celule vii și moarte pot fi identificate și ulterior analizate în celule fixate (A) și nefixate (B) folosind citometria în flux.
Un aspect special de luat în considerare atunci când se folosește colorantul proteic comun albastru trypan este faptul că acest colorant va colora celulele viabile în timp într-o manieră specifică celulei. Prin urmare, este esențial să se optimizeze protocoalele cu albastru trypan pentru fiecare tip de celule și experiment.
Toți acești coloranți pot fi utilizați pe celule și țesuturi unice și evaluați prin microscopie cu fluorescență sau citometrie de flux, deși colorarea cu albastru trypan este mai frecvent evaluată prin numărarea manuală a celulelor cu ajutorul unui hemocitometru și al unui microscop.
Dincolo de coloranții de acid nucleic impermeabili la celule, coloranții de acid nucleic permeabili la celule, cum ar fi portocaliul de acridină, difuzează cu ușurință prin membranele celulare și, astfel, colorează ADN-ul celulelor viabile. Celulele neviabile nu sunt colorate eficient deoarece membranele lor compromise lasă colorantul să difuzeze cu ușurință în afara lor. Portocaliul de acridină este un colorant cu dublă fluorescență care emite fluorescență verde atunci când este legat de ADN ds și fluorescență roșie atunci când este legat de ADN ss și ARN. Atunci când folosiți portocaliu de acridină ca colorant de legare a ADN-ului, rețineți că acesta nu se leagă eficient de cromatina condensată. După cum s-a discutat în secțiunea 6, acest colorant poate fi utilizat, de asemenea, pentru a evalua capacitatea celulelor de a menține un pH acid în lizozomi, un alt indicator al viabilității celulare. Coloranții de acid nucleic permeabili la celule pot fi utilizați pentru a identifica și a cuantifica populațiile de celule viabile prin microscopie, citometrie în flux sau analiză pe microplăci.
Coranții impermeabili și permeabili la celule pot fi utilizați în combinație cu anticorpi marcați fluorescent împotriva proteinelor de interes, ceea ce simplifică includerea unor controale cruciale ale viabilității în fiecare experiment. Un considerent esențial atunci când se utilizează acești coloranți pentru a evalua integritatea membranei este faptul că diferite tipuri de celule au caracteristici diferite de permeabilitate a membranei. De exemplu, unii coloranți ADN impermeabili la celule vor colora cu ușurință celulele eucariote moarte, dar nu pot colora procariote cu membrane compromise.
Integritatea membranelor poate fi evaluată, de asemenea, cu ajutorul testelor enzimatice. O alegere populară este evaluarea scurgerii enzimei citoplasmatice lactat dehidrogenază (LDH) în mediul de cultură la moartea celulelor. Testele colorimetrice LDH pot fi efectuate în format microplăcuță și citite cu ajutorul unui cititor de microplăcuțe ELISA.
Dezintegrarea membranei poate fi, de asemenea, măsurată cu ajutorul testelor de eliberare a cromului. Aici, celulele sunt marcate în prealabil cu 51Cr înainte de tratamentul experimental. Cromul se leagă de proteinele celulare și este eliberat în mediul de cultură la moartea celulelor. Prin determinarea cantității de 51Cr liber față de cel legat, cu ajutorul unui contor de scintilații, moartea celulară poate fi măsurată cantitativ. Celulele pot fi, de asemenea, marcate în prealabil cu coloranți fluorescenți. Aceste metode suferă uneori de un fond ridicat din cauza eliberării spontane a markerilor; ele sunt utile numai pentru aplicațiile care permit marcarea prealabilă a celulelor de interes.
2. Activitatea enzimatică
O altă distincție esențială între celulele viabile și cele neviabile este că celulele viabile sunt active din punct de vedere enzimatic. Activitatea esterazei, măsurată cu ajutorul unor substraturi cum ar fi diacetatul de carboxifluoresceină (CFDA), este utilizată în mod obișnuit ca indicator al activității enzimatice globale. CFDA este un colorant nefluorescent, permeabil la celule, care este hidrolizat pentru a forma molecula fluorescentă carboxifluoresceină de către esteraze intracelulare nespecifice prezente numai în celulele viabile. Deoarece carboxifluoresceina este încărcată negativ, aceasta este reținută necovalent în celulele viabile, rezultând o fluorescență verde.
CFDA-SE este un derivat al CFDA care este mai bine reținut în urma hidrolizei. Produsul său, CFSE, are grupări succinimidil ester care formează legături covalente cu aminele primare ale proteinelor intracelulare, permițând urmărirea pe termen lung a viabilității celulare. Deoarece CFSE este reținută covalent în celule, este un indicator mai fiabil al viabilității celulare și o măsură populară a proliferării celulare, deoarece fluorescența sa se înjumătățește la fiecare diviziune celulară (figura 3). S-au adus îmbunătățiri la CFDA-SE cu coloranți de proliferare care au o retenție celulară mai mare, oferă o rezoluție mai mare a diviziunii celulare și sunt disponibili într-o gamă largă de spectre de excitație și emisie pentru a permite încorporarea în aplicații fluorescente multicolore, cum ar fi citometria în flux.
A.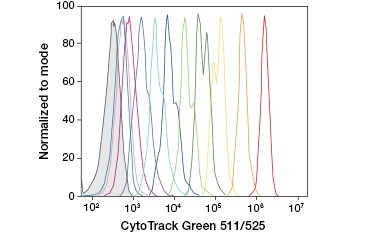
B.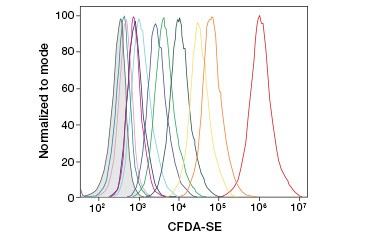
Fig. 3. Urmărirea generațiilor de celule prin citometrie în flux. Zece generații de celule pot fi rezolvate folosind CytoTrack™ Green 511/525 Cell Proliferation Assay (A) și până la opt folosind CFDA-SE (B).
Mulți alți substraturi fluorescente de esterază, cum ar fi derivații de calceină și BCECF, sunt disponibili cu proprietăți variate, inclusiv diferențe în spectrele de excitație/emisie. Deoarece fluorescența BCECF este sensibilă la pH, aceasta poate urmări, de asemenea, modificările pH-ului citosolic.
Utilizând substraturi de esterază permeabile la celule, viabilitatea poate fi evaluată prin microscopie cu fluorescență și citometrie de flux. Aceste substraturi pot fi, de asemenea, aplicate la eșantioane de țesut sau utilizate în testele de microplăci de mare randament.
3. Activitatea metabolică
O altă măsură comună a viabilității celulare este activitatea metabolică, care poate fi evaluată utilizând sonde oxidabile și reductibile.
Rezazurina este un indicator popular de oxidare-reducere (redox). Acest colorant permeabil la celule poate fi adăugat direct în mediile de cultură celulară, ceea ce îl face un test rapid și convenabil. În celulele metabolic active, resazurina albastră și slab fluorescentă este redusă pentru a forma resorufină, o moleculă roz și foarte fluorescentă. Această modificare poate fi monitorizată folosind atât teste fluorescente, cât și colorimetrice. Deoarece cantitatea de fluorescență este direct proporțională cu numărul de celule vii, care respiră, resazurina este utilizată pe scară largă pentru a măsura cantitativ viabilitatea celulară. Resazurina este o alternativă convenabilă, mai sensibilă și mai stabilă și netoxică la alți indicatori redox, cum ar fi sărurile de tetrazoliu MTT și XTT. Spre deosebire de testele pe bază de sare de tetrazoliu, care sunt colorimetrice și pot fi citite doar cu ajutorul unui cititor de microplăci, testele de viabilitate cu resazurină pot fi citite cu ajutorul citometriei în flux sau al microscopiei cu fluorescență. Resazurina și sărurile de tetrazoliu sunt deosebit de utile pentru aplicațiile de mare randament, deoarece viabilitatea poate fi evaluată în microplăci cu ajutorul unui cititor de microplăci (figura 4). XTT este adesea ales în locul MTT pentru aplicațiile cu randament ridicat, deoarece, spre deosebire de MTT, produce un colorant solubil în apă, eliminând astfel o etapă de solubilizare care este crucială pentru testele MTT. Sărurile de rezazurină și tetrazoliu sunt utilizate cel mai frecvent pentru a evalua viabilitatea celulelor aderente și a celulelor în soluție.
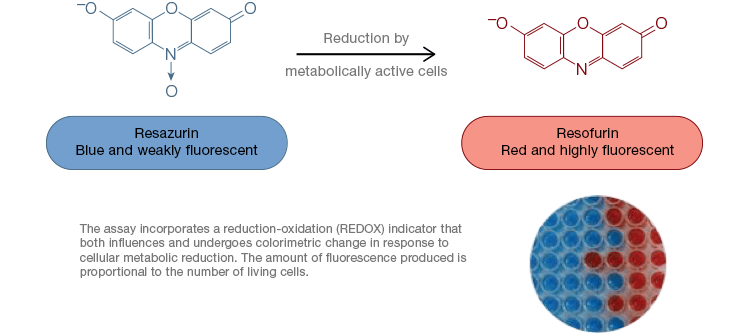
Fig. 4. Testele de oxidare a resazurinei netoxice sunt ușor de scalat pentru aplicații de mare randament. Oxidarea alamarBlue în celulele metabolic active are ca rezultat o schimbare colorimetrică din albastru în roșu, precum și o creștere a fluorescenței.
Dihidroradaminele, -calceinele și -fluoresceinele sunt derivați de rodamină, -calceină și -fluoresceină reduși care sunt permeabili la celule și incolori. Acești compuși sunt ușor oxidați în colorantul lor părinte fluorescent de către speciile reactive de oxigen prezente în celulele și țesuturile vii.
O altă clasă de teste de viabilitate care măsoară activitatea metabolică sunt testele luminescente de ATP. Acestea cuantifică ATP eliberat de celule la liză. Ele nu necesită perioade lungi de incubare, sunt extrem de sensibile și se citesc în mod obișnuit cu ajutorul unui cititor de microplăci.
Un factor care trebuie luat în considerare atunci când se utilizează teste care măsoară activitatea metabolică este faptul că activitatea metabolică poate diferi în diferite condiții de cultură celulară. Prin urmare, trebuie incluse controale adecvate pentru a ține cont de aceste diferențe.
4. Sinteza/replicarea ADN-ului
O altă măsură a viabilității și o metodă populară de evaluare a proliferării este cuantificarea încorporării BrdU în ADN nou sintetizat. ADN-ul care conține BrdU este identificat cu ajutorul anticorpilor BrdU conjugați sau al anticorpilor BrdU în combinație cu un anticorp secundar conjugat (figura 5). Aceste teste permit o varietate de citiri, deoarece anticorpii pot fi cuplați la diferite tipuri de indicatori (fluorofori, peroxidaze etc.). Marcarea cu anticorpi a markerilor celulari specifici permite, de asemenea, să se distingă populațiile proliferante specifice. Probele sunt fixate după incubare și apoi analizate cu ajutorul citometriei de flux, microscopiei cu fluorescență, imunohistochimiei sau cititoarelor de microplăci. Cu ajutorul citometriei de flux, celulele pot fi atribuite fazei G0/G1, S sau G2/M a ciclului celular pe baza conținutului total de ADN. Utilizarea substraturilor de peroxidază cromogenică permite citirea testelor fără un fluorometru. Iar prin utilizarea de -TdR în loc de BrdU, aceste teste pot fi convertite la o citire cu radiomarcare.
A.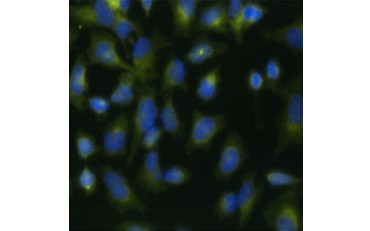
B.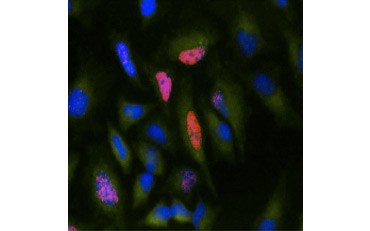
Fig. 5. Vizualizarea încorporării BrdU. Celulele HeLa au fost tratate cu 10 µg BrdU timp de 1 oră (B) sau au fost lăsate netratate (A). Celulele au fost colorate cu anticorpul anti-BrdU de șoarece, clona Bu20a (MCA2483; diluție 1:25), iar ca anticorp secundar s-a folosit anticorpul conjugat DyLight 549 (roșu) anti-Mouse IgG (H/L) de capră conjugat DyLight 549 (STAR117D549GA; diluție 1:50). Citoplasma a fost colorată cu anticorpul anti-GAPDH de iepure (AHP1628; diluție 1:100) și anticorpul conjugat DyLight 488 (verde) anti-Rabbit IgG de oaie (STAR36D488GA; diluție 1:50) a fost utilizat ca anticorp secundar. PureBlu™ DAPI (1351303) a fost utilizat ca un contracolorant nuclear.
5. Expresia markerilor de proliferare
Se știe că anumite proteine își cresc expresia în timpul proliferării celulare. Ki-67, de exemplu, este exprimat în nucleul celulelor în diviziune, dar nu este detectabil în timpul G0 și G1 (figura 6). În mod similar, fosforilarea histonei H3 poate fi utilizată pentru a identifica celulele în faza M. Alți markeri de proliferare utilizați în mod obișnuit includ antigenul nuclear al celulelor proliferante (PCNA) și minichromosome maintenance 2 (MCM2). Folosind anticorpi împotriva acestora, alți markeri cheie de proliferare sau markeri de linie celulară pot fi evaluați prin ELISA, citometrie în flux, imunohistochimie, microscopie cu fluorescență și Western blotting.
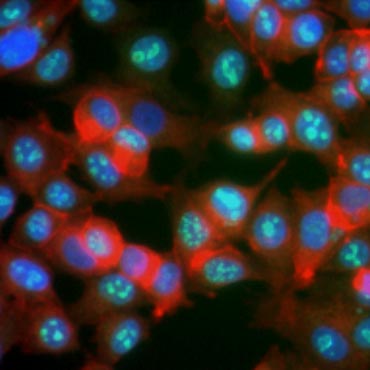
Fig. 6. Anticorpii împotriva Ki-67 identifică celulele proliferante. Colorația celulelor MCF-7 cu anti Ki-67 uman (HCA006, verde) contracarată cu falloidină (roșu) și Hoechst (albastru).
6. Potențialul membranar și pH
Celele vii mențin în mod activ gradienți ionici de-a lungul membranelor lor, generând potențiale transmembranare. Atunci când o celulă moare, aceste gradiente ionice sunt întrerupte. Acest lucru poate fi evaluat cu ajutorul coloranților potențiometrici. JC-1 este un colorant potențiometric utilizat în mod obișnuit. În celulele sănătoase, JC-1 se localizează în mitocondrii, unde formează agregate fluorescente roșii. La ruperea potențialului membranei mitocondriale, JC-1 difuzează în întreaga celulă și există sub formă de monomer fluorescent verde. Esterii etilici de tetrametilrhodamină (TMRE) și esterii metilici de tetrametilrhodamină (TMRM), la fel ca JC-1, se localizează în mitocondrii în celulele sănătoase și în citoplasmă în celulele muribunde. Spre deosebire de JC-1, acești coloranți nu prezintă o deplasare a spectrelor de emisie. În schimb, permeabilizarea membranei exterioare mitocondriale duce la o scădere a fluorescenței roșii a TMRM/TMRE.
Celele vii sunt capabile să genereze și să mențină un pH scăzut în organitele acide ale celulei, cum ar fi lizozomul. Acest lucru poate fi măsurat folosind coloranți acidotropici, cum ar fi portocaliu de acridină și roșu neutru. Un aspect de luat în considerare atunci când se utilizează portocaliu de acridină este faptul că acest colorant se leagă și de ADN și ARN. Atunci când se leagă de nucleotide monocatenare, portocaliul de acridină devine roșu; atunci când se leagă de ADN bicatenar, devine verde; iar atunci când se leagă de ADN în lizozom, devine portocaliu.
Indiferent de metoda aleasă, este extrem de important să se includă controale adecvate atunci când se efectuează oricare dintre testele descrise aici, deoarece condițiile experimentale și tipul de celule pot modifica performanța unor teste. Includeți întotdeauna controale pozitive și negative. În cazul în care se utilizează sonde în solvenți, includeți, de asemenea, martori tratați cu vehicule pentru a ține seama de efectele solventului. Folosiți controale specifice aplicației pentru a controla factori cum ar fi autofluorescența în experimentele de imunofluorescență și citometrie în flux și controalele de încărcare pentru Western blotting.
Pentru informații despre testele de viabilitate și proliferare celulară Bio-Rad, vizitați pagina noastră privind gama de sănătate celulară.
Citiți Partea a II-a Evaluarea sănătății celulare: Apoptosis
alamarBlue este o marcă comercială a Trek Diagnostic Systems. DyLight este o marcă comercială a Thermo Fisher Scientific.
Lasă un răspuns