Reações sobre o Carbono “Benzílico”: Brominação e Oxidação
On Outubro 12, 2021 by adminO carbono adjacente a um anel aromático – o carbono “benzílico” – pode participar em várias reacções úteis e interessantes. Hoje vamos dar exemplos e mecanismos para dois exemplos chave: brominação benzílica e oxidação benzílica. Aqui está o resumo rápido:
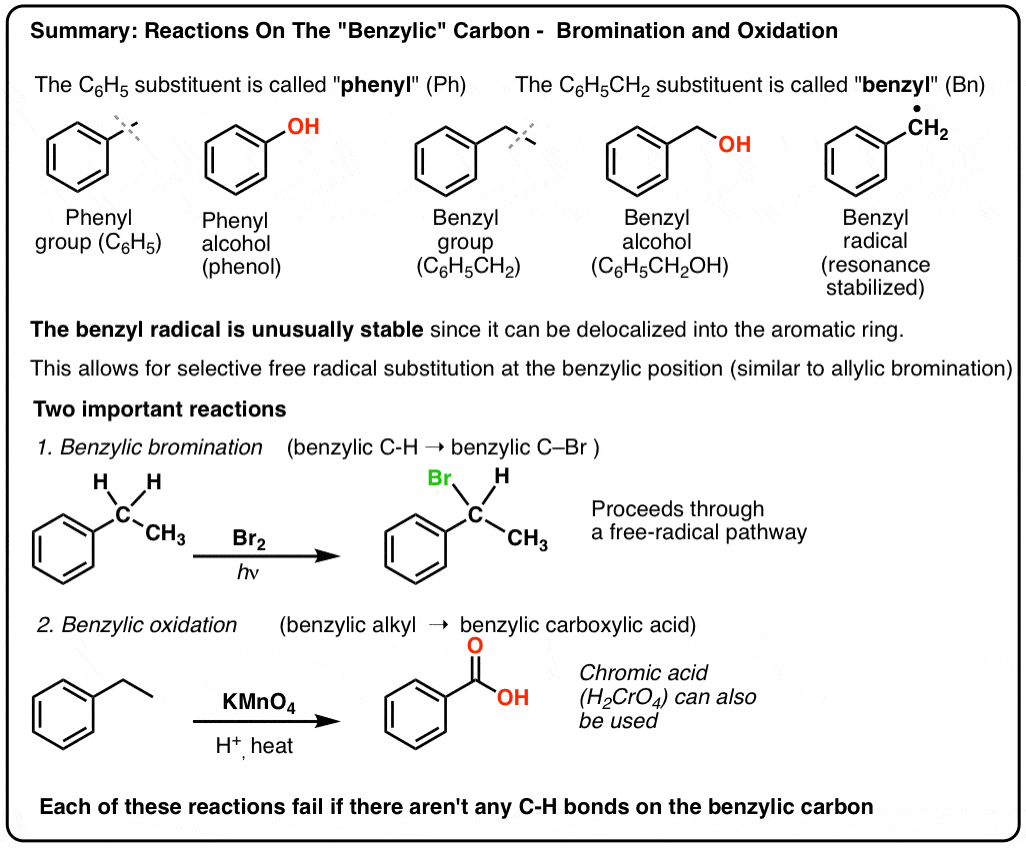
Tabela de Conteúdos
- Grupos Alquil = “Roughage”
- Há Algo Especial Sobre Grupos Alquil Adjacentes a um Anel Benzílico
- “Phenyl” vs “Benzyl” : Qual é a diferença?
- Os radicais benzílicos são estabilizados por ressonância; os radicais fenílicos não são.
- As ligações benzílicas C-H (e alélicas) são fracas, relativas a outras ligações benzílicas C-H
- Brominação benzílica
- Quando a “Brominação benzílica” NÃO funciona?
- Aplicações da Brominação Benzílica
- Oxidação benzílica com KMnO4 (ou H2CrO4)
- Oxidação benzílica requer uma ligação benzílica C-H
- Por que isso é importante?
- Notas
- Quiz Yourself!
- (Advanced) References and Further Reading
Alkyl Groups = “Roughage”
Na nutrição, “roughage” é o que você chama de toda a celulose e fibra presentes nos alimentos que simplesmente disparam através do seu corpo sem realmente serem digeridos.
Que descreve praticamente o comportamento dos grupos alquílicos na grande maioria das reacções químicas orgânicas que aprendemos. A química deles é “aborrecida”. Eles podem compreender a espinha dorsal e a estrutura geral da molécula, mas suas ligações C-H são inertes à maioria das condições de reação.
Na verdade, se você não contar a combustão, a única reação dos grupos alquílicos que cobrimos na química orgânica introdutória é a substituição dos radicais livres. E mesmo essa reação tende a ser bastante pouco seletiva, particularmente se você estiver lidando com a cloração radical livre.
Vimos que uma exceção a este comportamento “chato” pode ser encontrada na brominação dos chamados laços C-H “alélicos”. A posição “alélica” é um carbono que é adjacente a uma ligação dupla (não um C-H na própria ligação dupla! que é um C-H “vinílico”).
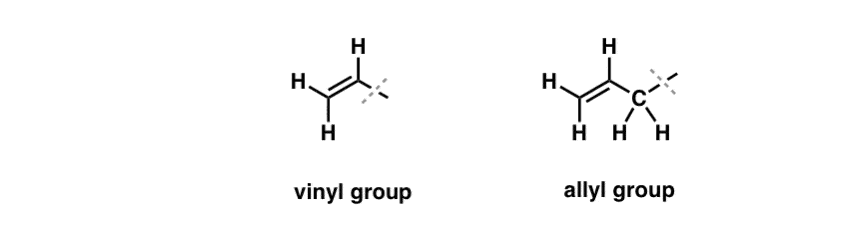
O que torna a posição “alélica” tão especial? Radicais alélicos, carbocações e ânions são consideravelmente estabilizados através da ressonância. O orbital do radical alélico, carbonização ou ânion pode se alinhar com os p-orbitais na ligação pi adjacente, resultando em um “sistema pi” maior e espalhando a carga por uma área maior.
Há algo especial sobre grupos alquílicos adjacentes a um anel de benzeno
Qual é a razão para esta pequena viagem pela faixa de memória? Bem, nós recentemente passamos um pouco da reação de alquilação do Friedel-Crafts, e eu não quero dar a impressão de que colocar um grupo alquilo em um anel de benzeno é um beco sem saída sintético.
Grupos alquílicos não precisam ser inertes! Como os carbonos alquílicos, os grupos alquílicos adjacentes aos anéis de benzeno são particularmente reactivos, e isto pode ter todo o tipo de aplicações importantes.
Existem duas reacções importantes que iremos cobrir neste post:
- Brominação benzílica – brominação do grupo alquilo adjacente a um anel aromático
- Oxidação benzílica – oxidação completa de um grupo alquilo adjacente ao benzeno para um ácido carboxílico.
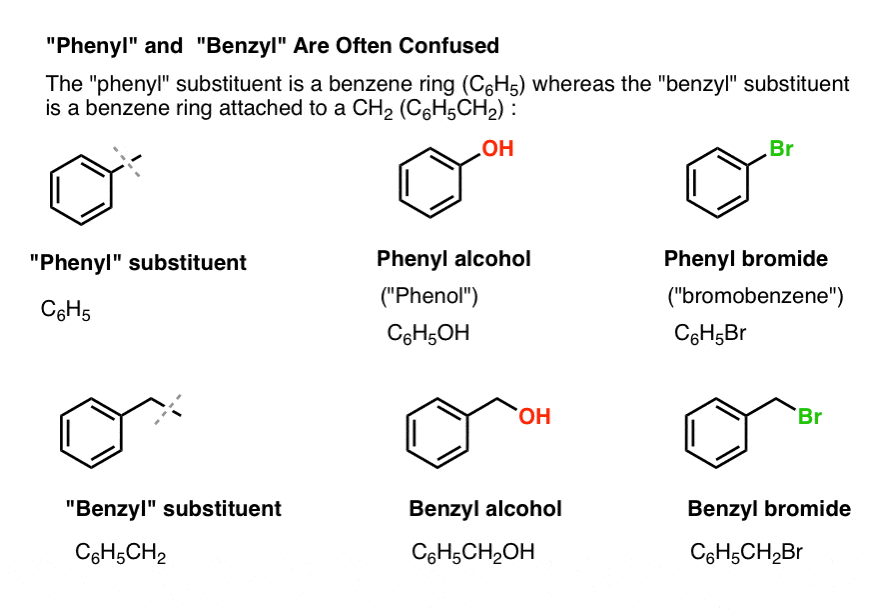
3. “Fenil” vs “Benzílico” : Qual é a diferença?
Primeiro, uma ordem de trabalho rápida. Vamos tirar alguma nomenclatura importante do caminho, porque “fenil” e “benzilo” causam muita confusão:
- Um grupo fenil (ou substituto do fenil) é benzeno menos um hidrogênio: C6H5 . Os carbonos no anel são carbonos fenil e os hidrogénios ligados aos carbonos fenil são ligações fenil C-H. É análogo ao vinil (ver acima).
- Um grupo benzil é metilbenzeno menos um hidrogênio: C6H5CH2 . O carbono adjacente ao anel é o carbono benzílico, e os hidrogénios ligados ao carbono benzílico são chamados de hidrogénios benzílicos. É análogo ao alil (acima).
4. Os radicais benzílicos são estabilizados por ressonância; os radicais fenílicos não são.
A analogia do fenil com o vinil e do benzilo com o alil também se estende à estabilidade dos seus radicais (assim como as suas carbonações e ânions).
- Os radicais fenil não são estabilizados por ressonância, uma vez que o orbital que contém o radical está em ângulo recto com os orbitais do pi-sistema, e não há sobreposição entre eles. Os radicais nos carbonos hibridizados sp2 são geralmente menos estáveis do que os radicais nos carbonos alquílicos. (Ver post: três factores que desestabilizam os radicais livres )
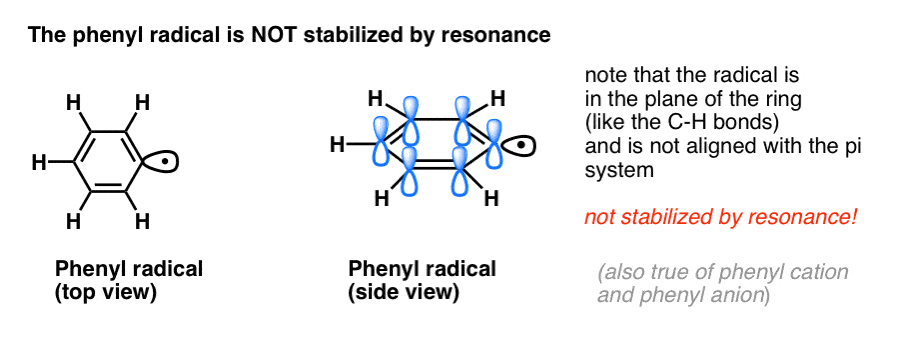
- Os radicais benzílicos são invulgarmente estáveis uma vez que o orbital que contém o radical pode alinhar-se com o sistema pi do anel do benzeno, tal como nos seus primos alélicos (isto também é verdade para os cátions benzílicos e aniões).
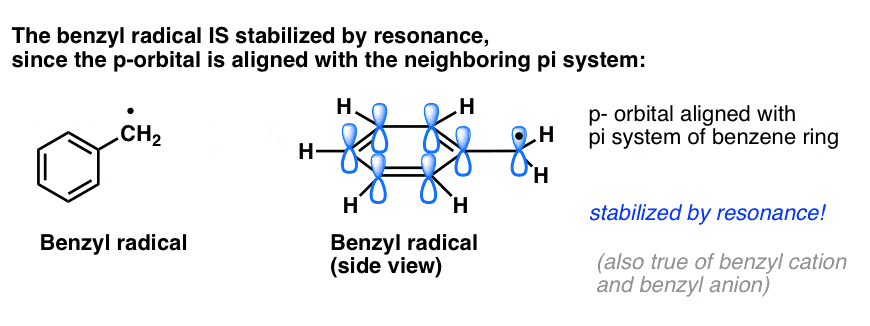
As ligações C-H benzílicas (e alélicas) são fracas, relativas a outras ligações C-H alquílicas
As ligações C-H benzílicas têm uma força de ligação (também conhecidas como BDE’s, ou energias de dissociação de ligações) de cerca de 90 kcal/mol, que é consideravelmente mais fraca do que as ligações terciárias C-H (força de ligação 93 kcal/mol) C-H secundárias (96 kcal/mol) e C-H primárias (100 kcal/mol). (as ligações Fenil C-H são cerca de 113 kcal/mol, refletindo novamente a instabilidade dos radicais fenil).
As energias de dissociação da ligação refletem a facilidade da clivagem homolítica da ligação C-H (ou seja, como é fácil dissociar a ligação em dois radicais livres) esta é outra forma de dizer que os radicais benzílicos são particularmente fáceis de formar, em relação a outros radicais alquílicos.
Vimos anteriormente que o mesmo é verdade para as ligações alílicas C-H. Na ‘brominação alélica’, uma das ligações C-H no grupo alquilo adjacente a uma ligação dupla é convertida para uma ligação C-Br, usando N-bromosuccinimida (NBS) e luz (hν) :
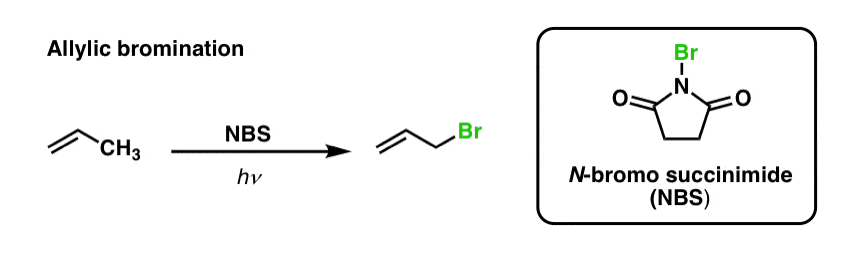
A reacção é selectiva para a ligação alélica C-H na presença de ligações C-H primárias, secundárias e terciárias, devido à resistência da ligação alélica C-H mais fraca (89 kcal/mol).
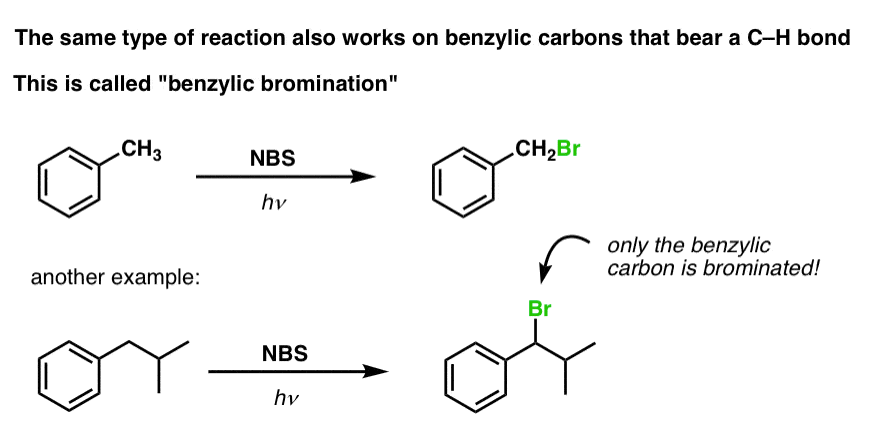
Brominação benzílica
Um processo semelhante funciona para os carbonos “benzílicos”. Podemos usar NBS (como acima) ou simplesmente Br2, já que os anéis aromáticos não são tão reativos com Br2 como as ligações duplas.
Onça formada (através do “calor” ou “luz”, que inicia a reação através da dissociação homolítica do Br-Br), o radical bromo, Br- pode quebrar as ligações mais fracas do benzílico C-H sem tocar nas ligações mais fortes do alquil C-H.
Por exemplo, aqui estão os produtos de sua reação com o tolueno, e também o isopropilbenzeno. Note que SOMENTE o carbono benzílico é brominado. Tudo o resto é deixado sozinho!
O mecanismo de brominação benzílica é essencialmente idêntico à brominação alélica, com etapas de iniciação, propagação e terminação. (Clique aqui para ver uma imagem pop-up do mecanismo.)
(Para mais discussão, veja este post: Bromação Alélica )
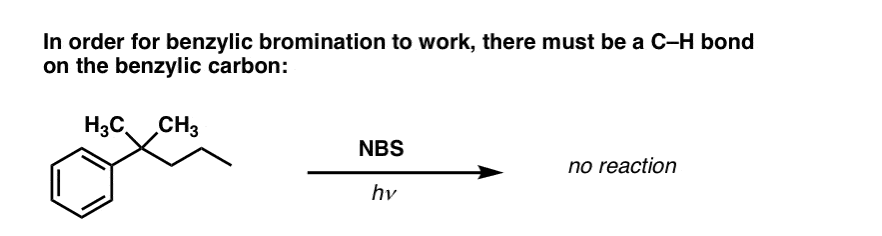
Quando a “Bromação Benzílica” NÃO Funciona?
Desde que a chave para esta reação é a formação do radical benzílico (relativamente estável), a brominação benzílica falhará em substratos onde a geração deste radical via quebra de uma ligação C-H é impossível.
Por exemplo, veja o exemplo abaixo. Como um radical benzílico pode ser gerado quando o carbono benzílico tem três grupos alquílicos ligados? Não pode – e a reação falha.
Aplicações de bromo benzílico
Então, porque é que a bromotação benzílica pode ser útil?
Bem, permite-nos empregar todas as reações de halogenetos alquílicos que cobrimos no Org 1 – principalmente substituição e eliminação – para fornecer produtos que seriam difíceis de instalar diretamente em um anel aromático através de reações de Friedel-Crafts.
Por exemplo, pode usar brominação benzílica para configurar uma reação SN2, por exemplo, após uma alquilação Friedel-Crafts:
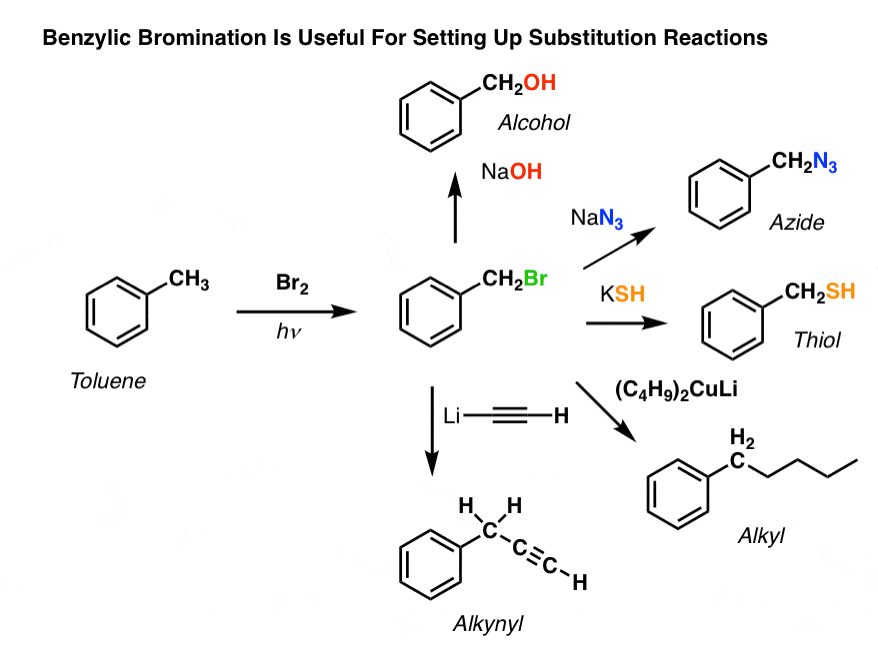
Ver como instalar um bom grupo de saída na posição benzílica nos dá todos os tipos de opções para instalar vários grupos funcionais?
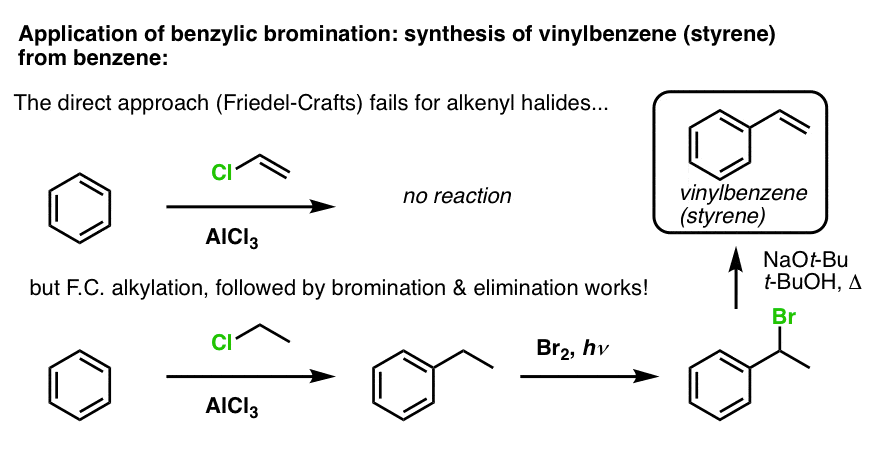
Outro exemplo é a síntese do estireno a partir do benzeno. À primeira vista, a abordagem mais directa pode parecer ser a reacção Friedel-Crafts do cloreto de vinil com benzeno. Mas o Friedel-Crafts não funciona para os halogenetos de alquilo (também conhecidos como halogenetos de vinil)! (os carbonatos de vinilo são menos estáveis que os carbonatos de alquilo).
Podemos contornar este bloqueio de estrada realizando uma alquilação Friedel-Crafts com cloreto de etilo, seguida de brominação benzílica e depois eliminação (via E2, com algo como NaOtBu/t-BuOH) para dar o alkene:
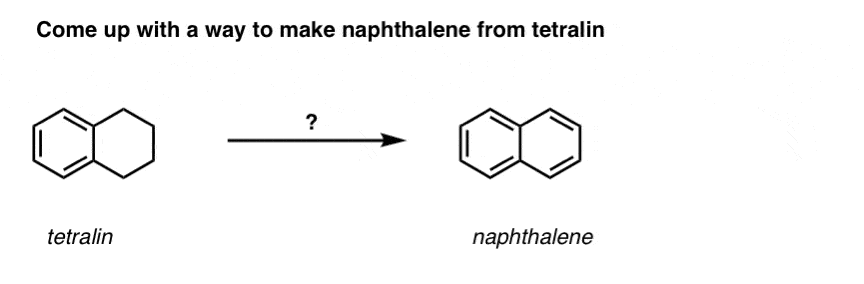
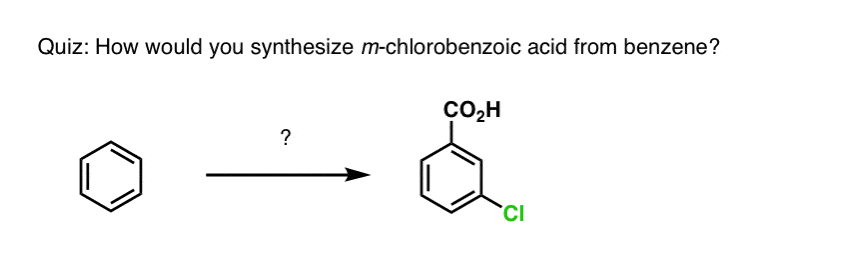
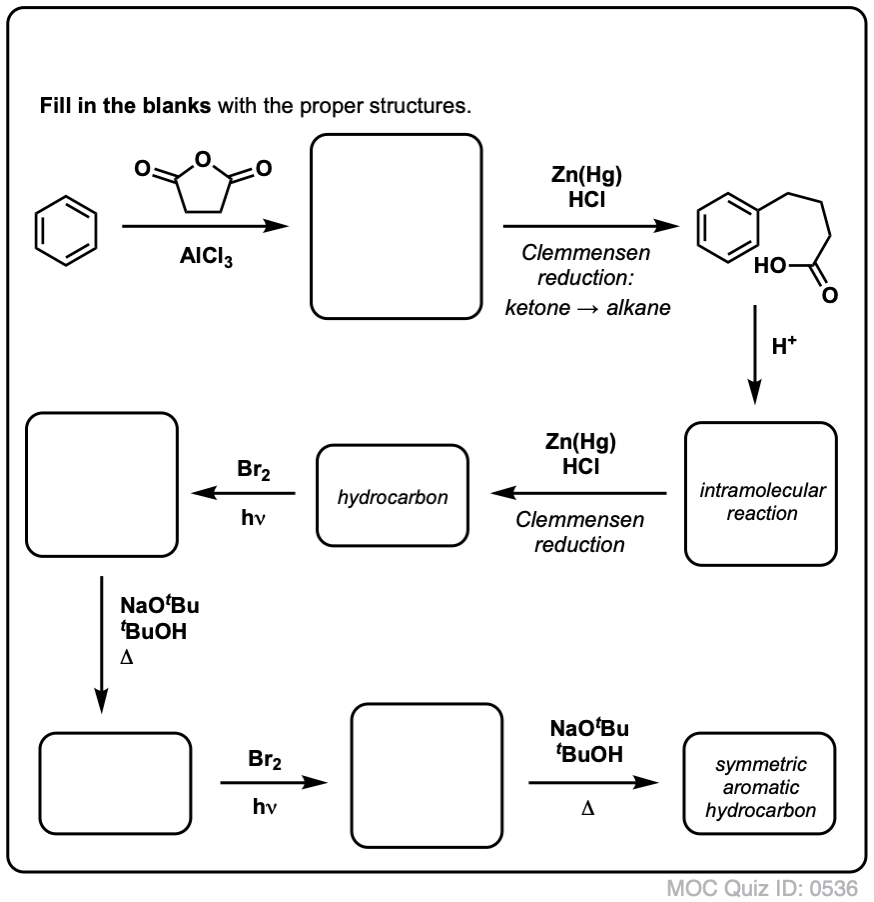
Com base no acima exposto, aqui vai um teste rápido para você. Como você poderia converter a tetralina (abaixo à esquerda) em naftalina (abaixo à direita)? Responda nas notas de rodapé.
9. Oxidação benzílica Com KMnO4 (ou H2CrO4)
Desde que a ligação benzílica C-H é relativamente fraca, você pode perguntar com razão se outros tipos de reações (além da bromação) podem ser realizadas nesta posição.
Eles certamente podem! Um exemplo principal é a oxidação benzílica – onde uma ligação benzílica C-H é quebrada e uma ligação benzílica C-O é formada.
Agora: existem reagentes bastante suaves para a oxidação benzílica que são o equivalente químico de fazer cócegas na ligação C-H com uma pena, resultando em um aldeído benzílico ou cetona .
Esse não é o tipo de oxidação benzílica que é coberto em um curso típico de química orgânica introdutória!
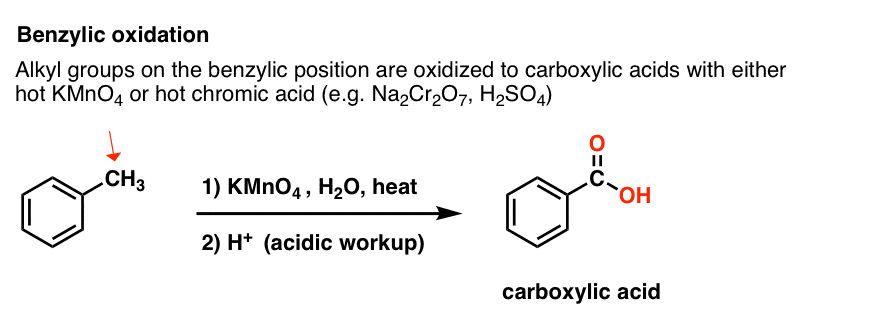
Em vez disso, o principal reagente para a oxidação benzílica que é coberto na maioria dos livros de introdução é o permanganato de potássio quente (KMnO4). O ácido crómico quente (H2CrO4, que é formado pela combinação de um sal dicromato como Na2Cr2O7 com um ácido forte como H2SO4) também pode ser usado para estes fins.
KMnO4 não é subtil. O KMnO4 não é suave. KMnO4 não é gentil.
Uma solução de KMnO4 quente é como um saco cheio de piranhas zangadas que arrancará toda a carne da sua molécula e deixará apenas ossos para trás. (Pensando bem, é como o seu fígado! )
O KMnO4 quente irá quebrar cada ligação benzílica C-H e convertê-la em uma ligação C-O. Do tolueno, por exemplo, o produto é ácido benzóico (um ácido carboxílico).
Mas não quebra apenas as ligações benzílicas C-H. Oh não. Ele vai atrás das ligações C-C também; pelo menos as que não estão diretamente ligadas a um anel de fenil. Por exemplo, o para-diethylbenzene é convertido em ácido para-benzenodicarboxílico.
Note que a ligação alquil C-C tem de ser clivada para que esta oxidação ocorra! (é provável que seja oxidado até ao gás CO2).
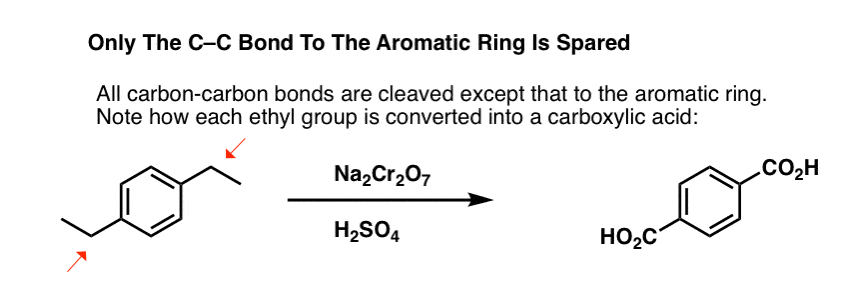
Uma variação interessante está numa molécula cíclica como a tetralina; o resultado é o ácido dicarboxílico.
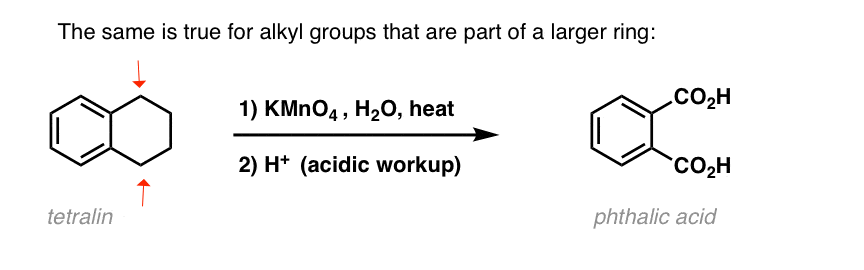
este ácido dicarboxílico é chamado ácido ftálico.
10. A oxidação benzílica requer uma ligação C-H benzílica
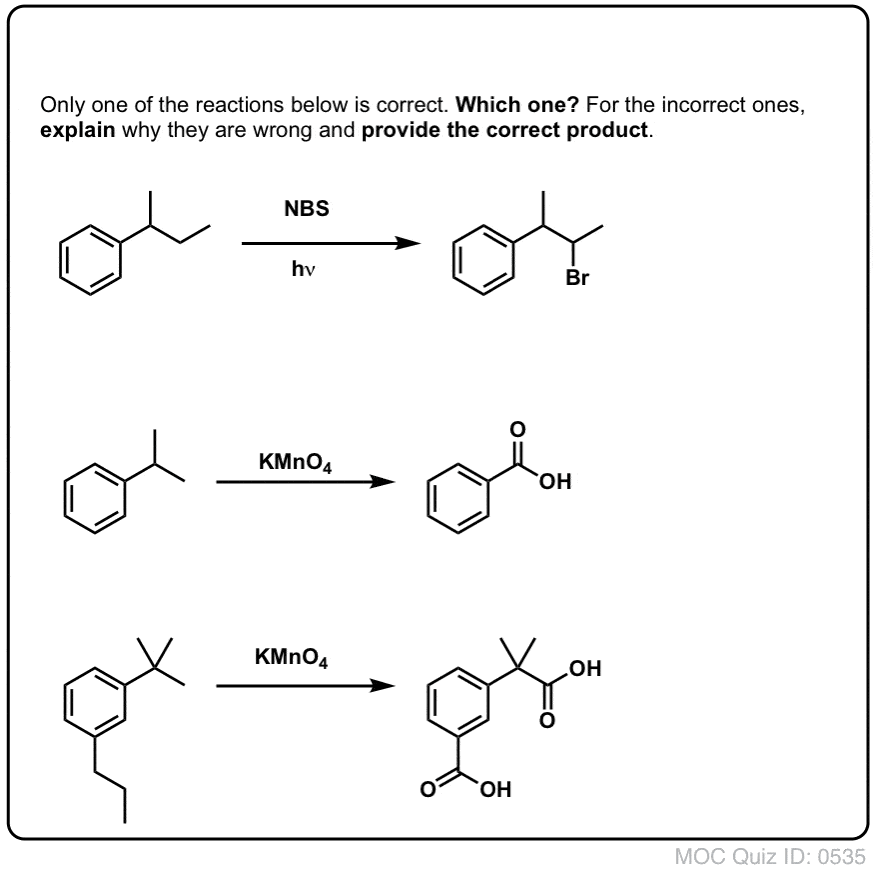
As com brominação benzílica, não ocorre nenhuma reação se não houver uma ligação C-H na posição benzílica. Por exemplo, a reação falha completamente com o t-butilbenzeno:
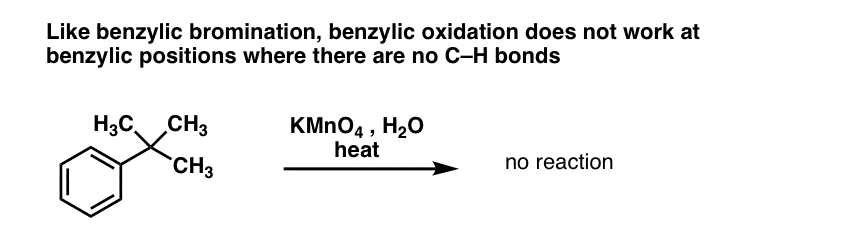
O mecanismo completo da oxidação benzílica é muito complexo, demorado e incerto para ser mostrado aqui, mas o primeiro passo é quase certamente a clivagem homolítica da ligação C-H pelo Mn=O para formar o radical benzílico.
Por que isso é importante?
Oxidação benzílica com KMnO4 é uma reação dura, mas pode ter as suas utilizações. Funciona melhor com moléculas simples que não têm grupos funcionais delicados e podem suportar algum tratamento muito rude.
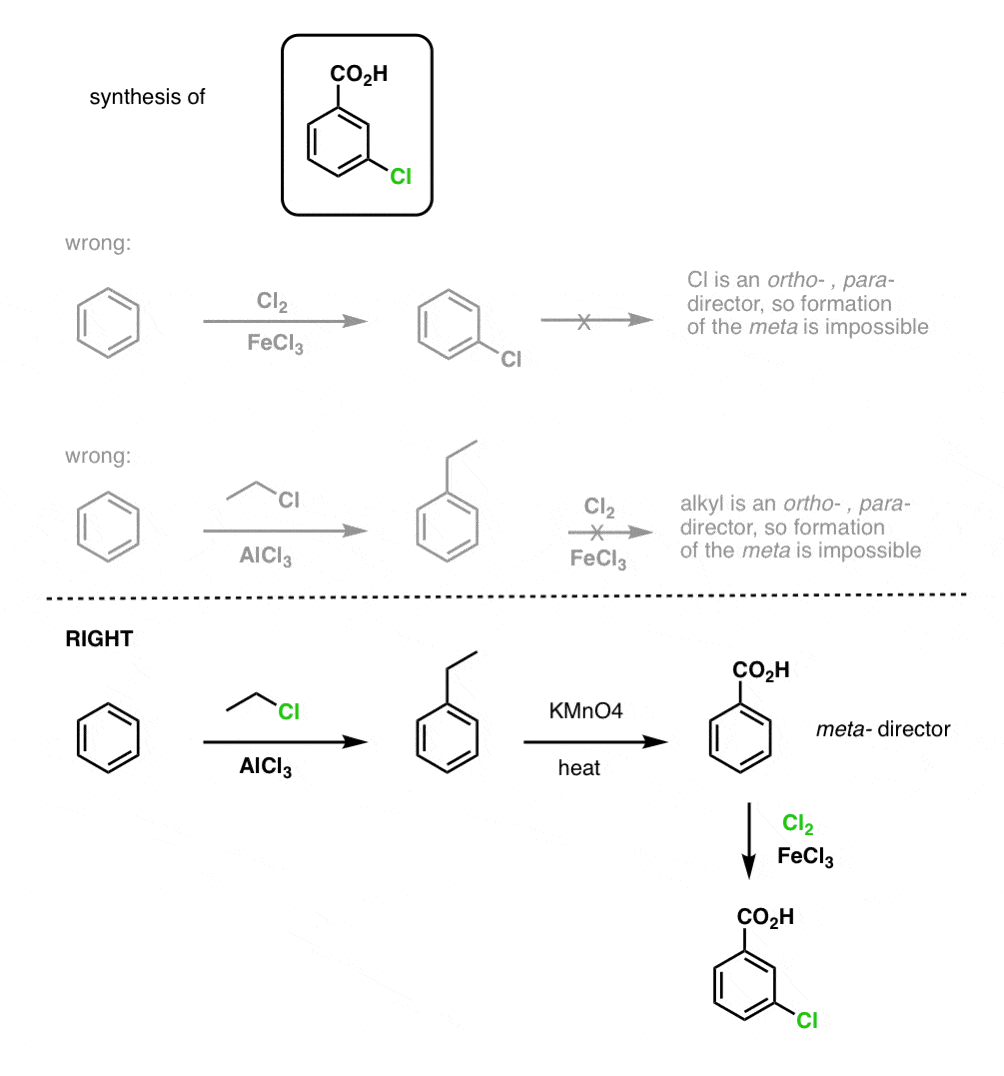
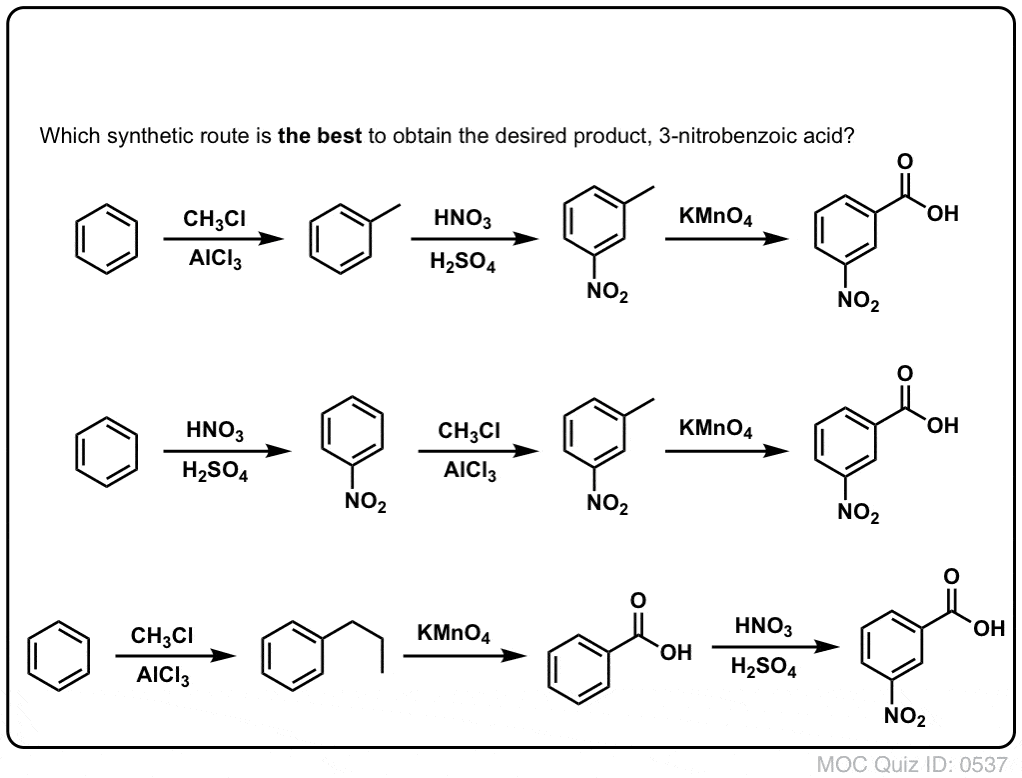
A primeira coisa a notar é que os ácidos carboxílicos não podem ser colocados directamente sobre um anel de benzeno através da acilação Friedel-Crafts, por isso a alquilação seguida de oxidação é uma solução útil.
A segunda função útil em síntese é o facto de que a oxidação benzílica converte um o- p- director (um grupo alquilo) num meta-director.
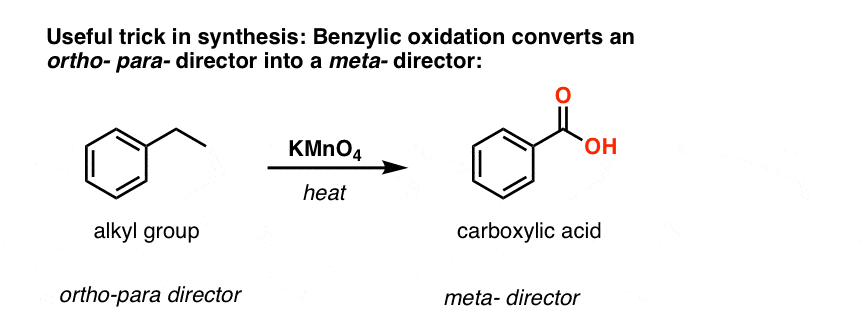
Por exemplo, confrontado com a síntese da seguinte molécula, como se procede? (dica: envolve uma oxidação benzílica em algum momento).
Teremos muito mais a dizer sobre a síntese de compostos aromáticos em mais alguns posts.
Próximo: Redução de carbonilos benzílicos – as reduções Clemmensen e Wolff-Kishner
Notas
“Repolho” também pode ser usado como um termo de gíria em química para “todas aquelas coisas na molécula que você pode seguramente ignorar” por qualquer razão. Por exemplo, bryostatin é uma besta de uma molécula que mostra promessa como um agente anticancerígeno. O problema é que é preciso uma tonelada de um bryozoan raro para obter uma quantidade decente de bryostatin, e isso não é suficiente para um ensaio clínico em humanos. Assim, vários grupos têm trabalhado para tornar mais simples, mais fácil sintetizar “bryologs” onde eles se livram do “repolho” que não é essencial para a atividade antitumoral.
Br2 geralmente não reagirá com anéis aromáticos sem um catalisador ácido de Lewis. No entanto, se um grupo forte ativador estiver presente (como OH, NR2, etc.) alguma brominação do anel pode ocorrer, especialmente a temperaturas elevadas.
Fato engraçado: “Oxidação benzílica” é a resposta ao quebra-cabeça de porque o metilbenzeno (tolueno) não é tão potente como o benzeno. Isso porque seu fígado tem enzimas citocromo p450 (contendo espécies de ferro em estado de alta oxidação) que podem oxidar o grupo CH3 benzílico para o ácido carboxílico mais solúvel em água, permitindo que ele seja limpo pelos rins.
Isto requer duas oxidações e duas eliminações. Uma forma cautelosa de o fazer é oxidar (ou seja, brominar) uma vez, e depois eliminar para dar um alqueno. O alceno poderia então ser submetido novamente à brominação (usando NBS, de modo a evitar a brominação da dupla ligação) para dar outra brominação (produto de brominação benzílica aqui mostrado, mas alélica também viável) que poderia ser tratada com base para dar naftaleno aromático.
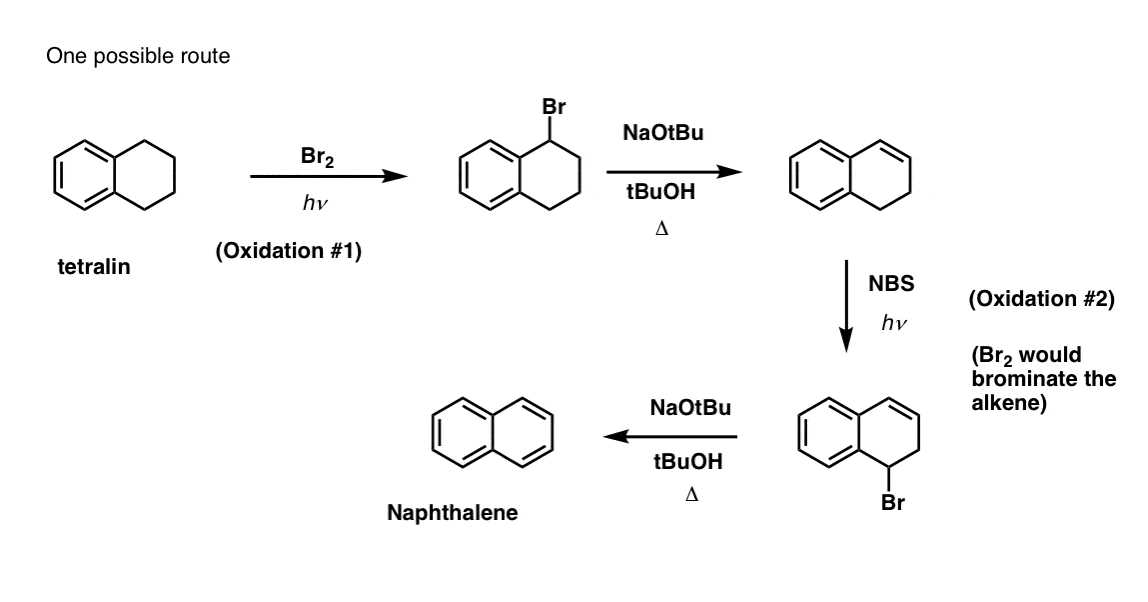
(na prática, acontece que ambas as brominações podem ser feitas ao mesmo tempo usando Br2 a alta temperatura. O tratamento com base pode então produzir naftaleno).
Resposta à pergunta 2.
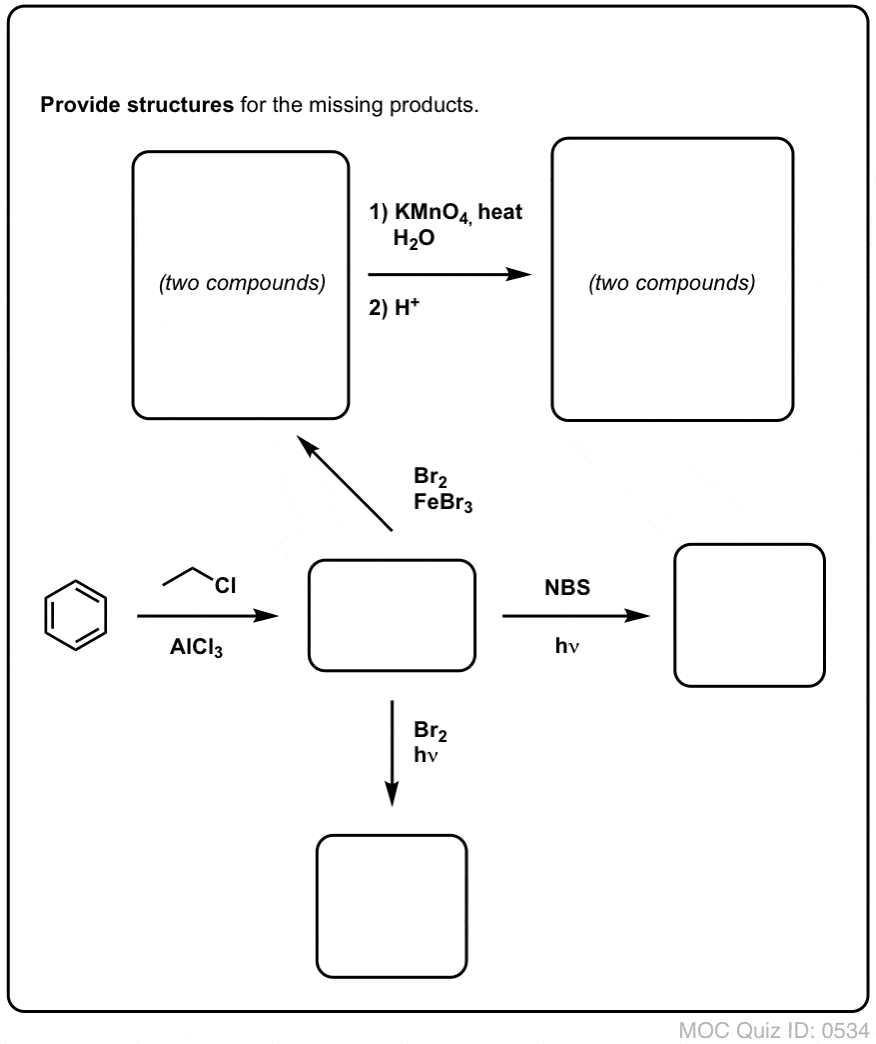
Quiz Yourself!
>
 Click to Flip
Click to Flip 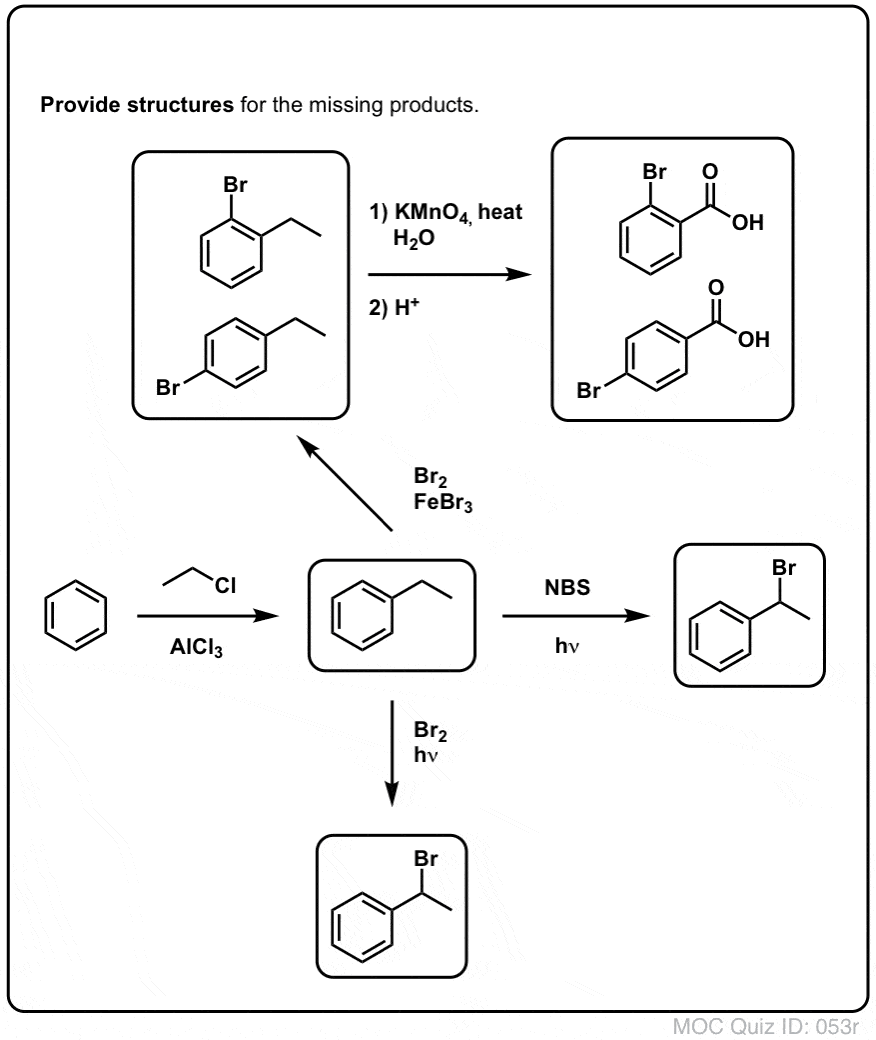
>
 Click to Flip
Click to Flip 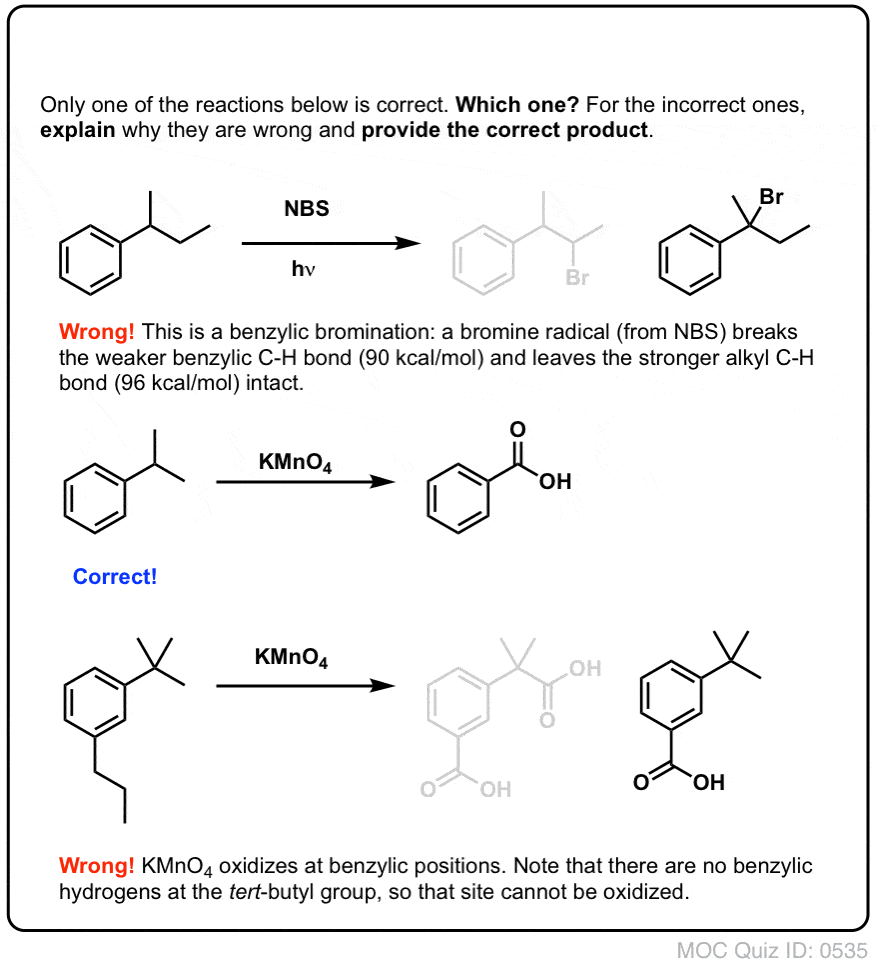
>
 Clique para inverter
Clique para inverter 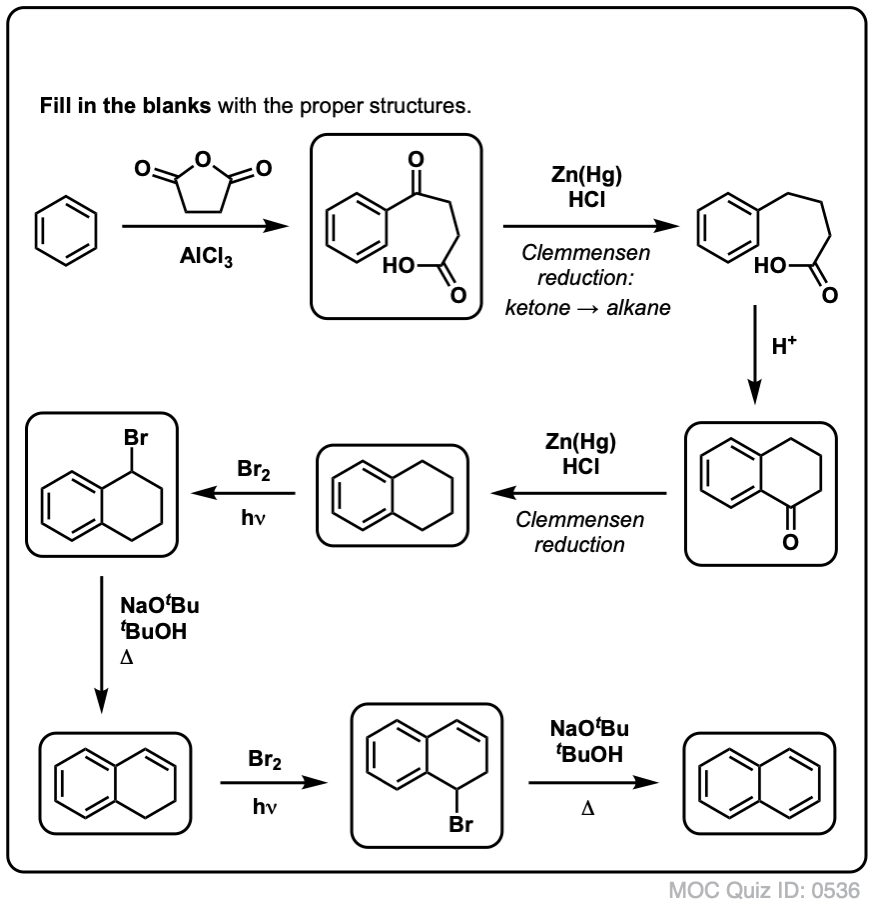
>
 Click to Flip
Click to Flip 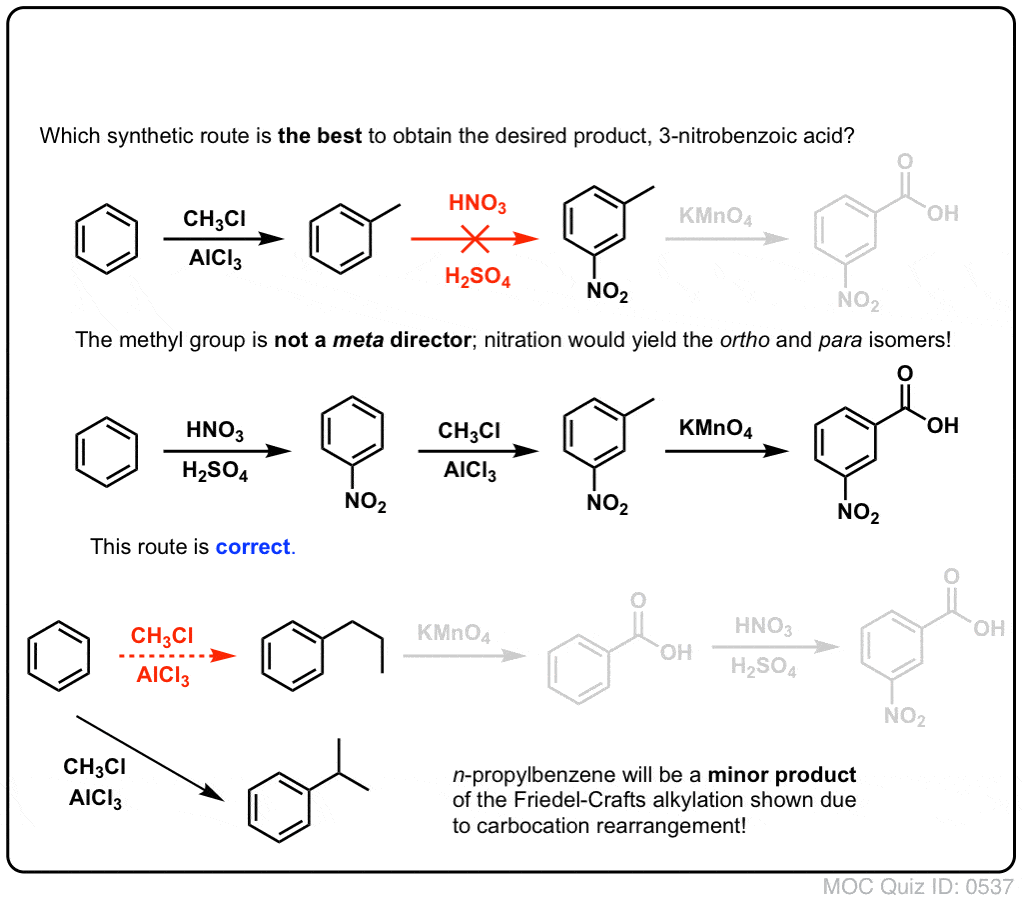
Referências (Avançadas) e Leitura Posterior
Brominação Benzílica:
Esta reacção também é conhecida como a reacção Wohl-Ziegler.
- Bromierung ungesättigter Verbindungen mit N-Brom-acetamid, ein Beitrag zur Lehre vom Verlauf chemischer Vorgänge
Wohl
Quimio. Ber. 1919, 52 (1), 51-63
DOI: 10.1002/cber.19190520109 - Die Halogenierung ungesättigter Substanzen in der Allylstellung
Ziegler, A. Späth, E. Schaaf, W. Schumann, E. Winkelmann
Just. Lieb. Ann. Chem. 1942, 551 (1), 80-119
DOI: 10.1002/jlac.19425510103
As duas primeiras publicações sobre esta reacção. Wohl usou N-bromoacetamida como o agente brominador, não NBS. Ziegler então realizou um estudo detalhado e relatou que NBS poderia ser usado como um agente brominador conveniente para brominação alélica. - Dibenzocyclooctene: Síntese Multigrama de um Bidentate Ligand
Géraldine Franck, Marcel Brill, e Günter Helmchen
Org. Síntese de um Bidentate Ligand. 2012, 89, 55-65
DOI: 10.15227/orgsyn.089.0055 - Brominações benzílicas com N-Bromosuccinimida em (Trifluorometil)benzeno
Diana Suarez, Gilles Laval, Shang-Min Tu, Dong Jiang, Claire L. Robinson, Richard Scott, Bernard T. Golding
Síntese 2009 (11): 1807-1810
DOI: 1055/s-0029-1216793
Referência #3 apresenta uma típica brominação benzílica usando NBS no CCl4, que foi em grande parte eliminada gradualmente devido a preocupações com a toxicidade. A referência #4 mostra que PhCF3 pode ser usado como solvente no lugar de CCl4 para brominação benzílica. - Brominações com N-Bromosuccinimida e Compostos Relacionados. The Wohl-Ziegler Reaction.
Carl Djerassi
Chemical Reviews 1948, 43 (2), 271-317
DOI: 10.1021/cr60135a004
Uma revisão antiga sobre esta reação feita pelo químico Carl Djerassi, cuja maior contribuição à saúde global foi o desenvolvimento da norethindrone – o primeiro contraceptivo feminino. - N-Bromosuccinimida. III. Curso estereoquímico de brometação benzílica
H. J. Dauben Jr. e Layton L. McCoy
Journal of the American Chemical Society 1959, 81 (20), 5404-5409
DOI: 10.1021/ja01529a038
Um estudo mecanicista sobre a estereoquímica da brominação benzílica. Observando a formação de brometos benzílicos racémicos a partir de substratos procrais, a intermediação dos radicais nesta reação é ainda mais fortalecida. As mesmas referências da brominação alélica podem ser redirecionadas aqui: - Mecanismos da Brominação Benzílica
Glen A. Russell, Charles. DeBoer, and Kathleen M. Desmond
Journal of the American Chemical Society 1963 85 (3), 365-366
DOI: 1021/ja00886a040
Brominação benzílica segue o mesmo mecanismo da bromoação alélica, como este trabalho explica.NBS (N-Bromosuccinimida) é um reagente conveniente para a bromodinâmica de radicais livres, e os seguintes trabalhos são estudos mecanicistas envolvendo NBS: - O Mecanismo da Bromodinâmica Benzílica com N-Bromosuccinimida
R. E. Pearson e J. C. Martin
Journal of the American Chemical Society 1963 85 (3), 354-355
DOI: 10.1021/ja00886a029
Estes trabalhos do Prof. J. C. Martin (UIUC) foram no início de sua carreira, antes de fazer o trabalho pelo qual ele é mais conhecido (estudos sobre moléculas ‘hipervalentes’, incluindo o desenvolvimento do ‘Dess-Martin Periodinane’). - A Identidade da Espécie em Cadeia de Transporte nas Brominações com N-Bromosuccinimida: Selectividade das N-Bromosuccinimidas Substituídas para Toluenos Substituídos
R. E. Pearson e J. C. Martin
Journal of the American Chemical Society 1963, 85 (20), 3142-3146
DOI: 10.1021/ja00903a021 - N-bromosuccinimida. Mecanismos de bromatinação alélica e reações relacionadas
J. H. Incremona e James Cullen Martin
Journal of the American Chemical Society 1970, 92 (3), 627-634
DOI: 10.1021/ja00706a034 - Radical succcinimidyl como um portador de cadeia. Mecanismo de brominação alélica
J. C. Day, M. J. Lindstrom e P. S. Skell
Journal of the American Chemical Society 1974, 96 (17), 5616-5617
DOI: 10.1021/ja00824a074 - Brominação Radical do Ciclohexeno em CCl4 por Bromo: Adição versus Substituição
D. W. McMillen e John B. Grutzner
The Journal of Organic Chemistry 1994, 59 (16), 4516-4528
DOI: 10.1021/jo00095a029
Este trabalho descreve estudos cinéticos cuidadosos que demonstram que uma baixa concentração de Br2 (como a fornecida pela NBS impura) favorecerá a substituição radical sobre uma reação de adição polar. - o-XYLYLENE DIBROMIDE
Emily F. M. Stephenson
Org. Synth. Vol. 34, p.100 (1954)
DOI: 10.15227/orgsyn.034.0100
Um procedimento confiável para brominação benzílica com Br2 em Sínteses Orgânicas. - Brominação de Tetralina. Síntese curta e eficiente de 1,4-Dibromonaftaleno
Osman Çakmak, Ismail Kahveci, Íbrahim Demirtaş, Tuncer Hökelek e Keith Smith
Checo. Chem. Comun. 2000, 65, 1791-1804
DOI: 10.1135/cccc20001791
Uma síntese conveniente de 1,4-dibromonaftaleno de tetralina, via brominação benzílica. Oxidação benzílica:
Existem muitas estratégias para a oxidação benzílica, incluindo o uso de soluções concentradas de KMnO4 ou ácido crómico. - Estudos cinéticos da oxidação de compostos aromáticos por permanganato de potássio. Parte IV. n- e iso-Propilbenzeno
C. F. Cullis e J. W. Ladbury
J. Chem. Soc. 1955, 4186-4190
DOI: 10.1039/JR9550004186 - PIPERIDINA DERIVATIVOS X. THE PHENYLPIPERIDYLCARBINOLS
Kenneth E. Crook e S. M. McElvain
Journal of the American Chemical Society 1930, 52 (10), 4006-4011
DOI: 1021/ja01373a035
Se houver outro substituto na posição benzílica, então oxidação com dar uma cetona em vez de um ácido carboxílico. - Oxidações Heterogêneas de Permanganato. 7. A Oxidação de Cadeias Laterais Alifáticas
Nazih A. Noureldin, Dongyuan Zhao, e Donald G. Lee
The Journal of Organic Chemistry 1997, 62 (25), 8767-8772
DOI: 1021/jo971168e
Reagentes podem ser adsorvidos em suportes sólidos para facilitar a condução de reações e reduzir resíduos. Neste caso, ao tornar o reagente KMnO4 heterogêneo, a reatividade muda ligeiramente, e isto pode ser explorado para algumas oxidações quimioletivas. Muitos outros reagentes podem ser usados para oxidação benzílica, aqui está uma seleção: - Oxidação Seletiva em Carbono Adjacente a Sistemas Aromáticos com IBX
K. C. Nicolaou, Phil S. Baran, e Yong-Li Zhong
Journal of the American Chemical Society 2001, 123 (13), 3183-3185
DOI: 10.1021/ja004218x
Um trabalho inicial do (agora estrela do rock de síntese total) Prof. Phil Baran (The Scripps Research Institute, La Jolla, CA) enquanto ainda era estudante de doutorado no grupo do Prof. Nicolaou. Este usa IBX (um reagente I(V) hipervalente) para fazer oxidações benzílicas, que ocorrem através de um mecanismo radical. Esta é uma reação útil com amplo escopo de substrato, como exemplificado por 25 exemplos no trabalho. - Oxidação Benzílica Direta e Seletiva de Alquilarenos via Abstração C-H Usando Brometos de Metal Alcalino
Katsuhiko Moriyama, Misato Takemura, e Hideo Togo
Cartas Orgânicas 2012, 14 (9), 2414-2417
DOI: 10.1021/ol300853z
Este utiliza Oxone como oxidante terminal para oxidação benzílica. - Síntese de Álcoois Benzílicos por Oxidação C-H
Lalita Tanwar, Jonas Börgel e Tobias Ritter
J. Am. Chem. Soc. 2019, 141, 17983-17988
DOI: 10.1021/jacs.9b09496
Usa peróxido de mesil como oxidante para a oxidação seletiva de posições benzílicas para álcoois. O mesilato de benzilo é formado, que pode ser hidrolisado ao álcool. - Oxidação eletroquímica benzílica das ligações C-H
Jason A. Marko, Anthony Durgham, Stacey Lowery Bretz, e Wei Liu
Chem. Commun.., 2019, 55, 937-940
DOI: 10.1039/C8CC08768G
A oxidação benzílica também pode ser efetuada por eletroquímica. - Reações de oxidação alélica e benzílica com clorito de sódio
Samuel M. Silvestre, Jorge A. R. Salvador
Tetraedro 2007, 63 (11), 2439-2445
DOI: 10.1016/j.tet.2007.01.012
NaClO2 é barato e também pode ser usado como oxidante.
Deixe uma resposta