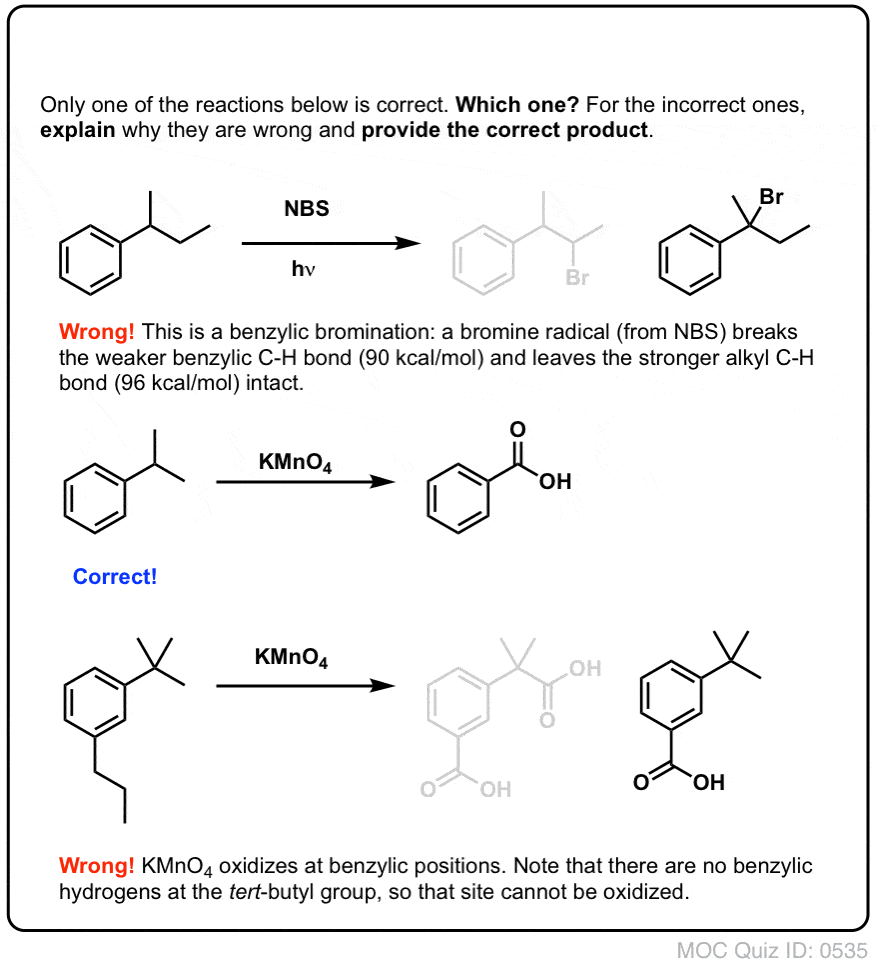
Reakcje na „Benzylowy” węgiel: Bromowanie i utlenianie
On 12 października, 2021 by adminWęgiel przylegający do pierścienia aromatycznego – „benzylowy” węgiel – może uczestniczyć w kilku użytecznych i ciekawych reakcjach. Dzisiaj przedstawimy przykłady i mechanizmy dwóch kluczowych przykładów: bromowania benzylowego i utleniania benzylowego. Oto krótkie podsumowanie:
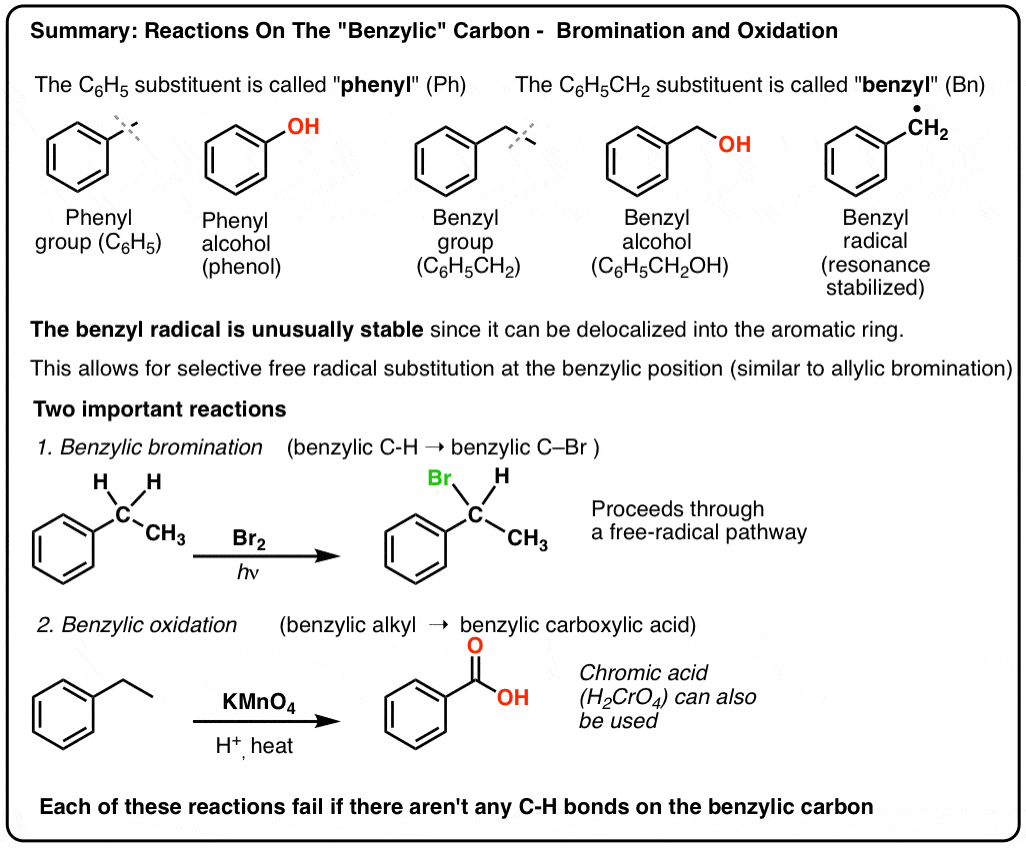
Table of Contents
- Alkyl Groups = „Roughage”
- There’s Something Special About Alkyl Groups Adjacent To A Benzene Ring
- „Phenyl” vs „Benzyl” : What’s The Difference?
- Rodniki benzylowe są stabilizowane przez rezonans; fenylowe nie są.
- Benzylowe (i allilowe) wiązania C-H są słabe, w stosunku do innych alkilowych wiązań C-H
- Bromowanie benzylowe
- Kiedy „bromowanie benzylowe” NIE działa?
- Zastosowanie bromowania benzylowego
- Oksydacja benzylowa z KMnO4 (lub H2CrO4)
- Oksydacja benzylowa wymaga wiązania benzylowego C-H
- Dlaczego to jest ważne?
- Notatki
- Zadaj sobie pytanie!
- (Zaawansowane) Odnośniki i dalsza lektura
Grupy alkilowe = „Pasze objętościowe”
W żywieniu, „pasze objętościowe” to to, co nazywamy celulozą i błonnikiem obecnym w środkach spożywczych, które po prostu przechodzą przez nasze ciało, nie będąc właściwie trawione.
To całkiem dobrze opisuje zachowanie grup alkilowych w ogromnej większości reakcji chemii organicznej, których się nauczyliśmy. Ich chemia jest „nudna”. Mogą one obejmować szkielet i ogólną strukturę cząsteczki, ale ich wiązania C-H są obojętne dla większości warunków reakcji.
W rzeczywistości, jeśli nie liczyć spalania, całkiem dużo jedyną reakcją grup alkilowych, które pokrywamy we wprowadzeniu do chemii organicznej jest substytucja wolnorodnikowa. I nawet ta reakcja ma tendencję do bycia dość nieselektywną, szczególnie jeśli masz do czynienia z chlorowaniem wolnorodnikowym.
Widzieliśmy, że wyjątek od tego „nudnego” zachowania można znaleźć w wolnorodnikowym bromowaniu tak zwanych „allilowych” wiązań C-H. Allylic” pozycja jest węgiel, który jest przylegający do podwójnego wiązania (nie C-H na podwójnym wiązaniu sam! to jest „vinylic” C-H).
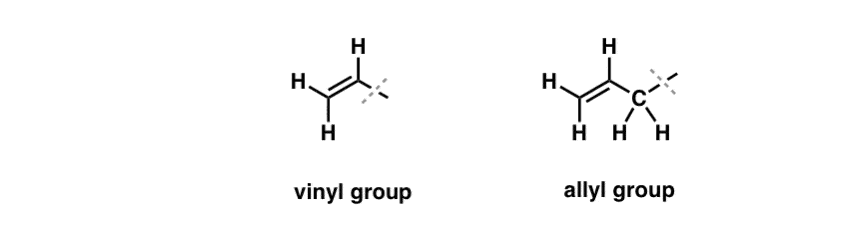
Co sprawia, że pozycja „allilowa” jest tak wyjątkowa? Rodniki allilowe, karbokationy i aniony są znacznie ustabilizowane poprzez rezonans. Orbitale rodnika allilowego, karbokationu lub anionu mogą ustawiać się w linii z orbitalami p w sąsiednim wiązaniu pi, co skutkuje większym „układem pi” i rozłożeniem ładunku na większy obszar.
There’s Something Special About Alkyl Groups Adjacent To A Benzene Ring
Co jest powodem tej małej wycieczki w dół uliczki pamięci? Cóż, ostatnio spędziliśmy trochę czasu nad reakcją alkilacji Friedela-Craftsa i nie chcę, abyście odnieśli wrażenie, że umieszczenie grupy alkilowej na pierścieniu benzenowym to syntetyczny ślepy zaułek.
Grupy alkilowe nie muszą być obojętne! Podobnie jak węgle allilowe, grupy alkilowe przylegające do pierścieni benzenowych są szczególnie reaktywne, co może mieć wiele ważnych zastosowań.
Istnieją dwie ważne reakcje, które omówimy w tym poście:
- Bromowanie benzylowe – wolnorodnikowe bromowanie grupy alkilowej przylegającej do pierścienia aromatycznego
- Utlenianie benzylowe – całkowite utlenienie grupy alkilowej przylegającej do benzenu do kwasu karboksylowego.
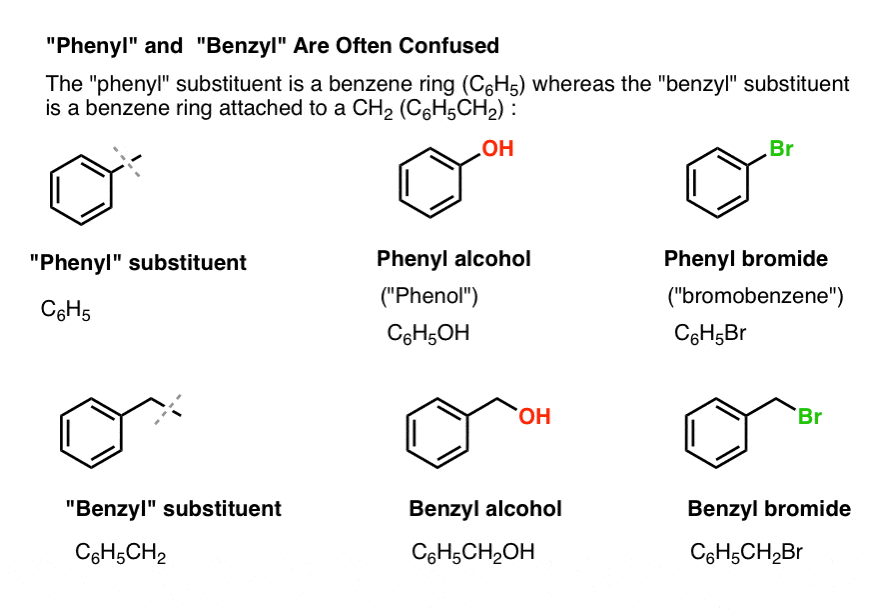
3. „Phenyl” vs „Benzyl” : What’s The Difference?
Po pierwsze, jedna szybka kolejność spraw. Załatwmy kilka ważnych nomenklatur z drogi, ponieważ „fenyl” i „benzyl” powodują wiele zamieszania:
- Grupa fenylowa (lub podstawnik fenylowy) to benzen pomniejszony o wodór: C6H5 . Węgle w pierścieniu to węgle fenylowe, a hydrogeny przyłączone do węgli fenylowych to wiązania fenylowe C-H. Jest to analogiczne do winylu (patrz wyżej).
- Grupa benzylowa to metylobenzen minus wodór: C6H5CH2 . Węgiel przylegający do pierścienia jest węglem benzylowym, a hydrogeny przyłączone do węgla benzylowego są nazywane hydrogenami benzylowymi. Jest to analogiczne do allilu (powyżej).
4. Benzyl Radicals Are Stabilized By Resonance; Phenyl Radicals Are Not.
Analgia fenylu z winylem i benzylu z allilem rozciąga się również na stabilność ich rodników (jak również ich karbokationów i anionów).
- Rodniki fenylu nie są stabilizowane przez rezonans, ponieważ orbital zawierający rodnik jest pod kątem prostym do orbitali układu pi, i nie ma nakładania się między nimi. Rodniki na sp2 hybrydyzowanych węglach są generalnie mniej stabilne niż rodniki na węglach alkilowych. (Patrz post: trzy czynniki destabilizujące wolne rodniki)
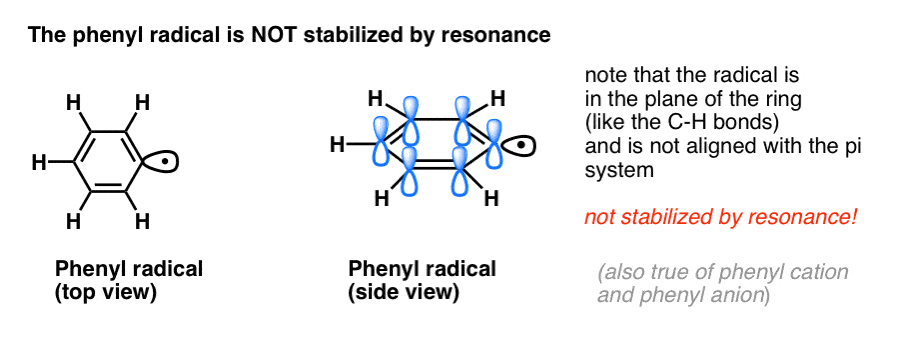
- Rodniki benzylowe są niezwykle stabilne, ponieważ orbitale zawierające rodnik mogą ustawiać się w jednej linii z układem pi pierścienia benzenowego, podobnie jak u ich allilowych kuzynów (dotyczy to również kationów i anionów benzylowych).
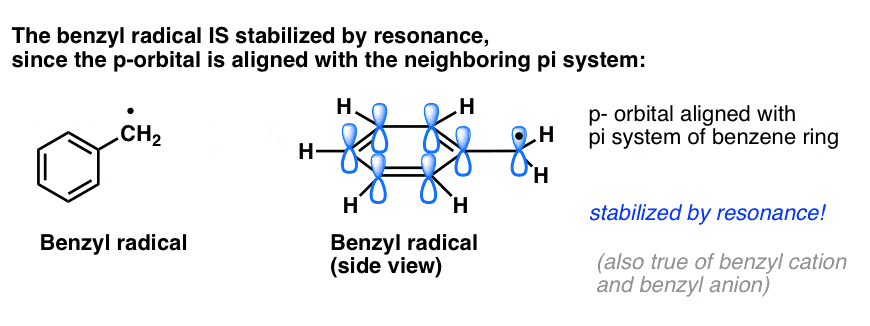
Benzylowe (i allilowe) wiązania C-H są słabe, w stosunku do innych alkilowych wiązań C-H
Benzylowe wiązania C-H mają siły wiązań (aka BDE’s, lub energie dysocjacji wiązań) około 90 kcal/mol, co jest znacznie słabsze niż trzeciorzędowe C-H (siła wiązania 93 kcal/mol), drugorzędowe C-H (96 kcal/mol) i pierwszorzędowe C-H (100 kcal/mol). (Wiązania fenylu C-H są około 113 kcal/mol, ponownie odzwierciedlając niestabilność rodników fenylu ).
Ponieważ energie dysocjacji wiązań odzwierciedlają łatwość homolitycznego rozszczepienia wiązania C-H (tj. jak łatwo jest zdysocjować wiązanie na dwa wolne rodniki), jest to inny sposób powiedzenia, że rodniki benzylowe są szczególnie łatwe do utworzenia, w stosunku do innych rodników alkilowych.
Wcześniej widzieliśmy, że to samo jest prawdziwe dla allilowych wiązań C-H . W „bromowaniu allilowym”, jedno z wiązań C-H na grupie alkilowej przylegające do wiązania podwójnego jest przekształcane w wiązanie C-Br, przy użyciu N-bromobursztynoimidu (NBS) i światła (hν) :
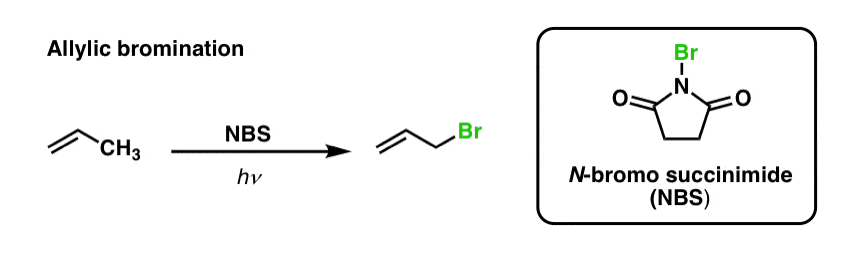
Reakcja jest selektywna dla allilowego C-H w obecności pierwszorzędowych, drugorzędowych i trzeciorzędowych wiązań C-H ze względu na słabszą siłę wiązania allilowego C-H (89 kcal/mol).
Bromowanie benzylowe
Podobny proces działa dla „benzylowych” węgli. Możemy użyć NBS (jak wyżej) lub po prostu Br2, ponieważ pierścienie aromatyczne nie są prawie tak reaktywne z Br2 jak wiązania podwójne.
Po utworzeniu (przez „ciepło” lub „światło”, które inicjuje reakcję poprzez homolityczną dysocjację Br-Br), rodnik bromu, Br- może złamać słabsze benzylowe wiązania C-H bez dotykania silniejszych alkilowych wiązań C-H.
Na przykład, tutaj są produkty jego reakcji z toluenem, a także izopropylobenzen. Zauważ, że TYLKO węgiel benzylowy jest bromowany. Wszystko inne jest pozostawione w spokoju!
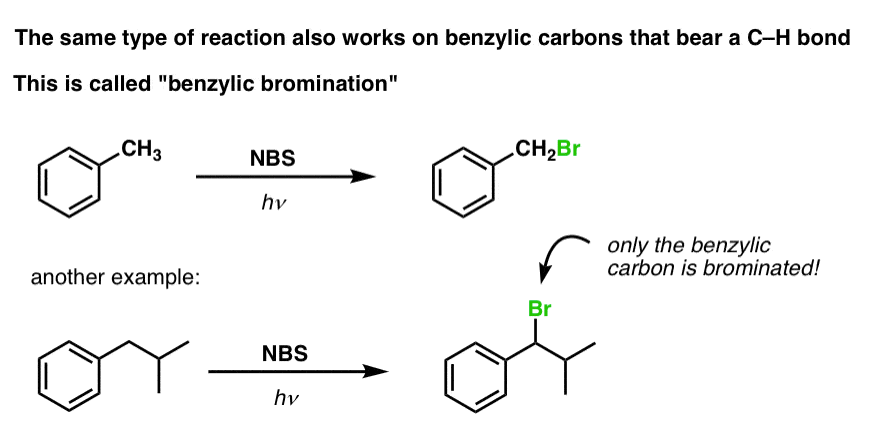
Mechanizm bromowania benzylowego jest zasadniczo identyczny jak bromowania allilowego, z etapami inicjacji, propagacji i zakończenia. (Kliknij tutaj, aby zobaczyć wyskakujący obraz mechanizmu.)
(Aby uzyskać więcej informacji, zobacz ten post: Bromowanie allilowe )
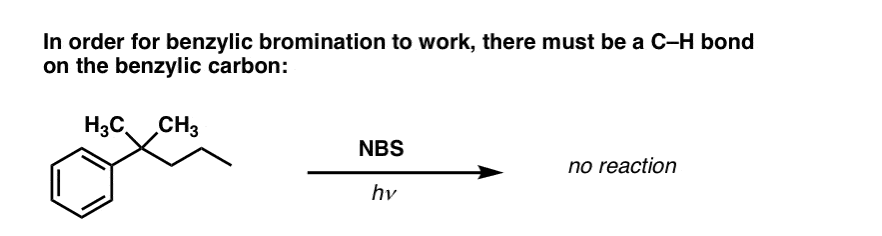
Kiedy „bromowanie benzylowe” NIE działa?
Ponieważ kluczem do tej reakcji jest tworzenie (względnie stabilnego) rodnika benzylowego, bromowanie benzylowe nie powiedzie się na substratach, gdzie generowanie tego rodnika poprzez rozerwanie wiązania C-H jest niemożliwe.
Na przykład, spójrz na poniższy przykład. Jak rodnik benzylowy może być generowany, gdy węgiel benzylowy ma trzy grupy alkilowe? Nie może – i reakcja kończy się niepowodzeniem.
Zastosowania bromowania benzylowego
Dlaczego więc bromowanie benzylowe może być użyteczne?
No cóż, pozwala nam to na zastosowanie wszystkich reakcji halogenków alkilowych, które omówiliśmy w Org 1 – głównie podstawienia i eliminacji – w celu dostarczenia produktów, które byłyby trudne do zainstalowania bezpośrednio na pierścieniu aromatycznym poprzez reakcje Friedela-Craftsa.
Na przykład, można użyć bromowania benzylowego do wywołania reakcji SN2, np. po alkilacji Friedela-Craftsa:
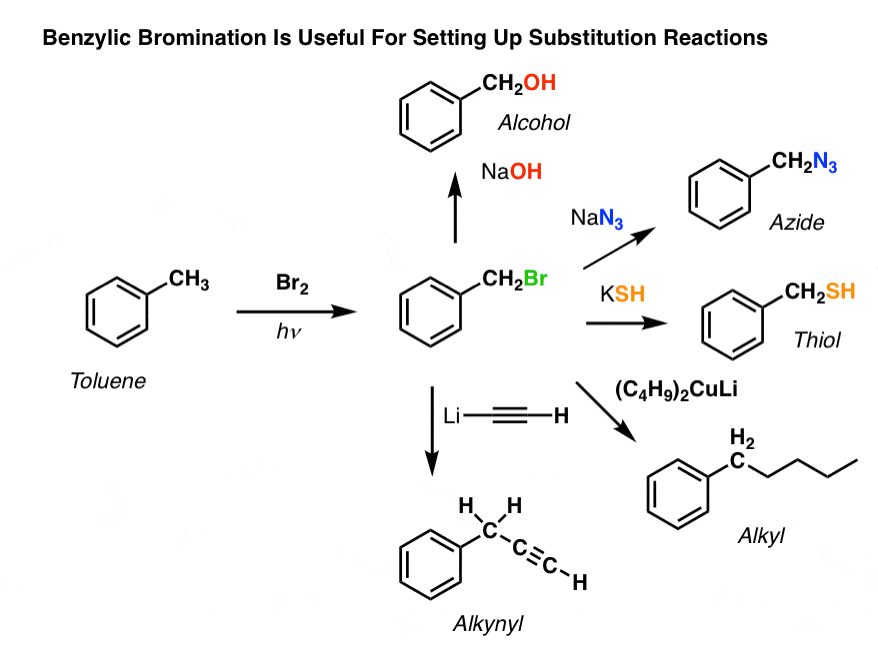
Widzisz jak zainstalowanie dobrej grupy opuszczającej w pozycji benzylowej daje nam wszystkie rodzaje opcji do zainstalowania różnych grup funkcyjnych?
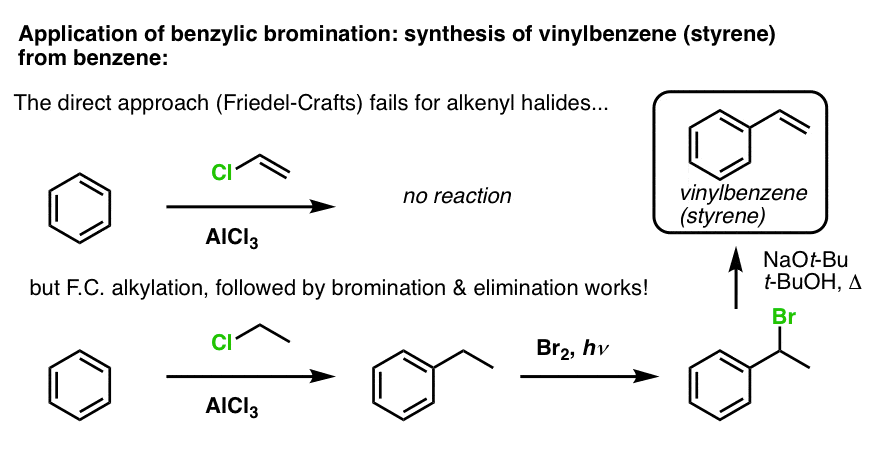
Innym przykładem jest synteza styrenu z benzenu. Na pierwszy rzut oka, najbardziej bezpośrednim podejściem może wydawać się reakcja Friedela-Craftsa chlorku winylu z benzenem. Ale reakcja Friedela-Craftsa nie działa dla halogenków alkenylowych (vel halogenków winylowych)! (Karbokationy winylowe są mniej stabilne niż karbokationy alkilowe).
Możemy obejść tę przeszkodę, wykonując alkilację Friedela-Craftsa za pomocą chlorku etylu, a następnie bromowanie benzylowe, a następnie eliminację (przez E2, z czymś takim jak NaOtBu/t-BuOH), aby uzyskać alken:
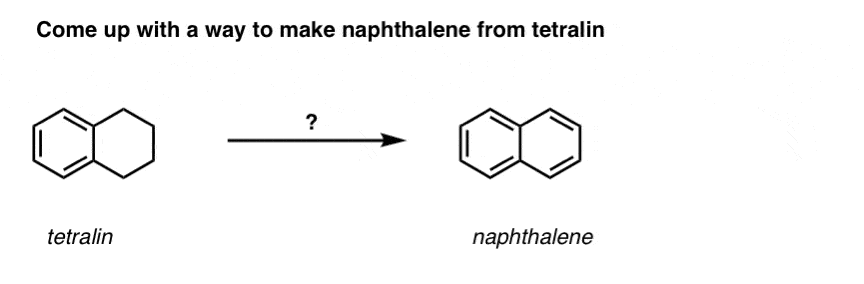
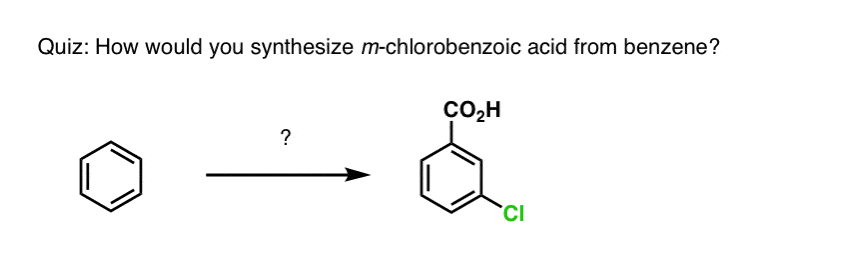
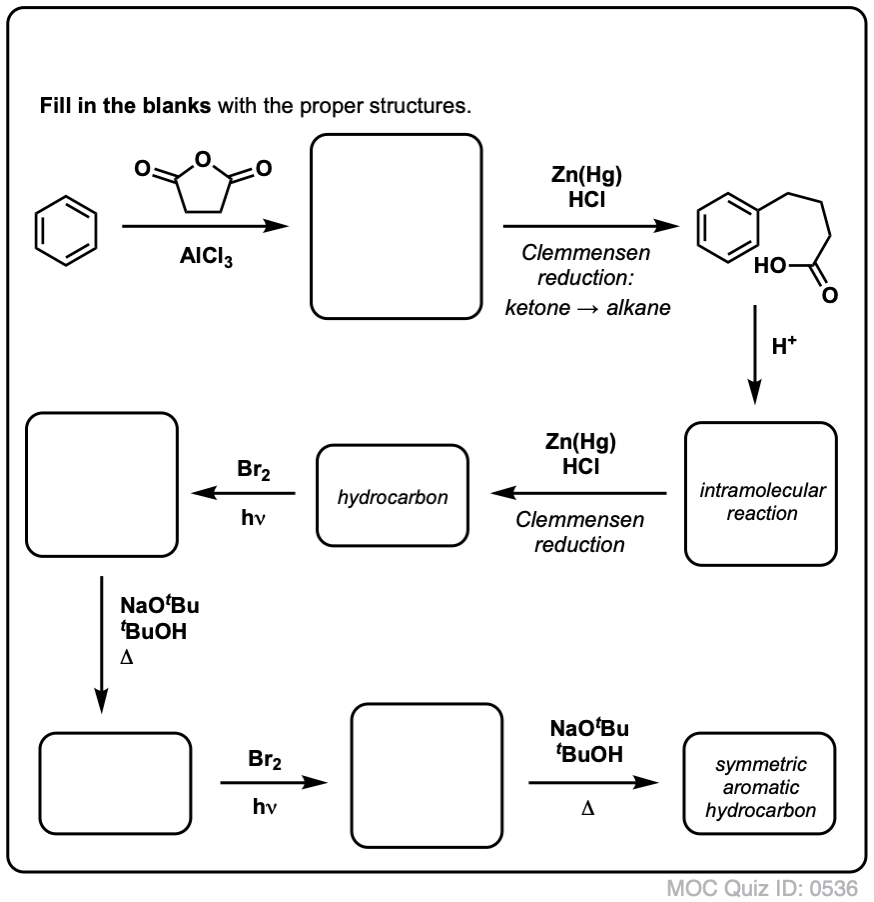
W oparciu o powyższe, oto szybki quiz dla Ciebie. Jak można przekształcić tetralinę (poniżej po lewej) w naftalen (poniżej po prawej)? Odpowiedź w przypisach.
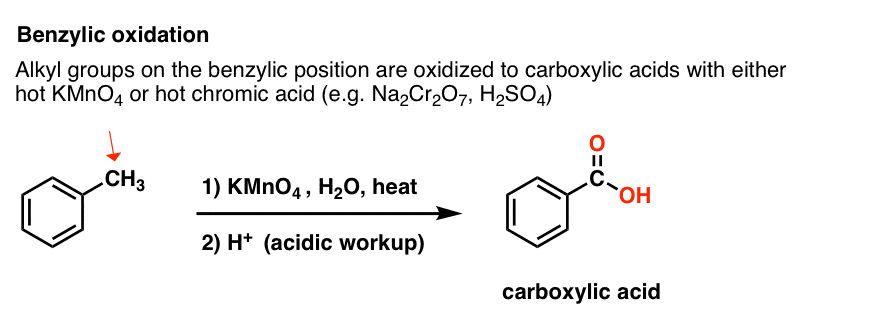
9. Benzylowe utlenianie KMnO4 (lub H2CrO4)
Ponieważ wiązanie benzylowe C-H jest stosunkowo słabe, można słusznie zapytać, czy inne typy reakcji (poza bromowaniem) mogą zachodzić w tej pozycji.
Z pewnością mogą! Doskonałym przykładem jest utlenianie benzylowe – gdzie wiązanie benzylowe C-H jest zerwane i powstaje wiązanie benzylowe C-O.
Teraz: istnieją dość łagodne odczynniki do utleniania benzylowego, które są chemicznym odpowiednikiem łaskotania wiązania C-H piórkiem, w wyniku czego powstaje aldehyd benzylowy lub keton.
To nie jest typ utleniania benzylowego, który jest uwzględniony w typowym kursie wprowadzającym do chemii organicznej!
Zamiast tego, głównym odczynnikiem do utleniania benzylowego, który jest uwzględniony w większości podręczników wprowadzających jest gorący nadmanganian potasu (KMnO4). Gorący kwas chromowy (H2CrO4, który powstaje przez połączenie soli dichromianu jak Na2Cr2O7 z silnym kwasem jak H2SO4) może być również używany do tych celów.
KMnO4 nie jest subtelny. KMnO4 nie jest delikatny. KMnO4 nie jest miły.
Roztwór gorącego KMnO4 jest jak torba pełna wściekłych piranii, które wyrwą całe ciało z twojej cząsteczki i zostawią za sobą tylko kości. (Pomyśl o tym, to trochę jak twoja wątroba! )
Gorący KMnO4 rozerwie każde benzylowe wiązanie C-H i przekształci je w wiązanie C-O. Z toluenu, na przykład, produktem jest kwas benzoesowy (kwas karboksylowy).
Ale nie tylko rozbija wiązania benzylowe C-H. O nie. Rozrywa również wiązania C-C; przynajmniej te, które nie są bezpośrednio połączone z pierścieniem fenylowym. Na przykład, para-dietylobenzen jest przekształcany w kwas para-benzenodikarboksylowy.
Zauważ, że alkilowe wiązanie C-C musi zostać rozszczepione, aby to utlenianie mogło nastąpić! (to jest prawdopodobnie utlenione aż do gazu CO2).
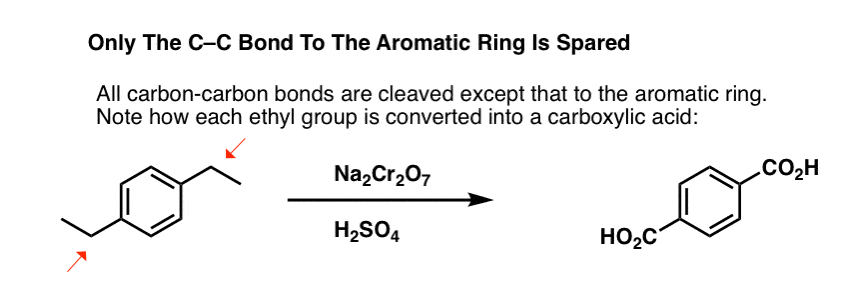
Ciekawa odmiana zachodzi na cząsteczce cyklicznej, takiej jak tetralina; wynikiem jest kwas dikarboksylowy.
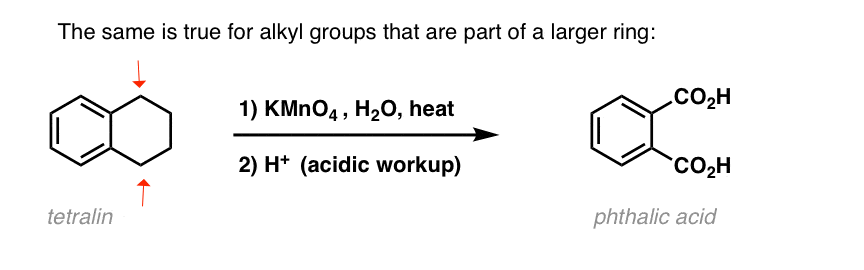
ten kwas dikarboksylowy jest nazywany kwasem ftalowym.
10. Utlenianie benzylowe wymaga wiązania C-H
Tak jak w przypadku bromowania benzylowego, reakcja nie zachodzi, jeśli na pozycji benzylowej nie ma wiązania C-H. Na przykład, reakcja nie zachodzi całkowicie z t-butylobenzenem:
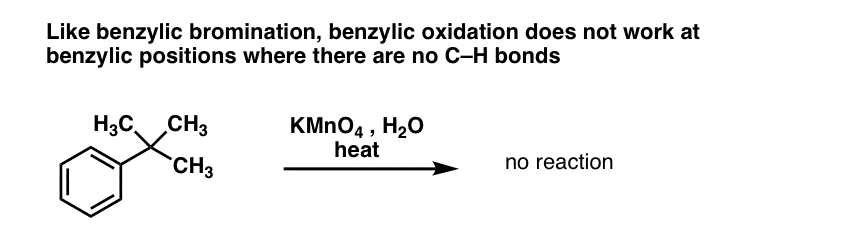
Pełny mechanizm utleniania benzylu jest zbyt złożony, długi i niepewny, aby go tu przedstawić, ale pierwszym krokiem jest prawie na pewno homolityczne rozszczepienie wiązania C-H przez Mn=O w celu utworzenia rodnika benzylowego.
Dlaczego to jest ważne?
Oksydacja benzylowa za pomocą KMnO4 jest trudną reakcją, ale może mieć swoje zastosowania. Działa najlepiej z prostymi cząsteczkami, które nie mają delikatnych grup funkcyjnych i mogą wytrzymać bardzo szorstkie traktowanie.
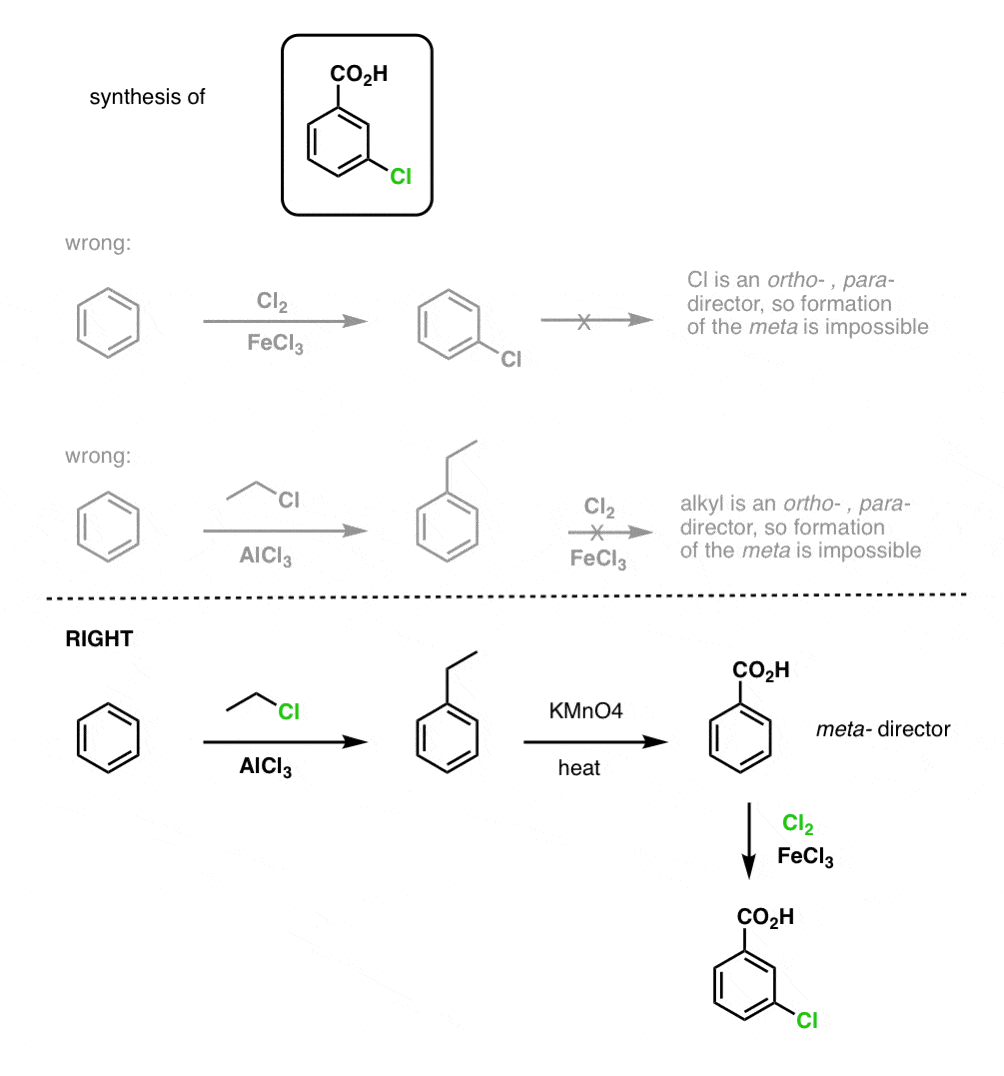
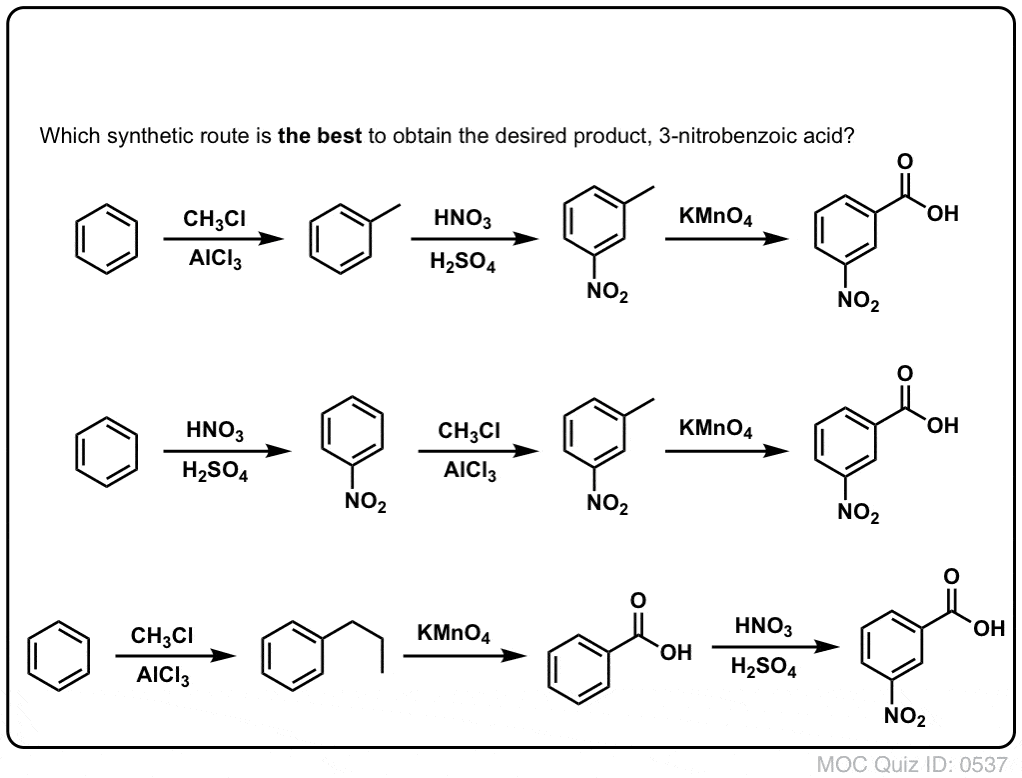
Pierwszą rzeczą, na którą należy zwrócić uwagę jest to, że kwasy karboksylowe nie mogą być umieszczone bezpośrednio na pierścieniu benzenowym poprzez acylowanie Friedela-Craftsa, więc alkilacja, a następnie utlenianie jest użytecznym obejściem.
Drugą użyteczną funkcją w syntezie jest fakt, że utlenianie benzylowe przekształca direktor o- p- (grupa alkilowa) w meta-dyrektor.
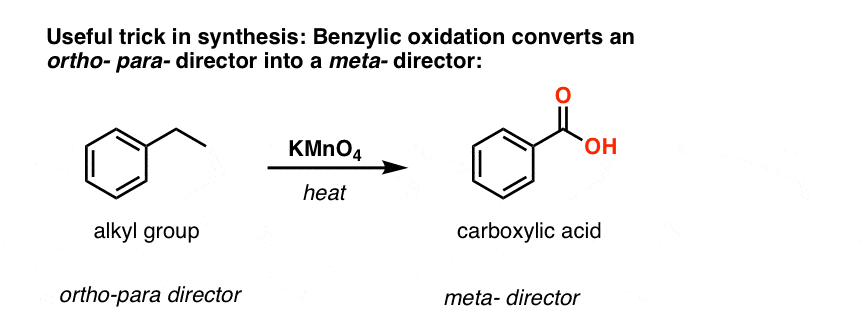
Na przykład, stojąc przed syntezą następującej cząsteczki, jak postępować? (podpowiedź: w pewnym momencie dochodzi do utlenienia benzylu).
Na temat syntezy związków aromatycznych będziemy mieli jeszcze wiele do powiedzenia w kilku kolejnych postach.
Następny: Redukcja karbonyli benzylowych – redukcje Clemmensena i Wolffa-Kishnera
Notatki
„Kapusta” może być również używana jako termin slangowy w chemii dla „wszystkich tych rzeczy na cząsteczce, które można bezpiecznie zignorować” z jakiegokolwiek powodu. Na przykład, bryostatyna jest bestią cząsteczki, która jest obiecująca jako środek przeciwnowotworowy. Problem w tym, że aby uzyskać przyzwoitą ilość bryostatyny potrzeba tony rzadkiego mszywioła, a to nie wystarczy do badań klinicznych na ludziach. Tak więc kilka grup pracowało nad stworzeniem prostszych, łatwiejszych do zsyntetyzowania „bryologów”, w których pozbywają się „kapusty”, która nie jest niezbędna do aktywności przeciwnowotworowej.
Br2 generalnie nie będzie reagować z pierścieniami aromatycznymi bez katalizatora w postaci kwasu Lewisa. Jeśli jednak obecna jest silna grupa aktywująca (taka jak OH, NR2, itp.), może dojść do bromowania pierścienia, zwłaszcza w podwyższonej temperaturze.
Zabawny fakt: „Benzylowe utlenianie” jest odpowiedzią na zagadkę, dlaczego metylobenzen (toluen) nie jest prawie tak silnym czynnikiem rakotwórczym jak benzen. To dlatego, że twoja wątroba ma enzymy cytochromu p450 (zawierające wysokie utlenianie-stanowe gatunki żelaza), które mogą utleniać benzylową grupę CH3 do bardziej rozpuszczalnego w wodzie kwasu karboksylowego, pozwalając mu być oczyszczone przez nerki.
Wymaga to dwóch utlenień i dwóch eliminacji. Ostrożny sposób, aby to zrobić jest utlenianie (tj. bromowanie) raz, a następnie wyeliminować, aby dać alkenu. Alken może być następnie poddany ponownemu bromowaniu (przy użyciu NBS, tak aby uniknąć bromowania wiązania podwójnego), aby uzyskać kolejny bromowanie (produkt bromowania benzylowego pokazany tutaj, ale allilowy również wykonalny), który może być traktowany zasadą, aby dać aromatyczny naftalen.
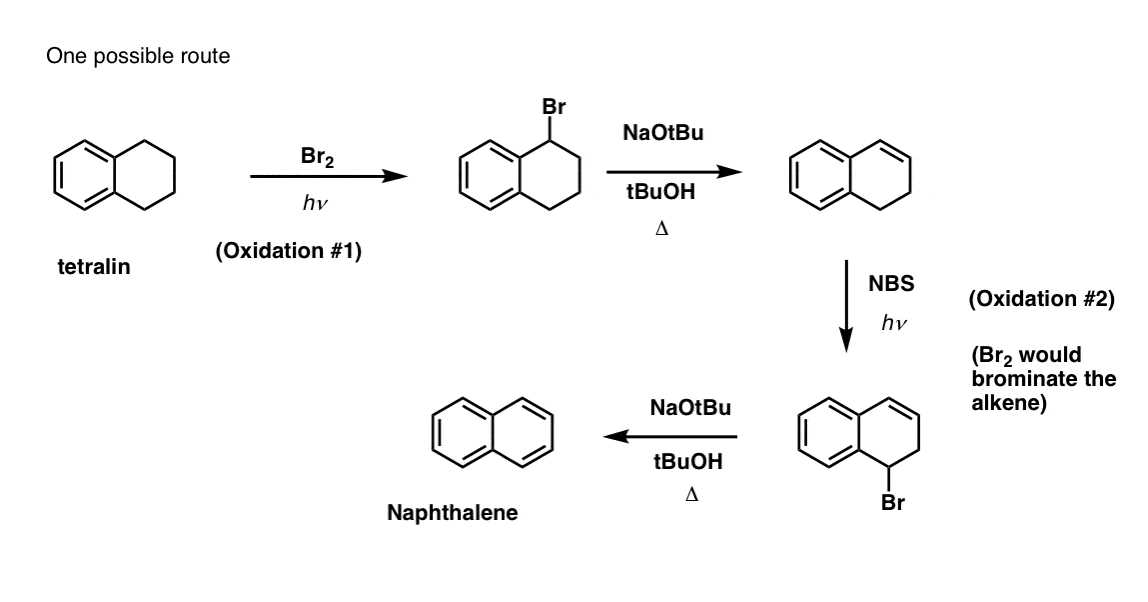
(w praktyce okazuje się, że oba bromowania mogą być wykonane w tym samym czasie przy użyciu Br2 w wysokiej temperaturze. W wyniku obróbki zasadą można wtedy otrzymać naftalen).
Odpowiedź na pytanie quizowe nr 2.
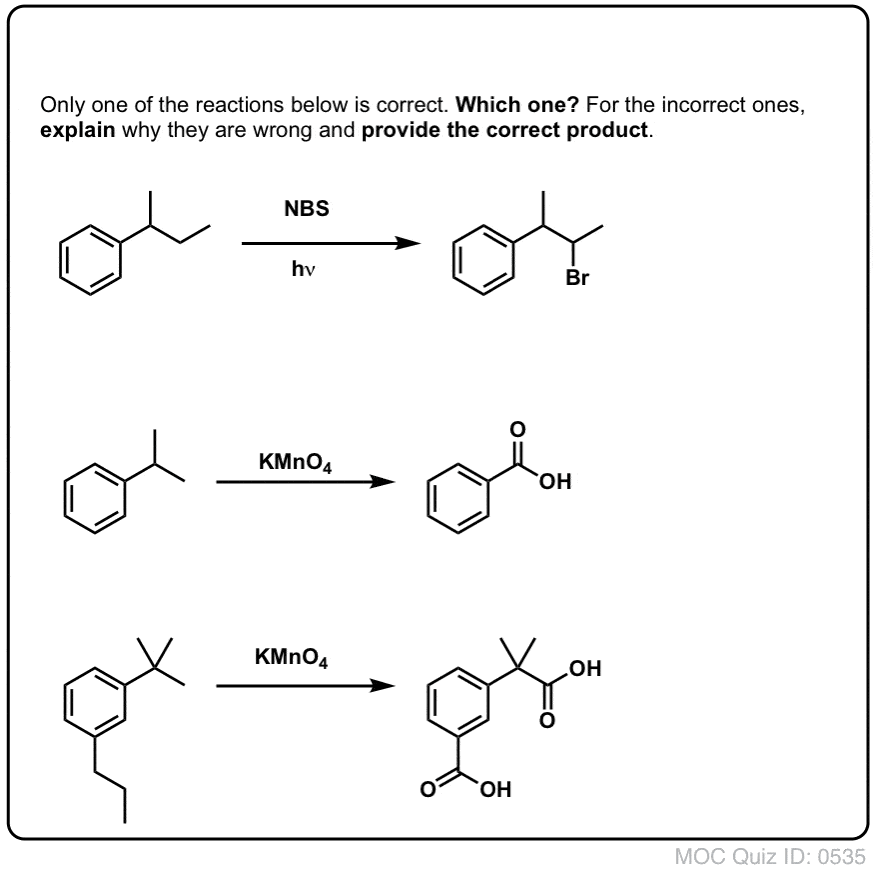
Zadaj sobie pytanie!
 Click to Flip
Click to Flip
 Click to Flip
Click to Flip 
 Click to Flip
Click to Flip 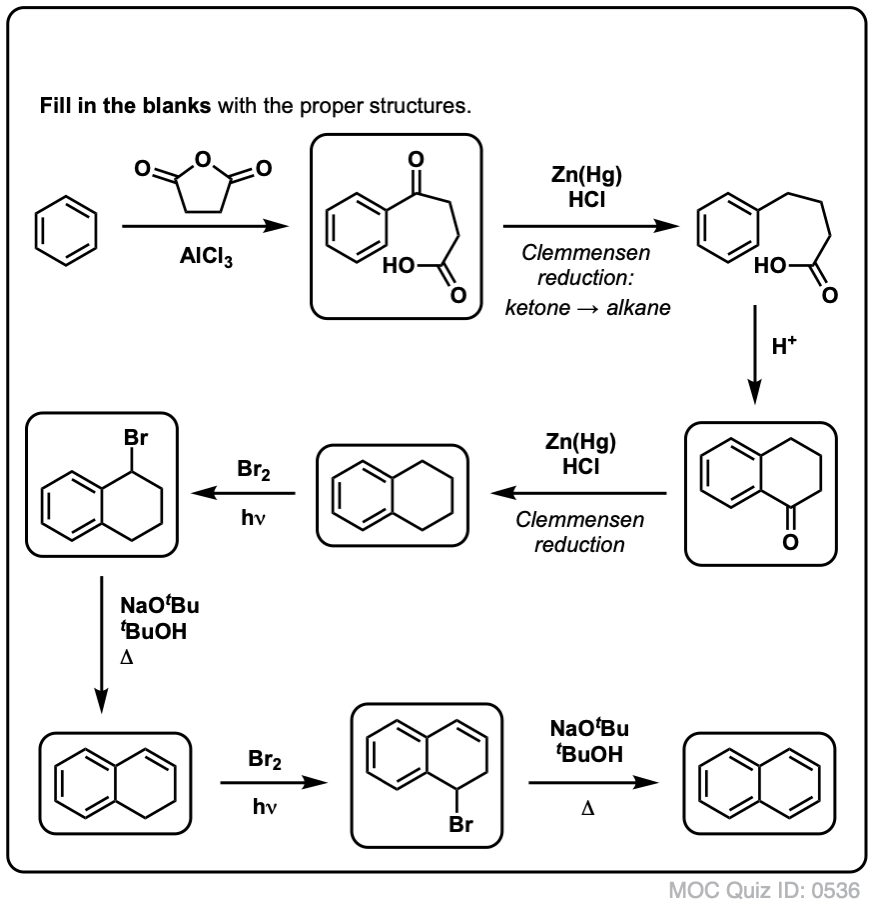
.
 Click to Flip
Click to Flip 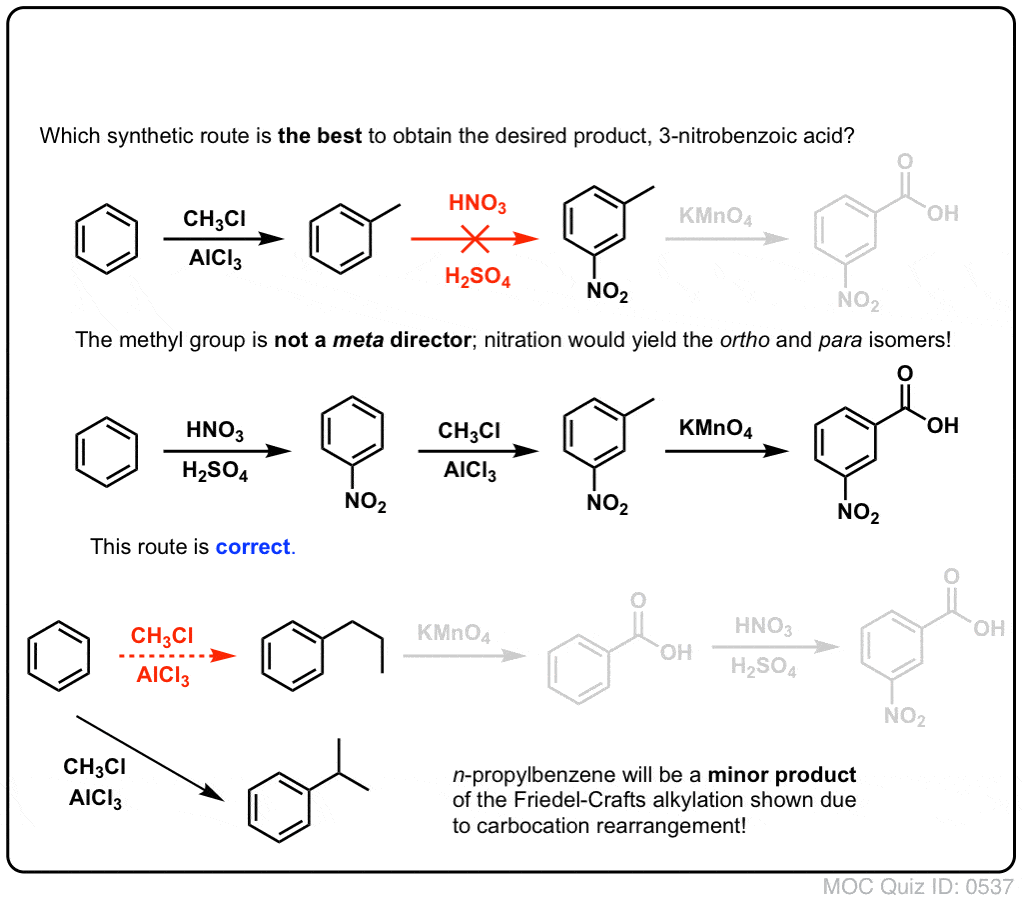
(Advanced) References and Further Reading
Benzylic Bromination:
Reakcja ta jest również znana jako reakcja Wohla-Zieglera.
- Bromierung ungesättigter Verbindungen mit N-Brom-acetamid, ein Beitrag zur Lehre vom Verlauf chemischer Vorgänge
Wohl
Chem. Ber. 1919, 52 (1), 51-63
DOI: 10.1002/cber.19190520109 - Die Halogenierung ungesättigter Substanzen in der Allylstellung
Ziegler, A. Späth, E. Schaaf, W. Schumann, E. Winkelmann
Just. Lieb. Ann. Chem. 1942, 551 (1), 80-119
DOI: 10.1002/jlac.19425510103
Dwie pierwsze publikacje dotyczące tej reakcji. Wohl jako czynnika bromotwórczego użył N-bromoacetamidu, a nie NBS. Następnie Ziegler przeprowadził szczegółowe badania i poinformował, że NBS może być stosowany jako wygodny czynnik bromujący do bromowania allilowego. - Dibenzocyklookten: Multi-gram Synthesis of a Bidentate Ligand
Géraldine Franck, Marcel Brill, and Günter Helmchen
Org. Synth. 2012, 89, 55-65
DOI: 10.15227/orgsyn.089.0055 - Bromowania benzylowe z N-bromobursztynoimidem w (trifluorometylo)benzenie
Diana Suarez, Gilles Laval, Shang-Min Tu, Dong Jiang, Claire L. Robinson, Richard Scott, Bernard T. Golding
Synthesis 2009 (11): 1807-1810
DOI: 1055/s-0029-1216793
Referencja #3 przedstawia typowe bromowanie benzylowe z użyciem NBS w CCl4, które zostało w dużej mierze wycofane z powodu obaw o toksyczność. Odnośnik #4 pokazuje, że PhCF3 może być używany jako rozpuszczalnik zamiast CCl4 do bromowania benzylowego. - Bromowanie z N-Bromobursztynoimidem i związkami pokrewnymi. The Wohl-Ziegler Reaction.
Carl Djerassi
Chemical Reviews 1948, 43 (2), 271-317
DOI: 10.1021/cr60135a004
Stary przegląd na temat tej reakcji autorstwa znanego chemika Carla Djerassi, którego głównym wkładem w światowe zdrowie było opracowanie noretindronu – pierwszego środka antykoncepcyjnego dla kobiet. - N-Bromobursztynoimid. III. Stereochemical Course of Benzylic Bromination
H. J. Dauben Jr. i Layton L. McCoy
Journal of the American Chemical Society 1959, 81 (20), 5404-5409
DOI: 10.1021/ja01529a038
Mechanistyczne badanie stereochemii bromowania benzylowego. Poprzez obserwację powstawania racemicznych bromków benzylowych z prochiralnych substratów, pośrednictwo rodników w tej reakcji jest dodatkowo wzmocnione.Te same referencje z bromowania allilowego mogą być ponownie wykorzystane tutaj: - Mechanisms of Benzylic Bromination
Glen A. Russell, Charles. DeBoer, and Kathleen M. Desmond
Journal of the American Chemical Society 1963 85 (3), 365-366
DOI: 1021/ja00886a040
Bromowanie benzylowe przebiega według tego samego mechanizmu co bromowanie allilowe, co wyjaśniono w tym artykule.NBS (N-Bromobursztynoimid) jest wygodnym odczynnikiem do bromowania wolnorodnikowego, a poniższe prace są badaniami mechanistycznymi z udziałem NBS: - The Mechanism of Benzylic Bromination with N-Bromosuccinimide
R. E. Pearson and J. C. Martin
Journal of the American Chemical Society 1963 85 (3), 354-355
DOI: 10.1021/ja00886a029
Te prace prof. J. C. Martina (UIUC) powstały we wczesnym okresie jego kariery, zanim wykonał prace, z których jest najbardziej znany (badania nad cząsteczkami „hiperwagentowymi”, w tym opracowanie „Periodynanu Dess-Martina”). - The Identity of the Chain-Carrying Species in Brominations with N-Bromosuccinimide: Selectivity of Substituted N-Bromosuccinimides toward Substituted Toluenes
R. E. Pearson and J. C. Martin
Journal of the American Chemical Society 1963, 85 (20), 3142-3146
DOI: 10.1021/ja00903a021 - N-bromobursztynoimid. Mechanisms of allylic bromination and related reactions
J. H. Incremona and James Cullen Martin
Journal of the American Chemical Society 1970, 92 (3), 627-634
DOI: 10.1021/ja00706a034 - Rodnik sukcynimidylowy jako nośnik łańcucha. Mechanizm bromowania allilowego
J. C. Day, M. J. Lindstrom, and P. S. Skell
Journal of the American Chemical Society 1974, 96 (17), 5616-5617
DOI: 10.1021/ja00824a074 - Radical Bromination of Cyclohexene in CCl4 by Bromine: Addition versus Substitution
D. W. McMillen and John B. Grutzner
The Journal of Organic Chemistry 1994, 59 (16), 4516-4528
DOI: 10.1021/jo00095a029
This paper describes careful kinetic studies that demonstrate that a low concentration of Br2 (such as that provided by impure NBS) will favour radical substitution over a polar addition reaction. - o-XYLYLENE DIBROMIDE
Emily F. M. Stephenson
Org. Synth. Vol. 34, p.100 (1954)
DOI: 10.15227/orgsyn.034.0100
A reliable procedure for benzylic bromination with Br2 in Organic Syntheses. - Bromowanie tetraliny. Short and Efficient Synthesis of 1,4-Dibromonaphthalene
Osman Çakmak, Ismail Kahveci, Íbrahim Demirtaş, Tuncer Hökelek and Keith Smith
Czech. Chem. Commun. 2000, 65, 1791-1804
DOI: 10.1135/cccc20001791
Wygodna synteza 1,4-dibromonaftalenu z tetraliny, poprzez bromowanie benzylowe.Benzylowe utlenianie:
Do utleniania benzylowego istnieje wiele strategii, w tym stosowanie stężonych roztworów KMnO4 lub kwasu chromowego. - Kinetic studies of the oxidation of aromatic compounds by potassium permanganate. Część IV. n- i izopropylobenzen
C. F. Cullis and J. W. Ladbury
J. Chem. Soc. 1955, 4186-4190
DOI: 10.1039/JR9550004186 - DERYWATYWY PIPERYDYNOWE X. THE PHENYLPIPERIDYLCARBINOLS
Kenneth E. Crook and S. M. McElvain
Journal of the American Chemical Society 1930, 52 (10), 4006-4011
DOI: 1021/ja01373a035
Jeśli na pozycji benzylowej jest inny podstawnik, to utlenianie z daje keton zamiast kwasu karboksylowego. - Heterogeniczne utlenianie nadmanganianem. 7. The Oxidation of Aliphatic Side Chains
Nazih A. Noureldin, Dongyuan Zhao, and Donald G. Lee
The Journal of Organic Chemistry 1997, 62 (25), 8767-8772
DOI: 1021/jo971168e
Reagenty mogą być adsorbowane na stałych nośnikach, aby ułatwić prowadzenie reakcji i zmniejszyć ilość odpadów. W tym przypadku, poprzez uczynienie odczynnika KMnO4 heterogenicznym, reaktywność zmienia się nieznacznie, co może być wykorzystane do niektórych chemoselektywnych utleniania.Wiele innych odczynników może być wykorzystanych do utleniania benzylu, oto wybór: - Selektywne utlenianie przy węglu przylegającym do układów aromatycznych z IBX
K. C. Nicolaou, Phil S. Baran, and Yong-Li Zhong
Journal of the American Chemical Society 2001, 123 (13), 3183-3185
DOI: 10.1021/ja004218x
Wczesna praca od (obecnie gwiazdy totalnej syntezy) Prof. Phila Barana (The Scripps Research Institute, La Jolla, CA), gdy był jeszcze doktorantem w grupie Prof. Nicolaou. Wykorzystuje on IBX (hiperwagentny odczynnik I(V)) do przeprowadzania utleniania benzylu, które zachodzi poprzez mechanizm rodnikowy. Jest to użyteczna reakcja o szerokim zakresie substratowym, czego przykładem jest 25 przykładów w pracy. - Direct and Selective Benzylic Oxidation of Alkylarenes via C-H Abstraction Using Alkali Metal Bromides
Katsuhiko Moriyama, Misato Takemura, and Hideo Togo
Organic Letters 2012, 14 (9), 2414-2417
DOI: 10.1021/ol300853z
This uses Oxone as the terminal oxidant for benzylic oxidation. - Synthesis of Benzylic Alcohols by C-H Oxidation
Lalita Tanwar, Jonas Börgel, and Tobias Ritter
J. Am. Chem. Soc. 2019, 141, 17983-17988
DOI: 10.1021/jacs.9b09496
W tym artykule wykorzystano nadtlenek mesylu jako utleniacz do selektywnego utleniania pozycji benzylowych do alkoholi. Powstaje mezylan benzylu, który może być hydrolizowany do alkoholu. - Elektrochemiczne benzylowe utlenianie wiązań C-H
Jason A. Marko, Anthony Durgham, Stacey Lowery Bretz, and Wei Liu
Chem. Commun., 2019, 55, 937-940
DOI: 10.1039/C8CC08768G
Oksydację benzylową można również przeprowadzić na drodze elektrochemii. - Reakcje utleniania allilowego i benzylowego za pomocą chloranu sodu
Samuel M. Silvestre, Jorge A. R. Salvador
Tetrahedron 2007, 63 (11), 2439-2445
DOI: 10.1016/j.tet.2007.01.012
NaClO2 jest niedrogi i może być również stosowany jako utleniacz.
.
Dodaj komentarz