Jakie są dwa rodzaje jonów i czym się różnią
On 28 grudnia, 2021 by adminJakie są dwa rodzaje jonów i czym się różnią

Jon:
Jon jest dodatnio lub ujemnie naładowanym atomem (lub grupą atomów). Jon powstaje w wyniku utraty lub zyskania elektronów przez atom, dlatego zawiera nierówną liczbę elektronów i protonów.
Przykład: Jon sodowy Na+, jon magnezowy Mg2+, jon chlorkowy Cl-, oraz jon tlenkowy O2-.
Istnieją dwa rodzaje jonów :
- kationy
- aniony.

1. Kation
Jon naładowany dodatnio nazywany jest kationem. Kation powstaje w wyniku utraty jednego lub więcej elektronów przez atom.
Przykład: Atom sodu traci 1 elektron, tworząc jon sodowy, Na+, który jest kationem :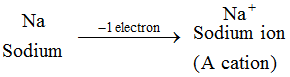 Jony wszystkich pierwiastków metalicznych są kationami.
Jony wszystkich pierwiastków metalicznych są kationami. 2. Anion
2. Anion
Ujemnie naładowany jon znany jest jako anion. Anion powstaje w wyniku zyskania jednego lub więcej elektronów przez atom.
Przykład: Atom chloru zyskuje 1 elektron, aby utworzyć jon chlorkowy, Cl-, który jest anionem.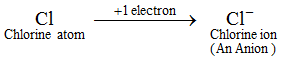 Anion zawiera więcej elektronów niż normalny atom. Normalny atom (lub atom obojętny) zawiera równą liczbę protonów i elektronów. Teraz, ponieważ anion powstaje przez dodanie jednego lub więcej elektronów do atomu, dlatego też anion zawiera więcej elektronów niż protonów. Jony wszystkich pierwiastków niemetalicznych są anionami.
Anion zawiera więcej elektronów niż normalny atom. Normalny atom (lub atom obojętny) zawiera równą liczbę protonów i elektronów. Teraz, ponieważ anion powstaje przez dodanie jednego lub więcej elektronów do atomu, dlatego też anion zawiera więcej elektronów niż protonów. Jony wszystkich pierwiastków niemetalicznych są anionami. Jony proste
Jony proste
Jony, które są utworzone z pojedynczych atomów nazywamy jonami prostymi.
Przykład: Jon sodowy, Na+, jest jonem prostym, ponieważ jest utworzony z pojedynczego atomu sodu, Na.
Jony złożone
Te jony, które są utworzone z grup połączonych atomów nazywamy jonami złożonymi
Przykład: Jon amonowy NH4+, jest jonem złożonym, który zbudowany jest z dwóch rodzajów połączonych ze sobą atomów, azotu i wodoru.
Związki jonowe
Związki, które zbudowane są z jonów nazywamy związkami jonowymi. W związku jonowym, dodatnio naładowane jony (kationy) i ujemnie naładowane jony (aniony) są utrzymywane razem przez silne siły elektrostatyczne przyciągania. Siły, które utrzymują jony razem w związku jonowym są znane jako wiązania jonowe lub wiązania elektrowalencyjne. Ponieważ związek jonowy składa się z równej liczby jonów dodatnich i jonów ujemnych, więc całkowity ładunek związku jonowego wynosi zero.
Przykład: Chlorek sodu (NaCl) jest związkiem jonowym, który składa się z równej liczby dodatnio naładowanych jonów sodu (Na+) i ujemnie naładowanych jonów chlorkowych (Cl-).
Niektóre związki jonowe
|
S.No. |
Nazwa | Formuła |
Iony obecne |
|
1 |
Chlorek sodu | NaCl | Na+ i Cl- |
| 2 | Chlorek potasu | KCl |
K+ i Cl- |
|
3 |
chlorek amonu | NH4Cl | NH4+ i Cl- |
|
4 |
chlorek magnezu chlorek | MgCl2 | Mg2+ i Cl- |
| 5 | chlorek wapnia | CaCl2 | Ca2+ i Cl- |
| 6 | Tlenek magnezu | MgO | Mg2+ i O2- |
| 7 | Tlenek wapnia | CaO | Ca2+ i O2- |
| 8 | Tlenek glinu | Al2O3 | Al3+ i O2- |
| 9 | Wodorotlenek sodu | NaOH | Na+ i OH- |
| 10 | Siarczan miedzi | CuSO4 | Cu2+ i SO42- |
| 11 | Bazotan wapnia | Ca(NO3)2 |
Ca2+ i NO3- |
.
Dodaj komentarz