Jądro nadobojczykowe
On 12 listopada, 2021 by admin| Mózg: Kompleks oliwkowy górny | ||
|---|---|---|
 |
||
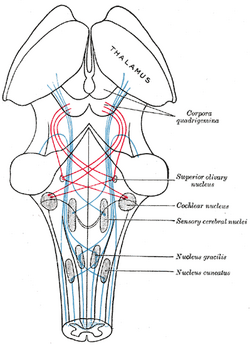
| Schemat przedstawiający przebieg włókien lemniskusa; lemniskus przyśrodkowy na niebiesko, boczny na czerwono. (Jądro oliwkowe górne jest zaznaczone w centrum po prawej stronie.) | ||
| ] | ||
| Łacina | nucleus olivaris superior | |
| Jądro Graya | przedmiot #187 787 | |
| Część | ||
| Komponenty | ||
| Tętnica | ||
| Wein | ||
| BrainInfo/UW | {{BrainInfoType}}-.565 | |
| MeSH | ||
Zespół oliwkowy górny (lub SOC lub oliwka górna) jest małą masą szarej substancji położonej na grzbietowej powierzchni bocznej części ciała trapezowatego. Mały u ludzi, ale dobrze rozwinięty u niektórych zwierząt, wykazuje podobną strukturę jak jądro oliwkowe dolne i znajduje się bezpośrednio nad nim. Niektóre z włókien ciała trapezowatego kończą się przez arborizing wokół komórek tego jądra, podczas gdy inne powstają z tych komórek.
Fizjologia
Jądro oliwkowe górne odgrywa szereg ról w słuchu. Jądro oliwkowe górne przyśrodkowe (MSO) jest wyspecjalizowanym jądrem, które, jak się uważa, mierzy różnicę czasu docierania dźwięków między uszami (międzyuszna różnica czasu lub ITD). ITD jest główną wskazówką dla określenia azymutu dźwięków o niskiej częstotliwości, tj. zlokalizowania ich na płaszczyźnie azymutalnej – ich stopnia w lewo lub w prawo.
Uważa się, że boczna oliwka górna (LSO) jest zaangażowana w pomiar różnicy poziomów dźwięków pomiędzy uszami (międzyuszna różnica poziomów lub ILD). ILD jest drugą ważną wskazówką w określaniu azymutu dźwięków o wysokiej częstotliwości.
Związek z układem słuchowym
Kompleks oliwki górnej jest ogólnie zlokalizowany w pons, ale u człowieka rozciąga się od rdzeniastego rdzenia do śródmózgowia i otrzymuje projekcje głównie z jądra przednio-przyśrodkowego ślimaka przez brzuszną strunę akustyczną, chociaż jądro tylno-przyśrodkowe również projektuje tam przez pośrednią strunę akustyczną. To właśnie w tym miejscu dochodzi do pierwszych ważnych interakcji obuusznych.
Jądra pierwotne
Kompleks oliwkowy górny dzieli się na trzy jądra pierwotne, MSO, LSO i jądro przyśrodkowe ciała trapezowatego, oraz kilka mniejszych jąder okołowodociągowych. Te trzy jądra są najczęściej badane, a przez to najlepiej poznane. Zazwyczaj uważa się, że tworzą one wstępującą azymutalną ścieżkę lokalizacyjną.
Oliwka przyśrodkowa górna (MSO)
Uważa się, że oliwka przyśrodkowa górna pomaga zlokalizować azymut dźwięku, czyli kąt w lewo lub w prawo, gdzie znajduje się źródło dźwięku. Pierwszym odruchem może być myślenie, że to jądro zawiera informacje pionowe, ale tak nie jest; informacje przetwarzane w MSO są ograniczone do płaszczyzny poziomej. Komórki bruzdkowate nie rzutują do niczego na poziomie ponsa i wchodzą do gry dopiero w kolliculi dolnej. Obecne są tylko dane poziome, ale pochodzą one z dwóch różnych źródeł słuchowych, co pomaga w lokalizacji dźwięku na osi azymutalnej. Oliwka górna dokonuje tego poprzez pomiar różnic w czasie pomiędzy sygnałami z dwóch uszu rejestrującymi ten sam bodziec. Podróż dookoła głowy trwa około 700 μs i zakłada się, że przyśrodkowa oliwka górna jest w stanie to wykryć. W rzeczywistości obserwuje się, że ludzie są w stanie wykryć różnice międzyuszne do 10 mikrosekund. Jądro jest zorganizowane tonotopicznie, ale azymutalna projekcja pola recepcyjnego jest „najprawdopodobniej złożoną, nieliniową mapą.”
Projekcje przyśrodkowej oliwki górnej kończą się gęsto w ipsilateralnym jądrze środkowym kolliculi dolnej. Większość z tych aksonów jest uważana za „okrągłe” lub typu R. Te aksony R są głównie glutamatergiczne i zawierają okrągłe pęcherzyki synaptyczne i tworzą asymetryczne połączenia synaptyczne.
- Jest to największe z jąder i u człowieka zawiera około 15 500 neuronów .
- Każde MSO otrzymuje dwustronne wejścia o niskiej częstotliwości z prawego i lewego AVCNs.
- Wyjście jest do ipsilateralnego lemniscusa bocznego i ostatecznie do kollicusa dolnego.
- MSO lepiej reaguje na bodźce obuuszne.
- Jej główna funkcja polega na wykrywaniu różnic w czasie dotarcia dźwięków do obu uszu, co jest częścią procesu lokalizacji (ITD).
Oliwka boczna górna (LSO)
Oliwka ta ma podobne funkcje jak oliwka przyśrodkowa górna, ale wykorzystuje intensywność do lokalizacji źródła dźwięku. Jest to część pnia mózgu, która etykietuje głośniejszy dźwięk z lewego ucha jako znajdujący się po lewej stronie. Oliwka boczna otrzymuje sygnały z obu jąder ślimaka, z ipsilateralnych komórek kulistych krzaczastych AVCN i kontralateralnych komórek kulistych krzaczastych AVCN poprzez ipsilateralną MNTB. Komórki główne MNTB są glicynergiczne, stanowią źródło hamowania dla LSO i są podstawą wrażliwości na ILD. Projekcje z obu jąder ślimaka są głównie wysokoczęstotliwościowe i te częstotliwości są następnie reprezentowane przez większość neuronów LSO (>2/3 ponad 2-3kHz u kota). Dodatkowe wejścia pochodzą z ipsilateralnego LNTB (glicynergiczne, patrz niżej), które dostarczają informacji hamujących z ipsilateralnego jądra ślimaka. Inne wejście, prawdopodobnie hamujące, pochodzi z ipsilateralnych komórek niesferycznych AVCN. Komórki te są albo kuliste krzaczaste, albo wielobiegunowe (gwiaździste). Każde z tych dwóch wejść może stanowić podstawę dla ipsilateralnego hamowania widocznego na mapach odpowiedzi flankujących pierwotne pobudzenie, wyostrzając strojenie częstotliwościowe jednostki.
LSO rzutuje obustronnie do centralnego jądra podkolanowego dolnego (ICC). Projekcje jednostronne są głównie hamujące (glicynergiczne), a kontralateralne pobudzające. Dodatkowymi celami projekcji są grzbietowe i brzuszne jądra półksiężyca bocznego (DNLL & VNLL). Projekcje GABAergiczne z DNLL tworzą podstawowe źródło GABA w słuchowym pniu mózgu i rzutują obustronnie do ICC i do kontralateralnego DNLL. Te zbieżne połączenia pobudzające i hamujące mogą działać w celu zmniejszenia zależności wrażliwości ILD od poziomu w ICC w porównaniu z LSO.
Dodatkowe projekcje tworzą boczną wiązkę olivocochlearną (LOC), która unerwia wewnętrzne komórki włoskowate ślimaka. Uważa się, że projekcje te mają długą stałą czasową i działają w celu normalizacji poziomu dźwięku wykrywanego przez każde ucho, aby pomóc w lokalizacji dźwięku. Istnieją znaczne różnice między gatunkami: Neurony projekcyjne LOC są rozmieszczone w obrębie LSO u gryzoni, a otaczają LSO u drapieżników (tj. kota).
Jądro przyśrodkowe ciała trapezowatego (MNTB)
- Jądro MNTB jest najmniejszą częścią SOC; obecność MNTB w ludzkim pniu mózgu jest wątpliwa.
- Każdy neuron otrzymuje tylko wejście o wysokiej częstotliwości przez kielich trzymany z kontralateralnej AVCN, a jego wyjście rzutuje się na ipsilateralną LSO.
- Znaleziono dwa typy odpowiedzi: „typ siekacza” podobny do komórek wrzecionowatych w AVCN i typ pierwotny, który jest podobny do komórek krzaczastych w AVCN.
Jądra okołokomorowe
SOC składa się z sześciu do dziewięciu jąder okołokomorowych, w zależności od cytowanego badacza, zwykle nazwanych na podstawie ich lokalizacji w odniesieniu do jąder pierwotnych. Jądra te otaczają każde z jąder pierwotnych i przyczyniają się do powstania zarówno wstępującego, jak i zstępującego systemu słuchowego. Jądra te tworzą również źródło pęczka olivocochlearnego, który unerwia ślimak. U świnki morskiej projekcje wstępujące do okrężnicy dolnej są głównie ipsilateralne (>80%), z największym pojedynczym źródłem pochodzącym z SPON. Również jądra brzuszne (RPO, VMPO, AVPO, & VNTB) są prawie całkowicie ipsilateralne, podczas gdy pozostałe jądra rzutują obustronnie.
.
.
Ventral Nucleus of Trapezoid Body (VNTB)
- VNTB to małe jądro położone bocznie do MNTB, i brzusznie do MSO.
- Złożone z heterogennej populacji komórek, jądro to rzutuje do wielu jąder słuchowych i tworzy przyśrodkowy pęczek olivocochlearny (MOC), który unerwia komórki włoskowate zewnętrzne ślimaka. Komórki te zawierają włókna elektromotoryczne i działają jako mechaniczne wzmacniacze/tłumiki w ślimaku.
- Jądro rzutuje do obu IC, bez komórek rzutujących obustronnie.
Jądro boczne ciała trapezowatego (LNTB)
- Położone brzusznie do LSO
- Kuliste komórki krzaczaste AVCN rzutują kolaterale dwustronnie, a kuliste komórki krzaczaste rzutują kolaterale ipsilateralnie do neuronów LNTB.
- Komórki są immunoreaktywne dla glicyny i są znakowane wstecznie po wstrzyknięciu tritiowanej glicyny do LSO
- Jądro ślimaka rzutuje do obu IC, z nielicznymi komórkami rzutującymi dwustronnie, jak również do ipsilateralnego LSO.
- Duże komórki wielobiegunowe rzutują do jądra ślimaka, ale nie do IC, zarówno u kota, jak i świnki morskiej.
- Wejścia są często przez końcowe pęcherzyki utrzymywane, wytwarzając bardzo szybką transdukcję sygnału.
Jądro nadskrzyżowaniowe (SPON) (Dorsomedial Periolivary Nucleus (DMPO))
- Położone bezpośrednio grzbietowo w stosunku do MNTB
- U szczurów SPON jest jednorodnym jądrem GABAergicznym. Te tonotopowo zorganizowane neurony otrzymują pobudzające wejścia z ośmiornic i komórek wielobiegunowych w kontralateralnym brzusznym jądrze ślimaka, wejście glicynergiczne (hamujące) z ipsilateralnego MNTB, nieznane wejście GABAergiczne (hamujące) i rzutują do ipsilateralnego ICC. Większość neuronów reaguje tylko na offset bodźca, może blokować fazowo bodźce AM do 200 Hz i może stanowić podstawę selektywności czasu trwania ICC. Warto zauważyć, że neurony SPON nie otrzymują zstępujących wejść z IC i nie rzutują do ślimaka lub jądra ślimakowego, jak to ma miejsce w przypadku wielu jąder perioliwialnych.
- W śwince morskiej, okrągłe do owalnych komórki wielobiegunowe rzutują do obu IC, z wieloma komórkami rzutującymi obustronnie. Bardziej wydłużone komórki, które rzutują do jądra ślimaka, nie rzutują do ICC. Wydaje się, że istnieją dwie populacje komórek, jedna, która rzutuje ipsilateralnie i jedna, która rzutuje dwustronnie.
- Większość informacji pochodzi z SPON gryzoni, ze względu na wybitny rozmiar jądra u tych gatunków, bardzo niewiele badań zostało wykonanych w DMPO kota, żadne z nich nie było obszerne.
Grzbietowe jądro okołokomorowe (DPO)
- Położone grzbietowo i przyśrodkowo w stosunku do LSO
- Zawiera zarówno jednostki EE (pobudzane przez oboje uszu), jak i E0 (pobudzane tylko przez ucho kontralateralne).
- Neurony są zorganizowane tonotopowo i mają wysoką częstotliwość.
- Może należeć do jednego jądra razem z DLPO
- Jądro rzutuje do obu IC, bez komórek rzutujących dwustronnie.
Jądro grzbietowo-boczne okołoruchowe (DLPO)
- Położone grzbietowo i bocznie od LSO
- Zawiera zarówno jednostki EE (pobudzane przez oboje uszu), jak i E0 (pobudzane tylko przez ucho kontralateralne).
- Neurony są zorganizowane tonotopowo i mają niską częstotliwość.
- Mogą należeć do jednego jądra razem z DPO
- Jądro rzutuje do obu IC, z nielicznymi komórkami rzutującymi dwustronnie.
Jądro brzuszno-boczne (VLPO)
- Położone brzusznie i w obrębie wzgórka brzusznego LSO
- Zawiera zarówno jednostki EI (pobudzane przez ucho kontralateralne i hamowane przez ucho ipsilateralne), jak i E0 (pobudzane tylko przez ucho kontralateralne).
- Neurony są zorganizowane tonotopicznie i mają wysoką częstotliwość.
Jądro przednio-boczne okołoruchowe (ALPO)
- Jądro rzutuje do obu IC, bez komórek rzutujących dwustronnie.
- Duże komórki wielobiegunowe rzutują do jądra ślimakowego, ale nie do IC, zarówno u kota, jak i świnki morskiej.
Jądro przednio-przyśrodkowe okołoślimakowe (VMPO)
- Zlokalizowane między MSO i MNTB.
- Syła projekcje do ICC dwustronnie.
- Jądro rzutuje do obu IC, bez komórek rzutujących dwustronnie.
Rostralne jądro okołokomorowe (RPO) (Anterior Periolivary Nucleus (APO))
- Położone między rostralnym biegunem MSO a VNLL
Jądro okołokomorowe ogoniaste (CPO) (Posterior Periolivary Nucleus (PPO))
- Zlokalizowane między biegunem ogonowym MSO a jądrem twarzowym (7N)
Posteroventral Periolivary Nucleus (PVPO)
- Jądro rzutuje do obu IC, bez komórek rzutujących dwustronnie.
Patofizjologia
An autopsja 21-letniej kobiety z autyzmem, padaczką i upośledzeniem umysłowym wykazała prawie całkowity brak oliwki górnej.
Zobacz także
- Ciało oliwkowe
- Kulesza RJ, Cytoarchitecture of the human superior olivary complex: Medial and lateral superior olive. Hearing Research 225(2007) 80-90
- 2.0 2.1 Oliver DL, et al. Axonal projections from the lateral and medial superior olive to the inferior colliculus of the cat: a study using electron microscopic autoradiography. J Comp Neurol. 1995 Sep 11;360(1):17-32 Cite error: Invalid
<ref>tag; name „R4” defined multiple times with different content - Cajal, S. R. Y. and L. Azoulay (1909). Histologie du système nerveux de l’homme et des vertébrés. Paris, Maloine.
- 4.0 4.1 Kandel, et al Principles of Neuroscience. Fourth edth. pp 591-624. Copyright 2000, by McGraw-Hill Co. Cite error: Invalid
<ref>tag; name „R2” defined multiple times with different content - Kulesza, R. J., Jr. (2007). „Cytoarchitecture of the human superior olivary complex: medial and lateral superior olive.” Hear Res 225(1-2): 80-90.
- Tsuchitani, C. and J. C. Boudreau (1967). „Encoding of stimulus frequency and intensity by cat superior olive S-segment cells.” J Acoust Soc Am 42(4): 794-805.
- 8.0 8.1 8.2 Cite error: Invalid
<ref>tag; name „R10” defined multiple times with different content - Wu, S. H. and J. B. Kelly (1994). „Fizjologiczne dowody na ipsilateralne hamowanie w bocznej oliwce górnej: odpowiedzi synaptyczne w wycinku mózgu myszy.” Hear Res 73(1): 57-64.
- Brownell, W. E., P. B. Manis, et al. (1979). „Ipsilateral inhibitory responses in the cat lateral superior olive.” Brain Res 177(1): 189-93.
- Darrow, K. N., S. F. Maison, et al. (2006). „Cochlear efferent feedback balances interaural sensitivity.” Nat Neurosci 9(12): 1474-6.
- Warr, W. B. i J. J. Guinan, Jr. (1979). „Efferent innervation of the organ of corti: two separate systems”. Brain Res 173(1): 152-5.
- 13.0 13.1 Schofield, B. R. i N. B. Cant (1991). „Organization of the superior olivary complex in the guinea pig. I. Cytoarchitektura, histochemia oksydazy cytochromowej i morfologia dendrytów.” J Comp Neurol 314(4): 645-70. Cite error: Invalid
<ref>tag; name „R7” defined multiple times with different content - 14.0 14.1 14.2 14.3 14.4 14.5 14.6 14.7 14.8 Illing, R. B., K. S. Kraus, et al. (2000). „Plasticity of the superior olivary complex.” Microsc Res Tech 51(4): 364-81. Cite error: Invalid
<ref>tag; name „R5” defined multiple times with different content Cite error: Invalid<ref>tag; name „R5” defined multiple times with different content Cite error: Invalid<ref>tag; name „R5” defined multiple times with different content Cite error: Invalid<ref>tag; name „R5” defined multiple times with different content Cite error: Invalid<ref>tag; name „R5” defined multiple times with different content Cite error: Invalid<ref>tag; name „R5” defined multiple times with different content Cite error: Invalid<ref>tag; name „R5” defined multiple times with different content Cite error: Invalid<ref>tag; name „R5” defined multiple times with different content - Warr, W. B. and J. E. Beck (1996). „Multiple projections from the ventral nucleus of the trapezoid body in the rat.” Hear Res 93(1-2): 83-101.
- 16.00 16.01 16.02 16.03 16.04 16.05 16.06 16.07 16.08 16.09 16.10 Schofield, B. R. and N. B. Cant (1992). „Organizacja kompleksu oliwkowego górnego u świnki morskiej: II. Patterns of projection from the periolivary nuclei to the inferior colliculus.” J Comp Neurol 317(4): 438-55. Cite error: Invalid
<ref>tag; name „R6” defined multiple times with different content Cite error: Invalid<ref>tag; name „R6” defined multiple times with different content Cite error: Invalid<ref>tag; name „R6” defined multiple times with different content Cite error: Invalid<ref>tag; name „R6” defined multiple times with different content Cite error: Invalid<ref>tag; name „R6” defined multiple times with different content Cite error: Invalid<ref>tag; name „R6” defined multiple times with different content Cite error: Invalid<ref>tag; name „R6” defined multiple times with different content Cite error: Invalid<ref>tag; name „R6” defined multiple times with different content Cite error: Invalid<ref>tag; name „R6” defined multiple times with different content Cite error: Invalid<ref>tag; name „R6” defined multiple times with different content - Smith, P. H., P. X. Joris, et al. (1993). „Projekcje fizjologicznie scharakteryzowanych aksonów komórek kulistych krzaczastych z jądra ślimakowego kota: dowód na linie opóźniające do przyśrodkowej górnej oliwki.” J Comp Neurol 331(2): 245-60.
- Wenthold, R. J., D. Huie, et al. (1987). „Glycine immunoreactivity localized in the cochlear nucleus and superior olivary complex.” Neuroscience 22(3): 897-912.
- 19.0 19.1 Adams, J. C. (1983). „Cytologia komórek periolivary i organizacja ich projekcji u kota”. J Comp Neurol 215(3): 275-89. Cite error: Invalid
<ref>tag; name „R8” defined multiple times with different content - Friauf, E. and J. Ostwald (1988). „Divergent projections of physiologically characterized rat ventral cochlear nucleus neurons as shown by intra-axonal injection of horseradish peroxidase.” Exp Brain Res 73(2): 263-84.
- Kulesza, R. J., Jr. and A. S. Berrebi (2000). „Superior paraolivary nucleus of the rat is a GABAergic nucleus.” J Assoc Res Otolaryngol 1(4): 255-69.
- Kulesza, R. J., Jr, G. A. Spirou, et al. (2003). „Physiological response properties of neurons in the superior paraolivary nucleus of the rat.” J Neurophysiol 89(4): 2299-312.
- WHITE JS, WARR WB. The dual origins of the olivocochlear bundle in the albino rat. J. Comp. Neurol. 219:203-214, 1983.
- Guinan, J. J., Jr, S. S. Guinan, et al. (1972). „Pojedyncze jednostki słuchowe w kompleksie górnego olivary. I. Odpowiedzi na dźwięki i klasyfikacje oparte na właściwościach fizjologicznych.” Int J Neurosci 4: 101-20.
- Tsuchitani, C. (1977). „Functional organization of lateral cell groups of cat superior olivary complex.” J Neurophysiol 40(2): 296-318.
- Rodier PM, Ingram JL, Tisdale B, Nelson S, Romano J (1996). Embriological pochodzenie dla autyzmu: anomalie rozwojowe jąder ruchowych nerwów czaszkowych. J Comp Neurol 370 (2): 247-61.
- MedEd at Loyola Neuro/frames/nlBSs/nl27fr.htm
- Image at med.utah.edu (pick 9b. Pons)
Ten artykuł był pierwotnie oparty na wpisie z publicznej domeny wydania Gray’s Anatomy. W związku z tym, niektóre informacje zawarte w tym artykule mogą być nieaktualne. Proszę edytować artykuł, jeśli tak jest, i nie krępuj się usunąć tego powiadomienia, gdy nie jest już istotne.
|
v-d-e
Mózg: rhombencephalon (hindbrain) |
||||||
|---|---|---|---|---|---|---|
| Metencephalon/ pons |
|
grzbietowy/
(tegmentum) |
Ventral/
(base) |
Raphe/reticular
|
||
| Myelencephalon/ medulla |
|
Dorsal
|
Ventral
|
Raphe/reticular
|
||
|
v-d-e
Układ sensoryczny: Układ słuchowy i układ przedsionkowy (TA A15.3, GA 10.1029) |
||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ucho zewnętrzne |
Pinna (Helix, Antihelix, Tragus, Antitragus, Incisura anterior auris, Earlobe) – Kanał słuchowy – Mięśnie małżowiny usznej Błona bębenkowa (Umbo, Pars flaccida) |
|||||||||||
| Ucho środkowe |
|
|||||||||||
| Ucho wewnętrzne/ (labirynt błoniasty, labirynt kostny) |
|
|||||||||||
| {| class=”navbox collapsible nowraplinks” style=”margin:auto;” | ||||||||||||
|
—
|
||||||||||||
|
||||||||||||
|}
Na tej stronie wykorzystano treści na licencji Creative Commons pochodzące z Wikipedii (zobacz autorów).
Dodaj komentarz