Frontiers in Neuroanatomy
On 6 stycznia, 2022 by adminIntroduction
Traktografia tensora dyfuzji rezonansu magnetycznego (DTT) jest szeroko stosowana do śledzenia włókien neuronalnych i analizy specyficznych traktów włókien. Ważną częścią aplikacji DTT do in vivo jest to, jak ustawić region zainteresowania (ROI) dla procesu analizy DTT. Wielu badaczy wyznaczyło ROI w oparciu o obraz anatomiczny i obliczoną kolorową mapę anizotropii frakcyjnej (FA) zgodnie z ich celem badawczym, generalnie (Hong i in., 2009; Kim i Jang, 2013; Li i in., 2013). Chociaż w tych podejściach stosuje się analizę opartą na wielu ROI, mają one wadę w zakresie dokładności wyników ze względu na ustawienia ROI zależne od użytkownika. Aby przezwyciężyć tę wadę, wyniki aktywacji funkcjonalnego MRI (fMRI) zostały połączone z analizą DTT (Propper i in., 2010; Li i in., 2013). Takie podejście kombinacyjne zapewnia dokładniejsze wyznaczanie ROI niż ręczne wyznaczanie ROI. Jednakże rozmiary obszarów aktywacji fMRI mogą być ewentualnie zmieniane zgodnie z daną wartością istotną statystycznie, a dodatkowy proces akwizycji obrazów powoduje zużycie czasu.
W tym badaniu zastosowaliśmy szablon obszaru Brodmanna (BA) do wyznaczenia ROI dla dokładnej analizy DTT dla szlaku włókien powięzi łukowatej (AF). Wśród wielu szlaków włókien neuronalnych w ludzkim mózgu, AF jest ważnym szlakiem włókien neuronalnych, który łączy obszary czołowe (Broca) i skroniowe (Wernicke’a), i jest związany z funkcjami językowymi. W związku z tym, uszkodzenia AF powodowały różnego rodzaju problemy językowe, takie jak afazja przewodzenia i deficyty mowy (Yamada i in., 2007; Jang, 2013; Li i in., 2013). Dlatego też identyfikacja cech anatomicznych wraz z lokalizacją szlaku włókien AF w normalnym mózgu człowieka lub u pacjentów z afazją stała się ważnym zagadnieniem, ponieważ byłoby to pomocne dla neurobiologów lub badaczy klinicznych w przewidywaniu stanu regeneracji włókien neuronalnych w przypadku afazji oraz w badaniach uzupełniających. Ponadto, szablon BA jest rodzajem standardowego szablonu, który pokazuje regiony kory mózgowej człowieka podzielone na 46 obszarów w oparciu o cechy cytoarchitektoniczne (Thottakara i in., 2006). Stosując charakterystykę wzorca BA dla podzielonych regionów kory jako standard, nasze podejście analityczne zapewnia dokładne i pomocne ustawienie ROI dla badań DTT. Dodatkowo, wygenerowaliśmy mapę prawdopodobieństwa szlaku włókien AF, aby oszacować drogę szlaku włókien w mózgu.
Materiały i Metody
Przedmioty
W badaniu wzięło udział 13 zdrowych osób, dziewięciu mężczyzn i cztery kobiety (praworęczni, średni wiek: 38,7 ± 6,4 lat, zakres wieku: 26-50 lat). Nie stwierdzono u nich wcześniejszych chorób neurologicznych ani fizycznych. Wszyscy uczestnicy zostali poddani ocenie radiologa i neurologa, po czym uznano ich za osoby zdrowe. Wszyscy uczestnicy zrozumieli cel badania i wyrazili pisemną, świadomą zgodę. Ten protokół badania został zatwierdzony przez lokalną Institutional Review Board.
Akwizycja i analiza danych
Dane obrazowania tensora dyfuzji (DTI) zostały uzyskane przy użyciu 1,5 T skanera MR (Gyroscan Intera, Philips Healthcare, The Best, Holandia) z sześciokanałową cewką głowicy phased array sensitivity encoding (SENSE) przy użyciu sekwencji impulsów single-shot spin echo echo-planar imaging (EPI). Dane DTI uzyskano przy następujących parametrach: czas powtórzenia (TR)/czas echa (TE) = 10,726/75 ms, pole widzenia (FOV) = 221 mm, macierz akwizycji = 96 × 96, macierz rekonstrukcji = 128 × 128, grubość warstwy = 2,3 mm i współczynnik SENSE = 2. Ważenie dyfuzji zastosowano wzdłuż 32 niekolinearnych i niekoplanarnych gradientów uwrażliwiających na dyfuzję o wartości b równej 1000 s/mm2. Pozyskano 67 ciągłych poprzecznych plasterków obejmujących cały mózg bez przerw między plasterkami, a akwizycja z przeplotem plasterków została zastosowana w celu zminimalizowania przesłuchów spowodowanych brakiem przerw między plasterkami.
Przed analizą danych DTI, efekty prądów wirowych i ruchu głowy zostały skorygowane przez rejestrację wszystkich obrazów DWI do obrazów nieważonych dyfuzją (wartość b = 0 s/mm2) przy użyciu afinicznej rejestracji wieloskalowej przez FSL (Smith i in., 2004)1. Do obliczenia map parametrów dyfuzji i śledzenia włókien wykorzystano oprogramowanie DTI Studio (Department of Radiology, Johns Hopkins University School of Medicine, Baltimore, MD, USA), w którym zastosowano przypisywanie włókien za pomocą algorytmu ciągłego śledzenia (FACT) i podejścia z wieloma ROI (Wakana i in., 2004; Jiang i in., 2006). Aby wyodrębnić i ocenić szlak włókien AF u każdego uczestnika, użyliśmy dwóch standardowych szablonów mózgu, które zostały dostarczone w oprogramowaniu MRIcro2. Szablon BA dostarcza maski objętościowej, która jest podzielona na 46 dyskretnych regionów korowych, z których każdy reprezentuje inny obszar BA. Podczas gdy używamy wstępnie zdefiniowanych regionów korowych w szablonie BA, możemy po prostu wybrać lub narysować określony obszar regionu, który jest skorelowany z początkiem szlaku włókien nerwowych, do wyboru ROI w śledzeniu włókien. W ten sposób, możliwe jest zminimalizowanie błędnego czynnika wywołanego przez zależne od użytkownika ustawienie ROI. Dodatkowo, do procesu normalizacji obrazów mózgu wykorzystano szablon MNI T1w. Wszystkie zestawy danych DTI uzyskane ze skanera MRI dla każdego uczestnika i obliczona mapa FA mają nieco inną orientację i informacje o położeniu. W związku z tym, niektóre błędne czynniki wynikające z różnych struktur i/lub lokalizacji pomiędzy badanymi mogą zostać wyeliminowane poprzez zastosowanie procesu normalizacji obrazu mózgu. Co więcej, proces normalizacji oparty na obrazie szablonowym dla wszystkich zbiorów danych jest bardziej pomocny w generowaniu mapy ścieżek prawdopodobieństwa traktów włóknistych w celu zachowania spójności lokalizacji. W tym badaniu, szlak włókien AF był analizowany tylko w dominującej (lewej) półkuli u wszystkich badanych. Na rycinie 1A przedstawiono schemat blokowy procedur przetwarzania, które wykonywano w następującej kolejności: (i) Mapa FA badanego została obliczona przy użyciu oprogramowania DTI Studio; (ii) Szablon T1w został współrejestrowany z mapą FA każdego badanego przy użyciu oprogramowania SPM8 (Wellcome Department of Cognitive Neurology, London, UK). Ze względu na niewielką różnicę w kontraście obrazu pomiędzy mapą FA a wzorcem T1w, możliwe jest zminimalizowanie błędnego czynnika w procesie współrejestracji; (iii) W celu przeprowadzenia procesu normalizacji pomiędzy wzorcem BA a zbiorami danych tensora dyfuzji, macierz transformacji, która została wygenerowana w kroku (ii), została zastosowana do wzorca BA; (iv) Na podstawie znormalizowanego wzorca BA narysowano dwa ROI w obszarze Broca i Wernicke’a, a następnie wyodrębniono trakt włókien AF u każdego uczestnika, stosując następujące kryteria; woksel o wartości FA mniejszej niż 0.2 lub kąt trajektorii mniejszy niż 80 stopni; oraz (v) wygenerowano binarne maski wyekstrahowanych szlaków włókien dla każdego uczestnika. Maski binarne mają tylko dwie wartości: jedną (woksele dla lokalizacji traktu włóknistego) i zero (woksele dla lokalizacji bez traktu włóknistego). Maski wszystkich badanych zostały znormalizowane przy użyciu wzorca MNI T1w z MRIcro z 12 parametrową rejestracją afiniczną przy użyciu odwrotnej macierzy transformacji oryginalnego procesu współrejestracji. Te znormalizowane maski dróg włóknistych zostały zsumowane i podzielone przez całkowitą liczbę badanych w celu wygenerowania probabilistycznej mapy dróg migotania przedsionków. Probabilistyczna mapa szlaków została nałożona na szablon MNI T1w z różną skalą w zależności od wartości prawdopodobieństwa woksela.
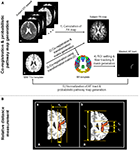
Rysunek 1. Schemat przepływu procedur analizy danych dla wyznaczania ROI w śledzeniu włókien/probabilistycznym generowaniu ścieżek (A) i procesu pomiaru względnych lokalizacji włókien (B). W przypadku pomiaru względnej lokalizacji powięzi łukowatej (AF) w probabilistycznej mapie ścieżek, (a) oznacza metodę pomiaru stosunku lokalizacji przyśrodkowo-bocznej między Xa i Xb, a (b) oznacza metodę pomiaru stosunku lokalizacji części przednio-tylnej między Ya i Yb lub Yc. Procesy pomiarowe stosunków lokalizacji zostały wykonane w Montreal Neurological Institute (MNI) T1w szablon, który jest przedstawiony na lokalizacji corona radiata.
Aby zbadać lokalizację szlaku włókien AF na każdym temacie, względna lokalizacja została zmierzona przez zajęty stosunek szlaku AF na podstawie lewej półkuli. Procesy pomiarowe przeprowadzono w części przyśrodkowo-bocznej i przednio-tylnej przy użyciu wygenerowanej probabilistycznej ścieżki włókien AF na szablonie MNI T1w (rysunek 1B). Lokalizacja przyśrodkowo-boczna była mierzona jako stosunek długości od szczeliny podłużnej do najbardziej bocznej granicy lewej półkuli mózgu (Xa) do długości od przyśrodkowej do bocznej lokalizacji poziomej części AF (Xb) w następujący sposób: (Xa/Xb) × 100. Stosunek położenia przednio-tylnego mierzono między długością od najbardziej przedniej do najbardziej tylnej granicy (Ya) a długością od przedniej do tylnej granicy pionowej części migotania przedsionków (Yb lub Yc). Wskaźnik położenia przednio-tylnego, bardziej szczegółowy, był mierzony oddzielnie na podstawie zbiegu części poziomej (stosunek między Ya i Yb) i części pionowej (stosunek między Ya i Yc) w następujący sposób: (Ya/Yb) × 100 i (Ya/Yc) × 100.
Wyniki
Profabilistyczne mapy szlaku włókien AF dla wszystkich grup badanych przedstawiono na rycinie 2. Zakres skali kolorów wskazuje prawdopodobieństwo, że dany woksel jest częścią szlaku włókien AF. Na tej probabilistycznej mapie szlaku włókien AF, zmierzony stosunek pozycji przyśrodkowo-bocznej wynosił 18%. Zmierzony stosunek pozycji anteroposterioralnej wynosił 35% w oparciu o punkt krzywizny AF. Stosunek ten został zmierzony odpowiednio dla części górnej 15% i części dolnej 20%. Na podstawie uzyskanych wyników można stwierdzić, że zmierzona przyśrodkowo-boczna część AF stanowi 1/5 całkowitej przyśrodkowo-bocznej długości półkuli na wzorcu MNI T1w. Zmierzona przednio-tylna część AF stanowiła 1/2 długości w stosunku do całkowitej przednio-tylnej długości półkuli. Ponadto, wyodrębniony trakt włókien AF, który został nałożony na poprzeczną płaszczyznę obrazu szablonu MNI T1w, nie ukazał w pełni ogólnego kształtu struktury traktu włókien AF ze względu na charakterystyczny zakrzywiony kształt traktu włókien AF in vivo; Jednakże, w szczególności, wyodrębniony szlak włókien AF dla każdego uczestnika, który został utworzony przez obraz maski w procedurze analizy (Rysunek 1) i zrekonstruowana mapa prawdopodobieństwa (Rysunek 2) opisały, że szlak włókien AF z naszych wyników był połączony z dwoma regionami mózgu pomiędzy obszarem Broca w dolnym zakręcie czołowym i obszarem Wernicke’a w tylnym górnym zakręcie skroniowym. Ponadto, wygenerowana probabilistyczna mapa ścieżek wyraźnie pokazała, że rozkłady połączonych szlaków włókien AF, które zostały wyodrębnione przez szablon BA dla ustawienia ROI z każdego podmiotu, były dobrze zlokalizowane i zdefiniowane w ludzkim mózgu bez żadnych błędów dyslokacji.
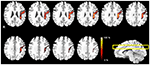
Rysunek 2. Probabilistyczne mapy szlaków włókien AF w lokalizacjach wielorzędowych. Pasek w skali kolorów wskazuje wartości probabilistyczne szlaku włókien.
Dyskusja
Ba jest dobrze zdefiniowanym ludzkim regionem kory mózgowej składającym się z 46 obszarów zgodnie z ich unikalnymi funkcjami. Wielu badaczy wykorzystało szablon BA do wskazania konkretnych miejsc aktywności mózgu w swoich badaniach, takich jak pacjenci z chorobami neurologicznymi lub strategiami leczenia, ponieważ BA różnicuje regiony nie tylko anatomicznie, ale również funkcjonalnie. W szczególności, wśród BA, obszar Broca i obszar Wernicke’a są połączone przez szlak włókien neuronowych AF, który jest zakrzywiony wokół szczeliny sylwiańskiej, która łączy skroniowe i czołowe obszary językowe (Rilling i in., 2008; Jang, 2013; Tak i Jang, 2014). Można się spodziewać, że AF jest najważniejszym traktem włóknistym związanym z funkcjami językowymi i ma wyraźny kształt krzywej połączonej w różnych kierunkach, w przeciwieństwie do innych traktów włóknistych, takich jak trakt korowo-rdzeniowy (reprezentatywny kierunek włókien nadrzędny-dolny) lub ciało modzelowate (reprezentatywny kierunek włókien lewy-prawy). Ponieważ szlak włókien AF jest silnie związany z pacjentami, którzy mają utrudnione zdolności językowe, takie jak afazja, identyfikacja dokładnej lokalizacji szlaku włókien AF jest istotnie brana pod uwagę w perspektywie klinicznej. Wiele podejść z wykorzystaniem technik obrazowania wielomodalnego i/lub inwazyjnych operacji śródoperacyjnych zostało przeprowadzonych w celu znalezienia neuroanatomicznej charakterystyki dróg włóknistych AF i oceny ich krytycznej roli w kontroli sprzężenia zwrotnego i sterowania produkcją języka (Duffau i in., 2002; Breier i in., 2008; Hosomi i in., 2009; Marchina i in., 2011; Zhao i in., 2012; Yamao i in., 2014). Metoda DTT, która została wprowadzona w przeszłości do śledzenia szlaku włókien nerwowych, jest szeroko stosowana do demonstracji charakterystyki włókien nerwowych przy użyciu obliczonych zjawisk dyfuzji cząsteczek wody in vivo. Takie podejście jest odpowiednie do wizualizacji przebiegu włókien, jak również łatwe do zastosowania. Ze względu na te cechy, metoda DTT i jej rozwój techniczny pozwoliły na wizualizację in vivo szlaków włóknistych związanych z istotą białą. Jednakże, pomimo postępu w ocenie przebiegu włókien metodą DTT, nadal istnieje ograniczenie związane z dokładnością ustawienia ROI w DTT.
W tym badaniu, zastosowaliśmy nie zależne od użytkownika ustawienie ROI dla DTT oparte na szablonie BA. ROI zdefiniowane na podstawie szablonu BA mają przewagę dla spójności traktu włókien nerwowych w porównaniu z ustawieniami ROI zależnymi od użytkownika. Dodatkowo, znormalizowaliśmy indywidualny szlak AF do szablonu MNI T1w, aby zbadać tendencję lokalizacji AF i jego probabilistyczną ścieżkę w ludzkim mózgu. Ścieżka probabilistyczna może zapewnić lepszą estymację prawdopodobieństwa połączeń włókien dla grupy badanych. Do tej pory, procedury wyboru ROI dla analizy DTT były zazwyczaj wykonywane z ustawieniami ROI zależnymi od użytkownika, co może powodować błędy analityczne w części tożsamości i odtwarzalności, nawet jeśli ROI były dobrze zdefiniowane przez doświadczonych badaczy. W szczególności, proponowane podejście analityczne do śledzenia włókien nerwowych in vivo u ludzi, które przeprowadzono z wyborem ROI na podstawie wzorca BA, ma siłę analityczną pozwalającą na akwizycję bardziej dokładnych ścieżek włókien, niezależnie od zanieczyszczenia błędami ustawienia ROI przez użytkowników lub badaczy. Jeśli chodzi o zachowanie identyfikacji i odtwarzalności wyników, można zapewnić wysoką zgodność z powodu dwóch głównych procedur analitycznych, takich jak normalizacja mózgu i ekstrakcja obszaru ROI z szablonu BA bez żadnych ręcznych ustawień. Ponadto, nasze podejścia mogą być łatwo dostosowane do analizy dla DTT studiów, i prowadzić do analizy połączeń włókien BA w innych obszarach mózgu dokładnie.
Istnieją pewne ograniczenia tego badania. Po pierwsze, mamy ograniczenie do naszej procedury analizy DTT z powodu rozważenia deterministycznego algorytmu śledzenia włókien. Dlatego uważamy, że zastosowanie innych algorytmów śledzenia włókien opartych na probabilistycznym algorytmie śledzenia włókien z szablonem BA i badania porównawcze dostarczą bardziej pomocnych informacji do oceny ustawienia ROI opartego na szablonie BA w badaniach klinicznych. Po drugie, przy rekrutacji uczestników badania wzięliśmy pod uwagę tylko osoby zdrowe, których populacja jest stosunkowo niska. W przyszłych badaniach, z dużą liczbą uczestników i/lub pacjentów, którzy mieli choroby w drogach włókien AF będą uczestniczyć, wierzymy, że wyniki również dają więcej wiarygodności.
W podsumowaniu, zademonstrowaliśmy śledzenie włókien AF z szablonem BA do wyboru ROI i jego probabilistyczną ścieżkę w ludzkim mózgu. Wierzymy, że proponowane przez nas podejścia analityczne są wystarczająco rozszerzone na inne badania DTT dla ustalenia ROI, a te mogą być dostarczone dokładne informacje o szlakach włókien nerwowych i ustawieniach badań klinicznych.
Wkład Autorów
D-HL, D-WL i B-SH zaprojektowali i koordynowali badania. D-HL i B-SH zgromadzili dane. D-HL i D-WL przeanalizowali dane. D-HL sporządził manuskrypt. B-SH był mentorem badania.
Oświadczenie o konflikcie interesów
Autorzy deklarują, że badania były prowadzone przy braku jakichkolwiek komercyjnych lub finansowych powiązań, które mogłyby być interpretowane jako potencjalny konflikt interesów.
Abbreviations
BA, Brodmann’s area; ROI, region of interest; AF, arcuate fasciculus; DTT, diffusion tensor tractography; DTI, diffusion tensor imaging; MNI, Montreal Neurological Institute; FA, fractional anisotropy.
Przypisy
- ^ www.fmrib.ox.ac.uk/fsl, Analysis Group, FMRIB, Oxford, UK.
- ^ www.mricro.com, Chris Rorden, CA, USA.
Breier, J. I., Hasan, K. M., Zhang, W., Men, D., and Papanicolaou, A. C. (2008). The language dysfunction after stroke and damage to white matter tracts evaluated using diffusion tensor imaging. AJNR Am. J. Neuroradiol. 29, 483-487. doi: 10.3174/ajnr.a0846
PubMed Abstract | CrossRef Full Text | Google Scholar
Duffau, H., Capelle, L., Sichez, N., Denvil, D., Lopes, M., Sichez, J. P., et al. (2002). Intraoperative mapping of the subcortical language pathways using direct stimulations. Brain 125, 199-214. doi: 10.1093/brain/awf016
PubMed Abstract | CrossRef Full Text | Google Scholar
Hong, J. H., Kim, S. H., Ahn, S. H., and Jang, S. H. (2009). The anatomical location of the arcuate fasciculus in the human brain: a diffusion tensor tractography study. Brain Res. Bull. 28, 52-55. doi: 10.1016/j.brainresbull.2009.05.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Hosomi, A., Nagakane, Y., Yamada, K., Kuriyama, N., Mizuno, T., Nishimura, T., et al. (2009). Assessment of arcuate fasciculus with diffusion-tensor tractography may predict the prognosis of aphasia in patients with left middle cerebral artery infarcts. Neuroradiology 51, 549-555. doi: 10.1007/s00234-009-0534-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Jang, S. H. (2013). Diffusion tensor imaging studies on arcuate fasciculus in stroke patients: a review. Front. Hum. Neurosci. 7:749. doi: 10.3389/fnhum.2013.00749
PubMed Abstract | CrossRef Full Text | Google Scholar
Jiang, H., van Zijl, P. C., Kim, J., Pearlson, G. D., and Mori, S. (2006). DtiStudio: program zasobowy do obliczeń tensora dyfuzji i śledzenia wiązek włókien. Comput. Methods Programs Biomed. 81, 106-116. doi: 10.1016/j.cmpb.2005.08.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Kim, S. H., and Jang, S. H. (2013). Prediction of aphasia outcome using diffusion tensor tractography for arcuate fasciculus in stroke. AJNR Am. J. Neuroradiol. 34, 785-790. doi: 10.3174/ajnr.a3259
PubMed Abstract | CrossRef Full Text | Google Scholar
Li, Z., Peck, K. K., Brennan, N. P., Jenabi, M., Hsu, M., Zhang, Z., et al. (2013). Diffusion tensor tractography of the arcuate fasciculus in patients with brain tumors: comparison between deterministic and probabilistic models. J. Biomed. Sci. Eng. 6, 192-200. doi: 10.4236/jbise.2013.62023
PubMed Abstract | CrossRef Full Text | Google Scholar
Marchina, S., Zhu, L. L., Norton, A., Zipse, L., Wan, C. Y., and Schlaug, G. (2011). Impairment of speech production predicted by lesion load of the left arcuate fasciculus. Stroke 42, 2251-2256. doi: 10.1161/STROKEAHA.110.606103
PubMed Abstract | CrossRef Full Text | Google Scholar
Propper, R. E., O’Donnell, L. J., Whalen, S., Tie, Y., Norton, I. H., Suarez, R. O., et al. (2010). A combined fMRI and DTI examination of functional language lateralization and arcuate fasciculus structure: effects of degree versus direction of hand preference. Brain Cogn. 73, 85-92. doi: 10.1016/j.bandc.2010.03.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Rilling, J. K., Glasser, M. F., Preuss, T. M., Ma, X., Zhao, T., Hu, X., et al. (2008). The evolution of the arcuate fasciculus revealed with comparative DTI. Nat. Neurosci. 11, 426-428. doi: 10.1038/nn2072
PubMed Abstrakt | CrossRef Full Text | Google Scholar
Smith, S. M., Jenkinson, M., Woolrich, M. W., Beckmann, C. F., Behrens, T. E., Johansen-Berg, H., et al. (2004). Advances in functional and structural MR image analysis and implementation as FSL. Neuroimage 23, S208-S219. doi: 10.1016/j.neuroimage.2004.07.051
PubMed Abstract | CrossRef Full Text | Google Scholar
Tak, H. J., and Jang, S. H. (2014). Relation between aphasia and arcuate fasciculus in chronic stroke patients. BMC Neurol. 14:46. doi: 10.1186/1471-2377-14-46
PubMed Abstract | CrossRef Full Text | Google Scholar
Thottakara, P., Lazar, M., Johnson, S. C., and Alexander, A. L. (2006). Application of Brodmann’s area templates for ROI selection in white matter tractography studies. Neuroimage 29, 868-878. doi: 10.1016/j.neuroimage.2005.08.051
PubMed Abstract | CrossRef Full Text | Google Scholar
Wakana, S., Jiang, H., Neage-Poetscher, L. M., van Zijl, P. C., and Mori, S. (2004). Fiber tract-based atlas of human white matter anatomy. Radiology 230, 77-87. doi: 10.1148/radiol.2301021640
PubMed Abstract | CrossRef Full Text | Google Scholar
Yamada, K., Nagakane, Y., Mizuno, T., Hosomi, A., Nakagawa, M., and Nishimura, T. (2007). MR tractography depicting damage to the arcuate fasciculus in a patient with conduction aphasia. Neurology 68:789. doi: 10.1212/01.wnl.0000256348.65744.b2
PubMed Abstract | CrossRef Full Text | Google Scholar
Yamao, Y., Matsumoto, R., Kunieda, T., Arakawa, Y., Kobayashi, K., Usami, K., et al. (2014). Intraoperative dorsal language network mapping by using single-pulse electrical stimulation. Hum. Brain Mapp. 35, 4345-4361. doi: 10.1002/hbm.22479
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhao, Y., Chen, X., Wang, F., Sun, G., Wang, Y., Song, Z., et al. (2012). Integration of diffusion tensor-based arcuate fasciculus fibre navigation and intraoperative MRI into glioma surgery. J. Clin. Neurosci. 19, 255-261. doi: 10.1016/j.jocn.2011.03.041
PubMed Abstract | CrossRef Full Text | Google Scholar
.
Dodaj komentarz