Colorectal Cancer: Open Access
On 9 października, 2021 by adminKeywords
Hand-assisted surgery; Laparoscopy; Colorectal surgery; Colectomy; Colon cancer
Introduction
Although the first reported laparoscopic assisted colectomy was in 1991 , the number of laparoscopic colonic procedures remained a minority of colonic resections. Wynikało to z faktu, że kolektomia laparoskopowa jest trudna technicznie i wymaga długiej krzywej uczenia. Dlatego też chirurgia laparoskopowa wspomagana rękoma (hand-assisted laparoscopic surgery – HALS) została uznana za przydatną alternatywę dla laparoskopowej chirurgii jelita grubego i wprowadzona jako technika hybrydowa, która pozwala na wprowadzenie niedominującej ręki chirurga do jamy brzusznej przez specjalny port ręczny z zachowaniem otrzewnej. Pozwala to na wizualizację laparoskopową, pomaga w dysekcji, retrakcji i umieszczaniu narzędzi laparoskopowych. Pod tym względem HALS łączy zalety operacji otwartej – z niedominującą ręką chirurga wewnątrz jamy brzusznej – z zaletami technik minimalnie inwazyjnych. Ręka wewnątrz jamy brzusznej przywraca wrażenia dotykowe, których brakuje w chirurgii laparoskopowej, umożliwia bezpieczną dysekcję i retrakcję palców oraz poprawia koordynację ręka-oko. Wszystkie te czynniki mogą odegrać istotną rolę w skróceniu czasu operacji.
HALS jest dodatkowo zalecany w procedurach laparoskopowych, które wymagają nacięcia w celu pobrania resekowanego materiału, jak w przypadku resekcji okrężnicy. Takie nacięcie, które zwykle wykonuje się na końcu zabiegów laparoskopowych, może być wykorzystane wcześniej, na początku operacji, w celu umieszczenia portu ręcznego, który pozwala chirurgowi na przejście jego niedominującej ręki w celu ułatwienia dysekcji, a tym samym skrócenia czasu operacji. Technika ta została wprowadzona jako „pomost” w kierunku całkowicie laparoskopowej chirurgii kolorektalnej.
Wskazania do kolektomii esicy
Wskazania do ręcznie wspomaganej laparoskopowej kolektomii esicy są podobne jak w przypadku konwencjonalnej metody otwartej. Technika ta może być proponowana wszystkim nowo przybyłym pacjentom z każdą patologią esicy wymagającą resekcji. Najczęstsze wskazania w regionie, w którym pracuje autor, to łagodne lub złośliwe nowotwory esicy, rozdęcie esicy i rzadziej choroba uchyłkowa.
Przygotowanie przedoperacyjne
Wykonuje się rutynowe przedoperacyjne badania krwi, RTG klatki piersiowej i EKG. Staging workup includes computerized tomography scan (CT) of the chest, abdomen and pelvis, colonoscopy and biopsy of the lesion to confirm the diagnosis. Zaleca się przygotowanie dwóch jednostek koncentratu krwinek czerwonych. Chociaż przedoperacyjne przygotowanie jelita grubego do operacji jest przedmiotem wielu dyskusji, mechaniczne przygotowanie jelita grubego jest zwykle podawane jak najwcześniej w dniu poprzedzającym operację, aby uniknąć gazowego wzdęcia okrężnicy, które może powodować trudności techniczne podczas zabiegu operacyjnego.
U pacjentów z gruczolakorakiem esicy, jeśli guz nie jest widoczny w tomografii komputerowej, wskazane jest wytatuowanie guza tuszem indyjskim podczas kolonoskopii przed operacją. Ma to szczególnie istotne znaczenie w przypadku kolektomii wykonywanej laparoskopowo, a nie ręcznie. Zalecana jest również profilaktyka anty-DVT w postaci heparyny drobnocząsteczkowej oraz profilaktyczne podawanie antybiotyków na sali operacyjnej podczas indukcji znieczulenia. Kombinacja cefuroksymu 750 mg i metronidazolu 500 mg podawana jest w większości przypadków jako dawka pojedyncza. W niektórych przypadkach podaje się kolejne dwie dawki w 8 i 16 godzinie po operacji.
Potrzebne narzędzia
Do przeprowadzenia udanej ręcznej kolektomii laparoskopowej potrzebny jest szereg narzędzi:
– Port ręczny: autor został przeszkolony w zakresie używania Lap Disc (Ethicon Endosurgery, Cincinnati, Ohio, USA). Potrzebny rozmiar (mały, średni lub duży) zależy od grubości i konturu ściany brzucha pacjenta. Dysk laparoskopowy składa się z trzech nałożonych na siebie plastikowych pierścieni połączonych membraną z gumy silikonowej (ryc. 1). Dolny, elastyczny pierścień posiada pamięć, która pozwala na jego ciasne włożenie do jamy brzusznej. Dwa sztywne pierścienie górny i środkowy blokują się razem za pomocą przekładni ślizgowej i są skręcane w celu zamknięcia zgodnie z ruchem wskazówek zegara, aby utrzymać ciśnienie gazu w otrzewnej, tworząc tak zwaną „zastawkę irysową”, której otwór można płynnie regulować. Należy unikać nadmiernego zaciśnięcia otworu. Aby otworzyć dysk, górny pierścień należy unieść i lekko obrócić zgodnie z ruchem wskazówek zegara, najpierw w celu zwolnienia kół zębatych, a następnie powoli obrócić w kierunku przeciwnym do ruchu wskazówek zegara.
Ryc. 1: Części dysku LapDisc; 3 plastikowe pierścienie, które są połączone silikonową membraną.
– Generator elektrochirurgiczny: użycie Harmonic Scalpel (Ethicon Endosurgery, USA) lub Ligature (Tyco, USA) zależy wyłącznie od preferencji i uznania chirurga.
– Dwa do trzech jednorazowych trokarów 12 mm i 10 mm.
– Staplery Endo (Ethicon Endosurgery, Cincinnati, Ohio, USA): dwa 45 mm endoskopowe przegubowe nożyce liniowe z doładowaniami naczyniowymi i niebieskimi doładowaniami.
– Staplery okrężne chirurgii otwartej.
Procedura
Ułożenie pacjenta i konfiguracja sali operacyjnej
Przy znieczuleniu ogólnym z intubacją dotchawiczą, pacjent jest układany na stole w pozycji leżącej z obiema rękami schowanymi po bokach, aby zapewnić więcej miejsca na ruchy chirurga i asystenta. Nogi pacjenta są ułożone płasko i rozdzielone, aby ułatwić przezkanałowe przejście staplerów okrężnych do zespolenia okrężniczo-odbytniczego w późniejszym etapie zabiegu. Unika się w ten sposób konieczności stosowania pozycji Lloyda-Daviesa, która może nie być konieczna. Po wprowadzeniu znieczulenia zakładany jest zgłębnik nosowo-żołądkowy i cewnik moczowy, które mogą być usunięte pod koniec operacji.
Główny chirurg stoi po prawej stronie pacjenta, a jego asystent/kamerzysta po lewej stronie pacjenta. Dwa monitory (główny i dodatkowy) są umieszczone z boku nóg pacjenta, aby umożliwić zarówno chirurgowi, jak i asystentowi najlepszy i optymalny widok na ekran.
Umieszczenie portu ręcznego
Po przygotowaniu brzucha i krocza za pomocą roztworu sterylizującego, brzuch i nogi są wycierane ręcznikiem. Pionowe nacięcie w linii środkowej (szerokość 4 palców) jest zaznaczane jako miejsce wprowadzenia portu ręcznego. To 6-7-centymetrowe nacięcie w linii środkowej, które wychodzi poza pępek, jest pogłębiane przez linię alba i otrzewną do jamy brzusznej. Hemostaza zostaje zabezpieczona za pomocą diatermii. Zakłada się dwa szwy mocujące i mocuje je do klipsów hemosatycznych, aby umożliwić uniesienie ściany jamy brzusznej podczas wprowadzania portu ręcznego, a następnie ułatwić wielokrotne wprowadzanie niedominującej ręki chirurga. Należy uważać, aby nie dotknąć portem ręcznym klipsów. Port ręczny wprowadza się przez powolne wepchnięcie elastycznego pierścienia do jamy brzusznej po uprzednim uniesieniu ściany jamy brzusznej za pomocą szwów mocujących po tej stronie. Następnie uniesiony zostaje drugi szew mocujący, a pierścień elastyczny jest powoli i delikatnie wpychany do jamy brzusznej. Zapewnia się pełny, szczelny kontakt pomiędzy elastycznym pierścieniem krążka a przednią ścianą jamy brzusznej. Otwór krążka laparoskopowego jest zaciskany zgodnie z ruchem wskazówek zegara wokół trokara 10-11 mm i wywoływana jest pneumoperitoneum poprzez insuflację jamy brzusznej CO2 do ciśnienia 13-15 mmHg.
Umieszczenie trokarów
Trokar 12 mm jest wprowadzany w prawym boku lub w prawym dole biodrowym, aby umożliwić przejście skalpela harmonicznego, innych rozwieraczy i staplerów endopatycznych. Kolejny trokar 10-11 mm jest wprowadzany w okolicy nadłonowej nad linią pośrodkową dla kamery. Sporadycznie może być potrzebny trzeci 10 mm port w lewym boku na poziomie pępka, który może być użyty jako kolejny port dla kamery. Chociaż laparoskop z 300 kamerami jest idealny w kolektomii laparoskopowej, kamera 00 jest równie dobra w dostarczaniu odpowiednich widoków (Rycina 2).
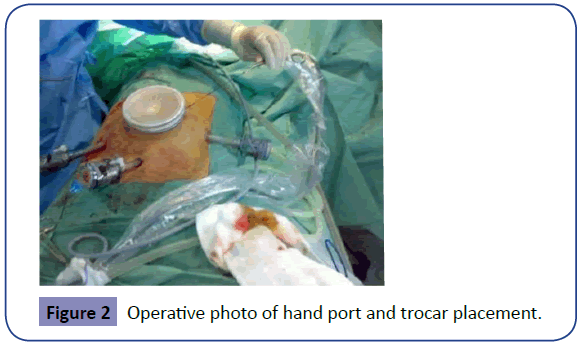
Rycina 2: Zdjęcie operacyjne umieszczenia portu ręcznego i trokara.
Postępowanie
Po wprowadzeniu miejsca portu i zaciśnięciu otworu wokół trokara 10 mm, wywołano pneumoperitoneum i wprowadzono laparoskop. Pozostałe 2-3 trokary wprowadzono we wskazanych wyżej pozycjach pod bezpośrednim nadzorem wzroku. Teraz jama brzuszna jest dokładnie oglądana za pomocą laparoskopu. Następnie usuwa się trokar i smaruje wnętrze tarczy sterylną galaretką k-y. Nasmarowany grzbiet niedominującej (lewej) ręki chirurga zostaje wprowadzony przez otwór portu do jamy brzusznej. Narządy jamy brzusznej, zwłaszcza wątroba, węzły chłonne i cała okrężnica są dokładnie omacywane i identyfikowane jest miejsce patologii. Pacjent jest następnie układany w stromej pozycji Trendelenberga i przechylany w prawo, aby umożliwić grawitacyjne przemieszczenie pętli jelita cienkiego do prawego górnego kwadrantu z następowym odsłonięciem pola operacyjnego.
Po potwierdzeniu miejsca patologii rozpoczyna się dysekcję od bocznej do przyśrodkowej części okrężnicy zstępującej i esiczej, używając ręki do wciągnięcia okrężnicy przyśrodkowo, a skalpela harmonicznego lub dissektora do otwarcia bocznego odbicia otrzewnowego przy białej linii Toldtsa. Może być konieczne połączenie tępej i ostrej dysekcji przy użyciu lewej ręki i skalpela harmonicznego przez drugi port. Ponieważ lewa okrężnica jest w pełni zmobilizowana przyśrodkowo, przed przystąpieniem do dalszych czynności należy zidentyfikować lewy moczowód i naczynia gonadalne. Następnie kontynuuje się dysekcję wzdłuż okrężnicy zstępującej aż do zgięcia śledzionowego i w dół aż do górnej części odbytnicy. Następnie okrężnica jest odbijana bocznie przy użyciu ręki, aby umożliwić uwidocznienie lewej okrężnicy i krezki esicy, która po rozciągnięciu wyróżnia się naczyniami krezkowymi dolnymi, co ułatwia identyfikację. Ta szypuła naczyniowa jest rozcinana wraz z towarzyszącymi jej węzłami chłonnymi przy użyciu skalpela harmonicznego i jest najlepiej dzielona przy użyciu endostaplerów naczyniowych lub uszczelniacza naczyń Ligasure, jeśli jest dostępny.
Dysekcja przyśrodkowa krezki jest następnie kontynuowana w płaszczyźnie przed powięzią Gerota w podobny sposób przy użyciu skalpela harmonicznego w celu uszczelnienia mniejszych naczyń krezkowych. Kontynuuje się to do momentu, gdy krwiak po rozcięciu bocznym jest widoczny i osiągnięte zostaną miejsca przewidywanych resekcji proksymalnych i dystalnych. Endostaplery z niebieskimi ładunkami są następnie wprowadzane przez drugi trokar i używane do dystalnego przecięcia okrężnicy odbytniczo-żołądkowej (Rycina 3). Przecięty koniec proksymalny jest następnie wyprowadzany na zewnątrz przez krążek okrężnicy, który jest pozostawiony in situ jako osłona rany (Rycina 4). Proksymalny koniec jest wycinany po zastosowaniu miękkiego, niegniotącego zacisku jelitowego, a próbka jest wysyłana do badania histopatologicznego.
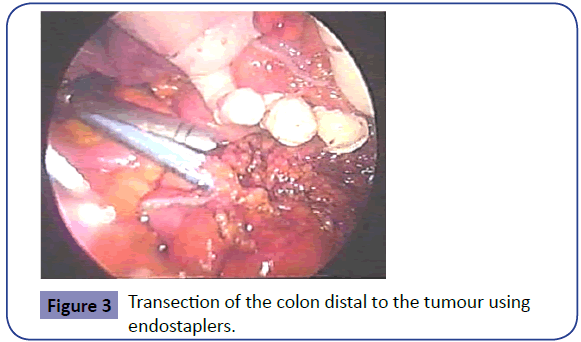
Rycina 3: Wycinanie okrężnicy dystalnie od guza przy użyciu endostaplerów.
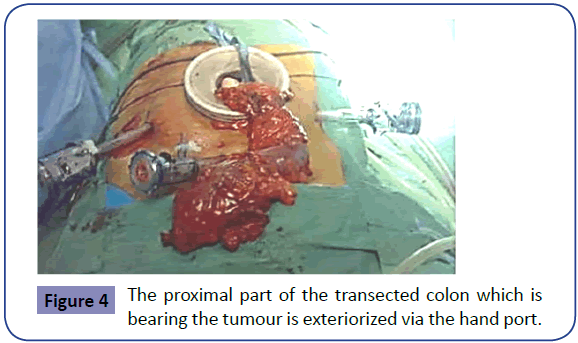
Ryc. 4: Proksymalna część okrężnicy, w której znajduje się guz, jest eksternalizowana przez port ręczny.
Kowadełko staplera okrężnego o rozmiarze 29 lub 31 jest umieszczane w dystalnym końcu okrężnicy i zakładany jest na nie szew okrężny. Usztywniony koniec okrężnicy z kowadełkiem jest wprowadzany z powrotem do jamy otrzewnej. Wprowadza się również lewą rękę i ponownie napełnia się brzuch. Koniec okrężnicy zstępującej z kowadełkiem jest przytrzymywany i orientowany po zidentyfikowaniu kikuta odbytnicy.
Prawą ręką w podwójnej rękawiczce główny chirurg wprowadza stapler okrężny przez odbyt, po tym jak asystent wykonuje rozciągnięcie zwieracza. Pod kontrolą wzroku laparoskopowego kowadełko jest mocowane do trokara staplera okrężnego z zachowaniem anatomicznego ułożenia krezki (Rycina 5). Stapler okrężny jest zamykany – po upewnieniu się, że żadne inne struktury nie są zamknięte – i wystrzeliwany przy użyciu techniki podwójnego zszywania, tworząc zespolenie koniec do końca okrężniczo-odbytnicze. Następnie urządzenie zszywające jest wycofywane, a pączki są sprawdzane pod kątem ukończenia przed wysłaniem ich wraz z wyciętym fragmentem okrężnicy do badania histopatologicznego. Integralność zespolenia jest sprawdzana przez wypełnienie miednicy sterylną wodą i wdmuchiwanie powietrza przez odbyt za pomocą strzykawki do pęcherza moczowego lub sztywnego sigmoidoskopu. Na koniec kontroluje się rynnę paracentralną pod kątem krwawienia, które należy zabezpieczyć. W zależności od uznania chirurga można założyć dren ssący w miednicy lub w rynience paracolowej przez miejsce portu podżołądkowego lub z lewego flanku. Przed usunięciem wszystkich trokarów brzuch jest całkowicie opróżniany, a we wszystkich miejscach po trokarach zakładane są szwy powięziowe, aby zapobiec powstaniu przepuklin trokarowych w przyszłości. Po usunięciu miejsca portu wykonuje się masowe zamknięcie rany w linii środkowej (Rycina 6).
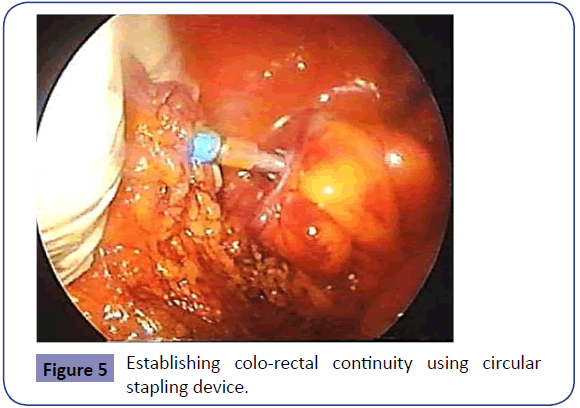
Rycina 5: Ustanowienie ciągłości okrężniczo-odbytniczej przy użyciu zszywacza okrężnego.
Rycina 6: Zamknięcie głębszych warstw miejsca portu ręcznego.
Uwaga Długość nacięcia; długość palca wskazującego
Opieka pooperacyjna
Wspólna zaleta z kolektomią laparoskopową, HALS wiąże się z mniejszym zużyciem narkotyków pooperacyjnych. Dlatego też analgezja domięśniowa jest przepisywana tylko na 24-48 godzin. Później przechodzi się na doustną analgezję niesteroidowymi lekami przeciwzapalnymi. Pacjent może pić wodę doustnie po odzyskaniu pełnej sprawności, a w pierwszej dobie pooperacyjnej podawane są płyny doustne. W drugiej dobie podawana jest miękka dieta, a w trzeciej dobie wznawia się pełną dietę. Dren, jeśli został założony, usuwa się, gdy jego zawartość jest minimalna; zwykle w drugiej lub trzeciej dobie, a pacjent jest wypisywany w czwartej lub piątej dobie po zabiegu, jeśli nie wystąpiły żadne powikłania. Wynik kosmetyczny zabiegu jest bardzo akceptowalny i satysfakcjonujący, szczególnie dla pacjentek (Rycina 7).
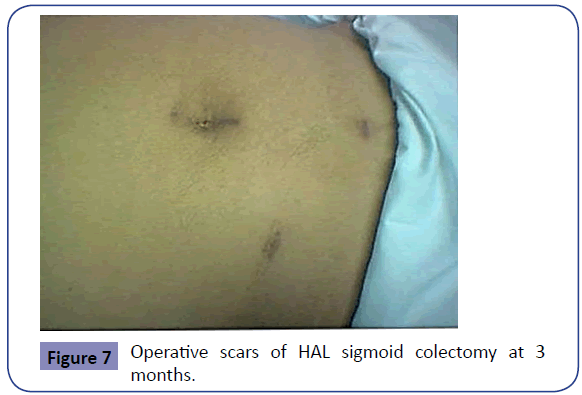
Rycina 7: Blizny pooperacyjne po HAL sigmoid colectomy po 3 miesiącach.
Dyskusja
HALS był stosowany do odcinkowej resekcji okrężnicy, resekcji przednich, całkowitej kolektomii, odwrócenia procedury Hartmanna oraz zabiegów w obrębie odbytnicy, takich jak rektopeksja i resekcja abdominoplastyczna. Jej zalety w porównaniu z kolektomią wspomaganą laparoskopowo obejmują łatwiejszą eksplorację, dysekcję i mobilizację okrężnicy oraz lepszą kontrolę wypadków krwotocznych, co zmniejsza odsetek konwersji.
Nie ma wątpliwości, że chirurgia kolorektalna HALS jest znacznie lepsza od otwartej kolektomii (OC), ponieważ zachowuje zalety chirurgii minimalnie inwazyjnej. W randomizowanym badaniu kontrolowanym (RCT), w którym porównano dwie dobrze dobrane grupy chorych poddawanych elektywnej resekcji raka prawej połowy okrężnicy (HALS vs. otwarta), stwierdzono, że wykonanie HALS trwało istotnie dłużej, ale spowodowało istotnie mniejszą utratę krwi i wiązało się z istotnie mniejszym bólem. Ponadto chorzy w grupie HALS szybciej wracali do zdrowia i krócej byli hospitalizowani. W innym RCT, HALS był związany z istotnie krótszym pobytem w szpitalu i długością nacięcia, szybszym powrotem funkcji przewodu pokarmowego, mniejszym zapotrzebowaniem na środki przeciwbólowe i mniejszą utratą krwi oraz niższą punktacją bólu. Ponadto, nie było istotnych różnic w czasie operacji, powikłaniach lub czasie do pełnego powrotu do zdrowia .
W literaturze opublikowano kilka badań porównujących HALS do laparoskopowo wspomaganych zabiegów kolorektalnych; niektóre z nich były RCT , a inne były prospektywnymi nierandomizowanymi badaniami . W badaniu HALS nie stwierdzono istotnych różnic pomiędzy obiema grupami pod względem czasu operacji, długości nacięcia, częstości powikłań i długości pobytu w szpitalu. Odnotowano jednak mniejszą liczbę konwersji w grupie HALS. Targarona i wsp. stwierdzili, że czas operacji i wynik kliniczny były podobne, ale odsetek konwersji był znacznie wyższy w grupie laparoskopowej. Jednak 4 z 6 konwersji w grupie laparoskopowej zostały wykonane techniką wspomaganą ręcznie. Podobnie w badaniu grupy Minimally Invasive Therapy and Technology (MITT) nie stwierdzono istotnych różnic w częstości powikłań i długoterminowych wynikach klinicznych, ale odsetek konwersji był niższy w grupie HALS. Co więcej, nie było widocznych różnic w czasie powrotu funkcji jelit, tolerancji diety, długości pobytu w szpitalu, punktacji bólu pooperacyjnego lub użycia narkotyków pomiędzy obiema grupami. Tjandra i wsp. stwierdzili podobne wyniki onkologiczne w zakresie usunięcia guza i liczby pobranych węzłów chłonnych pomiędzy obiema grupami. Czas operacji był jednak istotnie krótszy w grupie HALS. Również powrót funkcji jelit i oddawanie stolca były opóźnione w grupie HALS. W związku z tym, badanie to wykazało pewną różnicę w powrocie do zdrowia na korzyść grupy laparoskopowej. Duże retrospektywne, jednoośrodkowe badanie z kliniki Lahey, porównujące ręczną kolektomię esicy (n = 66) z laparoskopową kolektomią esicy (n = 85), nie wykazało istotnej różnicy w powrocie funkcji jelit (2,5 d vs 2,8 dni), długości pobytu w szpitalu (5,2 d vs 5,0 dni) ani krótkoterminowych powikłań, takich jak nieszczelność zespolenia, niedrożność jelit i zakażenie rany (21% vs 23%) pomiędzy obiema grupami. Stwierdzono natomiast istotną różnicę w czasie operacji (189 min vs 203 min) i odsetku konwersji (0% vs 13%) na korzyść grupy HALS. Długość nacięcia była jednak istotnie mniejsza (8,1 cm vs 6,2 cm) w grupie laparoskopowej. Na podstawie przeglądu piśmiennictwa, porównując HALS i laparoskopową chirurgię jelita grubego można stwierdzić, co następuje:
– HALS oferuje podobne minimalnie inwazyjne korzyści jak podejście laparoskopowe z krótszym czasem operacji i mniejszym odsetkiem konwersji.
– Oba podejścia mają porównywalny odsetek powikłań i długość pobytu, ale długość nacięcia jest większa w HALS.
– Istnieje zwiększony poziom markerów stanu zapalnego z większym zapotrzebowaniem na pooperacyjną analgezję narkotyczną i opóźnionym powrotem funkcji jelita po HALS.
– Jednakże HALS jest bardziej odpowiednie dla pacjentów otyłych i w przypadku długich procedur operacyjnych, takich jak całkowita kolektomia.
Wnioski
HAL sigmoid colectomy łączy w sobie zalety operacji laparoskopowej (minimalnie inwazyjnej), jak również konwencjonalnej operacji otwartej z przywróceniem czucia dotykowego sprzężenia zwrotnego, bezpieczną dysekcją palcami i szybką kontrolą wypadków krwawienia. Ponieważ pod koniec całkowicie laparoskopowej kolektomii konieczna jest rana brzuszna w celu pobrania materiału, dostęp ten może być wykonany i wykorzystany we wczesnym etapie zabiegu, co ułatwia dysekcję i skraca czas operacji. W przypadku tej hybrydowej procedury krzywa uczenia się jest bardzo krótka, ponieważ większość problemów technicznych, takich jak obsługa długiej okrężnicy i podwiązanie wielu dużych naczyń, które są związane z kolektomią laparoskopową, zostały przezwyciężone. Chirurgia laparoskopowa z ręcznym wspomaganiem jest zalecana jako uzupełnienie i „pomost” w kierunku procedur całkowicie laparoskopowych.
Konflikt interesów
Autor nie ma żadnego konfliktu interesów ani ujawnienia finansowego do zgłoszenia. Jednakże autor prowadził warsztaty chirurgii laparoskopowej z ręcznym wspomaganiem, które były sponsorowane przez Ethicon Endosurgery (Johnson and Johnson Middle East).
- Cooperman AM, Katz V, Zimmon D, Botero G (1991) Laparoscopic colon resection: A case report. J Laparoendosc. Surg1: 221-24.
- Meshikhes AWN (2010) Controversy of hand assisted laparoscopic colorectal surgery. World J Gastroenterol16:5662-8
- Targarona EM, Gracia E, Rodriguez M, Cerdan G, Balague C,et al. (2003)Hand assisted laparoscopic surgery. Arch Surg138:133-141.
- Jakimowicz JJ (2000) Will advanced laparoscopic surgery go hand-assisted? SurgEndosc14: 881-882.
- Katkhouda N, Lord RV (2000) Once more, with feeling: handoscopy or the rediscovery of the virtues of the surgeosn’s hand. SurgEndosc14:985-986.
- Guller U, Jain N, Hervy S, Purves H, Pietrobone R (2003) Laparoscopic vs. open colectomy: outcomes comparison based on large nationwide database. Arch Surg138:1179-86.
- Chung CC, Ng DC, Tsang WW, Tang WL, Yau KK,et al. (2007) Hand-assisted laparoscopic versus open right colectomy: a randomized controlled trial. Ann Surg246:728-733.
- Kang JC, Chung MH, Chao PC, Yeh CC, Hsiao CW,et al. (2004) Hand-assisted laparoscopic colectomy vs open colectomy: a prospective randomized study. SurgEndosc18:577-581.
- HALS Study Group (2000) Hand-assisted laparoscopic surgery vs standard laparoscopic surgery for colorectal disease. SurgEndosc14:896-901.
- Polle SW, van Berge Henegouwen MI, Slors JF, Cuesta MA, Gouma DJ (2008) Total laparoscopic restorative proctocolectomy: are there advantages compared with the open and hand-assisted approaches? Dis Colon Rectum51:541-548.
- Marcello PW, Fleshman JW, Milsom JW, Read TE, Arnell TD,et al. (2008) Hand-assisted laparoscopic vs. laparoscopic colorectal surgery: a multicenter, prospective, randomized trial. Dis Colon Rectum51:818-826.
- Targarona EM, Gracia E, Garriga J, Marti´nez-Bru C, Cortes M,et al.(2002) Prospective, randomized trial comparing conventional laparoscopic colectomy with hand-assisted laparoscopic colectomy: applicability, immediate clinical outcome, inflammatory response and cost. SurgEndosc16: 234-239.
- Tjandra JJ, Chan MK, Yeh CH (2008) Laparoscopic- vs. hand-assisted ultralow anterior resection: a prospective study. Dis Colon Rectum51:26-31.
- Hassan I, You YN, Cima RR, Larson DW, Dozois EJ,et al. (2008) Hand-assisted versus laparoscopic-assisted colorectal surgery: Practice patterns and clinical outcomes in a minimally-invasive colorectal practice. SurgEndosc. 22:739-743.
- Meshikhes AWN, El Tair M, Al Ghazal T (2011)Hand-assisted laparoscopic colorectal surgery: initial experience of a single surgeon.Saudi J Gastroenterol17:16-9.
.
Dodaj komentarz