Clostridium difficile ” Bakterie Gram-dodatnie ” Słownik profilów patogenów
On 21 grudnia, 2021 by adminClostridium difficile
Clostridium difficile jest Gram-dodatnią, wytwarzającą toksyny bakterią beztlenową należącą do rodziny Clostridiaceae z Clostridiales. Chociaż C. difficile nie toleruje tlenu, w niekorzystnych warunkach jest w stanie wytworzyć spory zdolne do przetrwania w otwartym środowisku przez wiele lat. C. difficile jest gatunkiem komensalistycznym, który zazwyczaj występuje we florze bakteryjnej jelita grubego u niewielkiej grupy dzieci, a liczba nosicieli maleje wraz z wiekiem dzieci (Kelly i LaMont, 1998). Gdy występuje w niewielkiej liczbie, organizm ten pozostaje niepatogenny. Jednakże, gdy uda mu się skolonizować i uzyskać większe populacje, jego patogenność staje się główną przyczyną różnych zakażeń jelita grubego.
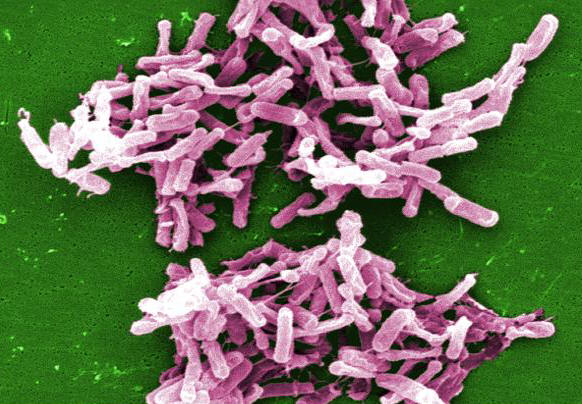
Rysunek 1. Mikrograf przedstawia bakterie Clostridium difficile wyhodowane z próbki stolca.
Zakażenie C. difficile powstaje w sposób oportunistyczny; normalna mikroflora w jelitach stanowi element obrony organizmu przed chorobotwórczą dominacją i dlatego masowa kolonizacja C. difficile występuje zwykle u osób, u których typowa flora jelita grubego została zaburzona w wyniku stosowania antybiotyków, u osób z obniżoną odpornością (chorych na AIDS lub raka) lub u osób przyjmujących tzw. środki oczyszczające jelita.
Wrodzona patogenność C. difficile polega na jego zdolności do wytwarzania toksyn. W szczególności, patogen ten wytwarza dwie silne cytotoksyny, mianowicie toksynę A i toksynę B, które ostatecznie prowadzą do zakażeń i chorób związanych z C. difficile (Mylonakis i in., 2001).
Toksyny A i toksyna B są glukozylotransferazami, które namierzają i unieczynniają enzymy GTPazy z rodziny Rho. Toksyna A indukuje depolimeryzację aktyny poprzez mechanizm skorelowany z obniżeniem ADP-rybozylacji niskocząsteczkowych białek Rho wiążących GTP. Opisano również inną toksynę, toksynę binarną, ale jej rola w chorobie nie jest jeszcze w pełni poznana. Ostatecznie prowadzi to do degradacji składników komórki nabłonkowej i nieuchronnej śmierci komórki. Dodatkowo, obie toksyny wywołują silną komórkową reakcję zapalną i masowe uwalnianie cytokin, jak również aktywują jelitowy układ nerwowy, przyciągając neutrofile do danego miejsca (Jefferson et al., 1999). Ogólnym skutkiem wytwarzania toksyny A i toksyny B jest uszkodzenie błony śluzowej okrężnicy i stan zapalny.
C. difficile przenosi się z człowieka na człowieka drogą fekalno-oralną. Ponieważ organizm tworzy odporne na ciepło przetrwalniki, może przez długi czas pozostawać w środowisku szpitala lub domu opieki. Można go wyhodować z prawie każdej powierzchni w szpitalu. Po spożyciu zarodników, przechodzą one przez żołądek bez szwanku z powodu ich kwasoodporności. W wyniku kontaktu z kwasami żółciowymi kiełkują w komórkach wegetatywnych w jelicie grubym i namnażają się.
Zakażenie wywołane przez C. difficile jest zazwyczaj ograniczone do dolnych
obszarów jamy brzusznej przewodu pokarmowego; objawy kliniczne zakażenia C. difficile różnią się pod względem ciężkości, od biegunki do ostrego zapalenia okrężnicy prowadzącego do śmierci. Pseudobłoniaste zapalenie jelita grubego (Pseudomembranous colitis – PMC) jest schorzeniem najczęściej kojarzonym z C.difficile, ponieważ w każdym przypadku zostało ono bezpośrednio powiązane z niemal wyłącznie inną przyczyną niż C.difficile. PMC charakteryzuje się postępującą biegunką, w wyniku której dochodzi do poważnego zapalenia błony śluzowej jelita grubego. Wraz z takimi objawami jak biegunka, gorączka, rozdęcie i ból brzucha dochodzi do tworzenia się błony rzekomej. Ta pseudobłonka składa się z różnych składników komórkowych, w tym fibryny, śluzu, resztek martwych komórek i leukocytów. Pseudomembrany pojawiają się w różnych miejscach ścian okrężnicy, a w przypadkach śmiertelnych tworzą osłonę na całej błonie śluzowej okrężnicy (Mylonakis i in., 2001).
Pseudobłoniaste zapalenie jelita grubego wywołane przez C. difficile leczy się specyficznymi antybiotykami, takimi jak wankomycyna lub metronidazol. W celu ograniczenia powikłań, lekarze często rozpoczynają leczenie na podstawie obrazu klinicznego, zanim dostępne są ostateczne wyniki. Znajomość lokalnej epidemiologii flory jelitowej w danej instytucji może ukierunkować terapię. Ponadto, doustna terapia nawadniająca jest przydatna w zatrzymywaniu płynów w czasie trwania biegunki. Co ciekawe, niektóre środki dezynfekcyjne powszechnie stosowane w szpitalach mogą być nieskuteczne w zwalczaniu przetrwalników C. difficile, a nawet mogą sprzyjać tworzeniu się przetrwalników. Jednakże, środki dezynfekujące zawierające wybielacz skutecznie zabijają organizmy i powinny być stale stosowane jako środki odkażające.
Hodowle laboratoryjne i procedury barwienia metodą Grama są uważane za zbyt mało specyficzne, aby zidentyfikować C. difficile w sytuacjach klinicznych, ze względu na podobieństwo morfologiczne do innych gatunków Clostridia, które tworzą normalną mikroflorę okrężnicy. Typowe testy diagnostyczne określają obecność produkcji toksyny A lub toksyny B (Mylonakis i in., 2001). Oznaczenie cytotoksyczności toksyny B w hodowli tkankowej pozostaje jednym z najczulszych i najdokładniejszych testów diagnostycznych. Enzyme-linked immunosorbent assays (ELISA) są również w stanie zidentyfikować toksynę A i/lub toksynę B w stolcu, które są szybkie, specyficzne i najczęściej stosowane w diagnostyce klinicznej domniemanych zakażeń C. difficile.
Jefferson, K.K., Smith, M.F. Jr, & Bodak, D.A. (1999). Roles of intracellular calcium and NF-kappa B in the Clostridium difficile toxin A-induced up-regulation and secretion of IL-8 from human monocytes. Journal of Immunology, 163: 5183-5191.
Kelly, C.P. & LaMont, T. (1998). Zakażenie Clostridium difficile. Annual Review of Medicine, 49: 375-390.
Mylonakis, E., Ryan, E.T., & Calderwood, S.B. (2001). Clostridium difficile-Associated Diarrhea. Archives of Internal Medicine, 161: 525-533.
Dodaj komentarz