Assessing Cell Health: Viability and Proliferation
On 11 października, 2021 by adminCzęść I: Viability and Proliferation Assays
Viability and Proliferation
Żywotność i proliferacja są dwiema odrębnymi cechami komórek. Żywotność jest miarą liczby żywych komórek w populacji, podczas gdy proliferacja jest miarą podziału komórek. Należy zauważyć, że nie wszystkie komórki zdolne do życia dzielą się. Chociaż proliferacja może być łatwo interpretowana jako żywotność, brak proliferacji nie powinien być automatycznie traktowany jako oznaka śmierci komórki.
Ocena żywotności i proliferacji
1. Przepuszczalność membran
Cechą charakterystyczną martwych i umierających komórek jest rozpad błon komórkowych i jądrowych. Wiele analiz żywotności wykorzystuje tę cechę śmierci komórki w celu odróżnienia komórek żywotnych od nieżywotnych.
Polarne, nieprzepuszczalne dla komórek barwniki kwasu nukleinowego, takie jak DAPI, jodek propidium (PI) oraz 7-AAD barwią martwe komórki, ponieważ barwniki te mogą wniknąć jedynie do komórek z uszkodzonymi błonami. PI wiąże zarówno RNA, jak i DNA, podczas gdy 7-AAD i DAPI oddziałują tylko z DNA. Barwniki te mogą być stosowane w połączeniu z analizami, które wykrywają aktywność enzymatyczną, takimi jak substraty esteraz omówione w następnej sekcji, lub z przepuszczalnymi dla komórek wskaźnikami żywotności w celu jednoczesnego znakowania żywych i martwych komórek. Oznaczenia PI, DAPI i 7-AAD mogą być odczytywane przy użyciu mikroskopu fluorescencyjnego, cytometru przepływowego (rysunek 1) lub czytnika mikropłytek.
A.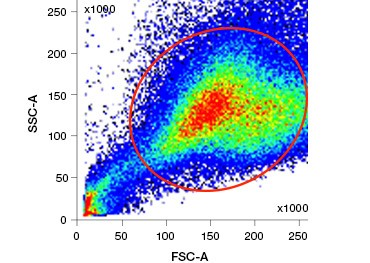
B.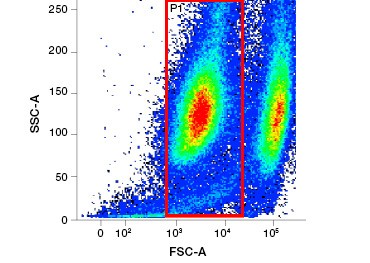
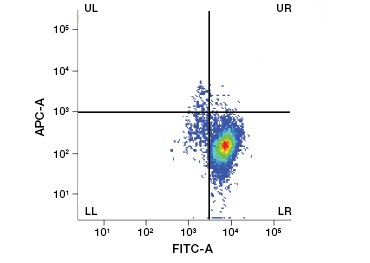
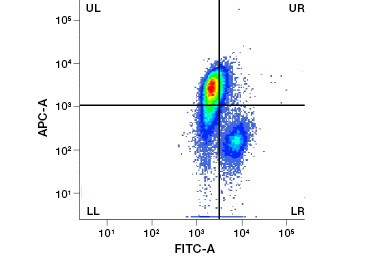
Rysunek 1. Barwienie jodkiem Propidium poprawia identyfikację komórek zainteresowania. Bramkowanie żywych komórek przy użyciu rozpraszania w przód i w bok może nie wystarczyć do usunięcia martwych komórek i nadal może być obecne wiązanie niespecyficzne (A). Użycie barwników żywotności takich jak jodek propidium może pomóc wyeliminować niespecyficzne wiązanie (B). Makrofagi J774 zostały wybarwione na CD11b i CD3, przy czym czerwone kółko i prostokąt wskazują strategię bramkowania dla żywych komórek.
Odmierzanie czasu jest krytyczne przy użyciu tych barwników, ponieważ frakcja wybarwionych komórek wzrasta podczas wybarwiania, ponieważ komórki nadal umierają. Należy zauważyć, że żaden z tych barwników nie jest możliwy do utrwalenia. Do zastosowań wymagających utrwalenia doskonałym wyborem są monoazidy etydyny lub aminoreaktywne barwniki białkowe.
Nieprzepuszczalne dla komórek barwniki białkowe są świetną alternatywą dla barwników kwasów nukleinowych, ponieważ są mniej toksyczne. Barwniki aminoreaktywne występują w szerokim zakresie widm wzbudzenia i emisji, co pozwala na większą elastyczność w projektowaniu paneli cytometrii przepływowej i mikroskopii niż barwniki DNA. Inną zaletą tych barwników białkowych jest to, że są one utrwalane (rysunek 2).
A.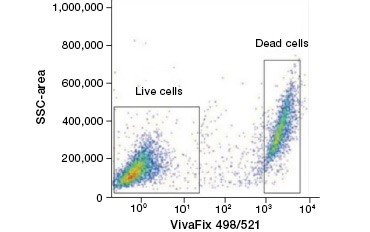
B.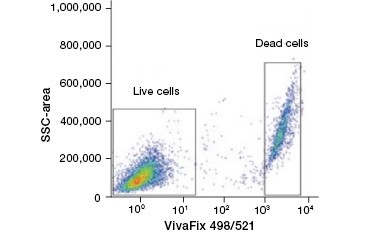
Fig. 2. Barwienia białkowe pozwalają odróżnić komórki żywe od martwych. Przy użyciu testów żywotności komórek VivaFix™, żywe i martwe populacje komórek mogą być zidentyfikowane, a następnie analizowane w utrwalonych (A) i nieutrwalonych (B) komórkach przy użyciu cytometrii przepływowej.
Specjalną uwagę przy użyciu powszechnie stosowanego barwnika białkowego błękitu trypanu należy zwrócić na fakt, że barwnik ten wybarwia żywe komórki w sposób specyficzny dla danej komórki. Dlatego krytyczna jest optymalizacja protokołów błękitu trypanu dla każdego typu komórek i eksperymentu.
Wszystkie te barwniki mogą być stosowane na pojedynczych komórkach i tkankach i oceniane przy użyciu mikroskopii fluorescencyjnej lub cytometrii przepływowej, chociaż barwienie błękitem trypanu jest częściej oceniane przez ręczne liczenie komórek przy użyciu hemocytometru i mikroskopu.
W przeciwieństwie do barwników kwasu nukleinowego nieprzepuszczalnych dla komórek, barwniki kwasu nukleinowego przepuszczalne dla komórek, takie jak oranż akrydynowy, łatwo dyfundują przez błony komórkowe i w ten sposób barwią DNA komórek zdolnych do życia. Komórki nieżywotne nie są skutecznie wybarwiane, ponieważ ich uszkodzone błony pozwalają barwnikowi łatwo z nich dyfundować. Oranż akrydynowy jest barwnikiem o podwójnej fluorescencji, który emituje zieloną fluorescencję, gdy wiąże się z dsDNA i czerwoną fluorescencję, gdy wiąże się z ssDNA i RNA. Używając oranżu akrydynowego jako barwnika wiążącego DNA, należy pamiętać, że nie wiąże on wydajnie skondensowanej chromatyny. Jak omówiono w sekcji 6, barwnik ten może być również wykorzystany do oceny zdolności komórek do utrzymania kwaśnego pH w lizosomach, co jest kolejnym wskaźnikiem żywotności komórek. Barwniki kwasu nukleinowego przepuszczalne dla komórek mogą być używane do identyfikacji i ilościowego określenia populacji komórek zdolnych do życia przez mikroskopię, cytometrię przepływową lub oznaczenia mikropłytkowe.
Barwniki nieprzepuszczalne i przepuszczalne dla komórek mogą być używane w połączeniu z przeciwciałami znakowanymi fluorescencyjnie przeciwko białkom będącym przedmiotem zainteresowania, co sprawia, że łatwo jest włączyć kluczowe kontrole żywotności do każdego eksperymentu. Kluczową kwestią przy użyciu tych barwników do oceny integralności błon jest to, że różne typy komórek mają różne charakterystyki przepuszczalności błon. Na przykład, niektóre nieprzepuszczalne dla komórek barwniki DNA łatwo wybarwiają martwe komórki eukariotyczne, ale nie są w stanie wybarwić prokariotów z uszkodzonymi błonami.
Integralność błon może być również oceniana przy użyciu testów enzymatycznych. Popularnym wyborem jest ocena wycieku cytoplazmatycznego enzymu dehydrogenazy mleczanowej (LDH) do medium hodowlanego przy śmierci komórki. Oznaczenia kolorymetryczne LDH mogą być przeprowadzane w formacie mikropłytki i odczytywane przy użyciu czytnika mikropłytek ELISA.
Dezintegracja błony może być również mierzona przy użyciu oznaczeń uwalniania chromu. Tutaj komórki są wstępnie znakowane 51Cr przed eksperymentalnym traktowaniem. Chrom wiąże się z białkami komórkowymi i jest uwalniany do medium hodowlanego po śmierci komórki. Poprzez określenie ilości wolnego w stosunku do związanego 51Cr, przy użyciu licznika scyntylacyjnego, śmierć komórki może być mierzona ilościowo. Komórki mogą być również wstępnie znakowane barwnikami fluorescencyjnymi. Metody te czasami cierpią z powodu wysokiego tła z powodu spontanicznego uwalniania etykiet; są one użyteczne jedynie w przypadku zastosowań, które pozwalają na wstępne znakowanie komórek zainteresowania.
2. aktywność enzymatyczna
Innym kluczowym rozróżnieniem między komórkami żywotnymi i nieżywotnymi jest to, że komórki żywotne są aktywne enzymatycznie. Aktywność esterazy, mierzona przy użyciu substratów takich jak diacetat karboksyfluoresceiny (CFDA), jest powszechnie stosowana jako wskaźnik ogólnej aktywności enzymatycznej. CFDA jest niefluorescencyjnym, przepuszczalnym dla komórek barwnikiem, który jest hydrolizowany w celu utworzenia fluorescencyjnej cząsteczki karboksyfluoresceiny przez niespecyficzne wewnątrzkomórkowe esterazy obecne jedynie w żywych komórkach. Ponieważ karboksyfluoresceina jest naładowana ujemnie, jest ona zatrzymywana niekowalencyjnie w żywych komórkach, co powoduje zieloną fluorescencję.
CFDA-SE jest pochodną CFDA, która jest lepiej zatrzymywana po hydrolizie. Jego produkt, CFSE, posiada grupy estrowe sukcynimidylu, które tworzą kowalencyjne wiązania z pierwszorzędowymi aminami białek wewnątrzkomórkowych, umożliwiając długotrwałe śledzenie żywotności komórek. Ponieważ CFSE jest kowalencyjnie zatrzymywana w komórkach, jest bardziej wiarygodnym wskaźnikiem żywotności komórek i popularną miarą proliferacji komórek, ponieważ jej fluorescencja zmniejsza się o połowę przy każdym podziale komórki (rysunek 3). Udoskonalenia CFDA-SE zostały wprowadzone z barwnikami proliferacyjnymi, które mają większą retencję komórek, zapewniają większą rozdzielczość podziałów komórkowych i są dostępne w szerokim zakresie widm wzbudzenia i emisji, aby umożliwić włączenie do wielokolorowych aplikacji fluorescencyjnych, takich jak cytometria przepływowa.
A.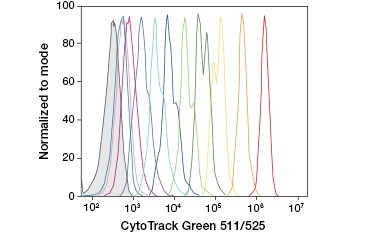
B.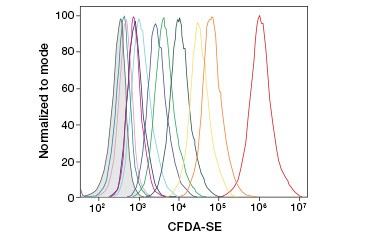
Fig. 3. Śledzenie pokoleń komórek za pomocą cytometrii przepływowej. Dziesięć generacji komórek można śledzić przy użyciu CytoTrack™ Green 511/525 Cell Proliferation Assay (A) i do ośmiu przy użyciu CFDA-SE (B).
Wiele innych fluorescencyjnych substratów esterazy, takich jak pochodne kalceiny i BCECF, jest dostępnych z różnymi właściwościami, w tym różnicami w widmach wzbudzenia/emisji. Ponieważ fluorescencja BCECF jest wrażliwa na pH, może ona również śledzić zmiany w cytozolowym pH.
Używając przepuszczalnych dla komórek substratów esterazowych, żywotność może być oceniana za pomocą mikroskopii fluorescencyjnej i cytometrii przepływowej. Substraty te mogą być również stosowane do próbek tkanek lub wykorzystywane w wysokowydajnych analizach mikropłytkowych.
3. Aktywność metaboliczna
Inną powszechnie stosowaną miarą żywotności komórek jest aktywność metaboliczna, która może być oceniana przy użyciu sond utleniających i redukujących.
Resuryna jest popularnym wskaźnikiem utleniania-redukcji (redoks). Ten przepuszczalny dla komórek barwnik może być dodawany bezpośrednio do pożywek hodowli komórkowych, co czyni go szybkim i wygodnym testem. W komórkach aktywnych metabolicznie, niebieska i słabo fluoryzująca resazuryna jest redukowana do postaci resorufinu, różowej i silnie fluoryzującej cząsteczki. Zmiana ta może być monitorowana zarówno przy użyciu testów fluorescencyjnych, jak i kolorymetrycznych. Ponieważ ilość fluorescencji jest wprost proporcjonalna do liczby żywych, oddychających komórek, rezazuryna jest szeroko stosowana do ilościowego pomiaru żywotności komórek. Resazuryna jest wygodną, bardziej czułą, stabilną i nietoksyczną alternatywą dla innych wskaźników redoks, takich jak sole tetrazolowe MTT i XTT. W przeciwieństwie do testów opartych na soli tetrazolowej, które są kolorymetryczne i mogą być odczytywane tylko za pomocą czytnika mikropłytek, testy żywotności Resazurin mogą być odczytywane za pomocą cytometrii przepływowej lub mikroskopu fluorescencyjnego. Resazuryna i sole tetrazolowe są szczególnie przydatne do zastosowań o dużej wydajności, ponieważ żywotność można oceniać w mikropłytkach przy użyciu czytnika mikropłytek (rysunek 4). XTT jest często wybierany zamiast MTT do zastosowań o dużej wydajności, ponieważ w przeciwieństwie do MTT daje barwnik rozpuszczalny w wodzie, eliminując w ten sposób etap rozpuszczania, który jest kluczowy dla testów MTT. Resazuryna i sole tetrazolowe są najczęściej stosowane do oceny żywotności komórek przylegających i komórek w roztworze.
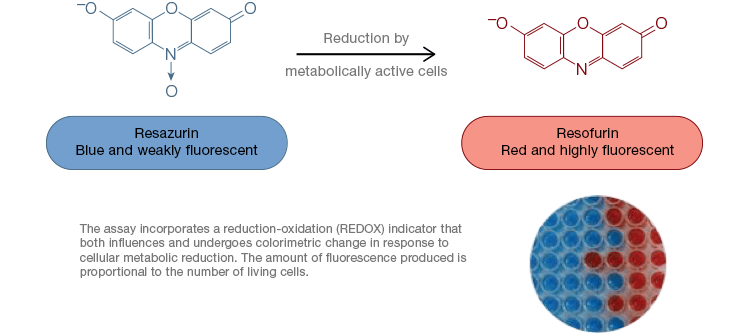
Fig. 4. Nietoksyczne testy utleniania rezazuryny są łatwo skalowalne do zastosowań o wysokiej wydajności. Utlenianie alamarBlue w aktywnych metabolicznie komórkach powoduje kolorymetryczną zmianę z niebieskiego na czerwony, jak również wzrost fluorescencji.
Dihydrohodaminy, -kalceiny i -fluoresceiny są zredukowanymi pochodnymi rodaminy, -kalceiny i -fluoresceiny, które przepuszczają komórki i są bezbarwne. Związki te są łatwo utleniane do ich fluorescencyjnego barwnika macierzystego przez reaktywne formy tlenu obecne w żywych komórkach i tkankach.
Inną klasą oznaczeń żywotności, które mierzą aktywność metaboliczną są luminescencyjne oznaczenia ATP. Ilościowo określają one ATP uwalniany przez komórki w momencie lizy. Nie wymagają one długich okresów inkubacji, są niezwykle czułe i są powszechnie odczytywane przy użyciu czytnika mikropłytek.
Jednym z czynników do rozważenia przy stosowaniu oznaczeń, które mierzą aktywność metaboliczną jest to, że aktywność metaboliczna może się różnić w różnych warunkach hodowli komórkowej. Właściwe kontrole muszą więc być włączone, aby uwzględnić te różnice.
4. synteza/replikacja DNA
Inną miarą żywotności i popularną metodą oceny proliferacji jest kwantyfikacja inkorporacji BrdU do nowo syntetyzowanego DNA. DNA zawierające BrdU jest identyfikowane przy użyciu sprzężonych przeciwciał BrdU lub przeciwciał BrdU w połączeniu ze sprzężonym przeciwciałem drugorzędowym (Rysunek 5). Te oznaczenia umożliwiają różnorodne odczyty, ponieważ przeciwciała mogą być sprzężone z różnymi rodzajami wskaźników (fluorofory, peroksydazy itd.). Znakowanie przeciwciałami specyficznych markerów komórkowych pozwala również na wyróżnienie specyficznych populacji proliferujących. Próbki są utrwalane po inkubacji, a następnie analizowane przy użyciu cytometrii przepływowej, mikroskopii fluorescencyjnej, immunohistochemii lub czytników mikropłytek. Używając cytometrii przepływowej, komórki mogą być przypisane do fazy G0/G1, S, lub G2/M cyklu komórkowego na podstawie ich całkowitej zawartości DNA. Użycie chromogennych substratów peroksydazowych pozwala na odczyt testów bez użycia fluorometru. A dzięki zastosowaniu -TdR zamiast BrdU, oznaczenia te można przekształcić w odczyty z użyciem radioznacznika.
A.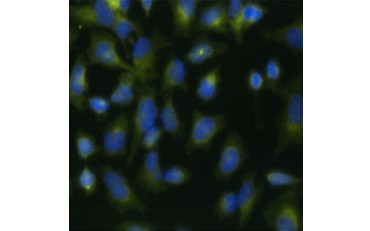
B.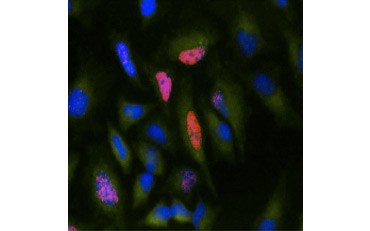
Fig. 5. Wizualizacja inkorporacji BrdU. Komórki HeLa traktowano 10 µg BrdU przez 1 godz. (B) lub pozostawiono bez leczenia (A). Komórki barwiono przeciwciałem Mouse Anti-BrdU Antibody, clone Bu20a (MCA2483; rozcieńczenie 1:25), a jako przeciwciało drugorzędowe stosowano przeciwciało Goat Anti-Mouse IgG (H/L) DyLight 549 Conjugated Antibody (red) (STAR117D549GA; rozcieńczenie 1:50). Cytoplazmę barwiono przeciwciałem Rabbit Anti-GAPDH Antibody (AHP1628; rozcieńczenie 1:100) i Sheep Anti-Rabbit IgG DyLight 488 Conjugated Antibody (green) (STAR36D488GA; rozcieńczenie 1:50) jako przeciwciałem wtórnym. PureBlu™ DAPI (1351303) użyto jako przeciwbarwnika jądrowego.
5. Ekspresja markerów proliferacji
Wiadomo, że niektóre białka zwiększają swoją ekspresję podczas proliferacji komórek. Ki-67, na przykład, ulega ekspresji w jądrze dzielących się komórek, ale nie jest wykrywalny podczas G0 i G1 (rysunek 6). Podobnie, fosforylacja histonu H3 może być wykorzystana do identyfikacji komórek w fazie M. Inne powszechnie stosowane markery proliferacji obejmują antygen jądrowy komórek proliferujących (PCNA) oraz konserwację minichromosomów 2 (MCM2). Wykorzystanie przeciwciał przeciwko tym, innym kluczowym markerom proliferacji lub markerom linii komórkowej może być ocenione przy użyciu ELISA, cytometrii przepływowej, immunohistochemii, mikroskopii fluorescencyjnej oraz Western blotting.
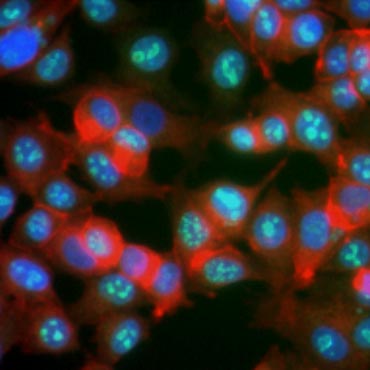
Fig. 6. Przeciwciała przeciwko Ki-67 identyfikują komórki proliferujące. Barwienie komórek MCF-7 ludzkimi przeciwciałami przeciwko Ki-67 (HCA006, zielone) barwionymi falloidyną (czerwone) i Hoechstem (niebieskie).
6. Potencjał błonowy i pH
Żywe komórki aktywnie utrzymują gradienty jonów w swoich błonach, generując potencjały transmembranowe. Kiedy komórka umiera, te gradienty jonowe są zaburzone. Może to być oceniane przy użyciu barwników potencjometrycznych. JC-1 jest powszechnie stosowanym barwnikiem potencjometrycznym. W zdrowych komórkach JC-1 lokalizuje się w mitochondriach, gdzie tworzy czerwone fluorescencyjne agregaty. Po załamaniu potencjału błony mitochondrialnej, JC-1 dyfunduje w całej komórce i występuje jako zielony fluoryzujący monomer. Estry etylowe tetrametylodaminy (TMRE) i estry metylowe tetrametylodaminy (TMRM), podobnie jak JC-1, lokalizują się w mitochondriach zdrowych komórek i w cytoplazmie komórek umierających. W przeciwieństwie do JC-1 barwniki te nie wykazują przesunięcia w swoim widmie emisyjnym. Zamiast tego, permeabilizacja zewnętrznej błony mitochondrialnej skutkuje zmniejszeniem czerwonej fluorescencji TMRM/TMRE.
Żywe komórki są w stanie generować i utrzymywać niskie pH w kwaśnych organellach komórki, takich jak lizosom. Może to być mierzone przy użyciu barwników kwasotropowych, takich jak oranż akrydynowy i czerwień obojętna. Jednym z czynników branych pod uwagę przy stosowaniu oranżu akrydynowego jest fakt, że barwnik ten wiąże również DNA i RNA. Po związaniu z jednoniciowymi nukleotydami, oranż akrydynowy fluoryzuje na czerwono; po związaniu z dwuniciowym DNA, fluoryzuje na zielono; a po związaniu z DNA w lizosomie, fluoryzuje na pomarańczowo.
Niezależnie od wybranej metody, krytycznie ważne jest włączenie odpowiednich kontroli podczas wykonywania któregokolwiek z opisanych tutaj oznaczeń, ponieważ warunki doświadczalne i typ komórki mogą zmienić wyniki niektórych oznaczeń. Zawsze dołączaj kontrole pozytywne i negatywne. W przypadku stosowania sond w rozpuszczalnikach, należy również dołączyć kontrole traktowane nośnikiem w celu uwzględnienia wpływu rozpuszczalnika. Używaj kontroli specyficznych dla aplikacji, aby kontrolować takie czynniki jak autofluorescencja w eksperymentach immunofluorescencji i cytometrii przepływowej oraz kontroli ładunku w Western blotting.
Aby uzyskać informacje na temat testów żywotności i proliferacji komórek firmy Bio-Rad, odwiedź naszą stronę poświęconą zdrowiu komórek.
Przeczytaj część II Ocena zdrowia komórek: Apoptosis
alamarBlue jest znakiem towarowym firmy Trek Diagnostic Systems. DyLight jest znakiem towarowym firmy Thermo Fisher Scientific.
.
Dodaj komentarz