A meta-analysis of metronidazole and vancomycin for the treatment of Clostridium difficile infection, stratified by disease severity | The Brazilian Journal of Infectious Diseases
On 20 stycznia, 2022 by adminIntroduction
Zakażenie Clostridium difficile (CDI) jest powszechne w placówkach służby zdrowia w całym rozwiniętym świecie1 i może prowadzić do poważnych powikłań, dłuższego pobytu w szpitalu oraz dodatkowych kosztów medycznych.2 W ciągu ostatnich 15 lat w Europie, Kanadzie i Stanach Zjednoczonych nastąpił znaczny wzrost zachorowalności i śmiertelności z powodu CDI. Wzrost ten był spowodowany głównie pojawieniem się nowego, hiperwirulentnego szczepu BI/NAP1/027, który pojawił się odpowiednio w 2003 roku w Ameryce Północnej i 2005 roku w Europie. Dane pochodzące z 28 szpitali gminnych w południowych Stanach Zjednoczonych sugerują, że C. difficile zastąpiła metycylinoopornego Staphylococcus aureus jako najczęstszą etiologię zakażeń związanych z opieką zdrowotną.3 Metronidazol i wankomycyna są najczęściej stosowanymi antybiotykami w leczeniu CDI, których skuteczność historycznie uważano za podobną.4,5 W 1995 roku Centers for Disease Control and Prevention of the United States zaleciło ograniczenie stosowania wankomycyny w szpitalach, ponieważ może ona przyczyniać się do zwiększenia częstości występowania Enterokoków opornych na wankomycynę (VRE).6 Od tego czasu metronidazol był powszechnie stosowany jako lek pierwszego rzutu w leczeniu CDI. Wraz z pojawieniem się i rozpowszechnieniem hiperwirulentnego szczepu C. difficile (BI/NAP1/027), zakażenia stały się cięższe i porównanie metronidazolu i wankomycyny zostało ponownie ocenione,7,8 zwłaszcza w przypadku leczenia pacjentów z ciężkim CDI. Zar i wsp. przeprowadzili pierwsze prospektywne, randomizowane, podwójnie zaślepione, kontrolowane placebo, jednoośrodkowe badanie porównujące metronidazol i wankomycynę w leczeniu CDI. Wyniki wykazały, że metronidazol i wankomycyna były równie skuteczne, ale wankomycyna była lepsza u pacjentów z ciężką postacią CDI.9 Wyniki badania miały ogromne znaczenie i przyczyniły się do uaktualnienia wytycznych praktyki klinicznej. Wytyczne zalecały stosowanie metronidazolu w przypadku łagodnego do umiarkowanego CDI, a wankomycyny w przypadku ciężkiego CDI, co było określane na podstawie nasilenia objawów.10-13 Jednak w badaniu przeprowadzonym przez Zar i wsp, 22 uczestników wyłączono z analizy, a w ścisłej analizie ITT wszystkich 82 losowo przydzielonych pacjentów z ciężką postacią choroby początkowy odsetek wyleczeń nie różnił się istotnie między wankomycyną a metronidazolem (79% vs. 66%, p=0,22).3,14 Następnie Le i wsp. odnotowali wyższy odsetek odpowiedzi klinicznej u pacjentów z ciężką postacią choroby, u których stosowano wankomycynę, ale tylko mniejszość pacjentów otrzymywała wankomycynę (n=8).15 Ostatnio Johnson i wsp. odnotowali podobne wskaźniki sukcesu klinicznego u pacjentów z ciężką postacią CDI u pacjentów leczonych wankomycyną lub metronidazolem, ale metronidazol był gorszy od wankomycyny u wszystkich pacjentów z CDI.16 Ponadto Pepin i wsp. zasugerowali, że utrata przewagi wankomycyny nad metronidazolem zbiegła się w czasie z pojawieniem się NAP1/027.17 Dlatego przeprowadziliśmy metaanalizę stratyfikującą pacjentów w zależności od ciężkości choroby, aby zbadać skuteczność metronidazolu w porównaniu z wankomycyną oraz zbadać, który środek był lepszy w leczeniu łagodnej lub ciężkiej choroby.
Materiały i metodyŹródła danych
W celu identyfikacji odpowiednich badań przeprowadzono systematyczne przeszukiwanie literatury w MEDLINE poprzez Pubmed (1978 do 31 października 2014), Embase (1978 do 31 października 2014) oraz Cochrane Central Register of Controlled Trials (biblioteka Cochrane). Kluczowymi hasłami wyszukiwania były „metronidazol i wankomycyna a clostridium difficile”; „metronidazol i wankomycyna a rzekomobłoniaste zapalenie jelita grubego”; „metronidazol i wankomycyna a biegunka związana z antybiotykami”. Wszystkie odnośniki do zidentyfikowanych artykułów, w tym odpowiednie prace przeglądowe, zostały ręcznie wyszukane i przejrzane. Abstrakty prezentowane na konferencjach naukowych, które były dla nas niedostępne, nie były wyszukiwane.
Wybór badań
Dwóch recenzentów (X.ZH.D i N.B.) niezależnie przeszukiwało artykuły i analizowało odpowiednie badania do dalszej oceny. Badanie uznawano za kwalifikujące się, jeśli było to RCT lub prospektywne badanie kohortowe, jeśli obejmowało dorosłych pacjentów z CDI, w tym z łagodną i/lub ciężką chorobą; jeśli badało bezpieczeństwo lub skuteczność metronidazolu i wankomycyny; jeśli podawało określone dane dotyczące wyleczenia klinicznego i mikrobiologicznego, śmiertelności i zdarzeń niepożądanych. Uwzględniano badania zaślepione lub niezaślepione oraz projekty randomizowane lub nierandomizowane. Wykluczono badania eksperymentalne oparte na zmiennych farmakokinetycznych lub farmakodynamicznych. Wykluczono również badania kliniczne obejmujące terapię skojarzoną.
Ocena jakościowa
Ocena jakości metodologicznej badań RCT i badań kohortowych włączonych do metaanalizy została przeprowadzona niezależnie przez dwóch recenzentów (X.ZH.D i N.B.) zgodnie z listą kontrolną opracowaną przez Downs i Black.18. Narzędzie to oceniało zarówno badania randomizowane, jak i nierandomizowane, zapewniając zarówno ogólną ocenę jakości badania, jak i profil ocen jakości raportowania, wiarygodności zewnętrznej, wiarygodności wewnętrznej (stronniczość, konfundacja) i mocy. Badania wysokiej jakości uzyskały 15 lub więcej punktów, natomiast badania niskiej jakości – 14 lub mniej punktów.
Eksploracja danych
Dwóch recenzentów niezależnie pobierało dane z każdego badania za pomocą przygotowanego wcześniej formularza. W przypadku jakichkolwiek rozbieżności zdań pomiędzy dwoma recenzentami, trzeci z nich dokonywał ekstrakcji danych aż do osiągnięcia konsensusu. Dane wyodrębnione z każdego badania obejmowały: (i) rok publikacji; (ii) populacja pacjentów; (iii) liczba pacjentów; (iv) stosowane środki przeciwdrobnoustrojowe i dawki; (v) wyniki kliniczne i mikrobiologiczne; oraz (vi) śmiertelność z wszystkich przyczyn. Zastosowaliśmy analizę ITT, zdefiniowaną jako włączenie wszystkich losowo przydzielonych pacjentów.
Analiza wyników
Wstępne wyleczenie kliniczne, trwałe wyleczenie, wyleczenie mikrobiologiczne, nawrót i śmiertelność z wszystkich przyczyn zostały użyte jako miary wyników w tej metaanalizie. Użyliśmy definicji początkowego wyleczenia klinicznego i nawrotu podanych w poszczególnych badaniach i odnotowaliśmy różnice między badaniami. Wyniki analizowano również w oparciu o następujące populacje: (i) wszyscy pacjenci, w tym pacjenci z łagodnym i ciężkim CDI; (ii) pacjenci z łagodnym CDI; (iii) pacjenci z ciężkim CDI; oraz (iv) pacjenci z rzekomobłoniastym zapaleniem jelita grubego (PMC).
Analiza danych i metody statystyczne
Analizy statystyczne przeprowadzono za pomocą programu Review Manager, wersja 5.2 (Cochrane Collaboration). Niejednorodność między badaniami oceniano testem heterogeniczności χ2 (p
0,05 oznaczało istotną heterogeniczność) oraz miarą niespójności I2. Zbiorcze współczynniki ryzyka (RR) i 95% przedziały ufności (CI) dla wyników obliczono za pomocą modelu fixed-effect (FEM), jeśli nie było statystycznie istotnej heterogeniczności wśród włączonych badań. W przeciwnym razie stosowano model REM (random-effect model). Analizy podgrup przeprowadzono w oparciu o stopień zaawansowania choroby.WynikiWybrane badania kliniczne
Schemat przepływu (ryc. 1) przedstawia szczegółowy proces przesiewania i selekcji badań włączonych do tej metaanalizy. W wyniku wyszukiwania literatury zidentyfikowano 2945 abstraktów. Do szczegółowej oceny otrzymaliśmy 47 pełnych prac. Spośród 41 wykluczonych badań, trzy artykuły zostały wykluczone, ponieważ były one częściami RCT już włączonych do tej metaanalizy, jedno badanie zostało wykluczone, ponieważ było to badanie farmakokinetyczne,19 inne badania zostały wykluczone z powodu różnych projektów badań, takich jak brak schematu kontroli, połączenie z innymi antybiotykami,20,21 różne wyniki,22 lub inny typ pacjentów,23 itp. W związku z tym do metaanalizy włączono ostatecznie sześć badań: dwa badania kohortowe15,24 i cztery RCT.4,5,9,16
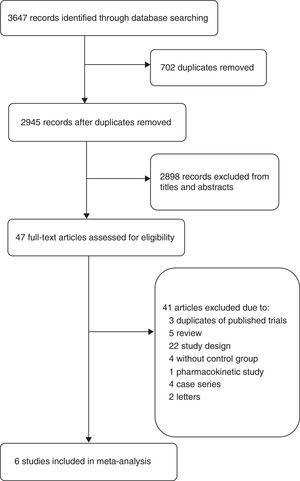
Flow diagram of included studies.
Charakterystyka badań
Główne cechy analizowanych badań przedstawiono w tabeli 1. Włączone badania charakteryzowały się wysoką jakością (dwa RCT uzyskały wynik 23, dwa wynik 20, a dwa badania kohortowe wynik 17). Dwa badania RCT przeprowadzono z zastosowaniem randomizacji, podwójnie ślepej próby i kontroli placebo,9,16 natomiast pozostałe dwa z zastosowaniem wyłącznie randomizacji.4,5 Trzy badania przeprowadzono w Stanach Zjednoczonych,4,9,15 dwa badania przeprowadzono w Austrii,5,24 natomiast jedno badanie obejmujące dwa badania RCT przeprowadzono odpowiednio w Stanach Zjednoczonych i Europie.16 Definicję CDI, początkowe wyleczenie kliniczne i nawrót choroby przedstawiono w tabeli 1. Definicja CDI niezmiennie obejmowała test na obecność toksyny C. difficile, mikroorganizmów lub PMC w połączeniu z biegunką. Jednakże, definicje biegunki różniły się nieznacznie, ale większość badań określała biegunkę jako nieuformowane stolce co najmniej trzy razy w ciągu 24 godzin.5,9,15,16 Wyniki początkowego wyleczenia klinicznego i nawrotu choroby zostały przedstawione we wszystkich badaniach, przy czym definicje różniły się nieznacznie. Na przykład, w pięciu badaniach4,5,9,15,16 za początkowe wyleczenie kliniczne uznano ustąpienie biegunki w ciągu 6-8 dni leczenia, podczas gdy Zar9 i Wenisch5 uwzględnili negatywny wynik pomiaru toksyny C. difficile lub białka C-reaktywnego. W większości przypadków za nawrót uznawano ponowne wystąpienie objawów i/lub potwierdzenie dodatnich wyników testów mikrobiologicznych podczas obserwacji trwającej 21-30 dni po początkowym ustąpieniu objawów.4,5,9,15,16 Trwałe wyleczenie zdefiniowano jako wyleczenie kliniczne przy braku nawrotów podczas obserwacji, które obliczono jako początkowe wyleczenie kliniczne minus nawroty. Powrót do zdrowia opisany przez Wenisch24 został uznany za trwałe wyleczenie. Pacjenci z umiarkowanym CDI w badaniu Johnsona i wsp. zostali uznani za pacjentów z ciężką chorobą, podczas gdy wszyscy pacjenci włączeni do badania Wenischa i wsp. zostali uznani za pacjentów z łagodną chorobą w oparciu o ocenę ciężkości CDI stosowaną w badaniach Zar9 i wytycznych.11. Ponadto Wenisch i wsp. nie wskazali przydziału do leczenia siedmiu pacjentów, którzy odpadli ze wszystkich grup,5 Johnson i wsp. podali, że analiza obejmowała wszystkich randomizowanych pacjentów, którzy otrzymali co najmniej jedną dawkę antybiotyków i mieli jakąkolwiek ocenę po podaniu dawki,16 co mogło wpłynąć na wyniki ITT.
Tabela uzupełniająca związana z tym artykułem znajduje się, w wersji online, pod adresem http://dx.doi.org/10.1016/j.bjid.2015.03.006.
Wstępne wyleczenie kliniczne
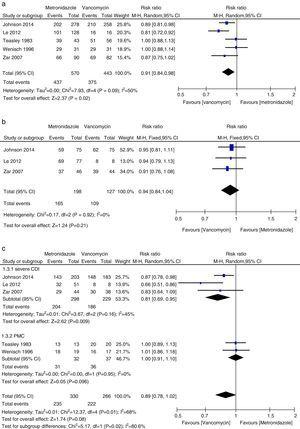
Meta-analiza początkowych wskaźników wyleczeń klinicznych porównująca metronidazol z wankomycyną dla wszystkich CDI, łagodnych CDI, ciężkich CDI i PMC.
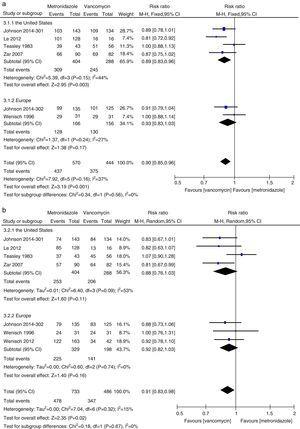
Meta-analiza wskaźników początkowego wyleczenia klinicznego i trwałego wyleczenia porównująca metronidazol z wankomycyną dla wszystkich pacjentów z CDI ze Stanów Zjednoczonych i Europy.
Podtrzymane wyleczenie Częstość nawrotów Wyleczenie mikrobiologiczne
Dwa istotne RCT podały wskaźniki wyleczenia mikrobiologicznego, zdefiniowane jako ujemne wyniki kontrolnej hodowli stolca po leczeniu i oznaczenia cytotoksyn w kierunku C. difficile u pacjentów leczonych bez objawów klinicznych.4,5 Jeśli chodzi o wyleczenie mikrobiologiczne, terapia metronidazolem była równie skuteczna jak terapia wankomycyną (161 pacjentów, FEM, RR=0,88, 95% CI=0,64-1,21, p=0,43, ryc. 6).

Meta-analiza wyleczeń mikrobiologicznych porównująca metronidazol z wankomycyną w leczeniu CDI.
Wszystkie zgony z przyczyn
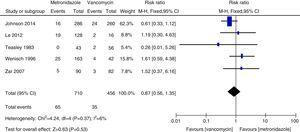
Meta-analiza śmiertelności spowodowanej wszystkimi przyczynami, porównująca metronidazol z wankomycyną w leczeniu CDI.
Dyskusja
CDI jest poważnym problemem w systemie opieki zdrowotnej o wzrastającej częstości występowania na całym świecie, który może powodować znaczną zachorowalność i śmiertelność.25. Śmiertelność pacjentów z ciężką postacią CDI wynosi od 9% do 25%; ponad połowa tych zgonów jest związana z CDI.14,26 Szczególnie ważne jest leczenie pacjentów z ciężką postacią CDI poprzez stosowanie odpowiedniej terapii przeciwdrobnoustrojowej.
W tej metaanalizie stwierdzono, że wankomycyna była lepsza od metronidazolu pod względem początkowego wyleczenia klinicznego i trwałego wyleczenia u pacjentów z CDI. Odsetek wyleczeń mikrobiologicznych był liczbowo niższy w przypadku terapii metronidazolem niż wankomycyną, choć różnica ta nie była istotna. Autorzy stanowiska z 2011 roku w swojej zbiorczej analizie stwierdzili równoważne wskaźniki początkowego wyleczenia klinicznego przy zastosowaniu metronidazolu i wankomycyny, najczęściej stosowanych leków.27,28 Ta niespójność wynikała głównie z różnych badań włączonych do poszczególnych przeglądów systematycznych. W obecnej metaanalizie uwzględniliśmy trzy dodatkowe badania.15,16,24 Gdy dane analizowano w zależności od ciężkości CDI, leczenie wankomycyną lub metronidazolem nie różniło się u pacjentów z łagodną postacią choroby. Jednak wskaźniki wyleczenia klinicznego i trwałego wyleczenia za pomocą wankomycyny u pacjentów z ciężkim CDI były znacznie większe niż wskaźniki w grupie metronidazolu. Nie znaleziono wystarczających dowodów na to, że wankomycyna i metronidazol były równie skuteczne u pacjentów z PMC, ze względu na małą liczbę ocenianych pacjentów. PMC był używany jako marker ciężkiej choroby.12 Kiedy pacjenci z ciężką CDI obejmowali pacjentów z PMC, nie stwierdzono istotnej różnicy między leczeniem metronidazolem i wankomycyną. Chociaż nie zaobserwowano różnicy statystycznej, w grupie leczonej wankomycyną zauważono silną tendencję do wyższego wskaźnika początkowego wyleczenia klinicznego i trwałego wyleczenia, podczas gdy w grupie pacjentów z łagodnym CDI było tak samo. Tak więc w przypadku pacjentów z ciężkim CDI wankomycyna była lepsza od metronidazolu. Venugopal i wsp. wykazali, że pacjenci z ciężkim CDI częściej przechodzili na wankomycynę, co sugeruje, że pacjenci ci słabo reagowali na metronidazol.29 Wyniki te zostały potwierdzone w obecnej metaanalizie. Wyniki leczenia metronidazolem były złe, ponieważ przepływ krwi do jelita grubego u pacjentów z ciężką chorobą mógł być zmniejszony, co powodowało mniejszą transudację metronidazolu do światła jelita.30,31 Ponadto fidaksomicyna została niedawno zatwierdzona do leczenia CDI i może być stosowana jako lek pomocniczy w przypadku niepowodzenia leczenia wankomycyną lub metronidazolem, ponieważ fidaksomicyna pozostaje wykrywalna w próbkach stolca pobranych do pięciu dni po podaniu pojedynczej dawki.32 W metaanalizie fidaksomycyna wykazała podobne wskaźniki wyleczeń klinicznych jak wankomycyna, ze znacznym zmniejszeniem częstości nawrotów zarówno u pacjentów z ciężką, jak i nieciężką postacią CDI.33 Dlatego w początkowym leczeniu ciężkiej postaci CDI lekiem pierwszego rzutu jest doustna wankomycyna; Alternatywnie można zastosować doustną fidaksomycynę.
Wskaźniki nawrotów wankomycyny i metronidazolu były ogólnie zgodne z wcześniejszymi danymi i nie stwierdzono istotnych różnic.27,28 Jednak wankomycyna była związana z niższymi wskaźnikami nawrotów niż metronidazol zarówno u wszystkich pacjentów z CDI, jak i u tych z ciężkim CDI. Nasze badanie sugeruje, że śmiertelność z powodu wszystkich przyczyn nie różniła się istotnie między wankomycyną a metronidazolem u wszystkich pacjentów z CDI. Śmiertelność z wszystkich przyczyn u wszystkich pacjentów z CDI wynosiła 100/1166 (8,5%), co jest niższe niż w europejskim badaniu wykazującym śmiertelność dla wszystkich przypadków 101/455 (22%) po trzech miesiącach.1
Wyniki obecnej metaanalizy muszą być postrzegane w kontekście potencjalnych ograniczeń. Po pierwsze, epidemiologia C. difficile uległa szybkiej zmianie i w krajach tych występuje większy odsetek ciężkich i nawracających przypadków niż zgłaszano wcześniej.1 Może to powodować różnice w populacjach badanych. Po drugie, w ciągu ostatniej dekady pojawiły się nowe metody diagnozowania CDI. Zastosowanie bardziej czułych i szybkich testów do diagnostyki CDI ma kluczowe znaczenie dla klinicznego postępowania z pacjentami. Chociaż w niektórych przypadkach kryteria diagnostyczne nie były tak rygorystyczne, odpowiedź na leczenie nie różniła się istotnie w obrębie jednego schematu leczenia lub między lekami.4 Po trzecie, ponieważ ta metaanaliza obejmowała stosunkowo niewielką liczbę badań, zwłaszcza RCT, precyzja szacunków mogła być zagrożona. Po czwarte, badacze nie byli zaślepieni na przydział do leczenia w czterech badaniach, co mogło wprowadzić błąd w raportowanych wynikach skuteczności. Po piąte, większość włączonych badań nie upewniła się, że wszystkie przypadki biegunki u włączonych pacjentów były spowodowane przez C. difficile, ponieważ nie wykluczały one obecności innych patogenów w stolcu jako przyczyny biegunki.4,5 Po szóste, skala ciężkości nie jest jeszcze wystarczająco naukowo potwierdzona i wymaga udoskonalenia nie tylko w celu standaryzacji przyszłych badań, ale także w celu wykorzystania w praktyce klinicznej.27,34 Dlatego obecne wyniki wymagają dalszego potwierdzenia.
W podsumowaniu, pomimo ograniczeń obecnej metaanalizy, analizy te wskazują, że wankomycyna oferuje znaczące korzyści w leczeniu CDI w porównaniu z metronidazolem. Pacjenci dobrze tolerowali oba leki, a częstość nawrotów była podobna. U pacjentów z łagodnym CDI terapia metronidazolem była równie skuteczna klinicznie jak wankomycyna; u pacjentów z ciężkim CDI wankomycyna była skuteczniejsza niż metronidazol. Ta różnica w skuteczności była najbardziej widoczna w podgrupie ciężkiego CDI i wspierała ostatnie zalecenia dotyczące stosowania wankomycyny jako terapii pierwszego rzutu w ciężkim CDI.
Konflikt interesów
Autorzy nie zgłaszają konfliktu interesów.
Finansowanie
To badanie było wspierane przez Major National Science and Technology Special Projects for New Drug (nr 2012ZX09303004) i Beijing Municipal Natural Science Foundation (nr 7132168).
Dodaj komentarz