Wat zijn de twee soorten ionen en hoe zijn ze verschillend
On december 28, 2021 by adminWat zijn de twee soorten ionen en hoe zijn ze verschillend

Ion:
Een ion is een positief of negatief geladen atoom (of groep van atomen). Een ion wordt gevormd door het verlies of de winst van elektronen door een atoom, zodat het een ongelijk aantal elektronen en protonen bevat.
Voorbeeld: Natriumion Na+, magnesiumion Mg2+, chloride-ion Cl-, en oxide-ion O2-.
Er zijn twee soorten ionen :
- cationen
- anionen.

1. Kation
Een positief geladen ion wordt kation genoemd. Een kation wordt gevormd door het verlies van een of meer elektronen door een atoom.
Voorbeeld: Natriumatoom verliest 1 elektron en vormt zo een natriumion, Na+, dat een kation is.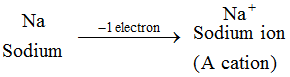 De ionen van alle metaalelementen zijn kationen.
De ionen van alle metaalelementen zijn kationen. 2. Anion
2. Anion
Een negatief geladen ion staat bekend als anion. Een anion wordt gevormd doordat een atoom een of meer elektronen wint.
Voorbeeld: Een chlooratoom wint 1 elektron en vormt zo een chloride-ion, Cl-, dat een anion is.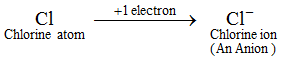 Een anion bevat meer elektronen dan een normaal atoom. Een normaal atoom (of een neutraal atoom) bevat een gelijk aantal protonen en elektronen. Aangezien een anion wordt gevormd door de toevoeging van een of meer elektronen aan een atoom, bevat een anion meer elektronen dan protonen. De ionen van alle niet-metaalelementen zijn anionen.
Een anion bevat meer elektronen dan een normaal atoom. Een normaal atoom (of een neutraal atoom) bevat een gelijk aantal protonen en elektronen. Aangezien een anion wordt gevormd door de toevoeging van een of meer elektronen aan een atoom, bevat een anion meer elektronen dan protonen. De ionen van alle niet-metaalelementen zijn anionen. Eenvoudige ionen
Eenvoudige ionen
Die ionen die uit enkelvoudige atomen worden gevormd, worden enkelvoudige ionen genoemd.
Voorbeeld: Natriumion, Na+, is een enkelvoudig ion omdat het gevormd wordt uit één natriumatoom, Na.
Samengestelde ionen
De ionen die gevormd worden uit groepen van samengevoegde atomen worden samengestelde ionen genoemd.
Voorbeeld: Ammonium ion NH4+, is een samengesteld ion dat is opgebouwd uit twee soorten samengevoegde atomen, stikstof en waterstof.
Ionische verbindingen
De verbindingen die zijn opgebouwd uit ionen worden ionische verbindingen genoemd. In een ionische verbinding worden de positief geladen ionen (kationen) en negatief geladen ionen (anionen) bij elkaar gehouden door de sterke elektrostatische aantrekkingskrachten. De krachten die de ionen in een ionische verbinding bij elkaar houden, worden ionische bindingen of elektrovalente bindingen genoemd. Aangezien een ionische verbinding bestaat uit een gelijk aantal positieve ionen en negatieve ionen, is de totale lading van een ionische verbinding nul.
Voorbeeld: Natriumchloride (NaCl) is een ionische verbinding die is opgebouwd uit een gelijk aantal positief geladen natriumionen (Na+) en negatief geladen chloride-ionen (Cl-).
Enkele ionische verbinding
|
S.nr. |
Naam | Formula |
Aanwezige ionen |
|
1 |
Natriumchloride | NaCl | Na+ en Cl- |
| 2 | Kaliumchloride | KCl |
K+ en Cl- |
|
3 |
Ammoniumchloride | NH4Cl | NH4+ en Cl- |
|
4 |
Magnesium chloride | MgCl2 | Mg2+ en Cl- |
| 5 | Calciumchloride | CaCl2 | Ca2+ en Cl- |
| 6 | Magnesiumoxide | MgO | Mg2+ en O2- |
| 7 | Calcium oxide | CaO | Ca2+ en O2- |
| 8 | Aluminium oxide | Al2O3 | Al3+ en O2- |
| 9 | Natriumhydroxide | NaOH | Na+ en OH- |
| 10 | Koper sulfaat | CuSO4 | Cu2+ en SO42- |
| 11 | Kaliumnitraat | Ca(NO3)2 |
Ca2+ en NO3- |
Geef een antwoord