Reacties op de “benzymatische” koolstof: Brominering en Oxidatie
On oktober 12, 2021 by adminDe koolstof die grenst aan een aromatische ring – de “benzymatische” koolstof – kan deelnemen aan verschillende nuttige en interessante reacties. Vandaag zullen wij voorbeelden en mechanismen geven voor twee belangrijke voorbeelden: benzyclische brominering en benzyclische oxidatie. Hier volgt een korte samenvatting:
Inhoudsopgave
- Alkylgroepen = “Ruwvoer”
- Er is iets speciaals aan alkylgroepen die grenzen aan een benzeenring
- “Fenyl” vs “Benzyl” : Wat is het verschil?
- Benzylradicalen worden gestabiliseerd door resonantie; fenylradicalen niet.
- Benzylische (en Allylische) C-H Bindingen Zijn Zwak, Vergeleken Met Andere Alkyl C-H Bindingen
- Benzylische Brominering
- Wanneer werkt “Benzylische Brominering” NIET?
- Toepassingen van benzylbrominering
- Benzyloxidatie met KMnO4 (of H2CrO4)
- Benzyloxidatie vereist een benzylische C-H binding
- Waarom is dit belangrijk?
- Noten
- Quiz Yourself!
- (Gevorderd) Referenties en verder lezen
Alkylgroepen = “Ruwvoer”
In de voeding is “ruwvoer” hoe je alle cellulose en vezels noemt die in voedingsmiddelen aanwezig zijn en die gewoon door je lichaam schieten zonder daadwerkelijk verteerd te worden.
Dat beschrijft zo’n beetje het gedrag van alkylgroepen in de overgrote meerderheid van de organische scheikunde-reacties die we hebben geleerd. Hun chemie is “saai”. Ze mogen dan wel de ruggengraat en de algemene structuur van het molecuul vormen, maar hun C-H bindingen zijn inert onder de meeste reactieomstandigheden.
In feite, als je verbranding niet meetelt, is zo’n beetje de enige reactie van alkylgroepen die we in de inleidende organische scheikunde behandelen, de vrije-radicale substitutie. En zelfs die reactie is niet erg selectief, vooral als je te maken hebt met vrije radicale chlorering.
We hebben gezien dat een uitzondering op dit “saaie” gedrag kan worden gevonden in de vrije-radicale brominering van zogenaamde “allylische” C-H bindingen. De “allylische” positie is een koolstof die grenst aan een dubbele binding (niet een C-H aan de dubbele binding zelf! dat is een “vinylische” C-H).
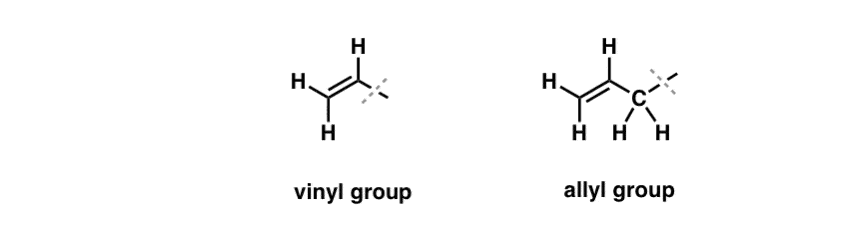
Wat maakt de “allylische” positie zo speciaal? Allylische radicalen, carbokationen en anionen worden aanzienlijk gestabiliseerd door resonantie. De orbitaal van de allylische radicaal, carbokation of anion kan zich afstemmen op de p-orbitalen in de aangrenzende pi binding, waardoor een groter “pi systeem” ontstaat en de lading over een groter gebied wordt verspreid.
Er is iets bijzonders aan de hand met alkylgroepen die aan een benzeenring grenzen
Wat is de reden voor deze kleine reis door het verleden? Nou, we hebben onlangs een tijdje de Friedel-Crafts alkyleringsreactie doorgenomen, en ik wil u niet de indruk geven dat het plaatsen van een alkylgroep aan een benzeenring een synthetisch doodlopende weg is.
Alkylgroepen hoeven niet inert te zijn! Net als allylkoolwaterstoffen zijn alkylgroepen die aan benzeenringen grenzen bijzonder reactief, en dat kan allerlei belangrijke toepassingen hebben.
Er zijn twee belangrijke reacties die we in dit bericht zullen behandelen:
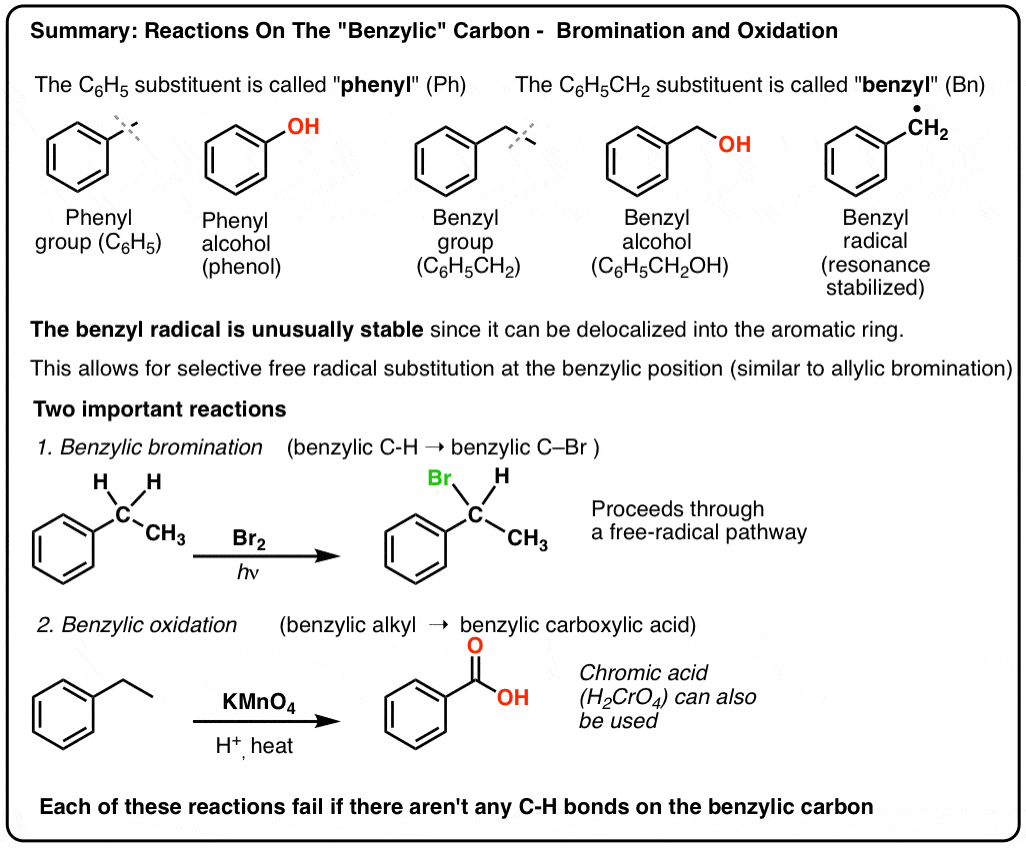
- Benzyclische brominering – vrije-radicale brominering van de alkylgroep grenzend aan een aromatische ring
- Benzyclische oxidatie – volledige oxidatie van een alkylgroep grenzend aan benzeen tot een carbonzuur.
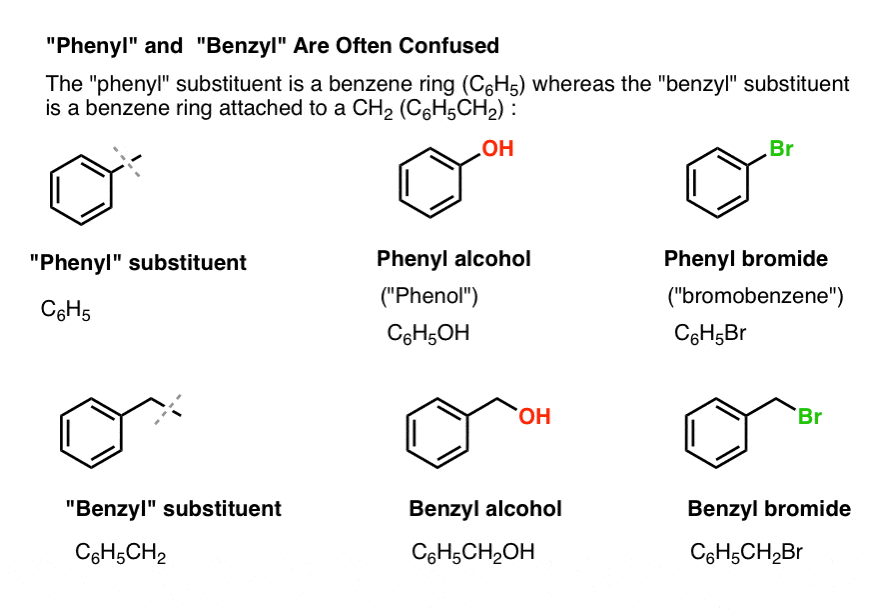
3. “Phenyl” vs “Benzyl” : Wat is het verschil?
Eerst even snel wat zaken op een rijtje zetten. Laten we eerst wat belangrijke nomenclatuur uit de weg ruimen, want “fenyl” en “benzyl” veroorzaken veel verwarring:
- Een fenylgroep (of fenylsubstituent) is benzeen minus een waterstof: C6H5 . De koolwaterstoffen in de ring zijn fenylkoolwaterstoffen, en de aan fenylkoolwaterstoffen vastzittende waterstofverbindingen zijn fenyl-C-H-bindingen. Het is analoog aan vinyl (zie hierboven).
- Een benzylgroep is methylbenzeen minus een waterstof: C6H5CH2 . De koolstof die aan de ring grenst is de benzyl-koolstof, en de hydrogenen die aan de benzyl-koolstof vastzitten worden benzyl-hydrogenen genoemd. Het is analoog aan allyl (hierboven).
4. Benzylradicalen worden gestabiliseerd door resonantie; fenylradicalen niet.
De analogie van fenyl met vinyl en benzyl met allyl strekt zich ook uit tot de stabiliteit van hun radicalen (evenals hun carbokationen en anionen).
- Fenylradicalen worden niet gestabiliseerd door resonantie, omdat de orbitaal waarin het radicaal zich bevindt loodrecht staat op de orbitalen van het pi-systeem, en er geen overlap tussen beide is. Radicalen op sp2 gehybridiseerde koolstaven zijn in het algemeen minder stabiel dan radicalen op alkylkoolstaven. (Zie post: drie factoren die vrije radicalen destabiliseren)
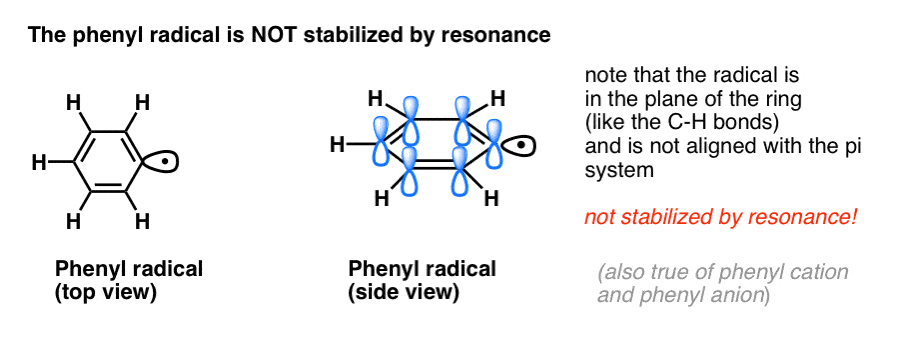
- Benzylradicalen zijn ongebruikelijk stabiel omdat de orbitaal waarin de radicaal zich bevindt, kan uitlijnen met het pi-systeem van de benzeenring, net als bij hun allylneven (dit geldt ook voor benzylkationen en -anionen).
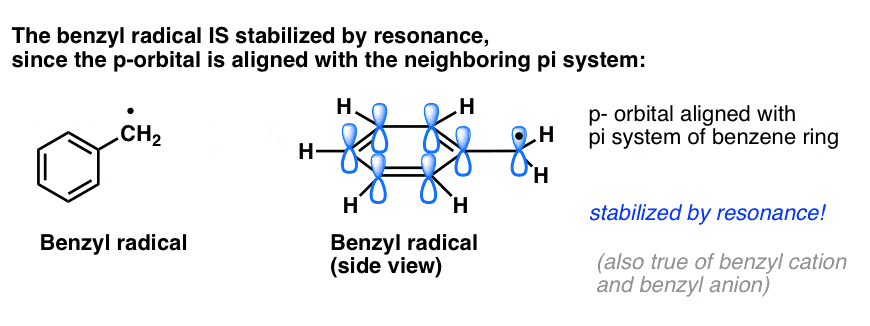
Benzylische (en allylische) C-H-bindingen zijn zwak, in verhouding tot andere alkyl-C-H-bindingen
Benzylische C-H-bindingen hebben bindingssterkten (ook wel BDE’s genoemd, of bindingsdissociatie-energieën) van ongeveer 90 kcal/mol, wat aanzienlijk zwakker is dan tertiaire C-H (bindingssterkte 93 kcal/mol), secundaire C-H (96 kcal/mol) en primaire C-H (100 kcal/mol) bindingen. (Fenyl C-H bindingen zijn ongeveer 113 kcal/mol, opnieuw een weerspiegeling van de instabiliteit van fenylradicalen).
De dissociatie-energie van de binding geeft aan hoe gemakkelijk de homolytische splitsing van de C-H binding verloopt (d.w.z. hoe gemakkelijk het is om de binding te dissociëren in twee vrije radicalen); dit is een andere manier om te zeggen dat benzylradicalen bijzonder gemakkelijk te vormen zijn, in vergelijking met andere alkylradicalen.
We hebben eerder gezien dat hetzelfde geldt voor allylische C-H bindingen. Bij ‘allylische brominering’ wordt een van de C-H bindingen op de alkylgroep naast een dubbele binding omgezet in een C-Br binding, met behulp van N-broomosuccinimide (NBS) en licht (hν) :
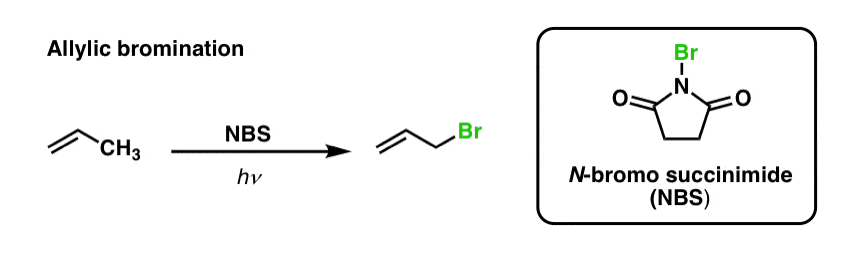
De reactie is selectief voor allylische C-H in aanwezigheid van primaire, secundaire en tertiaire C-H bindingen, vanwege de zwakkere allylische C-H bindingssterkte (89 kcal/mol).
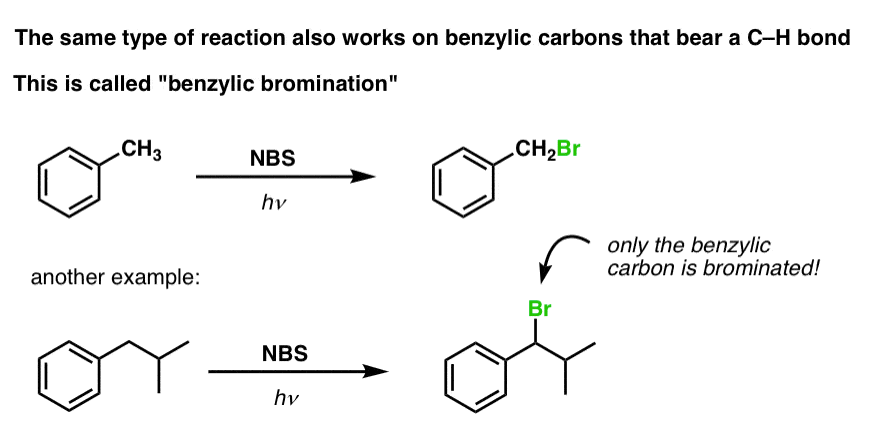
Benzyblische brominering
Een soortgelijk proces werkt voor “benzyblische” koolwaterstoffen. We kunnen NBS gebruiken (zoals hierboven) of gewoon Br2, omdat aromatische ringen lang niet zo reactief zijn met Br2 als dubbele bindingen dat zijn.
Eenmaal gevormd (door “warmte” of “licht”, dat de reactie initieert door homolytische dissociatie van Br-Br), kan het broomradicaal, Br- de zwakkere benzylische C-H bindingen verbreken zonder de sterkere alkyl C-H bindingen aan te tasten.
Zo zijn hier bijvoorbeeld de producten van de reactie met tolueen, en ook met isopropylbenzeen. Merk op dat ALLEEN de benzylkoolstof wordt gebromeerd. De rest wordt met rust gelaten!
Het mechanisme van benzymbrominering is in wezen identiek aan dat van allylbrominering, met initiatie-, propagatie- en terminatiestappen. (Klik hier om een pop-upbeeld van het mechanisme te zien.)
(Voor meer discussie, zie dit bericht: Allylische brominering)
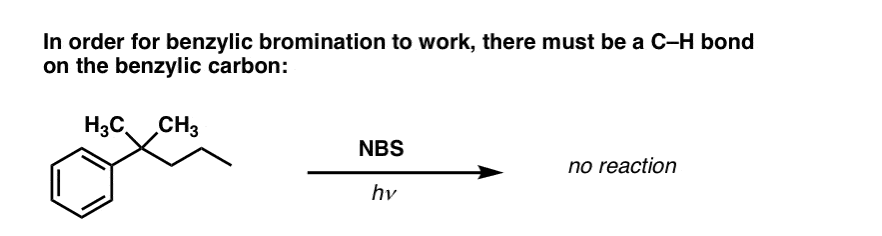
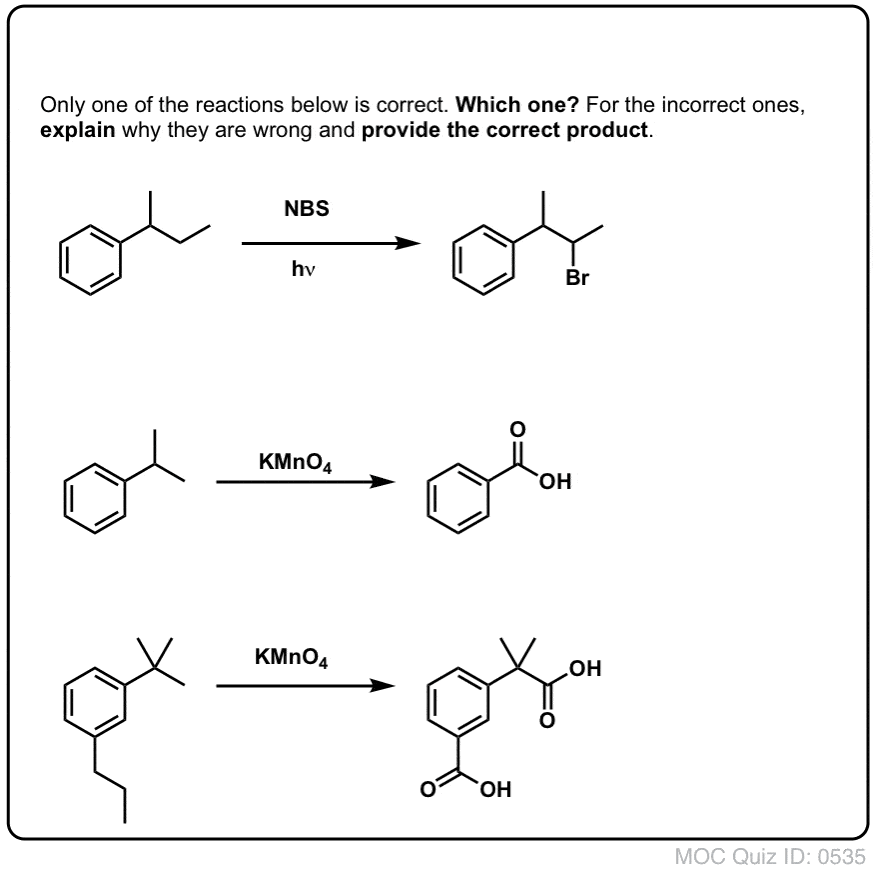
Wanneer werkt “benzylische brominering” NIET?
Omdat de sleutel tot deze reactie de vorming van het (relatief stabiele) benzylradicaal is, zal benzylbrominering falen op substraten waar het genereren van dit radicaal via het verbreken van een C-H binding onmogelijk is.
Kijk bijvoorbeeld eens naar het onderstaande voorbeeld. Hoe kan een benzylradicaal worden gegenereerd als aan de benzylkoolstof drie alkylgroepen zijn verbonden? Dat kan niet – en de reactie mislukt.
Toepassingen van benzymbrominering
Waarom zou benzymbrominering dan nuttig kunnen zijn?
Wel, het stelt ons in staat om alle reacties van alkylhalogeniden die we in Org 1 hebben behandeld – voornamelijk substitutie en eliminatie – te gebruiken om producten te maken die moeilijk rechtstreeks op een aromatische ring kunnen worden aangebracht via Friedel-Crafts reacties.
Zo kunnen we bijvoorbeeld benzymbromering gebruiken om een SN2-reactie op te zetten, bijvoorbeeld na een Friedel-Crafts alkylering:
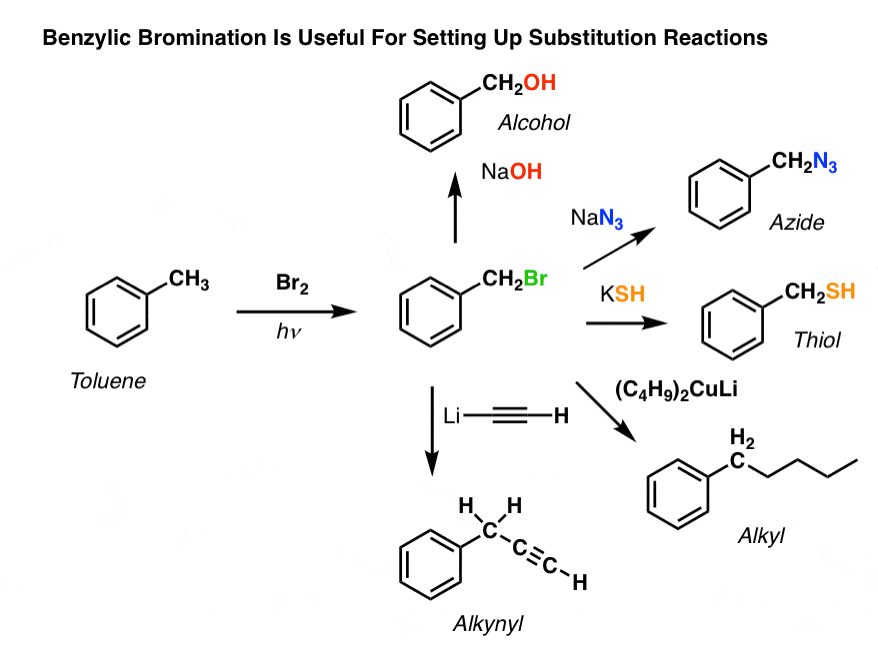
Zie je hoe het installeren van een goede vertrekgroep op de benzyblinse positie ons allerlei mogelijkheden geeft om verschillende functionele groepen te installeren?
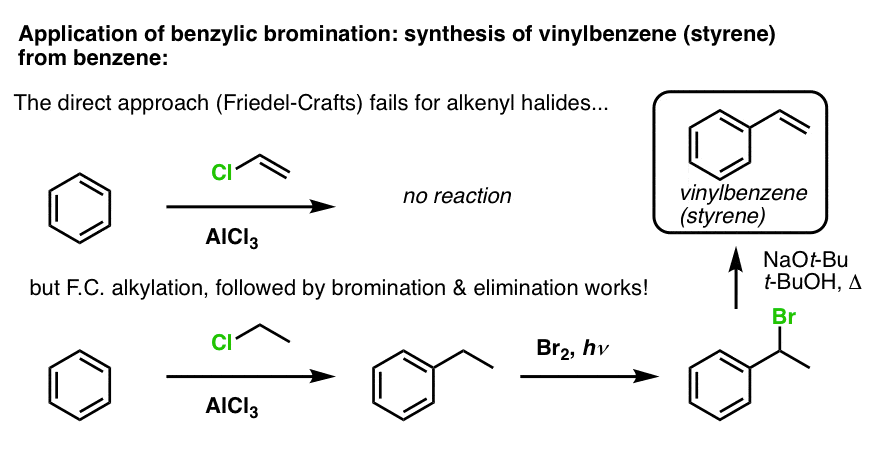
Een ander voorbeeld is de synthese van styreen uit benzeen. Op het eerste gezicht lijkt de meest directe benadering de Friedel-Crafts-reactie van vinylchloride met benzeen. Maar Friedel-Crafts werkt niet voor alkenylhalogeniden (aka vinylhalogeniden)! (vinylcarbocaties zijn minder stabiel dan alkylcarbocaties).
We kunnen deze hindernis omzeilen door een Friedel-Crafts alkylering uit te voeren met ethylchloride, gevolgd door benzylbromering en vervolgens eliminatie (via E2, met iets als NaOtBu/t-BuOH) om het alkeen te geven:
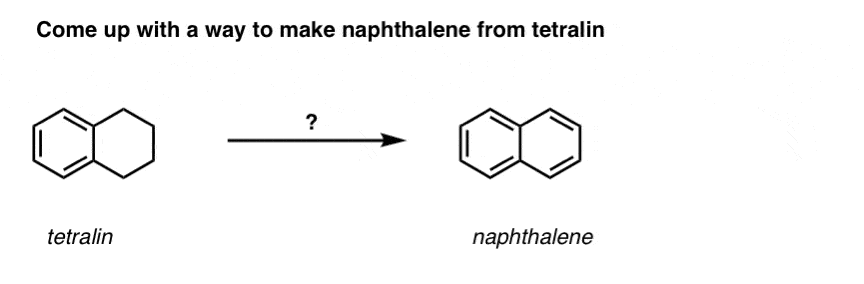
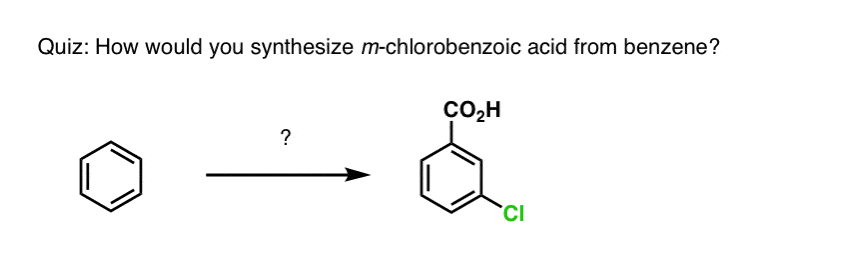
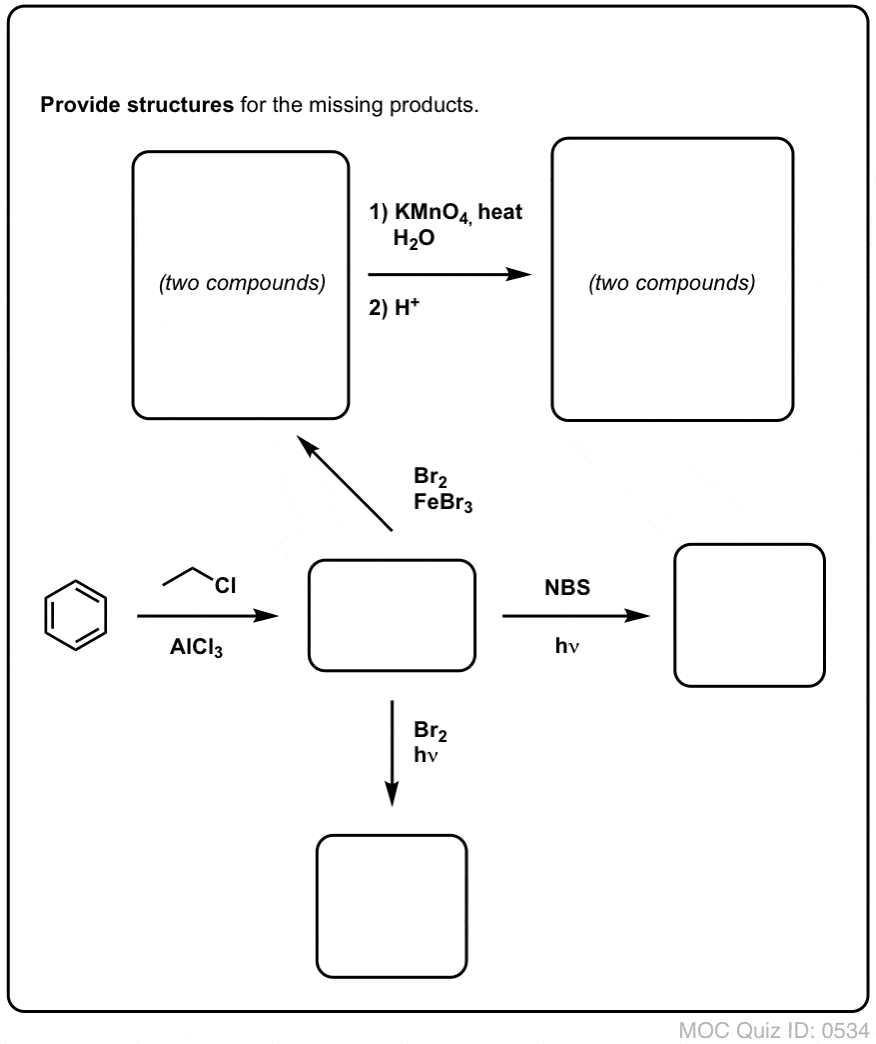
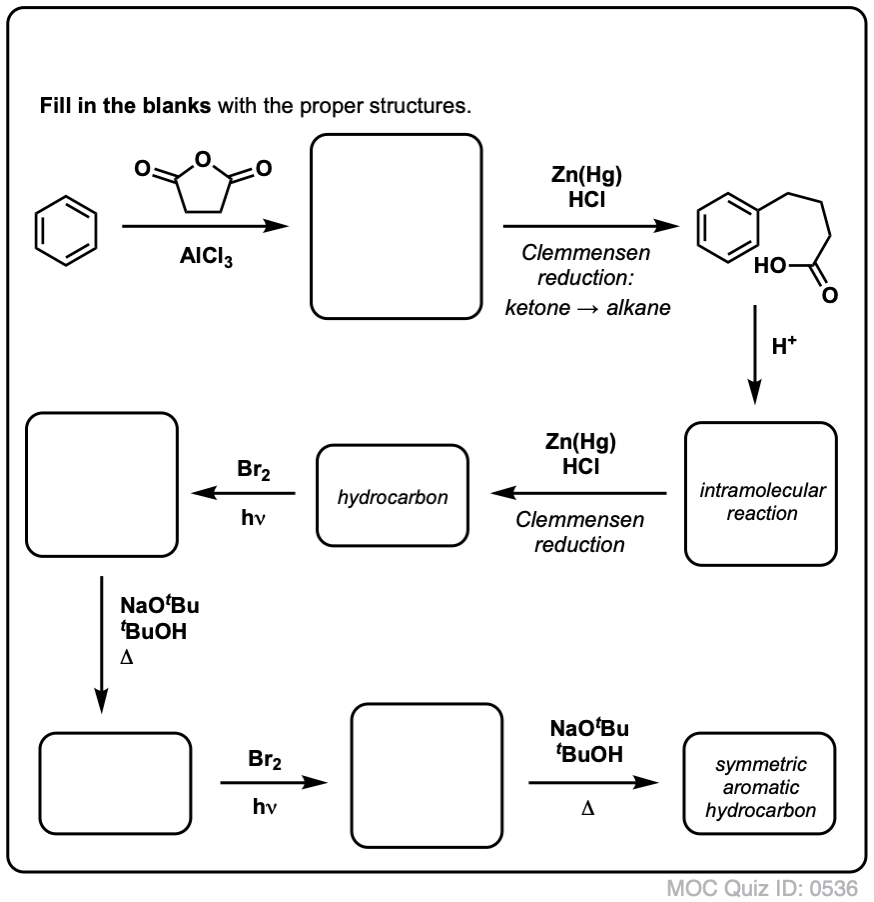
Op basis van het bovenstaande volgt hier een snelle quiz voor u. Hoe zou je tetralin (linksonder) kunnen omzetten in naftaleen (rechtsonder)? Antwoord in de voetnoten.
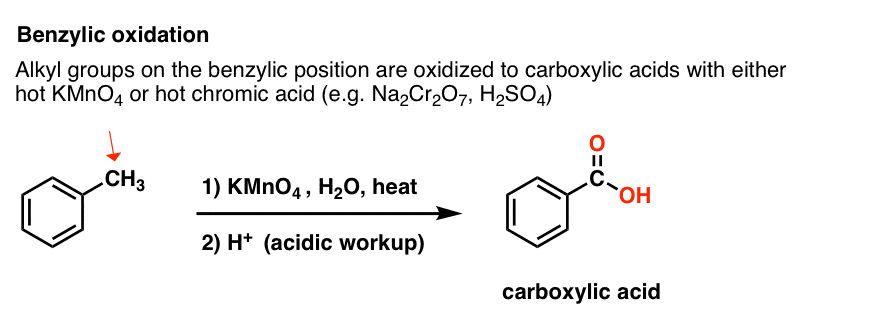
9. Benzyloxidatie Met KMnO4 (of H2CrO4)
Omdat de benzylische C-H binding relatief zwak is, kun je je terecht afvragen of op deze positie ook andere soorten reacties (naast brominering) kunnen worden uitgevoerd.
Dat kunnen ze zeker! Een goed voorbeeld is benzyloxidatie – waarbij een benzylische C-H binding wordt verbroken en een benzylische C-O binding wordt gevormd.
Nu: er bestaan vrij milde reagentia voor benzyloxidatie die het chemische equivalent zijn van het kietelen van de C-H binding met een veer, resulterend in een benzylisch aldehyde of keton .
Dat is niet het type benzyloxidatie dat wordt behandeld in een typische inleidende cursus organische chemie!
In plaats daarvan is het belangrijkste reagens voor benzyloxidatie dat in de meeste inleidende leerboeken wordt behandeld heet kaliumpermanganaat (KMnO4). Heet chroomzuur (H2CrO4, dat wordt gevormd door een dichromaatzout als Na2Cr2O7 te combineren met een sterk zuur als H2SO4) kan ook voor deze doeleinden worden gebruikt.
KMnO4 is niet subtiel. KMnO4 is niet zachtaardig. KMnO4 is niet vriendelijk.
Een oplossing van heet KMnO4 is als een zak vol boze piranha’s die al het vlees van je molecuul scheuren en alleen botten achterlaten. (Nu ik erover nadenk, het is net zoiets als je lever! )
Hete KMnO4 zal elke benzylische C-H binding verbreken en omzetten in een C-O binding. Van tolueen, bijvoorbeeld, is het product benzoëzuur (een carbonzuur).
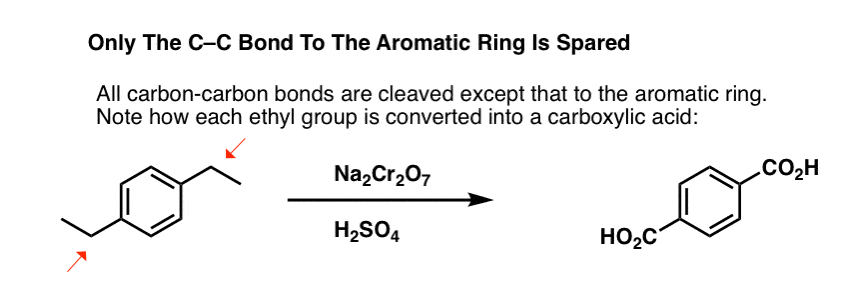
Maar het breekt niet alleen de benzylische C-H bindingen. Oh nee. Het gaat ook achter C-C bindingen aan; tenminste degene die niet direct aan een fenylring vastzitten. Zo wordt para-diethylbenzeen omgezet in para-benzeendicarbonzuur.
Merk op dat de alkyl C-C binding moet worden gesplitst om deze oxidatie te laten plaatsvinden! (het is waarschijnlijk helemaal geoxideerd tot CO2-gas).
Een interessante variatie is op een cyclisch molecuul als tetralin; het resultaat is het dicarbonzuur.
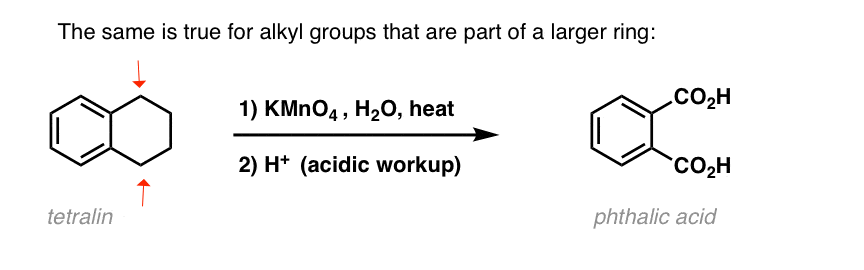
dit dicarbonzuur wordt ftaalzuur genoemd.
10. Benzyclische oxidatie vereist een benzyclische C-H binding
Zoals bij benzyclische brominering treedt geen reactie op als er geen C-H binding op de benzyclische plaats aanwezig is. De reactie mislukt bijvoorbeeld volledig met t-butylbenzeen:
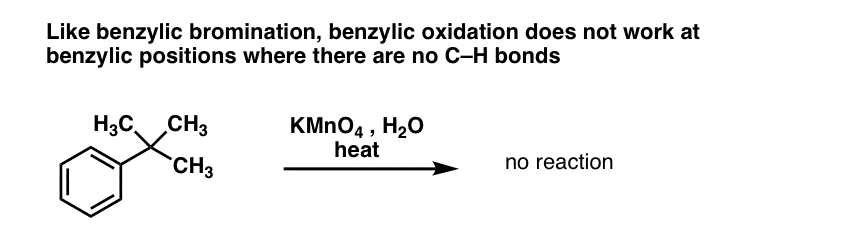
Het volledige mechanisme van benzyclische oxidatie is te complex, te lang en te onzeker om hier te laten zien, maar de eerste stap is vrijwel zeker homolytische splitsing van de C-H binding door de Mn=O om de benzyclische radicaal te vormen.
Waarom is dit belangrijk?
Benzyclische oxidatie met KMnO4 is een harde reactie, maar ze kan haar nut hebben. Het werkt het beste met eenvoudige moleculen die geen gevoelige functionele groepen hebben en bestand zijn tegen een zeer ruwe behandeling.
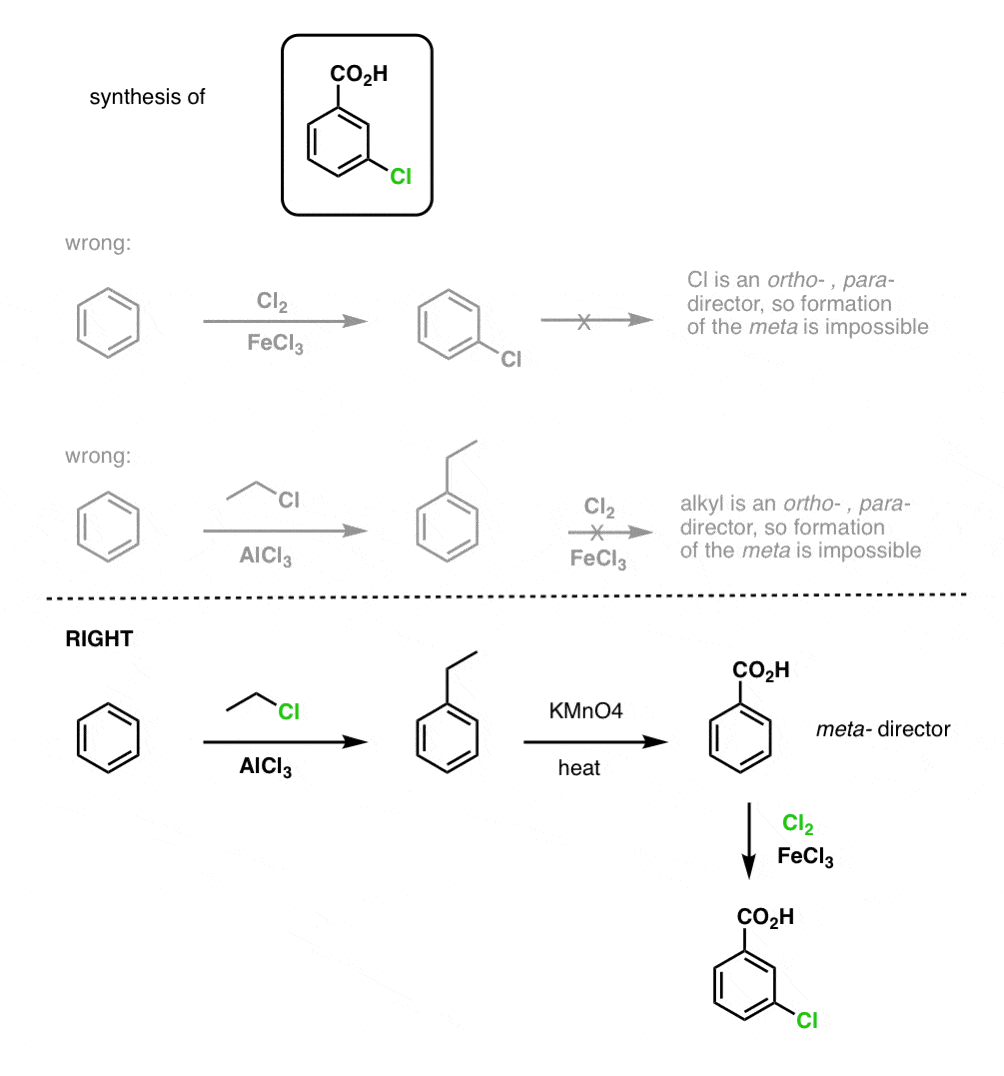
Het eerste ding om op te merken is dat carbonzuren niet direct op een benzeenring kunnen worden geplaatst via de Friedel-Crafts acylering, dus alkylering gevolgd door oxidatie is een nuttige workaround.
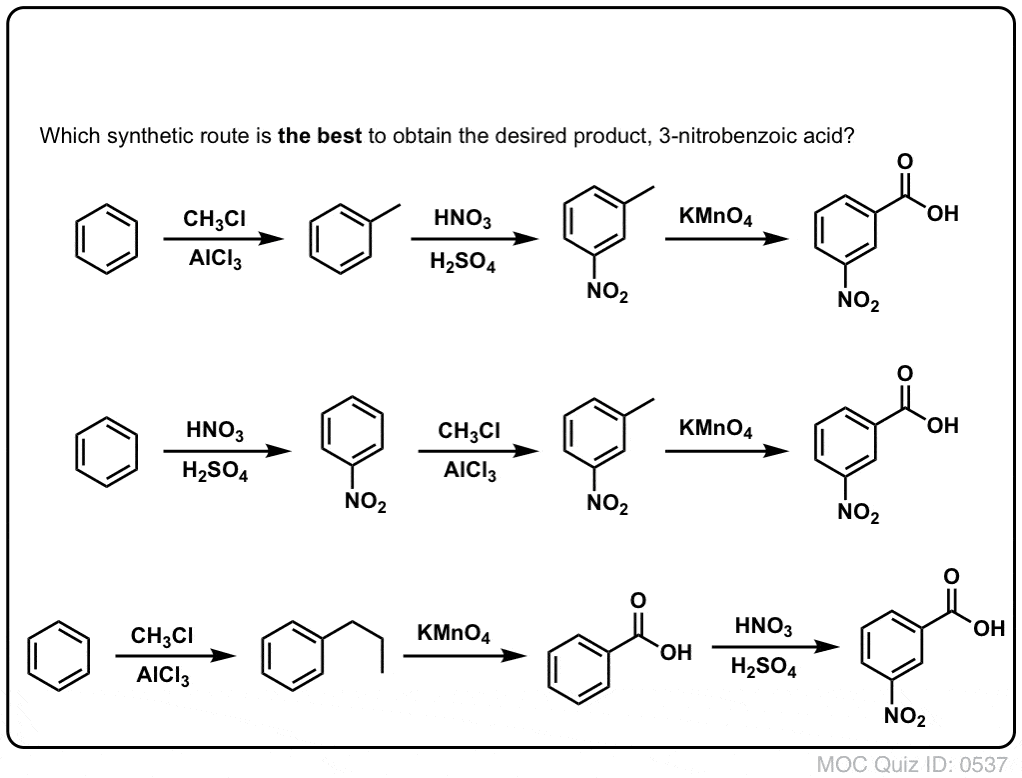
De tweede nuttige functie in de synthese is het feit dat benzyloxidatie een o- p-regisseur (een alkylgroep) omzet in een meta-regisseur.
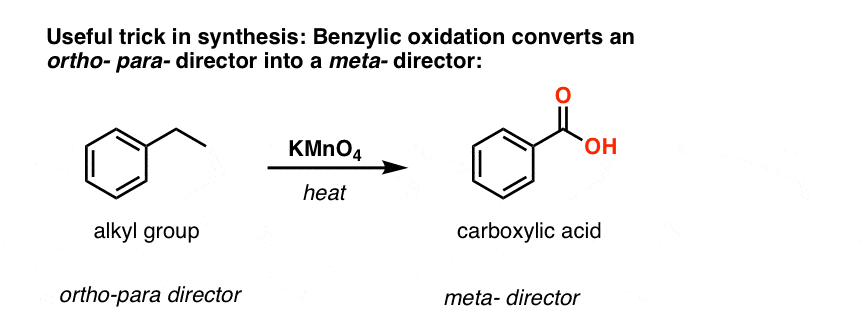
Bijv. geconfronteerd met de synthese van het volgende molecuul, hoe ga je dan te werk? (hint: er is een oxidatie van benzyl op een bepaald punt bij betrokken).
We zullen nog veel meer te vertellen hebben over de synthese van aromatische verbindingen in een paar andere berichten.
Volgende: Reductie van benzylische carbonylen – de Clemmensen- en Wolff-Kishnerreducties
Noten
“Kool” kan in de scheikunde ook als slangterm worden gebruikt voor “al dat spul op het molecuul dat je veilig kunt negeren” om wat voor reden dan ook. Bijvoorbeeld, bryostatine is een beest van een molecuul dat veelbelovend is als een antikanker middel. Het probleem is dat er een ton van een zeldzame bryozo nodig is om een behoorlijke hoeveelheid bryostatine te krijgen, en dat is niet genoeg voor een klinische proef op mensen. Dus hebben verschillende groepen gewerkt aan het maken van eenvoudigere, gemakkelijker te synthetiseren “bryologs” waarbij ze zich ontdoen van de “kool” die niet essentieel is voor antitumor activiteit.
Br2 zal over het algemeen niet reageren met aromatische ringen zonder een Lewiszuur katalysator. Als er echter een sterke activerende groep aanwezig is (zoals OH, NR2, enz.) kan er enige brominering van de ring optreden, vooral bij verhoogde temperaturen.
Leuk weetje: “Benzyclische oxidatie” is het antwoord op het raadsel waarom methylbenzeen (tolueen) lang niet zo’n krachtig carcinogeen is als benzeen. Dat komt omdat je lever cytochroom p450-enzymen heeft (die hoge oxidatie-staat ijzersoorten bevatten) die de benzylische CH3-groep kunnen oxideren tot het beter in water oplosbare carbonzuur, waardoor het door je nieren kan worden opgeruimd.
Hiervoor zijn twee oxidaties en twee eliminaties nodig. Een voorzichtige manier om het te doen is eenmaal oxideren (d.w.z. bromineren), en dan elimineren om een alkeen te krijgen. Het alkeen kan dan opnieuw gebromeerd worden (met NBS, om broomvorming van de dubbele binding te voorkomen) om nog een broomering te geven (hier is het benzylbroomproduct afgebeeld, maar allylisch is ook mogelijk), die met base kan worden behandeld om aromatisch naftaleen te geven.
(In de praktijk blijkt dat beide broomeringen tegelijk kunnen worden gedaan met Br2 bij hoge temperatuur. Behandeling met base kan dan naftaleen opleveren).
Antwoord op quizvraag 2.
Quiz Yourself!
 Klik om te flippen
Klik om te flippen 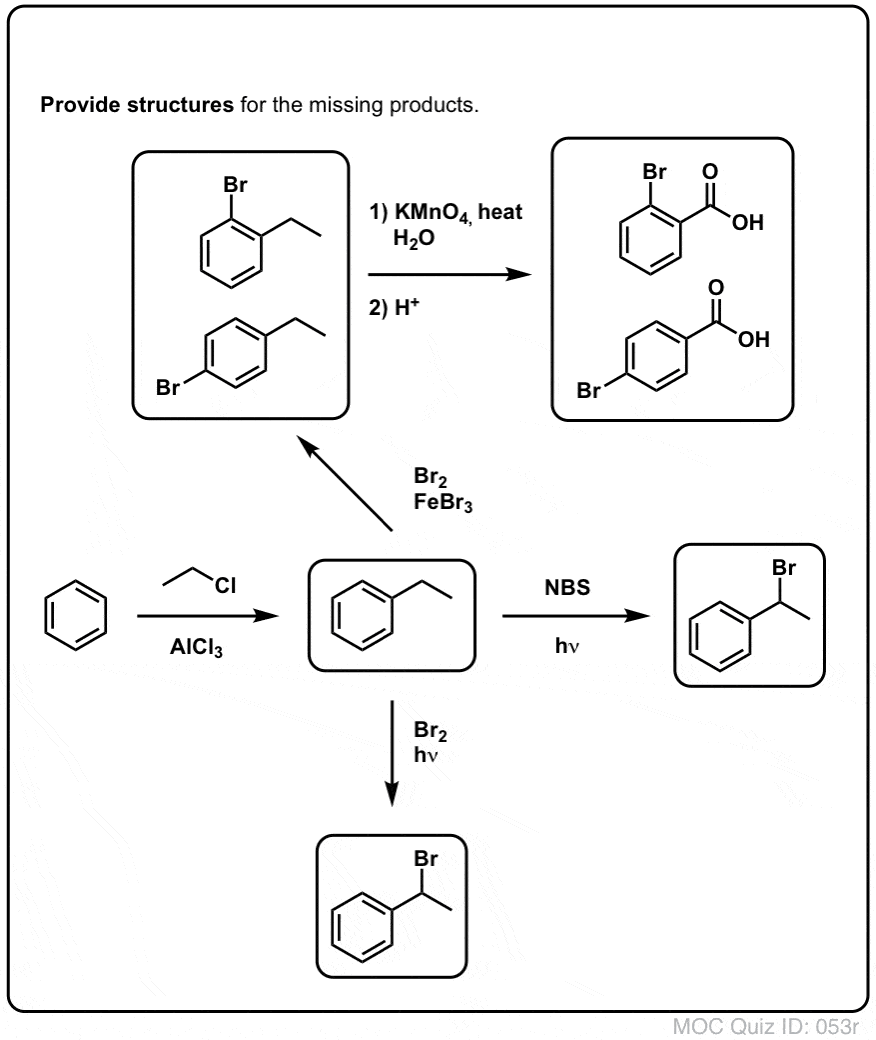
 Klik om te flippen
Klik om te flippen 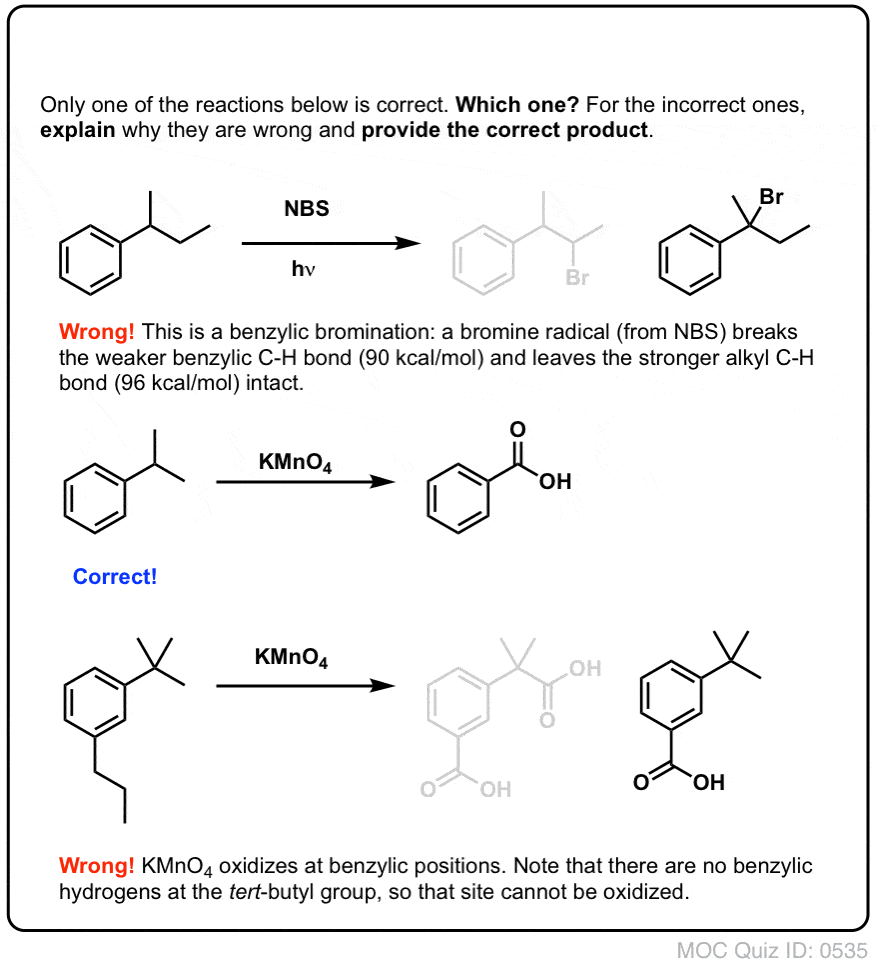
 Klik om te flippen
Klik om te flippen 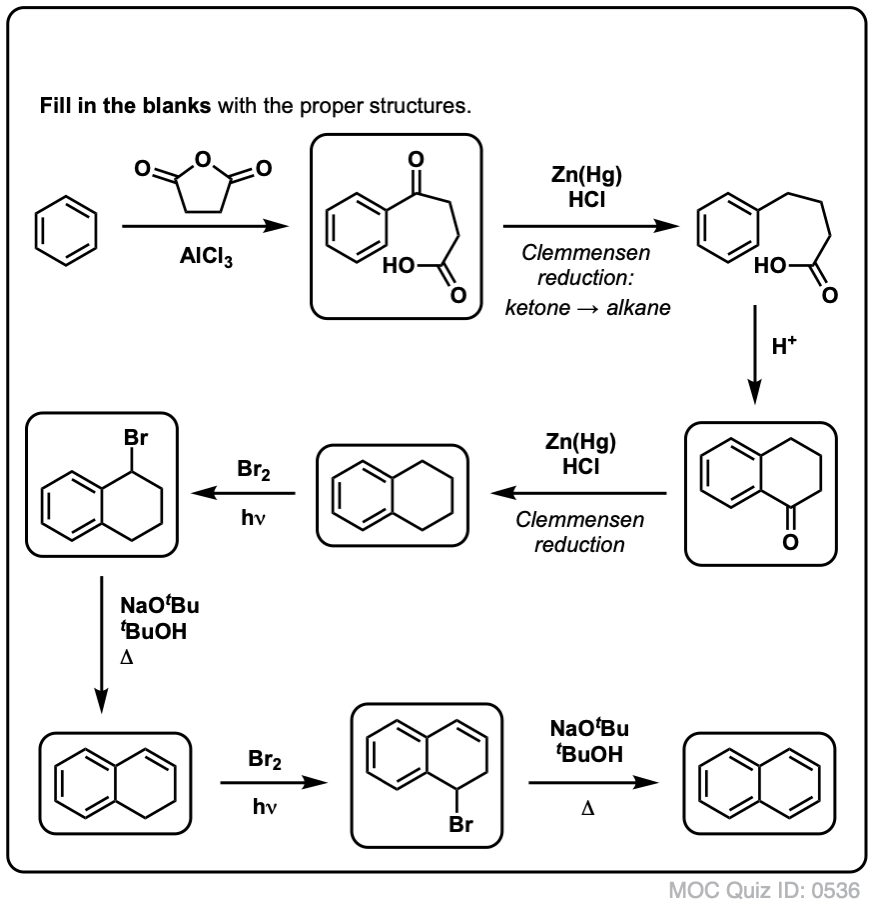
 Klik om te bladeren
Klik om te bladeren 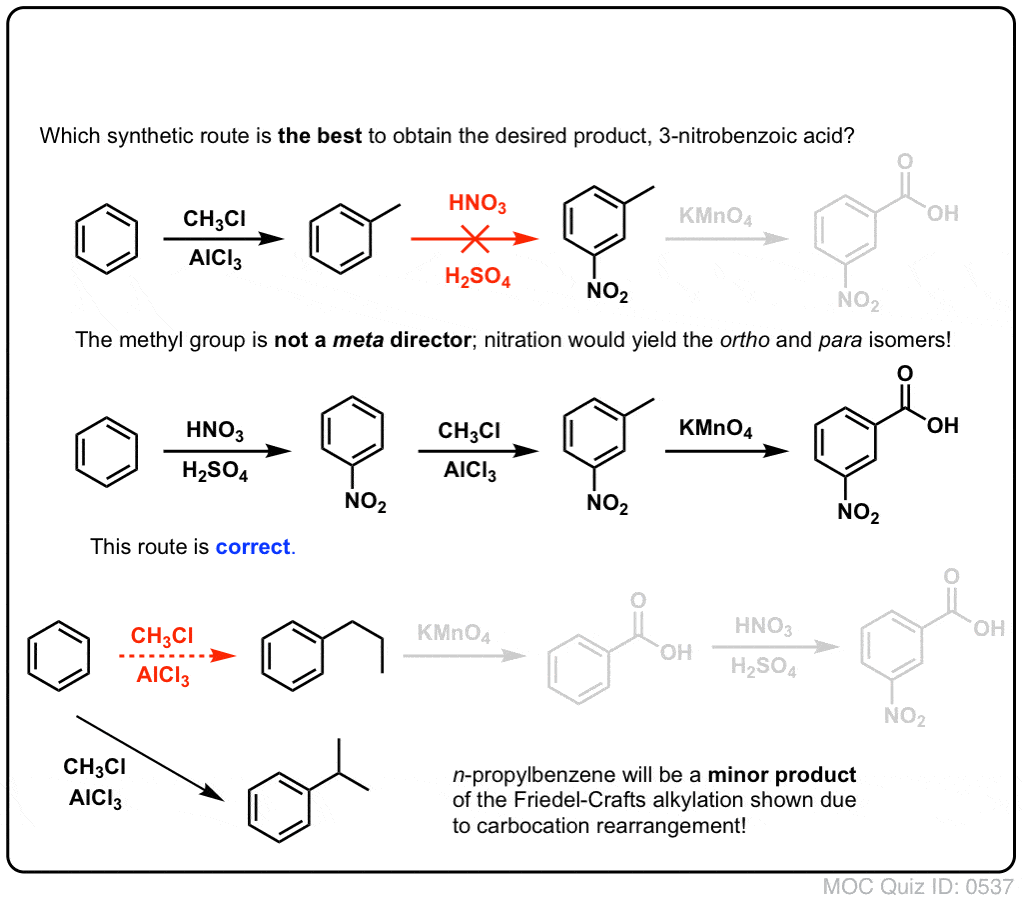
(Geavanceerd) Referenties en verder lezen
Benzylbrominering:
Deze reactie is ook bekend als de Wohl-Ziegler reactie.
- Bromierung ungesättigter Verbindungen mit N-Brom-acetamid, ein Beitrag zur Lehre vom Verlauf chemischer Vorgänge
Wohl
Chem. Ber. 1919, 52 (1), 51-63
DOI: 10.1002/cber.19190520109 - Die Halogenierung ungesättigter Substanzen in der Allylstellung
Ziegler, A. Späth, E. Schaaf, W. Schumann, E. Winkelmann
Just. Lieb. Ann. Chem. 1942, 551 (1), 80-119
DOI: 10.1002/jlac.19425510103
De eerste twee publicaties over deze reactie. Wohl gebruikte N-broomacetamide als broomvormer, niet NBS. Ziegler heeft vervolgens een gedetailleerde studie uitgevoerd en gerapporteerd dat NBS gebruikt kan worden als een handig broommiddel voor allylische brominering. - Dibenzocyclooctene: Multi-gram Synthese van een Bidentaat Ligand
Géraldine Franck, Marcel Brill, and Günter Helmchen
Org. Synth. 2012, 89, 55-65
DOI: 10.15227/orgsyn.089.0055 - Benzyclische broomminaties met N-broomosuccinimide in (trifluormethyl)benzeen
Diana Suarez, Gilles Laval, Shang-Min Tu, Dong Jiang, Claire L. Robinson, Richard Scott, Bernard T. Golding
Synthesis 2009 (11): 1807-1810
DOI: 1055/s-0029-1216793
Referentie #3 toont een typische benzylbrominering met NBS in CCl4, die wegens toxiciteitsproblemen grotendeels is uitgefaseerd. Referentie #4 laat zien dat PhCF3 gebruikt kan worden als oplosmiddel in plaats van CCl4 voor benzyblische brominering. - Broominjecties met N-Broomosuccinimide en verwante verbindingen. The Wohl-Ziegler Reaction.
Carl Djerassi
Chemical Reviews 1948, 43 (2), 271-317
DOI: 10.1021/cr60135a004
Een oud overzichtswerk over deze reactie van de bekende scheikundige Carl Djerassi, wiens grote bijdrage aan de wereldgezondheid de ontwikkeling van norethindrone – het eerste anticonceptiemiddel voor vrouwen – was. - N-Bromosuccinimide. III. Stereochemisch verloop van benzylobrominering
H. J. Dauben Jr. and Layton L. McCoy
Journal of the American Chemical Society 1959, 81 (20), 5404-5409
DOI: 10.1021/ja01529a038
Een mechanistische studie naar de stereochemie van benzylbrominering. Door de vorming van racemische benzymbromides uit prochirale substraten te observeren, wordt de intermediacy van radicalen in deze reactie verder versterkt.Dezelfde referenties van allylische brominering kunnen hier worden hergebruikt: - Mechanismen van benzylische brominering
Glen A. Russell, Charles. DeBoer, and Kathleen M. Desmond
Journal of the American Chemical Society 1963 85 (3), 365-366
DOI: 1021/ja00886a040
Benzyblische brominering volgt hetzelfde mechanisme als allylische brominering, zoals in dit artikel wordt uitgelegd.NBS (N-Broombarnsteenzimide) is een geschikt reagens voor vrije-radicale brominering, en de volgende artikelen zijn mechanistische studies met NBS: - The Mechanism of Benzylic Bromination with N-Bromosuccinimide
R. E. Pearson and J. C. Martin
Journal of the American Chemical Society 1963 85 (3), 354-355
DOI: 10.1021/ja00886a029
Deze artikelen van Prof. J. C. Martin (UIUC) dateren uit het begin van zijn carrière, voordat hij het werk deed waar hij het meest bekend om is geworden (studies over ‘hypervalente’ moleculen, waaronder de ontwikkeling van het ‘Dess-Martin Periodinane’). - The Identity of the Chain-Carriering Species in Brominations with N-Bromosuccinimide: Selectivity of Substituted N-Bromosuccinimides toward Substituted Toluenes
R. E. Pearson and J. C. Martin
Journal of the American Chemical Society 1963, 85 (20), 3142-3146
DOI: 10.1021/ja00903a021 - N-broomosuccinimide. Mechanismen van allylische brominering en verwante reacties
J. H. Incremona en James Cullen Martin
Journal of the American Chemical Society 1970, 92 (3), 627-634
DOI: 10.1021/ja00706a034 - Succinimidylradicaal als ketendrager. Mechanisme van allylische brominering
J. C. Day, M. J. Lindstrom, and P. S. Skell
Journal of the American Chemical Society 1974, 96 (17), 5616-5617
DOI: 10.1021/ja00824a074 - Radicale brominering van Cyclohexeen in CCl4 door broom: Addition versus Substitution
D. W. McMillen en John B. Grutzner
The Journal of Organic Chemistry 1994, 59 (16), 4516-4528
DOI: 10.1021/jo00095a029
Dit artikel beschrijft zorgvuldige kinetische studies die aantonen dat een lage concentratie Br2 (zoals die van onzuivere NBS) radicale substitutie zal bevoordelen boven een polaire additiereactie. - o-XYLYLENE DIBROMIDE
Emily F. M. Stephenson
Org. Synth. Vol. 34, p.100 (1954)
DOI: 10.15227/orgsyn.034.0100
Een betrouwbare procedure voor benzyblische brominering met Br2 in Organic Syntheses. - Brominering van Tetralin. Short and Efficient Synthesis of 1,4-Dibromonaphthalene
Osman Çakmak, Ismail Kahveci, Íbrahim Demirtaş, Tuncer Hökelek and Keith Smith
Czech. Chem. Commun. 2000, 65, 1791-1804
DOI: 10.1135/cccc20001791
Een gemakkelijke synthese van 1,4-dibroomnaftaleen uit tetralin, via benzyblische brominering.Benzyloxidatie:
Er bestaan veel strategieën voor benzyloxidatie, waaronder het gebruik van geconcentreerde oplossingen van KMnO4 of chroomzuur. - Kinetische studies van de oxidatie van aromatische verbindingen door kaliumpermanganaat. Deel IV. n- en isopropylbenzeen
C. F. Cullis en J. W. Ladbury
J. Chem. Soc. 1955, 4186-4190
DOI: 10.1039/JR9550004186 - PIPERIDINE DERIVATIVEN X. DE PHENYLPIPERIDYLCARBINOLEN
Kenneth E. Crook en S. M. McElvain
Journal of the American Chemical Society 1930, 52 (10), 4006-4011
DOI: 1021/ja01373a035
Als er een andere substituent op de benzylpositie zit, dan geeft oxidatie met een keton in plaats van een carbonzuur. - Heterogene Permanganaat Oxidaties. 7. The Journal of Organic Chemistry 1997, 62 (25), 8767-8772
DOI: 1021/jo971168e
Reagenten kunnen worden geadsorbeerd aan vaste dragers om reacties gemakkelijker te laten verlopen en afval te verminderen. In dit geval, door het maken van de KMnO4 reagens heterogeen, de reactiviteit verandert iets, en dit kan worden benut voor een aantal chemoselectieve oxidaties.Een heleboel andere reagentia kunnen worden gebruikt voor benzylic oxidatie, hier is een selectie: - Selectieve oxidatie op koolstof grenzend aan aromatische systemen met IBX
K. C. Nicolaou, Phil S. Baran, and Yong-Li Zhong
Journal of the American Chemical Society 2001, 123 (13), 3183-3185
DOI: 10.1021/ja004218x
Een vroeg artikel van (nu rockstar van de totaalsynthese) Prof. Phil Baran (The Scripps Research Institute, La Jolla, CA) toen hij nog een PhD student was in de groep van Prof. Nicolaou. Deze gebruikt IBX (een hypervalent I(V)-reagens) om benzyloxidaties te doen, die via een radicaalmechanisme verlopen. Dit is een nuttige reactie met een breed substraat toepassingsgebied, zoals geïllustreerd door 25 voorbeelden in de paper. - Directe en selectieve benzyclische oxidatie van alkylarenen via C-H abstractie met behulp van alkalimetaalbromiden
Katsuhiko Moriyama, Misato Takemura, en Hideo Togo
Organic Letters 2012, 14 (9), 2414-2417
DOI: 10.1021/ol300853z
Dit gebruikt Oxone als terminal oxidant voor benzylic oxidation. - Synthesis of Benzylic Alcohols by C-H Oxidation
Lalita Tanwar, Jonas Börgel, and Tobias Ritter
J. Am. Chem. Soc. 2019, 141, 17983-17988
DOI: 10.1021/jacs.9b09496
Dit gebruikt mesylperoxide als oxidant voor de selectieve oxidatie van benzylposities tot alcoholen. Het benzyl mesylaat wordt gevormd, dat kan worden gehydrolyseerd tot de alcohol. - Elektrochemische benzyclische oxidatie van C-H bindingen
Jason A. Marko, Anthony Durgham, Stacey Lowery Bretz, and Wei Liu
Chem. Commun, 2019, 55, 937-940
DOI: 10.1039/C8CC08768G
Benzyclische oxidatie kan ook via elektrochemie. - Allylische en benzyclische oxidatiereacties met natriumchloriet
Samuel M. Silvestre, Jorge A. R. Salvador
Tetrahedron 2007, 63 (11), 2439-2445
DOI: 10.1016/j.tet.2007.01.012
NaClO2 is goedkoop en kan ook als oxidans worden gebruikt.
Geef een antwoord