” Hoe groot is een E. coli cel en wat is zijn massa?
On december 3, 2021 by adminHoe groot is een E. coli cel en wat is zijn massa?
Leesmodus
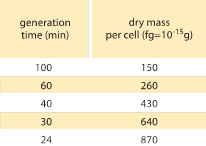
Tabel 1: Verband tussen bacteriële massa en delingsduur. De droge massa per cel wordt gegeven als functie van de generatietijd (verdubbelingstijd). Er wordt verondersteld dat de massa ongeveer exponentieel toeneemt met de groeisnelheid, zoals oorspronkelijk werd waargenomen door M. Schaechter et al. J. Gen. Microbiol., 19:592, 1958. Het celdrooggewicht werd berekend aan de hand van een waarde van 173 µg per OD460 eenheid van één ml (BNID 106437). De gebruikte stam is B/r, een stam die vaak wordt gebruikt in vroege bacteriële fysiologische studies. Waarden overgenomen uit F.C. Neidhardt, “Escherichia coli and Salmonella: Cellular and Molecular Biology”, Vol. 1., Chapter 3, ASM Press, 1996.
De grootte van een typische bacterie zoals E. coli dient als een handige standaardmaat voor het karakteriseren van lengteschalen in de moleculaire en celbiologie. Een “vuistregel”, gebaseerd op generaties van licht- en elektronenmicroscopie metingen voor de afmetingen van een E. coli cel is om deze een diameter van ongeveer ≈1µm, een lengte van ≈2µm, en een volume van ≈1µm3 (1 fL) toe te kennen (BNID 101788). De vorm kan worden benaderd als een sferocilinder, d.w.z. een cilinder met hemisferische kapjes. Gegeven de genoemde diameter en lengte kunnen we een meer verfijnde schatting voor het volume berekenen van ≈1,3 µm3 (5π/12 om precies te zijn). Het verschil tussen deze waarde en de hierboven geciteerde vuistregel toont aan met welke mate van inconsistentie wij gemakkelijk kunnen leven bij het gebruik van vuistregels. Een van de eenvoudigste routes naar een schatting van de massa van een bacterie is gebruik te maken van het ≈1 µm3 volume van een E. coli cel en aan te nemen dat deze dezelfde dichtheid heeft als water. Deze naïeve schatting resulteert in een andere standaardwaarde, namelijk dat een bacterie zoals E. coli een massa heeft van ≈1 pg (pico=10-12). Omdat de meeste cellen voor ongeveer 2/3 uit water bestaan (BNID 100044, 105482) en de andere bestanddelen, zoals eiwitten, een karakteristieke dichtheid hebben van ongeveer 1,3 maal de dichtheid van water (BNID 101502, 104272), is de omrekening van celvolume naar massa nauwkeurig tot ongeveer 10%.
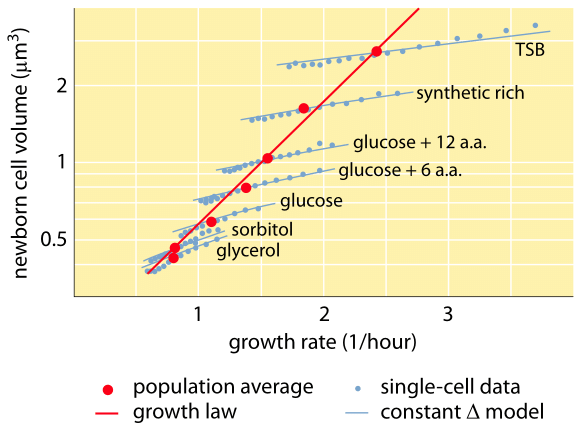
Fig. 1: Verband tussen celvolume en groeisnelheid. Met behulp van microscopie en microfluïdische apparatuur kan het celvolume onder verschillende omstandigheden worden gemeten op het niveau van één cel, wat bevestigt dat het gemiddelde celvolume exponentieel toeneemt met de groeisnelheid. De variatie tussen cellen voor een bepaalde conditie schaalt echter anders. De variatie in single-cel gedrag wordt gebruikt om modellen van celgrootte regulering te testen. (Aangepast van S. Taheri-Araghi et al., Curr. Biol. 25:385, 2015.)
Een van de klassieke resultaten van bacteriële fysiologie benadrukt dat de plasticiteit in eigenschappen van cellen voortvloeit uit de afhankelijkheid van de celmassa van de groeisnelheid. Eenvoudig gezegd: een hogere groeisnelheid gaat gepaard met grotere cellen. Deze waarneming heeft betrekking op fysiologische veranderingen waarbij media die de groeisnelheid verhogen ook grotere cellen opleveren, zoals blijkt uit figuur 1. Dit bleek ook genetisch het geval te zijn wanneer langdurige experimentele evolutiestudies die tot snellere groeisnelheden leidden, grotere celvolumes lieten zien (BNID 110462). Dergelijke waarnemingen helpen ons de mythe van “de cel” te ontkrachten – waarbij mensen, vaak zonder zich daarvan bewust te zijn, metingen over één cel gebruiken om conclusies te trekken over andere celtypes of hetzelfde celtype onder andere omstandigheden. Klassieke studies van Dennis en Bremer systematiseerden deze metingen en stelden vast dat de droge massa varieert, zoals blijkt uit tabel 1, van een gemiddelde waarde van 148 fg voor cellen die zich om de 100 minuten delen tot 865 fg voor cellen met een deeltijd van 24 minuten, wat neerkomt op een meer dan vijfvoudig verschil, afhankelijk van de groeisnelheid. Een soortgelijke tendens is waargenomen bij andere organismen (b.v. voor budding yeast, BNID 105103). Bij ongeveer 70% water komen deze waarden overeen met een volumebereik tussen ongeveer 0,4 en 2,5 µm3. Hoe kunnen we de grotere afmetingen rationaliseren voor cellen die tegen een hogere snelheid groeien? Deze vraag staat tot op de dag van vandaag ter discussie (Molenaar D. et al. MSB 5:323, 2009; Amir, A., Phys. Rev, Let., 112:208102, 2014). De verklaringen variëren van de suggestie dat het een voordeel heeft in de manier waarop de middelen worden toegewezen tot de bewering dat het eigenlijk slechts een neveneffect is van het hebben van een ingebouwde periode van ongeveer 60 minuten vanaf het moment dat een cel besluit dat hij genoeg massa heeft verzameld om de voorbereidingen voor de deling te beginnen en totdat hij klaar is met de DNA-replicatie en de daad van de deling. Deze ruwweg constante “vertragingsperiode” leidt in deze redenering tot een exponentiële afhankelijkheid van de gemiddelde celmassa van de groeisnelheid (Amir, A., Phys. Rev, Let, 112:208102, 2014).
Methodes om celvolume te meten variëren van het gebruik van een Coulter Counter ((BNID 100004), die volume afleidt op basis van veranderingen in de weerstand van een kleine opening als een cel daarin passeert, tot meer directe metingen met behulp van fluorescentiemicroscopie die cellengten en -diameters onder verschillende omstandigheden meten (figuur 1 en BNID 106577, 111480). Verrassend genoeg kan het feit dat verschillende laboratoria niet altijd op dezelfde waarden uitkomen, te wijten zijn aan verschillen in kalibratiemethoden of in precieze stammen en groeiomstandigheden. Een ongekende mogelijkheid om celmassa te meten wordt bereikt door effectief te wegen cellen op een microscopische cantilever. Zoals geïllustreerd in figuur 2A, wordt vloeistofstroming gebruikt om een cel te dwingen heen en weer in de uitgeholde cantilever. De meting maakt gebruik van het feit dat de cel massa de oscillatiefrequentie van de cantilever beïnvloedt. Deze frequentie kan met een fenomenale nauwkeurigheid worden gemeten en worden gebruikt om massa’s af te leiden met een precisie van femtogrammen. Door de richting van de vloeistofstroom te veranderen, wordt de cel gedurende minuten of langer gevangen gehouden en wordt de massaaccumulatiesnelheid continu gemeten op het niveau van één cel. Bij de eerste toepassing van deze techniek is gebleken dat eencellige cellen die groter zijn ook sneller massa accumuleren, hetgeen licht werpt op een reeds lang bestaande vraag: is celgroei lineair met de tijd of beter beschreven door een ongeveer exponentiële trend? De verschillen kunnen miniem zijn, maar met deze revolutionaire mogelijkheden werd duidelijk gezien dat het laatste scenario de situatie in verschillende geteste celtypes beter weergeeft, zoals te zien is in figuur 2B.
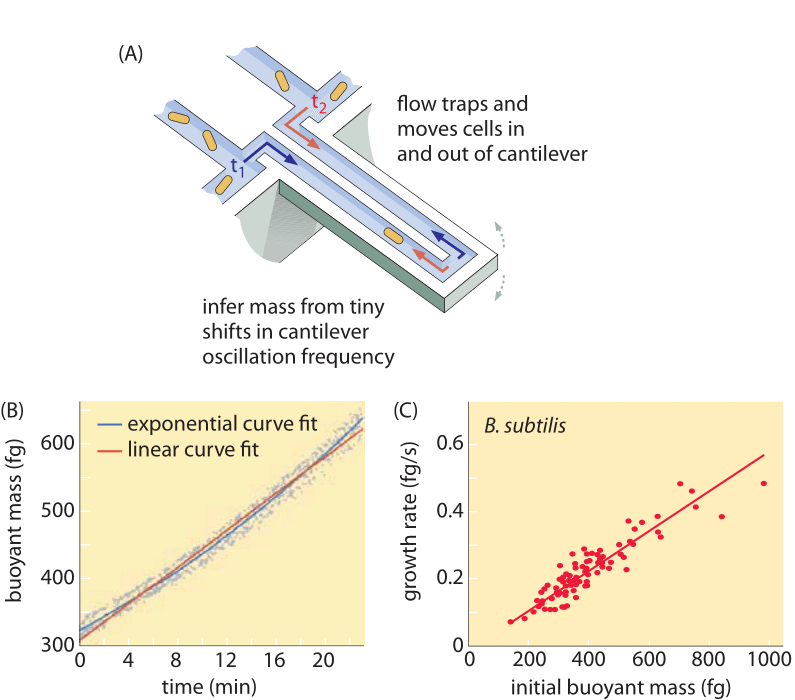
Fig. 2: Het gebruik van drijfmassa om de groei van enkele cellen te meten. (A) Een micron-schaal cantilever oscilleert bij hoge frequentie en de massa van cellen kan worden bepaald uit veranderingen in de oscillatiefrequentie. (B) Gemeten in de tijd resulteert dit in een accumulatiecurve van de massa van een enkele cel, zoals afgebeeld. (C) Afgebeeld zijn B. subtilis-cellen. Een vergelijking tussen de voorspellingen van lineaire en exponentiële groeimodellen wordt weergegeven als beste passing. De gelijkenis toont aan hoe dicht de twee modellen bij elkaar liggen over een bereik van slechts een tweevoudige toename in de loop van de celcyclus. Het drooggewicht van de cel is ongeveer 4 maal de opwaartse massa. (Aangepast van M. Godin et al., Nature Meth. 7:387, 2010.)





Geef een antwoord