Assessing Cell Health: Viability and Proliferation
On oktober 11, 2021 by adminPart I: Viability and Proliferation Assays
Viability and Proliferation
Viability en proliferation zijn twee verschillende kenmerken van cellen. Levensvatbaarheid is een maat voor het aantal levende cellen in een populatie, terwijl proliferatie een maat is voor de celdeling. Er zij op gewezen dat niet alle levensvatbare cellen zich delen. Hoewel proliferatie gemakkelijk kan worden geïnterpreteerd als levensvatbaarheid, moet afwezigheid van proliferatie niet automatisch worden opgevat als een teken van celdood.
Beoordeling van levensvatbaarheid en proliferatie
1. Membraanpermeabiliteit
Een kenmerk van dode en stervende cellen is de afbraak van cel- en kernmembranen. Veel levensvatbaarheidstests gebruiken dit kenmerk van celdood om levensvatbare van niet-levensvatbare cellen te onderscheiden.
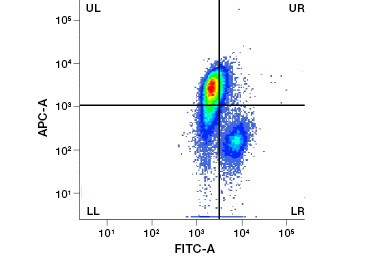
Polaire, celondoorlaatbare nucleïnezuurkleuren zoals DAPI, propidiumjodide (PI) en 7-AAD kleuren dode cellen omdat deze kleuring alleen cellen met gecompromitteerde membranen kan binnendringen. PI bindt zowel RNA als DNA, terwijl 7-AAD en DAPI alleen met DNA interageren. Deze kleurstoffen kunnen worden gebruikt in combinatie met assays die enzymatische activiteit detecteren, zoals de esterasesubstraten die in het volgende hoofdstuk worden besproken, of met levensvatbaarheidsindicatoren die door de cel kunnen worden doorgelaten, om levende en dode cellen tegelijk te kleuren. PI-, DAPI- en 7-AAD-tests kunnen worden afgelezen met een fluorescentiemicroscoop, een flowcytometer (figuur 1) of een microtiterplaatlezer.
A.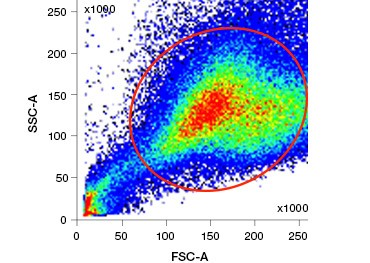
B.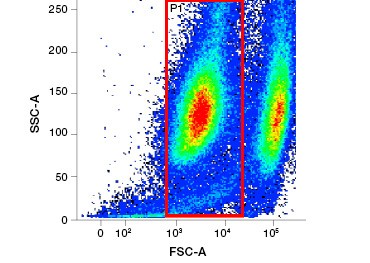
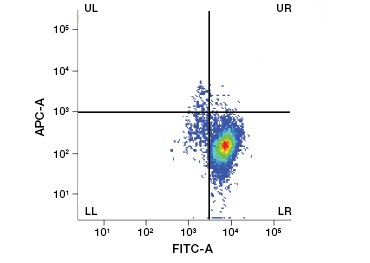
Fig. 1. Propidiumjodidekleuring verbetert de identificatie van cellen van belang. Gating van levende cellen met behulp van voorwaartse en zijwaartse verstrooiing is niet altijd voldoende om dode cellen te verwijderen en niet-specifieke binding kan nog steeds aanwezig zijn (A). Het gebruik van levensvatbaarheidskleurstoffen zoals propidiumjodide kan helpen bij het elimineren van niet-specifieke binding (B). J774 macrofagen werden gekleurd voor CD11b en CD3, waarbij de rode cirkel en rechthoek de gating-strategie voor levende cellen aangeven.
Timing is van cruciaal belang bij het gebruik van deze kleurstoffen omdat de fractie van gekleurde cellen toeneemt tijdens de kleuring naarmate cellen blijven afsterven. Opgemerkt moet worden dat geen van deze kleurstoffen fixeerbaar is. Voor toepassingen die fixatie vereisen, zijn ethidiummonoaziden of aminereactieve eiwitkleurstoffen een uitstekende keuze.
Celondoorlatende eiwitkleurstoffen zijn een goed alternatief voor nucleïnezuurkleuren, omdat ze minder toxisch zijn. Amine-reactieve kleurstoffen zijn er in een breed scala van excitatie- en emissiespectra en bieden dus meer flexibiliteit bij het ontwerpen van flowcytometrie- en microscopiepanels dan DNA-kleurstoffen. Een ander voordeel van deze eiwitkleuren is dat ze fixeerbaar zijn (figuur 2).
A.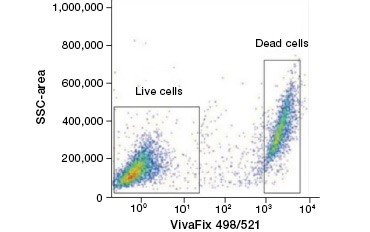
B.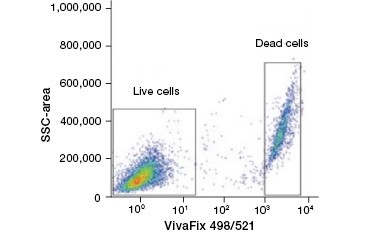
Fig. 2. Eiwitkleuren onderscheiden levende van dode cellen. Met VivaFix™ cellevensvatbaarheidstests kunnen levende en dode celpopulaties worden geïdentificeerd en vervolgens geanalyseerd in gefixeerde (A) en niet-gefixeerde (B) cellen met behulp van flowcytometrie.
Een speciale overweging bij het gebruik van de gebruikelijke eiwitkleurstof trypanblauw is dat deze kleurstof levensvatbare cellen na verloop van tijd op een celspecifieke manier kleurt. Het is daarom van cruciaal belang om trypan blauw protocollen te optimaliseren voor elk celtype en experiment.
Al deze kleurstoffen kunnen worden gebruikt op afzonderlijke cellen en weefsels en geëvalueerd met behulp van fluorescentiemicroscopie of flowcytometrie, hoewel trypan blauw kleuring wordt vaker geëvalueerd door het tellen van cellen handmatig met behulp van een hemocytometer en microscoop.
In tegenstelling tot celondoorlatende nucleïnezuurkleuren, diffunderen celpermeabele nucleïnezuurkleuren, zoals acridine oranje, gemakkelijk over celmembranen en kleuren zo het DNA van levensvatbare cellen. Niet-levensvatbare cellen worden niet efficiënt gekleurd omdat hun gecompromitteerde membranen de kleurstof gemakkelijk uit de cellen laten diffunderen. Acridine oranje is een tweevoudige fluorescentiekleuring die groene fluorescentie afgeeft wanneer zij zich bindt aan dsDNA en rode fluorescentie wanneer zij zich bindt aan ssDNA en RNA. Bij gebruik van acridine oranje als een DNA-bindende kleurstof, in gedachten houden dat het niet efficiënt bindt gecondenseerd chromatine. Zoals besproken in hoofdstuk 6, kan deze kleurstof ook worden gebruikt om het vermogen van cellen om de zure pH in de lysosomen te handhaven, een andere indicator van de levensvatbaarheid van cellen, te beoordelen. Celpermeabele nucleïnezuurkleuren kunnen worden gebruikt om levensvatbare celpopulaties te identificeren en te kwantificeren met behulp van microscopie, flowcytometrie of microplate-assay.
Celpermeabele en -permeabele kleurstoffen kunnen worden gebruikt in combinatie met fluorescent gelabelde antilichamen tegen eiwitten van belang, waardoor het eenvoudig is cruciale levensvatbaarheidscontroles in elk experiment op te nemen. Een belangrijke overweging bij het gebruik van deze kleurstoffen om de membraanintegriteit te beoordelen is dat verschillende celtypes verschillende membraanpermeabiliteitskenmerken hebben. Zo zullen sommige celondoorlatende DNA-kleurstoffen dode eukaryote cellen gemakkelijk kleuren, maar zijn ze niet in staat prokaryoten met gecompromitteerde membranen te kleuren.
Membraanintegriteit kan ook worden beoordeeld met behulp van enzymatische assays. Een populaire keuze is het beoordelen van lekkage van het cytoplasmatische enzym lactaatdehydrogenase (LDH) in het kweekmedium bij celdood. LDH colorimetrische bepalingen kunnen worden uitgevoerd in microtiterplaatformaat en worden afgelezen met een ELISA microtiterplaatlezer.
Membraandisintegratie kan ook worden gemeten met behulp van chroomvrijgavebepalingen. Hierbij worden cellen voorafgaand aan de experimentele behandeling met 51Cr gelabeld. Chroom bindt zich aan celeiwitten en komt bij celdood vrij in het kweekmedium. Door met een scintillatieteller de hoeveelheid vrij versus gebonden 51Cr te bepalen, kan de celdood kwantitatief worden gemeten. Cellen kunnen ook worden voorgelabeld met fluorescerende kleurstoffen. Deze methoden hebben soms te lijden van een hoge achtergrond als gevolg van spontane afgifte van labels; ze zijn alleen nuttig voor toepassingen die het mogelijk maken vooraf labelen van cellen van belang.
2. Enzymatische activiteit
Een ander belangrijk onderscheid tussen levensvatbare en niet-levensvatbare cellen is dat levensvatbare cellen enzymatisch actief zijn. Esterase-activiteit, zoals gemeten met substraten als carboxyfluoresceïnediacetaat (CFDA), wordt algemeen gebruikt als indicator van de totale enzymactiviteit. CFDA is een niet-fluorescerende, celdoorlatende kleurstof die wordt gehydrolyseerd tot het fluorescerende molecuul carboxyfluoresceïne door niet-specifieke intracellulaire esterasen die alleen in levensvatbare cellen aanwezig zijn. Omdat carboxyfluoresceïne negatief geladen is, wordt het niet-scheidbaar vastgehouden in levensvatbare cellen, wat resulteert in groene fluorescentie.
CFDA-SE is een derivaat van CFDA dat bij hydrolyse beter wordt vastgehouden. Het product, CFSE, heeft succinimidyl-estergroepen die covalente bindingen vormen met primaire aminen van intracellulaire eiwitten, waardoor de levensvatbaarheid van de cellen op lange termijn kan worden gevolgd. Omdat CFSE covalent in de cellen wordt vastgehouden, is het een betrouwbaardere indicator van de levensvatbaarheid van de cellen en een populaire maatstaf voor de celdeling, aangezien de fluorescentie bij elke celdeling wordt gehalveerd (figuur 3). Verbeteringen aan CFDA-SE zijn gemaakt met proliferatie kleurstoffen die een grotere cel retentie hebben, bieden een grotere resolutie van celdeling, en zijn verkrijgbaar in een breed scala van excitatie en emissie spectra op te nemen in multicolor fluorescerende toepassingen zoals flowcytometry.
A.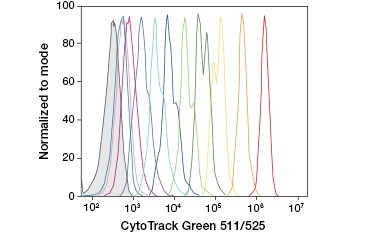
B.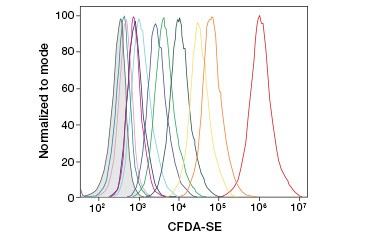
Fig. 3. Volgen van celgeneraties met behulp van flowcytometrie. Tien celgeneraties kunnen worden opgespoord met CytoTrack™ Green 511/525 Cell Proliferation Assay (A) en maximaal acht met CFDA-SE (B).
Vele andere fluorescerende esterasesubstraten, zoals calceinederivaten en BCECF, zijn verkrijgbaar met uiteenlopende eigenschappen, waaronder verschillen in excitatie/emissiespectra. Omdat de fluorescentie van BCECF pH-gevoelig is, kan deze ook veranderingen in de cytosolische pH volgen.
Met gebruikmaking van celdoorlatende esterasesubstraten kan de levensvatbaarheid worden beoordeeld met fluorescentiemicroscopie en flowcytometrie. Deze substraten kunnen ook worden toegepast op weefselmonsters of gebruikt in high-throughput microplate assays.
3. Metabole activiteit
Een andere veel voorkomende maatregel van de levensvatbaarheid van cellen is metabole activiteit, die kan worden geëvalueerd met behulp van oxideerbare en reduceerbare probes.
Resazurine is een populaire oxidatie-reductie (redox) indicator. Deze voor de cel doorlaatbare kleurstof kan rechtstreeks aan celkweekmedia worden toegevoegd, waardoor het een snelle en gemakkelijke assay is. In metabolisch actieve cellen wordt het blauwe en zwak fluorescerende resazurine gereduceerd tot resorufine, een roze en sterk fluorescerend molecuul. Deze verandering kan worden gevolgd met zowel fluorescente als colorimetrische assays. Omdat de hoeveelheid fluorescentie recht evenredig is met het aantal levende, respirerende cellen, wordt resazurine veel gebruikt om de levensvatbaarheid van cellen kwantitatief te meten. Resazurine is een handig, gevoeliger en stabieler, en niet-toxisch alternatief voor andere redox-indicatoren zoals de tetrazoliumzouten MTT en XTT. In tegenstelling tot op tetrazoliumzouten gebaseerde bepalingen, die colorimetrisch zijn en alleen met een microtiterplaatlezer kunnen worden afgelezen, kunnen levensvatbaarheidstests met resazurine worden afgelezen met flowcytometrie of fluorescentiemicroscopie. Resazurine en tetrazoliumzouten zijn bijzonder nuttig voor toepassingen met een hoge verwerkingscapaciteit, omdat de levensvatbaarheid in microtiterplaten kan worden beoordeeld met behulp van een microtiterplaataflezer (figuur 4). XTT wordt vaak verkozen boven MTT voor toepassingen met een hogere verwerkingscapaciteit omdat het, in tegenstelling tot MTT, een in water oplosbare kleurstof oplevert, waardoor een oplosbaarheidsstap die cruciaal is voor MTT-tests, overbodig wordt. Resazurine en tetrazoliumzouten worden het meest gebruikt om de levensvatbaarheid van adherente cellen en cellen in oplossing te beoordelen.
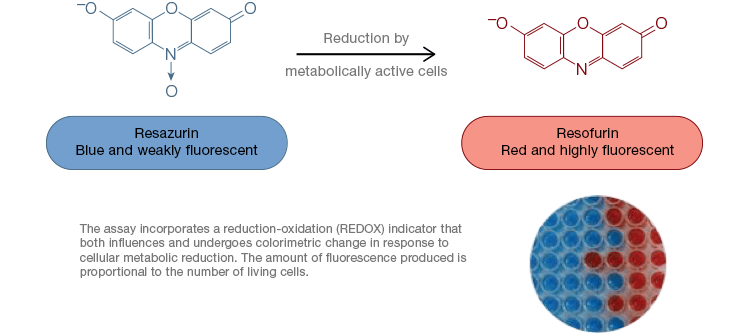
Fig. 4. Niet-toxische resazurine-oxidatietests zijn gemakkelijk schaalbaar voor toepassingen met een hoge verwerkingscapaciteit. Oxidatie van alamarBlue in metabolisch actieve cellen resulteert in een colorimetrische verandering van blauw naar rood en een toename van de fluorescentie.
Dihydrorhodaminen, -calceïnen en -fluoresceïnen zijn gereduceerde-rhodamine-, -calceïne- en -fluoresceïnederivaten die celpermeant en kleurloos zijn. Deze verbindingen worden gemakkelijk geoxideerd tot hun fluorescerende moederkleurstof door reactieve zuurstofspecies die aanwezig zijn in levende cellen en weefsels.
Een andere klasse van levensvatbaarheidstests die de metabolische activiteit meten, zijn luminescente ATP-assays. Deze kwantificeren ATP dat bij de lysis van de cellen vrijkomt. Zij vereisen geen lange incubatieperiode, zijn uiterst gevoelig, en worden gewoonlijk afgelezen met behulp van een microplatelezer.
Een factor waarmee rekening moet worden gehouden bij het gebruik van assays die de metabolische activiteit meten, is dat de metabolische activiteit onder verschillende celkweekomstandigheden kan verschillen. De juiste controles moeten dus worden opgenomen om rekening te houden met deze verschillen.
4. DNA-synthese/replicatie
Een andere maat voor de levensvatbaarheid, en een populaire methode om de proliferatie te beoordelen, is de kwantificering van BrdU-integratie in nieuw gesynthetiseerd DNA. BrdU-bevattend DNA wordt geïdentificeerd met behulp van geconjugeerde BrdU-antilichamen of BrdU-antilichamen in combinatie met een geconjugeerd secundair antilichaam (figuur 5). Deze assays maken een verscheidenheid van uitlezingen mogelijk, aangezien antilichamen aan verschillende soorten indicatoren (fluoroforen, peroxidasen, enz.) kunnen worden gekoppeld. Met antilichaamlabeling van specifieke celmerkers kunnen ook specifieke prolifererende populaties worden onderscheiden. De monsters worden na de incubatie gefixeerd en vervolgens geanalyseerd met behulp van flowcytometrie, fluorescentiemicroscopie, immunohistochemie of microtiterplaatlezers. Met behulp van flowcytometrie kunnen cellen op basis van hun totale DNA-gehalte worden ingedeeld in de G0/G1-, S- of G2/M-fase van de celcyclus. Door gebruik te maken van chromogene peroxidasesubstraten kunnen assays worden afgelezen zonder fluorometer. En door gebruik te maken van -TdR in plaats van BrdU kunnen deze bepalingen worden omgezet in een aflezing met radiolabel.
A.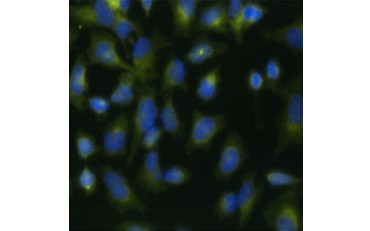
B.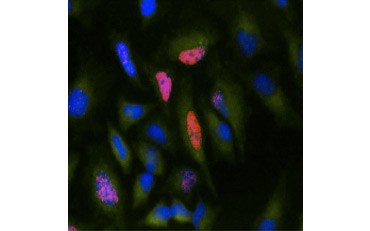
Fig. 5. Visualisatie van BrdU-opname. HeLa-cellen werden gedurende 1 uur behandeld met 10 µg BrdU (B) of onbehandeld gelaten (A). De cellen werden gekleurd met Muis Anti-BrdU Antilichaam, kloon Bu20a (MCA2483; 1:25 verdunning) en Geiten Anti-Muis IgG (H/L) DyLight 549 Geconjugeerd Antilichaam (rood) (STAR117D549GA; 1:50 verdunning) werd gebruikt als secundair antilichaam. Het cytoplasma werd gekleurd met konijn Anti-GAPDH antilichaam (AHP1628; 1:100 verdunning) en schapen Anti-Rabijn IgG DyLight 488 Geconjugeerd antilichaam (groen) (STAR36D488GA; 1:50 verdunning) werd gebruikt als een secundair antilichaam. PureBlu™ DAPI (1351303) werd gebruikt als nucleaire tegenkleuring.
5. Proliferatie marker expressie
Van bepaalde eiwitten is bekend dat ze in expressie toenemen tijdens celproliferatie. Ki-67, bijvoorbeeld, wordt uitgedrukt in de kern van delende cellen, maar is niet detecteerbaar tijdens G0 en G1 (figuur 6). Evenzo kan de fosforylering van histon H3 worden gebruikt om cellen in de M-fase te identificeren. Andere veelgebruikte proliferatiemarkers zijn prolifererend celkernantigeen (PCNA) en minichromosoombehoud 2 (MCM2). Met antilichamen tegen deze en andere belangrijke proliferatie- of cellijnmerkers kunnen ELISA’s, flowcytometrie, immunohistochemie, fluorescentiemicroscopie en Western blotting worden uitgevoerd.
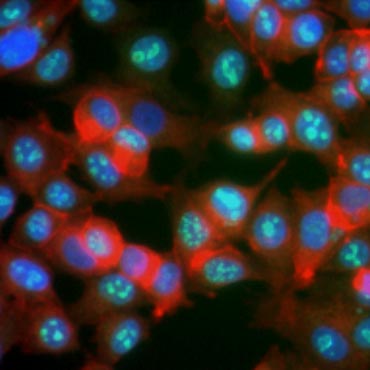
Fig. 6. Antilichamen tegen Ki-67 identificeren prolifererende cellen. Kleuring van MCF-7 cellen met humaan anti-Ki-67 (HCA006, groen), tegengekleurd met falloïdine (rood) en Hoechst (blauw).
6. Membraanpotentiaal en pH
Levende cellen houden actief ionengradiënten over hun membranen in stand, waardoor transmembraanpotentialen ontstaan. Wanneer een cel sterft, worden deze ionengradiënten verstoord. Dit kan worden beoordeeld met potentiometrische kleurstoffen. JC-1 is een veelgebruikte potentiometrische kleurstof. In gezonde cellen lokaliseert JC-1 zich in de mitochondriën, waar het rood fluorescerende aggregaten vormt. Bij afbraak van het mitochondriaal membraanpotentiaal diffundeert JC-1 door de cel en bestaat het als een groen fluorescerend monomeer. Tetramethylrhodamine ethylesters (TMRE) en Tetramethylrhodamine methylesters (TMRM) lokaliseren net als JC-1 in gezonde cellen in de mitochondriën en in stervende cellen in het cytoplasma. In tegenstelling tot JC-1 vertonen deze kleurstoffen geen verschuiving in hun emissiespectrum. In plaats daarvan resulteert permeabilisatie van de buitenmembraan van de mitochondriën in een afname van de rode fluorescentie van TMRM/TMRE.
Gezonde cellen zijn in staat een lage pH te genereren en te handhaven in de zure organellen van de cel, zoals het lysosoom. Dit kan worden gemeten met zuur-tropische kleurstoffen zoals acridine oranje en neutraal rood. Een overweging bij het gebruik van acridine oranje is dat deze kleurstof ook DNA en RNA bindt. Wanneer acridine oranje zich bindt aan enkelstrengs nucleotiden, fluoresceert het rood; wanneer het zich bindt aan dubbelstrengs DNA, fluoresceert het groen; en wanneer het zich bindt aan DNA in het lysosoom, fluoresceert het oranje.
Of welke methode ook wordt gekozen, het is van cruciaal belang om de juiste controles uit te voeren bij het uitvoeren van de hier beschreven assays, aangezien de experimentele omstandigheden en het celtype de prestaties van sommige assays kunnen veranderen. Neem altijd positieve en negatieve controles op. Wanneer probes in oplosmiddelen worden gebruikt, moeten ook met medium behandelde controles worden opgenomen om rekening te houden met de effecten van het oplosmiddel. Gebruik toepassingsspecifieke controles om factoren te controleren zoals autofluorescentie bij immunofluorescentie- en flowcytometrie-experimenten en laadcontroles bij Western blotting.
Voor informatie over Bio-Rad’s cellevensvatbaarheids- en proliferatietests, bezoek onze pagina over celgezondheid.
Lees deel II Assessing Cell Health: Apoptosis
alamarBlue is een handelsmerk van Trek Diagnostic Systems. DyLight is een handelsmerk van Thermo Fisher Scientific.
Geef een antwoord