T細胞免疫学。 The maths of memory
On 1月 20, 2022 by admin免疫学的記憶(身体が以前に遭遇した病原体を「記憶」して戦う能力)は、医学史上最も重要な発見の1つであるワクチン接種の基礎を形成しています。 しかし、ワクチン接種の大成功にもかかわらず、体がどのようにして長期的な免疫学的記憶を維持しているのかについてはまだ十分に解明されておらず、この知識のギャップが「次世代ワクチン」の開発や、がんに対してT細胞という免疫細胞を展開する取り組みの妨げになっています
免疫系にはさまざまな種類の細胞が存在します。 これらの細胞の中には、病原体に出会わなくても認識できるものがある。 しかし、T細胞を含む他の免疫細胞は、「仕事をしながら学ぶ」のです。初めて病原体に遭遇したとき、これらの細胞は比較的ゆっくりと反応しますが、後に「記憶」を形成してより効率的に反応するようになります。 長期的な免疫学的記憶がどのように維持されるかをよりよく理解するためには、記憶T細胞の動態についてもっと知る必要がある。 具体的には、新しいT細胞(ナイーブT細胞)のメモリーT細胞への勧誘、細胞分裂によるメモリーT細胞の更新、そして個々のメモリーT細胞の生存という3つのプロセスの相対的な寄与を理解する必要がある。 しかし、これらのプロセスを定量化することは困難である。
がん患者のデータを用いた以前の研究では、メモリーT細胞の寿命は比較的短いことが示されていた(Michieら、1992)。 その後、約20年前に、DNA標識技術により、研究者はT細胞がどのように急速に分裂し、死滅するかを追跡できるようになり、T細胞の動態の研究において飛躍的な進歩を遂げた(Hellersteinら、1999年)。 その後、これらの方法を用いて、メモリーT細胞は健康なヒトでは6カ月以下しか生きられないこと(Westeraら、2013年)、一方、ナイーブT細胞は最大で9年間生きられること(Vrisekoopら、2008年)が確認された。 したがって、寿命が長いことは、メモリーT細胞の重要な特徴ではない。 むしろ、一生続く可能性のある免疫学的記憶(Crotty and Ahmed, 2004)は、比較的短命の細胞によって維持されているのである。 しかし、メモリーT細胞のプールが、既存のメモリーT細胞の分裂によって、あるいはナイーブT細胞のプールへの勧誘によって、どの程度維持されているかは、まだ不明である。 ナイーブT細胞は非常に多様であり、あるナイーブT細胞がメモリーT細胞のプールに入る確率は極めて低いため、後者のプロセスはわずかな役割に過ぎないと考えられている。
さて、eLifeでは、グラスゴー大学、マウントサイナイ大学アイカーン医学部、ロイヤルフリー病院の免疫学者、Graeme Gossel、Thea Hogan、Daniel Cownden、Benedict Seddon、Andrew Yatesが、どのようにT細胞記憶が維持されるかを研究するために2つの独立したアプローチで行ったことが報告されています(Gossel et al, 2017). Gosselらは、「時間的運命マッピング」と呼ばれる手法で、抗がん剤ブスルファンを用いて、マウスの骨髄の造血幹細胞(つまり、T細胞のような血液細胞になるための幹細胞)を殺し、末梢T細胞プールはそのままにしたのです。 そして、ドナーマウスの骨髄細胞を移植したところ、表面に発現するタンパク質マーカー(CD45)のみが異なるT細胞に成熟した。 したがって、これらのマウスでは、新しく形成されたT細胞と元のT細胞とを区別し、どの細胞が置き換わっているかを追跡し、その動態を測定することができた(図1A)
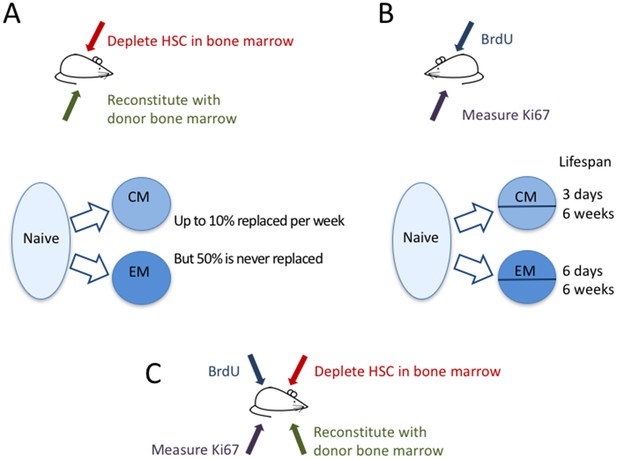
メモリーT細胞の動態
Gossel らは、2つの実験手法を用いてマウスにおけるメモリーT細胞の動態を研究した。 (A)既存のメモリーT細胞のプールへのナイーブT細胞の流入を定量化するために、彼らはCD45.1+マウスの骨髄の造血幹細胞(HSC)を選択的に殺すためにブスルファンという薬を使い(赤矢印)、CD45.2+マウスの骨髄から得た新しい細胞を加えた(緑矢印)。 Naive T細胞(水色の泡)は、1週間あたりセントラルメモリーT細胞(CM)の約10%、エフェクターメモリーT細胞(EM)の約6%を置換した(青矢印)。 常在メモリT細胞集団の約半数は決して入れ替わらなかった。 (B)二番目の実験では、メモリーT細胞のDNAをマーカーBrdUで標識し、異なるメモリーT細胞亜集団の細胞がどの程度急速に分裂し、死んでいくかを測定した。 Ki67というマーカー(紫矢印)を測定することによって、CM細胞とEM細胞を最近分裂した細胞(Ki67+)とそうでない細胞(Ki67-)に分類することができた。 CMとEMの両プールには、動きの速い細胞と遅い細胞が存在した。短命の細胞はそれぞれ3日と6日程度、長命の細胞は両サブ集団で6週間程度生きていることが確認された。 (C) 将来的には、これら2つのアプローチを組み合わせて、最近加入した細胞(CD45.2+)と既存のメモリーT細胞(CD45.1+)の細胞分裂と死について比較することが有用かもしれない。
© 2007, Seans Potato Business, Wikimedia Commons, Creative Commons Attribution-Share Alike 3.0 Unported. 図1パートA~Cで使用したマウスは、Seans Potato Businessの許可を得て複製しています。
マウスにナイーブT細胞を活性化する感染症がないにもかかわらず、メモリーT細胞のプールに常に大量のナイーブT細胞の流入があるようであった。 メモリーT細胞プールには、セントラルメモリーT細胞やエフェクターメモリーT細胞などの異なる亜集団があり、それらは表面に見られる異なるタンパク質マーカーによって区別することができる。 Gosselらは、ナイーブT細胞が1週間ごとにセントラルメモリーT細胞の10%程度を置き換えていることを発見した。 エフェクターメモリーT細胞では、この数値は若年成体で週に約6%、高齢のマウスでは週に1%であった。 7870>
このようにメモリーT細胞が新しいナイーブT細胞と急速に入れ替わるにもかかわらず、マウスが8週齢になる前に形成されたメモリーT細胞のプールの約50%は新しいナイーブT細胞に置き換わることがなかった。 このように、記憶T細胞プールのかなりの部分は生涯を通じて高い割合で入れ替わるが、同じように大きな割合が幼少期から維持されているのである。 7870>
異なるT細胞亜集団の動態をよりよく理解するために、Gosselらは細胞分裂中の細胞のDNAを標識し、細胞が分裂中に自然に発現するKi67というタンパク質を測定した(図1B)。 Ki67マーカーは、最近分裂した細胞を示す「タイムスタンプ」として使われ、DNA標識は「スタンプを押した」細胞と「スタンプを押していない」細胞の両方のダイナミクスを追跡するために使われた。 Gosselらは、中枢記憶T細胞プールとエフェクター記憶T細胞プールの両方が、本質的に異なる動態を持つT細胞サブセットで構成されていることを初めて明らかにした。 7870>
この研究は、詳細な定量実験と数理モデルを見事に組み合わせ、記憶T細胞の長期維持に関する重要な知見を明らかにしたものである。 しかし、この研究は多くの疑問も投げかけている。 例えば、実験用マウスのメモリーT細胞のプールは、ヒト成人のそれよりもヒトの赤ちゃんのそれに似ていることが最近明らかになった(Beura et al.、2016)。 清潔な実験室環境であっても、新しいナイーブT細胞が1週間あたりメモリーT細胞プールの最大10%を置き換えるとすれば、病原体に絶えず曝されているヒトではどの程度置き換えられるのか疑問に思うかもしれない。
何がこれらの細胞をメモリーT細胞プールに追い込むのか、慢性潜在感染が新しいナイーブT細胞をメモリープールに絶えず勧誘するのかもまだ不明である。 しかしながら、記憶T細胞プールのかなりの部分が抵抗性であり、ナイーブT細胞プールからの新しい細胞で置き換えることができないようである。 今後の研究では、これらのT細胞は何が原因で耐性なのか、また、感染中でさえも置換されないのか、について検討する必要がある。 最後になったが、記憶T細胞プールのうち交換されないものと、迅速かつ継続的に交換されるものを組み合わせることの利点は何なのだろうかと考える人がいるかもしれない
。
コメントを残す