2種類のイオンとその違い
On 12月 28, 2021 by admin2種類のイオンとその違い

イオン:
イオンとはプラスまたはマイナスに帯電した原子(あるいは原子団)のことです。 イオンは原子が電子を失ったり得たりすることで形成されるので、不等数の電子と陽子を含んでいます。
例.
イオンには2種類あり、
- 陽イオン
- 陰イオン

1.陽イオンは陽子、陰イオンは陰イオンである。 カチオン
正電荷のイオンはカチオンと呼ばれます。 陽イオンは原子が1個以上の電子を失うことによって形成されます。 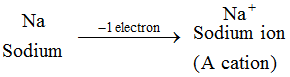 すべての金属元素のイオンは陽イオンである。
すべての金属元素のイオンは陽イオンである。  2.陰イオン
2.陰イオン
負に帯電したイオンは陰イオンとして知られている。 陰イオンは原子が1個以上の電子を獲得することによって形成される
。
例:塩素原子が1個の電子を獲得して、陰イオンである塩化物イオン(Cl-)を形成する。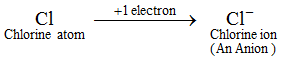 陰イオンは通常の原子より多くの電子を含む。 通常の原子(または中性原子)には、同じ数の陽子と電子があります。 さて、陰イオンは原子に1個以上の電子が加わってできるため、陽子より電子のほうが多く含まれる。 金属以外の元素のイオンはすべて陰イオンである。
陰イオンは通常の原子より多くの電子を含む。 通常の原子(または中性原子)には、同じ数の陽子と電子があります。 さて、陰イオンは原子に1個以上の電子が加わってできるため、陽子より電子のほうが多く含まれる。 金属以外の元素のイオンはすべて陰イオンである。 単純イオン
単純イオン
単一の原子から形成されるイオンを単純イオンというが、その例。
化合物イオン
複数の原子が結合してできるイオンを化合物イオンという。 アンモニウムイオンNH4+は窒素と水素の2種類の原子が結合した化合物イオンである
イオン性化合物
イオンが結合した化合物をイオン性化合物という。 イオン化合物では、正電荷のイオン(陽イオン)と負電荷のイオン(陰イオン)が強い静電気力によって結合している。 イオン化合物においてイオンをつなぎ止める力は、イオン結合または電気価数結合と呼ばれる。 イオン性化合物は、同数の正イオンと負イオンから構成されているので、イオン性化合物全体の電荷は0です
例
例:塩化ナトリウム(NaCl)は、同数の正電荷のナトリウムイオン(Na+)と負電荷の塩化物イオン(Cl-)からなるイオン化合物です。
いくつかのイオン化合物
|
S.No. |
名称 | 式 |
存在するイオン |
|||
|
1 |
塩化ナトリウムNaCl | Na+とCl- | ||||
| 2 | 塩化カリウム | KCl |
K+とCl- |
|||
|
3 |
塩化アンモニウム | NH4Cl | NH4+ とCl- | |||
|
4 |
マグネシウム 塩化カルシウム | MgCl2 | Mg2+ と Cl- | |||
| 5 | Calcium chloride | CaCl2 | Ca2+ とCl- | MgCl2 | Ca+ と Cl- | MgCl2 |
| 6 | 酸化マグネシウム | MgO | Mg2+ と O2- | |||
| 7 | 酸化カルシウム | Ca2+とO2- | ||||
| 8 | 酸化アルミニウム | Al2O3 | Al3+とO2- | |||
| 9 | 水酸化ナトリウム | NaOH | Na+とOH- | |||
| 10 | 硫酸銅 | CuSO4 | Cu2+ および SO42- | |||
| 11 | 硝酸カルシウム | Ca(NO3)2 |
Ca2+ および NO3- |
コメントを残す