Valutazione della salute cellulare: Vitalità e Proliferazione
Il Ottobre 11, 2021 da adminParte I: Saggi di Vitalità e Proliferazione
Viabilità e Proliferazione
Viabilità e proliferazione sono due caratteristiche distinte delle cellule. La vitalità è una misura del numero di cellule vive in una popolazione, mentre la proliferazione è una misura della divisione cellulare. Va notato che non tutte le cellule vitali si dividono. Anche se la proliferazione può essere facilmente interpretata come vitalità, l’assenza di proliferazione non dovrebbe essere automaticamente presa come un segno di morte cellulare.
Valutazione della vitalità e della proliferazione
1. Permeabilità della membrana
Un segno distintivo delle cellule morte e morenti è la rottura delle membrane cellulari e nucleari. Molti saggi di vitalità usano questa caratteristica della morte cellulare per distinguere le cellule vitali da quelle non vitali.
Le macchie di acido nucleico polari e impermeabili alle cellule come DAPI, ioduro di propidio (PI) e 7-AAD colorano le cellule morte perché queste macchie possono entrare solo nelle cellule con membrane compromesse. PI lega sia l’RNA che il DNA, mentre 7-AAD e DAPI interagiscono solo con il DNA. Queste macchie possono essere utilizzate in combinazione con saggi che rilevano l’attività enzimatica, come i substrati di esterasi discussi nella prossima sezione, o con indicatori di vitalità cellulare permeabili per etichettare le cellule vive e morte simultaneamente. I saggi PI, DAPI e 7-AAD possono essere letti utilizzando un microscopio a fluorescenza, un citometro a flusso (Figura 1) o un lettore di micropiastre.
A.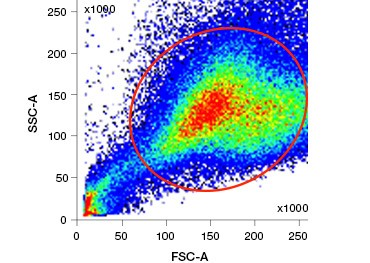
B.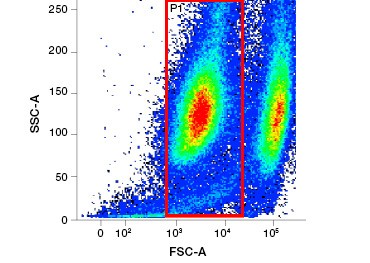
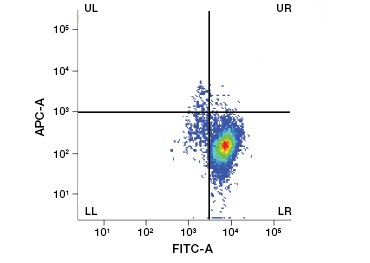
Fig. 1. La colorazione con ioduro di propidio migliora l’identificazione delle cellule di interesse. Il gating delle cellule vive utilizzando la diffusione in avanti e laterale può non essere sufficiente per rimuovere le cellule morte e il legame non specifico può essere ancora presente (A). L’uso di coloranti di vitalità come lo ioduro di propidio può aiutare ad eliminare il legame non specifico (B). I macrofagi J774 sono stati colorati per CD11b e CD3, con il cerchio rosso e il rettangolo che indicano la strategia di gating per le cellule vive.
Il tempo è fondamentale quando si utilizzano questi coloranti perché la frazione di cellule macchiate aumenta durante la colorazione come le cellule continuano a morire. Va notato che nessuno di questi coloranti è fissabile. Per le applicazioni che richiedono la fissazione, i monoazidi di etidio o i coloranti proteici ammino-reattivi sono una scelta eccellente.
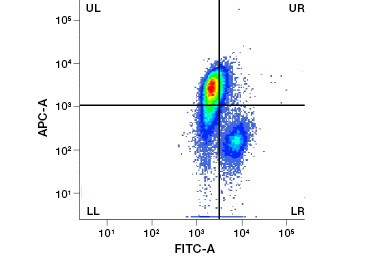
I coloranti proteici impermeabili alle cellule sono una grande alternativa ai coloranti dell’acido nucleico, poiché sono meno tossici. I coloranti ammino-reattivi sono disponibili in un’ampia gamma di spettri di eccitazione ed emissione e permettono quindi una maggiore flessibilità nella progettazione di pannelli per citometria a flusso e microscopia rispetto ai coloranti del DNA. Un altro vantaggio di queste macchie proteiche è che sono fissabili (Figura 2).
A.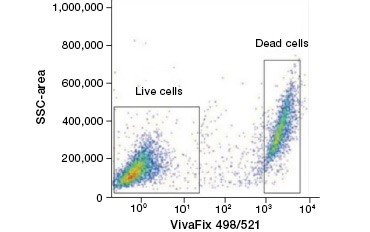
B.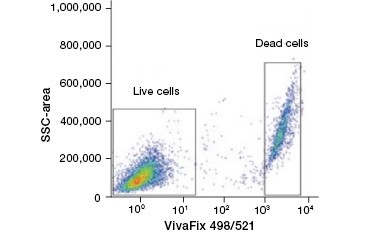
Fig. 2. Le macchie proteiche distinguono le cellule vive da quelle morte. Utilizzando i saggi di vitalità cellulare VivaFix™, le popolazioni di cellule vive e morte possono essere identificate e successivamente analizzate in cellule fissate (A) e non fissate (B) utilizzando la citometria a flusso.
Una considerazione speciale quando si utilizza il comune colorante proteico trypan blue è che questo colorante macchia le cellule vitali nel tempo in modo specifico per le cellule. È quindi fondamentale ottimizzare i protocolli trypan blue per ogni tipo di cellula ed esperimento.
Tutti questi coloranti possono essere utilizzati su singole cellule e tessuti e valutati utilizzando la microscopia a fluorescenza o la citometria a flusso, anche se la colorazione trypan blue è più comunemente valutata contando le cellule manualmente utilizzando un emocitometro e un microscopio.
A differenza delle macchie di acido nucleico impermeabili alle cellule, le macchie di acido nucleico permeabili alle cellule, come l’arancio di acridina, si diffondono facilmente attraverso le membrane cellulari e quindi colorano il DNA delle cellule vitali. Le cellule non vitali non sono efficacemente colorate perché le loro membrane compromesse permettono al colorante di diffondersi facilmente al di fuori di esse. L’arancio di acridina è un colorante a doppia fluorescenza che emette una fluorescenza verde quando si lega al dsDNA e una fluorescenza rossa quando si lega al ssDNA e all’RNA. Quando si usa l’arancio di acridina come colorante che lega il DNA, bisogna tenere presente che non lega in modo efficiente la cromatina condensata. Come discusso nella sezione 6, questo colorante può essere utilizzato anche per valutare la capacità delle cellule di mantenere il pH acido nei lisosomi, un altro indicatore della vitalità cellulare. Le macchie di acido nucleico permeabili alle cellule possono essere utilizzate per identificare e quantificare le popolazioni di cellule vitali mediante microscopia, citometria a flusso o saggio su micropiastra.
I coloranti impermeabili e permeabili alle cellule possono essere utilizzati in combinazione con anticorpi marcati con fluorescenza contro le proteine di interesse, rendendo semplice includere controlli di vitalità cruciali in ogni esperimento. Una considerazione chiave quando si utilizzano questi coloranti per valutare l’integrità della membrana è che diversi tipi di cellule hanno diverse caratteristiche di membrana-permeabilità. Per esempio, alcune macchie di DNA impermeabili alle cellule coloreranno prontamente le cellule eucariotiche morte, ma non sono in grado di colorare i procarioti con membrane compromesse.
L’integrità della membrana può anche essere valutata utilizzando saggi enzimatici. Una scelta popolare è la valutazione della perdita dell’enzima citoplasmatico lattato deidrogenasi (LDH) nel mezzo di coltura alla morte cellulare. I saggi colorimetrici LDH possono essere eseguiti in formato micropiastra e letti utilizzando un lettore di micropiastre ELISA.
La disintegrazione della membrana può anche essere misurata utilizzando saggi di rilascio di cromo. Qui le cellule sono pre-etichettate con 51Cr prima del trattamento sperimentale. Il cromo si lega alle proteine cellulari e viene rilasciato nel mezzo di coltura alla morte delle cellule. Determinando la quantità di 51Cr libero rispetto a quello legato, utilizzando un contatore a scintillazione, la morte cellulare può essere misurata quantitativamente. Le cellule possono anche essere preetichettate con coloranti fluorescenti. Questi metodi a volte soffrono di un elevato background a causa del rilascio spontaneo delle etichette; sono utili solo per applicazioni che permettono la preetichettatura delle cellule di interesse.
2. Attività enzimatica
Un’altra distinzione chiave tra cellule vitali e non vitali è che le cellule vitali sono enzimaticamente attive. L’attività dell’esterasi, misurata usando substrati come il carbossifluoresceina diacetato (CFDA), è comunemente usata come indicatore dell’attività enzimatica complessiva. CFDA è un colorante non fluorescente e permeabile alle cellule che viene idrolizzato per formare la molecola fluorescente carbossifluoresceina da esterasi intracellulari aspecifiche presenti solo nelle cellule vitali. Poiché la carbossifluoresceina è caricata negativamente, viene trattenuta in modo non covalente nelle cellule vitali, con conseguente fluorescenza verde.
CFDA-SE è un derivato di CFDA che viene trattenuto meglio dopo l’idrolisi. Il suo prodotto, CFSE, ha gruppi di estere succinimidile che formano legami covalenti con le ammine primarie delle proteine intracellulari, permettendo il monitoraggio a lungo termine della vitalità cellulare. Poiché il CFSE è covalentemente trattenuto nelle cellule, è un indicatore più affidabile della vitalità cellulare e una misura popolare della proliferazione cellulare, poiché la sua fluorescenza si dimezza ad ogni divisione cellulare (Figura 3). Miglioramenti a CFDA-SE sono stati fatti con coloranti proliferazione che hanno una maggiore ritenzione delle cellule, forniscono una maggiore risoluzione della divisione cellulare, e sono disponibili in una vasta gamma di spettri di eccitazione ed emissione per consentire l’incorporazione in applicazioni fluorescenti multicolore come la citometria a flusso.
A.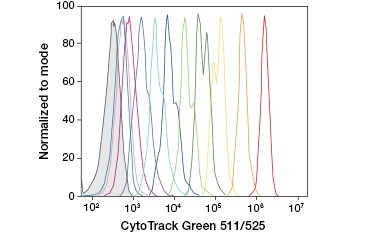
B.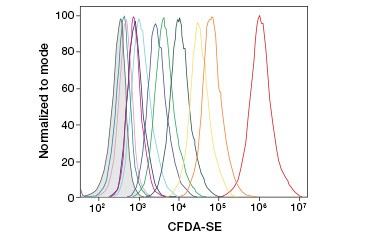
Fig. 3. Tracciamento delle generazioni di cellule mediante citometria a flusso. Dieci generazioni di cellule possono essere risolti utilizzando CytoTrack ™ Green 511/525 Cell Proliferation Assay (A) e fino a otto utilizzando CFDA-SE (B).
Molti altri substrati esterasi fluorescente, come i derivati della calceina e BCECF, sono disponibili con proprietà variabili, comprese le differenze di eccitazione / emissione spettri. Poiché la fluorescenza del BCECF è sensibile al pH, può anche seguire i cambiamenti del pH citosolico.
Utilizzando substrati di esterasi permeabili alle cellule, la vitalità può essere valutata mediante microscopia a fluorescenza e citometria a flusso. Questi substrati possono anche essere applicati a campioni di tessuto o utilizzati in saggi di micropiastra ad alta produttività.
3. Attività metabolica
Un’altra misura comune della vitalità cellulare è l’attività metabolica, che può essere valutata utilizzando sonde ossidabili e riducibili.
La resazurina è un popolare indicatore di ossido-riduzione (redox). Questo colorante permeabile alle cellule può essere aggiunto direttamente ai mezzi di coltura cellulare, rendendolo un saggio veloce e conveniente. Nelle cellule metabolicamente attive, la resazurina blu e debolmente fluorescente viene ridotta per formare la resorufina, una molecola rosa e altamente fluorescente. Questo cambiamento può essere monitorato utilizzando sia saggi fluorescenti che colorimetrici. Poiché la quantità di fluorescenza è direttamente proporzionale al numero di cellule vive e in respirazione, la resazurina è ampiamente utilizzata per misurare quantitativamente la vitalità cellulare. La resazurina è un’alternativa conveniente, più sensibile e stabile e non tossica ad altri indicatori redox come i sali di tetrazolio MTT e XTT. A differenza dei saggi basati sui sali di tetrazolio, che sono colorimetrici e possono essere letti solo utilizzando un lettore di micropiastre, i saggi di vitalità della resazurina possono essere letti utilizzando la citometria a flusso o la microscopia a fluorescenza. La resazurina e i sali di tetrazolio sono particolarmente utili per applicazioni ad alta produttività perché la vitalità può essere valutata in micropiastre utilizzando un lettore di micropiastre (Figura 4). XTT è spesso scelto sopra MTT per applicazioni ad alta produttività perché a differenza di MTT produce un colorante solubile in acqua, eliminando così una fase di solubilizzazione che è cruciale per saggi MTT. La resazurina e i sali di tetrazolio sono più comunemente usati per valutare la vitalità delle cellule aderenti e delle cellule in soluzione.
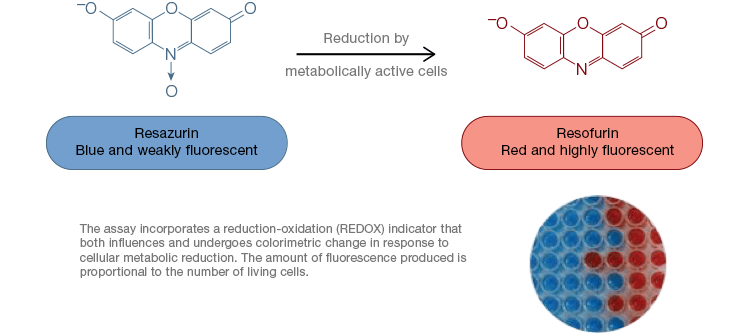
Fig. 4. Non tossico resazurin saggi di ossidazione sono facilmente scalabili per applicazioni ad alta produttività. L’ossidazione dell’alamarBlu in cellule metabolicamente attive provoca un cambiamento colorimetrico dal blu al rosso e un aumento della fluorescenza.
Diidrodamine, -calceine e -fluoresceine sono derivati ridotti di rodamina, -calceina e -fluoresceina che sono permeabili alle cellule e incolori. Questi composti sono prontamente ossidati al loro colorante madre fluorescente dalle specie reattive dell’ossigeno presenti nelle cellule e nei tessuti viventi.
Un’altra classe di test di vitalità che misura l’attività metabolica sono i test ATP luminescenti. Questi quantificano l’ATP rilasciato dalle cellule durante la lisi. Non richiedono lunghi periodi di incubazione, sono estremamente sensibili e vengono comunemente letti utilizzando un lettore di micropiastre.
Un fattore da considerare quando si utilizzano saggi che misurano l’attività metabolica è che l’attività metabolica può differire in diverse condizioni di cultura cellulare. È quindi necessario includere controlli adeguati per tenere conto di queste differenze.
4. Sintesi/replicazione del DNA
Un’altra misura della vitalità, e un metodo popolare per valutare la proliferazione, è la quantificazione dell’incorporazione di BrdU nel DNA appena sintetizzato. Il DNA contenente BrdU viene identificato utilizzando anticorpi BrdU coniugati o anticorpi BrdU in combinazione con un anticorpo secondario coniugato (Figura 5). Questi saggi permettono una varietà di letture in quanto gli anticorpi possono essere accoppiati a diversi tipi di indicatori (fluorofori, perossidasi, ecc.). L’etichettatura anticorpale di specifici marcatori cellulari permette anche di distinguere specifiche popolazioni proliferanti. I campioni vengono fissati dopo l’incubazione e poi analizzati utilizzando la citometria a flusso, la microscopia a fluorescenza, l’immunoistochimica o i lettori di micropiastre. Usando la citometria a flusso, le cellule possono essere attribuite alla fase G0/G1, S o G2/M del ciclo cellulare in base al loro contenuto totale di DNA. L’uso di substrati cromogenici di perossidasi permette di leggere i saggi senza un fluorimetro. E utilizzando -TdR invece di BrdU questi saggi possono essere convertiti in una lettura radiolabel.
A.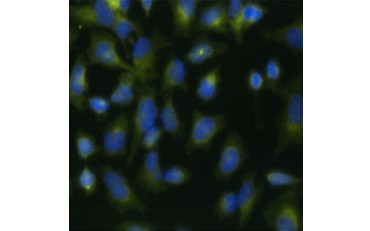
B.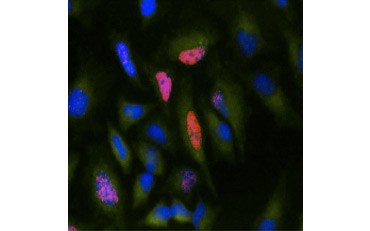
Fig. 5. Visualizzazione dell’incorporazione di BrdU. Le cellule HeLa sono state trattate con 10 µg di BrdU per 1 ora (B) o lasciate non trattate (A). Le cellule sono state colorate con un anticorpo di topo anti-BrdU, clone Bu20a (MCA2483; diluizione 1:25) e come anticorpo secondario è stato usato un anticorpo di capra anti-topo IgG (H/L) coniugato DyLight 549 (rosso) (STAR117D549GA; diluizione 1:50). Il citoplasma è stato colorato con l’anticorpo di coniglio anti-GAPDH (AHP1628; diluizione 1:100) e l’anticorpo di pecora anti-Rabbit IgG DyLight 488 coniugato (verde) (STAR36D488GA; diluizione 1:50) è stato usato come anticorpo secondario. PureBlu™ DAPI (1351303) è stato usato come colorante nucleare.
5. Espressione dei marcatori di proliferazione
Alcune proteine sono note per aumentare l’espressione durante la proliferazione cellulare. Ki-67, per esempio, è espresso nel nucleo delle cellule che si dividono ma non è rilevabile durante G0 e G1 (Figura 6). Allo stesso modo, la fosforilazione dell’istone H3 può essere usata per identificare le cellule in fase M. Altri marcatori di proliferazione comunemente usati includono l’antigene nucleare delle cellule proliferanti (PCNA) e la manutenzione del minicromosoma 2 (MCM2). Usando anticorpi contro questi, altri marcatori di proliferazione chiave o marcatori di lignaggio cellulare possono essere valutati usando ELISA, citometria a flusso, immunoistochimica, microscopia a fluorescenza e Western blotting.
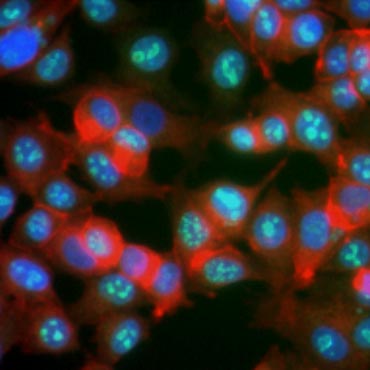
Fig. 6. Gli anticorpi contro Ki-67 identificano le cellule proliferanti. Colorazione di cellule MCF-7 con anticorpi umani anti Ki-67 (HCA006, verde) controcolorati con falloidina (rosso) e Hoechst (blu).
6. Potenziale di membrana e pH
Le cellule vive mantengono attivamente gradienti ionici attraverso le loro membrane, generando potenziali transmembrana. Quando una cellula muore questi gradienti ionici sono interrotti. Questo può essere valutato utilizzando coloranti potenziometrici. JC-1 è un colorante potenziometrico comunemente usato. Nelle cellule sane JC-1 si localizza nei mitocondri, dove forma aggregati rossi fluorescenti. Alla rottura del potenziale di membrana mitocondriale, JC-1 si diffonde in tutta la cellula ed esiste come monomero fluorescente verde. Gli esteri etilici della tetrametilrhodamina (TMRE) e gli esteri metilici della tetrametilrhodamina (TMRM) come JC-1 si localizzano nei mitocondri delle cellule sane e nel citoplasma delle cellule morenti. A differenza del JC-1 questi coloranti non mostrano uno spostamento nei loro spettri di emissione. Invece, la permeabilizzazione della membrana esterna mitocondriale provoca una diminuzione della fluorescenza rossa TMRM/TMRE.
Le cellule attive sono in grado di generare e mantenere un basso pH negli organelli acidi della cellula, come il lisosoma. Questo può essere misurato usando macchie acidotropiche come l’arancio di acridina e il rosso neutro. Una considerazione quando si usa l’arancio di acridina è che questo colorante lega anche il DNA e l’RNA. Quando legato a nucleotidi a singolo filamento, acridina arancione fluorescente rosso; quando legato a doppio filamento di DNA, fluorescente verde; e quando legato al DNA nel lisosoma, fluorescente arancione.
A prescindere dal metodo scelto, è estremamente importante includere controlli appropriati quando si esegue uno qualsiasi dei saggi descritti qui, come condizioni sperimentali e tipo di cella può alterare le prestazioni di alcuni saggi. Includere sempre controlli positivi e negativi. Quando si usano sonde in solventi, includere anche controlli trattati con veicoli per tenere conto degli effetti del solvente. Utilizzare controlli specifici per l’applicazione per controllare fattori quali l’autofluorescenza negli esperimenti di immunofluorescenza e citometria a flusso e i controlli di carico per il Western blotting.
Per informazioni sui test di vitalità e proliferazione cellulare di Bio-Rad, visitare la nostra pagina sulla gamma di salute cellulare.
Leggere la Parte II Valutazione della salute cellulare: Apoptosi
alamarBlue è un marchio di Trek Diagnostic Systems. DyLight è un marchio di Thermo Fisher Scientific.
Lascia un commento