Una meta-analisi di metronidazolo e vancomicina per il trattamento dell’infezione da Clostridium difficile, stratificata per gravità della malattia | The Brazilian Journal of Infectious Diseases
Il Gennaio 20, 2022 da adminIntroduzione
L’infezione da Clostridium difficile (CDI) è prevalente nell’ambiente sanitario in tutto il mondo sviluppato1 e può provocare gravi complicazioni, una maggiore degenza ospedaliera e costi medici aggiuntivi.2 C’è stato un marcato aumento dell’incidenza e del tasso di mortalità della CDI in Europa, Canada e Stati Uniti negli ultimi 15 anni. L’aumento è attribuibile principalmente all’emergere di un nuovo ceppo ipervirulento di BI/NAP1/027, emerso nel 2003 in Nord America e nel 2005 in Europa, rispettivamente. I dati provenienti da 28 ospedali di comunità nel sud degli Stati Uniti suggerivano che C. difficile aveva sostituito lo Staphylococcus aureus resistente alla meticillina come eziologia più comune delle infezioni associate all’assistenza sanitaria.3 Il metronidazolo e la vancomicina sono gli antibiotici più comunemente usati per la CDI, che storicamente si riteneva avessero un’efficacia simile.4,5 Nel 1995, i Centers for Disease Control and Prevention degli Stati Uniti hanno raccomandato di ridurre l’uso della vancomicina negli ospedali perché potrebbe contribuire ad aumentare la prevalenza di Enterococco resistente alla vancomicina (VRE).6 Da allora il metronidazolo è stato comunemente usato come trattamento di prima linea per la CDI. Con l’emergere e la prevalenza del ceppo ipervirulento di C. difficile (BI/NAP1/027), le infezioni sono diventate più gravi e il confronto tra metronidazolo e vancomicina è stato rivalutato,7,8 soprattutto quando viene usato per trattare i pazienti con CDI grave. Zar et al. hanno condotto il primo studio prospettico, randomizzato, in doppio cieco, controllato con placebo, in un solo centro, confrontando metronidazolo e vancomicina per la CDI. I risultati hanno mostrato che il metronidazolo e la vancomicina erano ugualmente efficaci, ma la vancomicina era superiore per i pazienti con CDI grave.9 I loro risultati erano di enorme importanza e hanno dato suggerimenti per aggiornare le linee guida della pratica clinica. La guida raccomandava che il metronidazolo fosse usato per la CDI da lieve a moderata e la vancomicina per la CDI grave, che era determinata dalla gravità dei sintomi.10-13 Tuttavia, in uno studio di Zar et al, 22 partecipanti sono stati esclusi dall’analisi e da una rigorosa analisi ITT di tutti gli 82 pazienti assegnati a caso con malattia grave, il tasso di cura iniziale non era significativamente diverso tra vancomicina e metronidazolo (79% vs 66%, p=0,22).3,14 Successivamente, Le et al. hanno riportato un tasso di risposta clinica più elevato nei pazienti con malattia grave con vancomicina, ma solo una minoranza di pazienti aveva ricevuto la vancomicina (n=8).15 Recentemente, Johnson et al. hanno riportato tassi simili di successo clinico nei pazienti con CDI grave nei pazienti trattati con vancomicina o metronidazolo, ma il metronidazolo era inferiore alla vancomicina per tutti i pazienti con CDI.16 Inoltre, Pepin et al. hanno suggerito che la perdita di superiorità della vancomicina rispetto al metronidazolo ha coinciso con l’emergere del NAP1/027.17 Pertanto, abbiamo condotto una meta-analisi stratificando i pazienti secondo la gravità della malattia, per studiare l’efficacia del metronidazolo rispetto alla vancomicina, e per indagare quale agente fosse superiore per il trattamento della malattia lieve o grave.
Materiali e metodiFonti dei dati
E’ stata condotta una ricerca sistematica della letteratura in MEDLINE via Pubmed (1978 al 31 ottobre 2014), Embase (1978 al 31 ottobre 2014) e il Cochrane Central Register of Controlled Trials (Cochrane library) per identificare gli studi rilevanti. I termini di ricerca chiave erano “metronidazolo e vancomicina e clostridium difficile”; “metronidazolo e vancomicina e colite pseudomembranosa”; “metronidazolo e vancomicina e diarrea associata ad antibiotici”. Tutti i riferimenti degli articoli inizialmente identificati, compresi gli articoli di revisione pertinenti, sono stati cercati e rivisti a mano. Gli abstract presentati in conferenze scientifiche che non erano disponibili per noi non sono stati cercati.
Selezione degli studi
Due revisori (X.ZH.D e N.B.) hanno cercato indipendentemente gli articoli ed esaminato gli studi rilevanti per un’ulteriore valutazione. Uno studio è stato considerato eleggibile se era un RCT o uno studio prospettico di coorte, se coinvolgeva pazienti adulti con CDI compresa la malattia lieve e/o grave; se studiava la sicurezza o l’efficacia di metronidazolo e vancomicina; se riportava dati specifici riguardanti la cura clinica e microbiologica, la mortalità e gli eventi avversi. Sono stati inclusi studi in cieco o non in cieco e disegni randomizzati o non randomizzati. Gli studi sperimentali basati su variabili farmacocinetiche o farmacodinamiche sono stati esclusi. Sono stati esclusi anche gli studi clinici che coinvolgono la terapia di combinazione dei farmaci.
Valutazione qualitativa
La valutazione della qualità metodologica degli RCT e degli studi di coorte inclusi nella meta-analisi sono stati eseguiti indipendentemente da due revisori (X.ZH.D e N.B.) secondo la lista di controllo sviluppata da Downs e Black.18 Questo strumento ha valutato sia gli studi randomizzati che quelli non randomizzati fornendo sia un punteggio complessivo della qualità dello studio che un profilo di punteggi per valutare la qualità del reporting, la validità esterna, la validità interna (bias, confondimento) e la potenza. Gli studi di alta qualità hanno ottenuto 15 o più punti, mentre gli studi di bassa qualità hanno ottenuto 14 o meno punti.
Estrazione dei dati
Due revisori hanno estratto indipendentemente i dati da ogni studio con un modulo di revisione predefinito. In caso di disaccordo tra i due revisori, un terzo revisore ha estratto i dati fino a raggiungere il consenso. I dati estratti da ogni studio erano: (i) anno di pubblicazione; (ii) popolazione di pazienti; (iii) numero di pazienti; (iv) agenti antimicrobici e dosaggi utilizzati; (v) risultati clinici e microbiologici; e (vi) mortalità per tutte le cause. Abbiamo usato l’analisi ITT, definita come comprendente tutti i pazienti assegnati in modo casuale.
Esiti analizzati
Cura clinica iniziale, cura sostenuta, cura microbiologica, recidiva e mortalità per tutte le cause sono stati usati come misure di risultato per questa meta-analisi. Abbiamo usato la definizione di cura clinica iniziale e di recidiva riportata nei singoli studi e abbiamo registrato le differenze tra gli studi. Gli esiti sono stati analizzati anche in base alle seguenti popolazioni: (i) tutti i pazienti compresi quelli con CDI lieve e grave; (ii) pazienti con CDI lieve; (iii) pazienti con CDI grave; e (iv) pazienti con colite pseudomembranosa (PMC).
Analisi dei dati e metodi statistici
Le analisi statistiche sono state fatte con il programma Review Manager, versione 5.2 (Cochrane Collaboration). L’eterogeneità tra gli studi è stata valutata con il test di eterogeneità χ2 (p
0,05 è stato definito per indicare un’eterogeneità significativa) e la misura di incoerenza I2. I rapporti di rischio (RR) e gli intervalli di confidenza (CI) al 95% per i risultati sono stati calcolati con il modello a effetti fissi (FEM) se non c’era un’eterogeneità statisticamente significativa tra gli studi inclusi. Altrimenti, veniva utilizzato il modello a effetti casuali (REM). Le analisi di sottogruppo sono state eseguite in base alla gravità della malattia.RisultatiStudi clinici selezionati
Il diagramma di flusso (Fig. 1) mostra il processo dettagliato di screening e selezione degli studi inclusi in questa meta-analisi. La ricerca della letteratura ha identificato 2945 abstracts. Abbiamo ottenuto 47 articoli completi per una valutazione dettagliata. Dei 41 studi esclusi, tre articoli sono stati esclusi perché erano parti di RCT già inclusi in questa meta-analisi, uno studio è stato escluso perché era uno studio farmacocinetico,19 altri studi sono stati esclusi a causa di diversi disegni di studio come la mancanza di regime di controllo, la combinazione con altri antibiotici,20,21 risultati diversi,22 o diverso tipo di pazienti,23 ecc. Così, sei studi sono stati infine inclusi in questa meta-analisi: due studi di coorte15,24 e quattro RCT.4,5,9,16
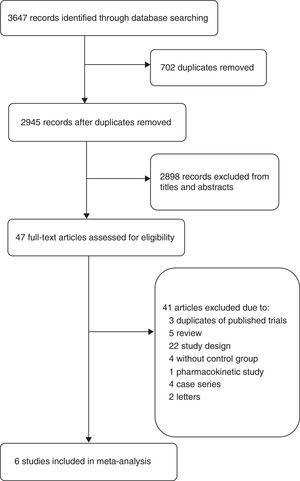
Diagramma di flusso degli studi inclusi.
Caratteristiche degli studi
Le caratteristiche principali degli studi analizzati sono riportate nella tabella 1. Gli studi inclusi erano di alta qualità (due RCT avevano un punteggio di 23, due un punteggio di 20, e due studi di coorte un punteggio di 17). Due RCT sono stati condotti utilizzando disegni randomizzati, in doppio cieco e con controllo del placebo,9,16 mentre gli altri due utilizzando solo la randomizzazione.4,5 Tre studi sono stati condotti negli Stati Uniti,4,9,15 due studi sono stati condotti in Austria,5,24 mentre un unico studio comprendente due RCT è stato condotto rispettivamente negli Stati Uniti e in Europa.16 La definizione di CDI, la cura clinica iniziale e la recidiva sono riportate nella tabella 1 supplementare. La definizione di CDI includeva invariabilmente un test per la tossina C. difficile, microrganismi o PMC combinato con la diarrea. Tuttavia, le definizioni di diarrea variavano leggermente, ma la maggior parte degli studi si riferiva alla diarrea come feci non formate almeno tre volte in un periodo di 24 ore.5,9,15,16 Gli esiti della cura clinica iniziale e della recidiva erano riportati in tutti gli studi con definizioni leggermente diverse. Per esempio, cinque studi4,5,9,15,16 consideravano la cura clinica iniziale se la diarrea si risolveva entro 6-8 giorni di trattamento, mentre Zar9 e Wenisch5 incorporavano un risultato negativo di una misurazione della tossina C. difficile o della proteina C reattiva. La maggior parte ha considerato la recidiva quando i sintomi sono ricomparsi e/o i risultati dei test microbiologici positivi sono stati confermati durante il follow-up di 21-30 giorni dopo la risoluzione iniziale dei sintomi.4,5,9,15,16 La cura sostenuta è stata definita come la cura clinica in assenza di recidive durante il follow-up, che è stata calcolata come la cura clinica iniziale meno le recidive. La guarigione riportata da Wenisch24 è stata considerata come cura sostenuta. I pazienti con CDI moderata nello studio di Johnson et al. sono stati considerati come malattia grave, mentre tutti i pazienti inclusi nello studio di Wenisch et al. sono stati considerati come malattia lieve in base alla valutazione della gravità della CDI utilizzata negli studi di Zar9 e nelle linee guida.11 Inoltre, Wenisch et al. non hanno indicato l’assegnazione del trattamento di sette dropout da tutti i gruppi,5 Johnson et al. hanno riferito che l’analisi ha incluso tutti i pazienti randomizzati che hanno ricevuto almeno una dose di antibiotici e hanno avuto una valutazione post-dose,16 che potrebbe aver influenzato i risultati ITT.
Tabella supplementare relativa a questo articolo può essere trovata, nella versione online, a http://dx.doi.org/10.1016/j.bjid.2015.03.006.
Cura clinica iniziale
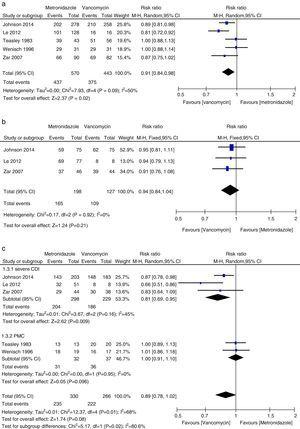
Meta-analisi dei tassi di guarigione clinica iniziale che confrontano il metronidazolo con la vancomicina per tutti i CDI, CDI lieve, CDI grave e PMC.
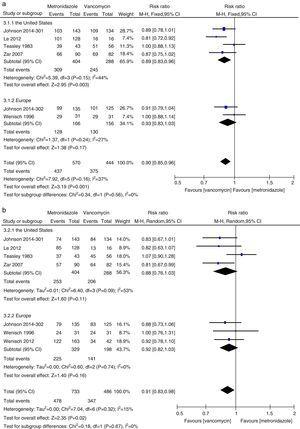
Meta-analisi della cura clinica iniziale e dei tassi di cura sostenuta confrontando il metronidazolo alla vancomicina per tutti i pazienti CDI dagli Stati Uniti e dall’Europa.
Cura sostenuta Tasso di recidiva Cura microbiologica
Due RCT rilevanti hanno fornito tassi di cura microbiologica, definiti come risultati negativi della coltura delle feci di follow-up post trattamento e del test della citotossina per C. difficile in pazienti trattati senza sintomi clinici.4,5 Per quanto riguarda la cura microbiologica, la terapia con metronidazolo è stata efficace quanto la terapia con vancomicina (161 pazienti, FEM, RR=0,88, 95% CI=0,64-1,21, p=0,43, Fig. 6).

Meta-analisi della cura microbiologica che confronta il metronidazolo con la vancomicina per CDI.
Tasso di morte per tutte le cause
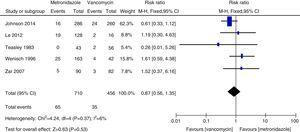
Meta-analisi del tasso di morte per tutte le cause che confronta il metronidazolo con la vancomicina per la CDI.
Discussione
La CDI è un problema serio nel sistema sanitario con una crescente incidenza in tutto il mondo che può causare morbilità e mortalità significative.25 I tassi di mortalità riportati per i pazienti con CDI grave vanno dal 9% al 25%; più della metà di questi decessi sono legati alla CDI.14,26 È particolarmente importante trattare i pazienti con CDI grave utilizzando una terapia antimicrobica appropriata.
In questa meta-analisi abbiamo trovato che la vancomicina era superiore al metronidazolo in termini di cura clinica iniziale e cura sostenuta nei pazienti con CDI. I tassi di cura microbiologica, era numericamente inferiore con la terapia con metronidazolo che con vancomicina, anche se la differenza non era significativa. Gli autori di un position paper del 2011 nella loro analisi raggruppata hanno trovato tassi equivalenti di cura clinica iniziale con metronidazolo e vancomicina, gli agenti più comunemente usati.27,28 Questa incongruenza era principalmente dovuta ai diversi studi inclusi in ciascuna revisione sistematica. Abbiamo incluso altri tre studi nell’attuale meta-analisi.15,16,24 Quando i dati sono stati analizzati in base alla gravità della CDI, il trattamento con vancomicina o metronidazolo non differiva per i pazienti con malattia lieve. Tuttavia, i tassi di cura clinica e di cura sostenuta con la vancomicina nei pazienti con CDI grave erano significativamente maggiori di quelli del gruppo metronidazolo. Non abbiamo trovato prove sufficienti che la vancomicina e il metronidazolo fossero ugualmente efficaci nei pazienti con PMC, a causa del piccolo numero di pazienti valutati. La PMC è stata usata come marcatore della malattia grave.12 Quando i pazienti con CDI grave hanno incluso i pazienti con PMC, non è stata trovata alcuna differenza significativa tra la terapia con metronidazolo e vancomicina. Sebbene non sia stata osservata alcuna differenza statistica, è stata notata una forte tendenza verso una cura clinica iniziale e tassi di cura sostenuti più alti nel gruppo della vancomicina, mentre era lo stesso per i pazienti con CDI lieve. Quindi, per i pazienti con CDI grave la vancomicina era superiore al metronidazolo. Venugopal et al. hanno dimostrato che i pazienti con CDI grave erano più inclini a passare alla vancomicina, suggerendo che questi pazienti rispondevano male al metronidazolo.29 Questi risultati sono stati confermati nella meta-analisi attuale. I risultati del trattamento con il metronidazolo erano scarsi perché il flusso di sangue al colon nei pazienti con malattia grave potrebbe essere diminuito con conseguente minore trasudazione del metronidazolo nel lume.30,31 Inoltre, la fidaxomicina è stata recentemente approvata per il trattamento della CDI e può essere utilizzata come agente secondario in caso di fallimento con la vancomicina o il metronidazolo perché la fidaxomicina è rimasta rilevabile nei campioni di feci raccolti fino a cinque giorni dopo una singola dose.32 In uno studio di meta-analisi, la fidaxomicina ha dimostrato tassi di guarigione clinica simili a quelli della vancomicina con una significativa diminuzione del tasso di recidiva sia nei pazienti con CDI grave che non grave.33 Pertanto, per il trattamento iniziale della CDI grave, la vancomicina orale è il farmaco di prima linea; In alternativa, può essere usata la fidaxomicina orale.
I tassi di recidiva di vancomicina e metronidazolo erano in generale accordo con i dati precedenti e non è stata trovata alcuna differenza significativa.27,28 Tuttavia, la vancomicina era associata a tassi di recidiva più bassi rispetto al metronidazolo sia in tutti i pazienti con CDI che in quelli con CDI grave. Il nostro studio suggerisce che il tasso di mortalità per tutte le cause non era significativamente diverso tra vancomicina e metronidazolo in tutti i pazienti con CDI. Il tasso di mortalità per tutte le cause di tutti i pazienti con CDI è stato di 100/1166 (8,5%), che è inferiore a un’indagine europea che mostra un tasso di mortalità per tutti i casi di 101/455 (22%) dopo tre mesi.1
I risultati della presente meta-analisi devono essere visti nel contesto di potenziali limitazioni. In primo luogo, l’epidemiologia del C. difficile è cambiata rapidamente con una grande proporzione di casi gravi e ricorrenti che si verificano in questi paesi rispetto a quanto riportato in precedenza.1 Questo potrebbe comportare differenze nelle popolazioni di studio. In secondo luogo, negli ultimi dieci anni sono emersi nuovi metodi per la diagnosi di CDI. L’uso di test più sensibili e rapidi per la diagnosi di CDI è fondamentale per la gestione clinica dei pazienti. Anche se i criteri diagnostici non erano così rigorosi in alcuni casi, la risposta al trattamento non differiva sostanzialmente all’interno di un singolo regime farmacologico o tra i farmaci.4 In terzo luogo, poiché questa meta-analisi ha incluso un numero relativamente piccolo di studi, specialmente gli RCT, la precisione delle stime potrebbe essere stata compromessa. Quarto, gli investigatori non erano ciechi all’assegnazione del trattamento nei quattro studi, il che potrebbe aver introdotto distorsioni nei risultati di efficacia riportati. Quinto, la maggior parte degli studi inclusi non assicurava che tutti i casi di diarrea dei pazienti inclusi fossero causati da C. difficile, perché questi non escludevano la presenza di altri patogeni nelle feci come causa della diarrea.4,5 Sesto, il punteggio di gravità non è ancora validato e abbastanza scientifico, e doveva essere migliorato non solo per la standardizzazione degli studi futuri, ma anche per l’uso nella pratica clinica.27,34 Pertanto, i risultati attuali devono essere ulteriormente confermati.
In conclusione, nonostante le limitazioni della meta-analisi attuale, queste analisi indicano che la vancomicina offre vantaggi significativi nel trattamento della CDI rispetto al metronidazolo. I pazienti hanno tollerato bene i due farmaci e i tassi di ricaduta sono stati simili. Per i pazienti con CDI lieve, la terapia con metronidazolo era clinicamente efficace quanto la vancomicina; per i pazienti con CDI grave la vancomicina era più efficace del metronidazolo. Questa differenza di efficacia era più evidente nel sottogruppo di CDI grave e ha sostenuto le recenti raccomandazioni di utilizzare la vancomicina come terapia di prima linea per la CDI grave.
Conflitti di interesse
Gli autori non dichiarano conflitti di interesse.
Finanziamento
Questo studio è stato sostenuto dal Major National Science and Technology Special Projects for New Drug (No. 2012ZX09303004) e Beijing Municipal Natural Science Foundation (No. 7132168).
Lascia un commento