Reazioni sul carbonio “benzilico”: bromurazione e ossidazione
Il Ottobre 12, 2021 da adminIl carbonio adiacente a un anello aromatico – il carbonio “benzilico” – può partecipare a diverse reazioni utili e interessanti. Oggi forniremo esempi e meccanismi per due esempi chiave: bromurazione benzilica e ossidazione benzilica. Ecco il rapido riassunto:
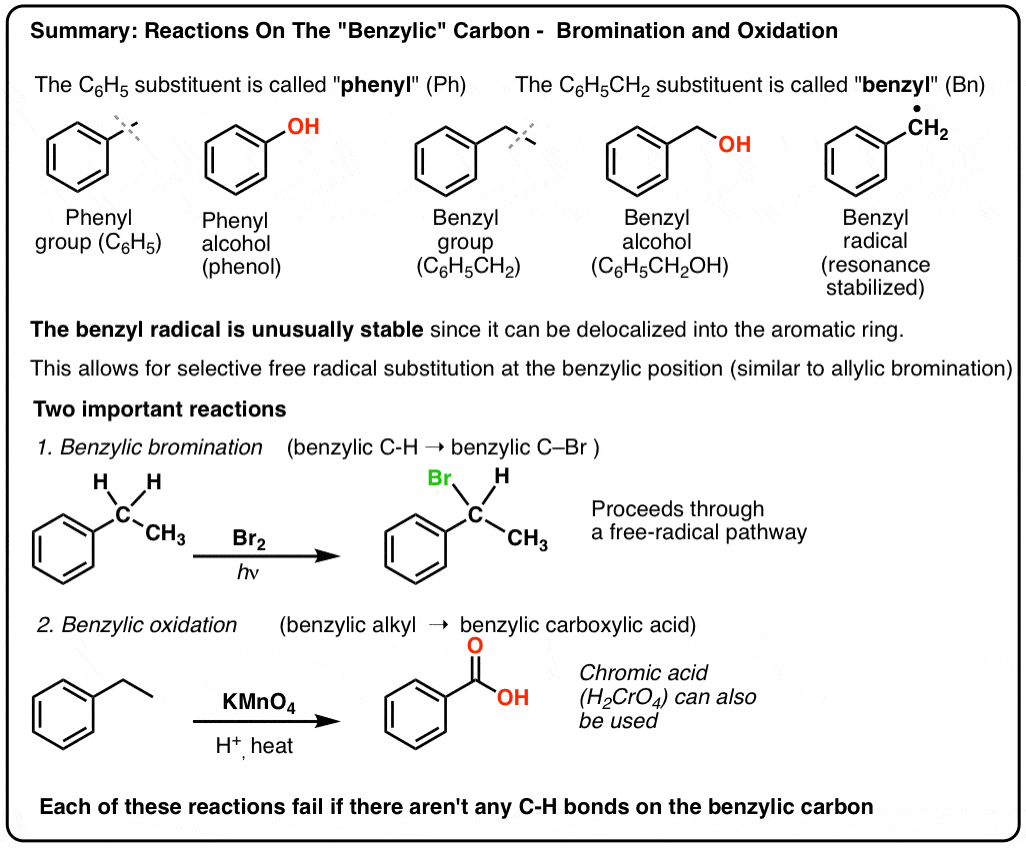
Tabella del contenuto
- Gruppi alchilici = “ruvidità”
- C’è qualcosa di speciale nei gruppi alchilici adiacenti a un anello di benzene
- “Fenile” vs “Benzile” : Qual è la differenza?
- I radicali benzilici sono stabilizzati per risonanza; i radicali fenilici no.
- I legami C-H benzilici (e allilici) sono deboli, relativamente ad altri legami C-H alchilici
- Brominazione benzilica
- Quando la “brominazione benzilica” NON funziona?
- Applicazioni della bromurazione benzilica
- Ossidazione benzilica con KMnO4 (o H2CrO4)
- L’ossidazione benzilica richiede un legame C-H benzilico
- Perché è importante?
- Note
- Quiz Yourself!
- (Avanzato) Riferimenti e ulteriori letture
Gruppi alchilici = “Roughage”
Nella nutrizione, “roughage” è come si chiama tutta la cellulosa e le fibre presenti nei prodotti alimentari che attraversano il corpo senza essere effettivamente digerite.
Questo descrive abbastanza bene il comportamento dei gruppi alchilici nella maggior parte delle reazioni di chimica organica che abbiamo imparato. La loro chimica è “noiosa”. Possono costituire la spina dorsale e la struttura generale della molecola, ma i loro legami C-H sono inerti alla maggior parte delle condizioni di reazione.
Infatti, se non contiamo la combustione, praticamente l’unica reazione dei gruppi alchilici che trattiamo nella chimica organica introduttiva è la sostituzione free-radical. E anche quella reazione tende ad essere piuttosto poco selettiva, in particolare se si tratta di clorurazione a radicali liberi.
Abbiamo visto che un’eccezione a questo comportamento “noioso” può essere trovata nella bromurazione free-radical dei cosiddetti legami C-H “allilici”. La posizione “allilica” è un carbonio che è adiacente a un doppio legame (non un C-H sul doppio legame stesso! quello è un C-H “vinilico”).
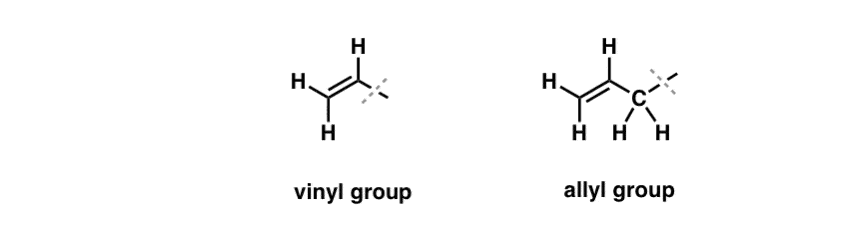
Cosa rende la posizione “allilica” così speciale? I radicali allilici, i carbocationi e gli anioni sono notevolmente stabilizzati attraverso la risonanza. L’orbitale del radicale allilico, del carbocation o dell’anione può allinearsi con gli orbitali p del legame pi adiacente, creando un “sistema pi” più grande e distribuendo la carica su un’area maggiore.
C’è qualcosa di speciale nei gruppi alchilici adiacenti a un anello di benzene
Qual è il motivo di questo piccolo viaggio sul viale della memoria? Beh, abbiamo recentemente passato un po’ di tempo sulla reazione di alchilazione di Friedel-Crafts, e non voglio darvi l’impressione che mettere un gruppo alchilico su un anello benzenico sia un vicolo cieco sintetico.
I gruppi alchilici non devono essere inerti! Come i carboni allilici, i gruppi alchilici che sono adiacenti agli anelli benzenici sono particolarmente reattivi, e questo può avere tutti i tipi di applicazioni importanti.
Ci sono due importanti reazioni che copriremo in questo post:
- Bromurazione benzilica – bromurazione a radicali liberi del gruppo alchilico adiacente a un anello aromatico
- Ossidazione benzilica – ossidazione completa di un gruppo alchilico adiacente al benzene a un acido carbossilico.
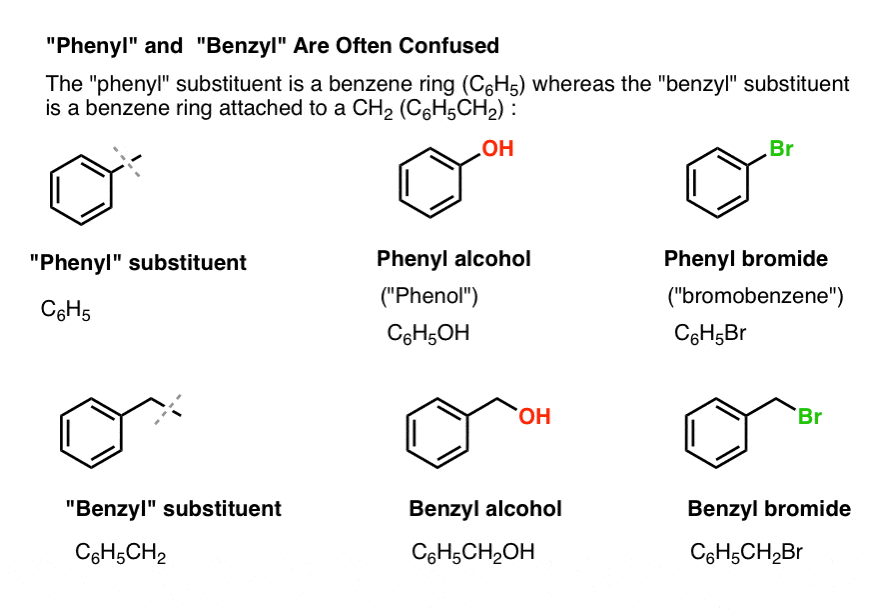
3. “Fenile” vs “Benzil” : Qual è la differenza?
Primo, un rapido ordine del giorno. Togliamo di mezzo un po’ di nomenclatura importante, perché “fenile” e “benzile” causano molta confusione:
- Un gruppo fenile (o sostituente fenile) è il benzene meno un idrogeno: C6H5 . I carboni nell’anello sono carboni fenilici, e gli idrogeni attaccati ai carboni fenilici sono legami fenilici C-H. È analogo al vinile (vedi sopra).
- Un gruppo benzilico è il metilbenzene meno un idrogeno: C6H5CH2 . Il carbonio adiacente all’anello è il carbonio benzilico, e gli idrogeni attaccati al carbonio benzilico sono chiamati idrogeni benzilici. È analogo all’allile (sopra).
4. I radicali benzilici sono stabilizzati per risonanza; i radicali fenilici no.
L’analogia del fenile con il vinile e del benzile con l’allile si estende anche alla stabilità dei loro radicali (così come dei loro carbocationi e anioni).
- I radicali fenili non sono stabilizzati dalla risonanza, poiché l’orbitale contenente il radicale è ad angolo retto rispetto agli orbitali del sistema pi, e non c’è sovrapposizione tra loro. I radicali su carboni ibridati sp2 sono generalmente meno stabili dei radicali su carboni alchilici. (Vedi post: tre fattori che destabilizzano i radicali liberi)
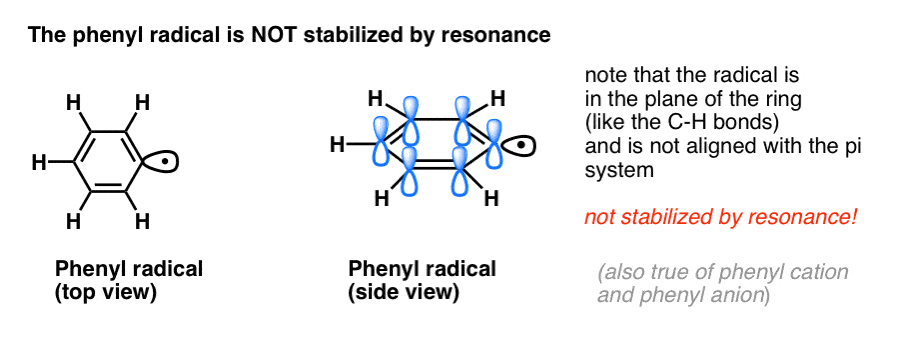
- I radicali benzilici sono insolitamente stabili poiché l’orbitale contenente il radicale può allinearsi con il sistema pi dell’anello benzenico, proprio come nei loro cugini allilici (questo è vero anche per i cationi e gli anioni benzilici).
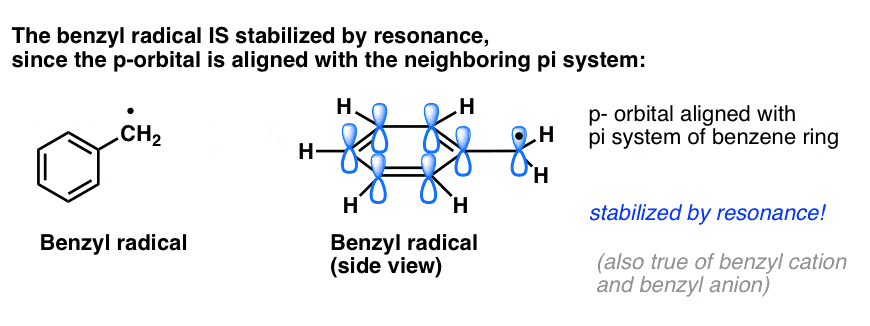
I legami C-H benzilici (e allilici) sono deboli, relativamente ad altri legami C-H alchilici
I legami C-H benzilici hanno forza di legame (alias BDE, o energie di dissociazione del legame) di circa 90 kcal/mol, che è considerevolmente più debole dei legami C-H terziari (forza del legame 93 kcal/mol), C-H secondari (96 kcal/mol) e C-H primari (100 kcal/mol). (I legami C-H fenili sono circa 113 kcal/mol, di nuovo riflettendo l’instabilità dei radicali fenili).
Poiché le energie di dissocazione dei legami riflettono la facilità di scissione omolitica del legame C-H (cioè quanto è facile dissociare il legame in due radicali liberi) questo è un altro modo per dire che i radicali benzilici sono particolarmente facili da formare, rispetto ad altri radicali alchilici.
Abbiamo già visto che lo stesso è vero per i legami C-H allilici. Nella ‘bromurazione allilica’, uno dei legami C-H sul gruppo alchilico adiacente a un doppio legame viene convertito in un legame C-Br, usando N-bromosuccinimmide (NBS) e luce (hν) :
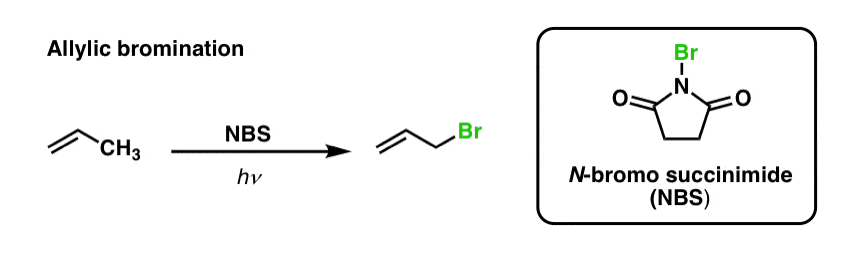
La reazione è selettiva per il C-H allilico in presenza di legami C-H primari, secondari e terziari a causa della debole resistenza del legame C-H allilico (89 kcal/mol).
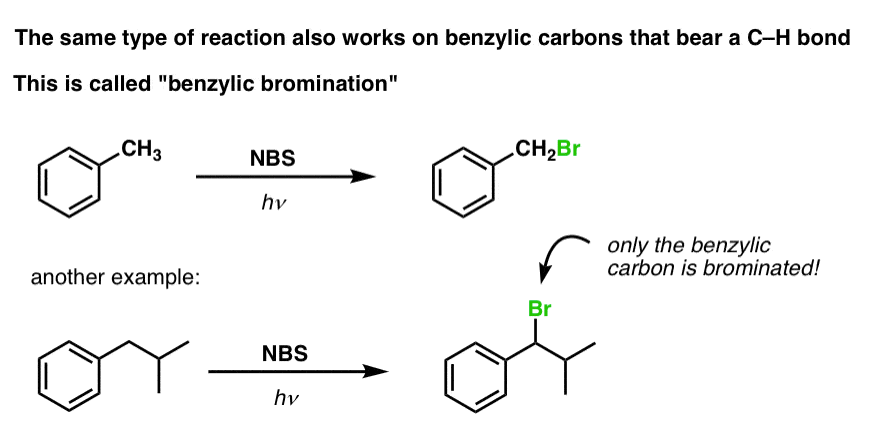
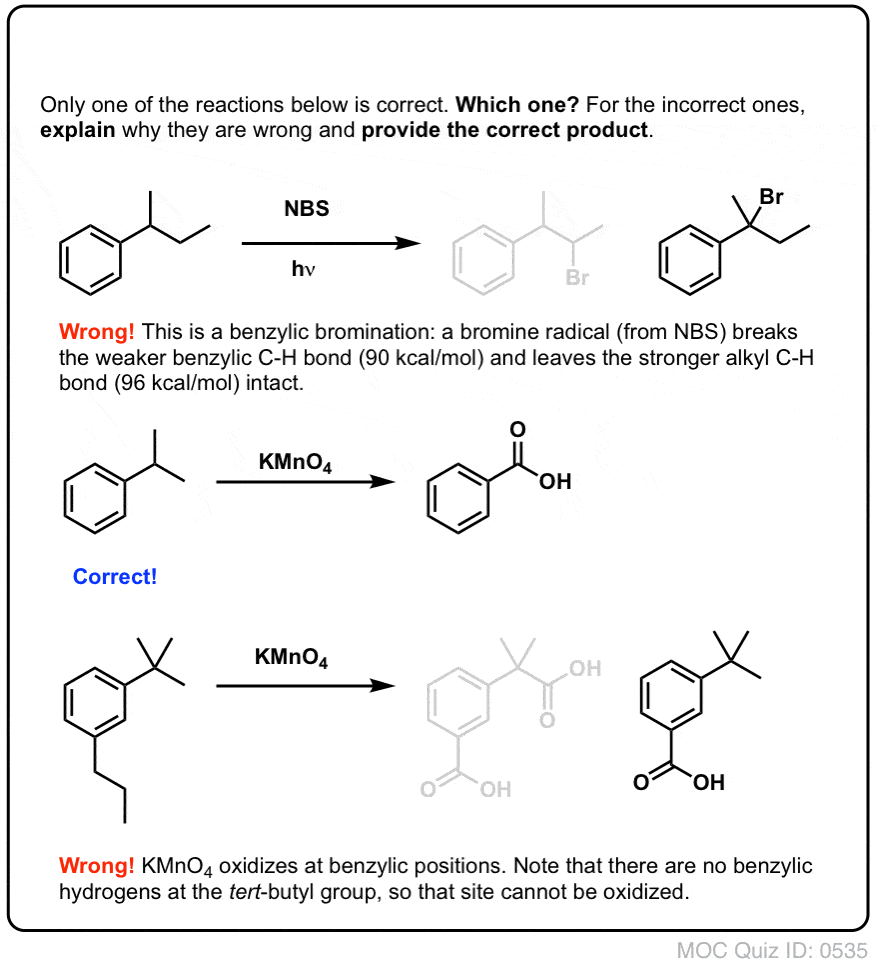
Bromurazione benzilica
Un processo simile funziona per i carboni “benzilici”. Possiamo usare NBS (come sopra) o semplicemente Br2, poiché gli anelli aromatici non sono così reattivi con Br2 come i doppi legami.
Una volta formato (attraverso il “calore” o la “luce”, che avvia la reazione attraverso la dissociazione omolitica di Br-Br), il radicale bromo, Br- può rompere i legami C-H benzilici più deboli senza toccare i legami C-H alchilici più forti.
Per esempio, ecco i prodotti della sua reazione con il toluene, e anche l’isopropilbenzene. Si noti che SOLO il carbonio benzilico è bromurato. Tutto il resto è lasciato solo!
Il meccanismo della bromurazione benzilica è essenzialmente identico alla bromurazione allilica, con fasi di inizio, propagazione e terminazione. (Clicca qui per vedere un’immagine pop-up del meccanismo.)
(Per ulteriori discussioni, vedi questo post: Brominazione allilica)
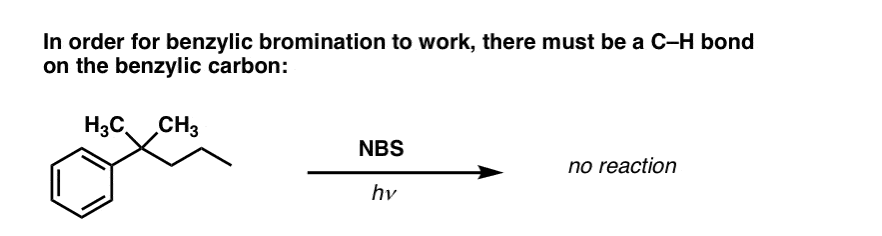
Quando la “bromurazione benzilica” NON funziona?
Siccome la chiave di questa reazione è la formazione del radicale benzilico (relativamente stabile), la bromurazione benzilica fallirà su substrati dove la generazione di questo radicale attraverso la rottura di un legame C-H è impossibile.
Per esempio, guarda l’esempio qui sotto. Come può essere generato un radicale benzilico quando il carbonio benzilico ha tre gruppi alchilici attaccati? Non può – e la reazione fallisce.
Applicazioni della bromurazione benzilica
Perché la bromurazione benzilica potrebbe essere utile?
Beh, ci permette di impiegare tutte le reazioni degli alogenuri alchilici che abbiamo trattato in Org 1 – soprattutto sostituzione ed eliminazione – per fornire prodotti che sarebbe difficile installare direttamente su un anello aromatico attraverso le reazioni di Friedel-Crafts.
Per esempio, possiamo usare la bromurazione benzilica per impostare una reazione SN2, per esempio dopo un’alchilazione di Friedel-Crafts:
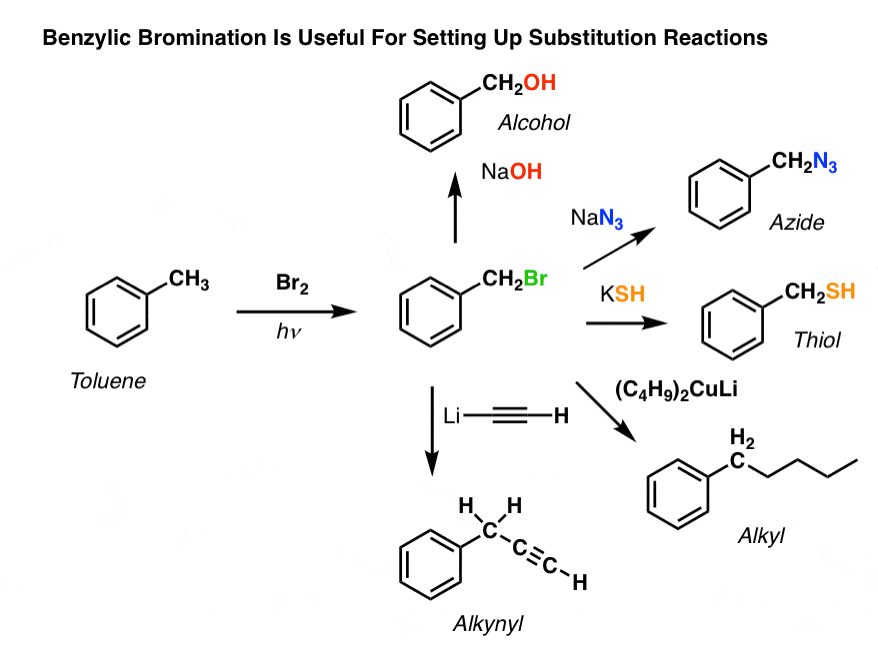
Vedi come l’installazione di un buon gruppo lasciante in posizione benzilica ci dà tutti i tipi di opzioni per installare vari gruppi funzionali?
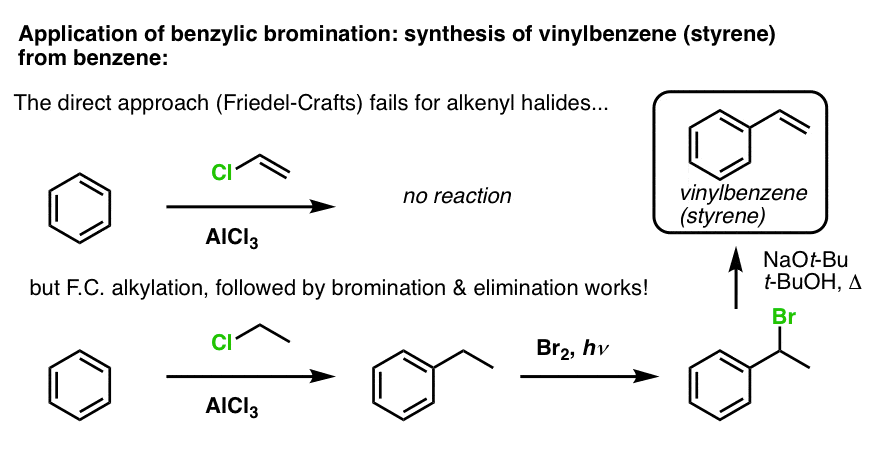
Un altro esempio è la sintesi dello stirene dal benzene. A prima vista, l’approccio più diretto potrebbe sembrare la reazione di Friedel-Crafts del cloruro di vinile con il benzene. Ma la Friedel-Crafts non funziona per gli alogenuri alchenilici (alias alogenuri di vinile)! (i carbocationi di vinile sono meno stabili dei carbocationi di alchile).
Possiamo aggirare questo ostacolo eseguendo un’alchilazione di Friedel-Crafts con cloruro di etile, seguita da bromurazione benzilica e poi eliminazione (via E2, con qualcosa come NaOtBu/t-BuOH) per dare l’alchene:
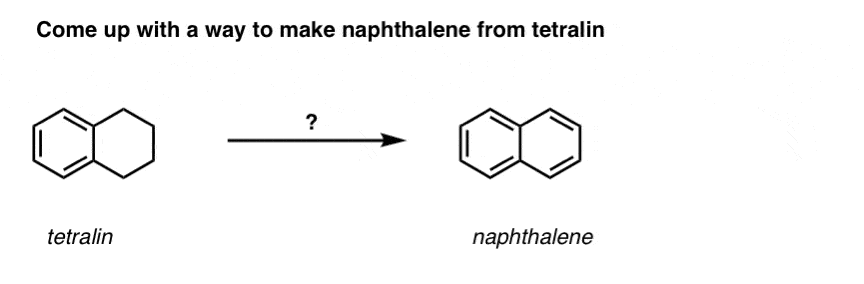
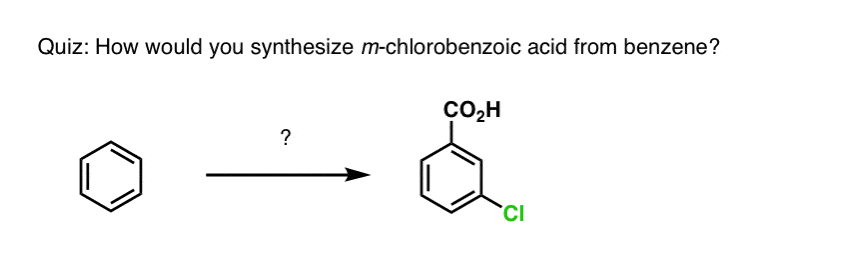
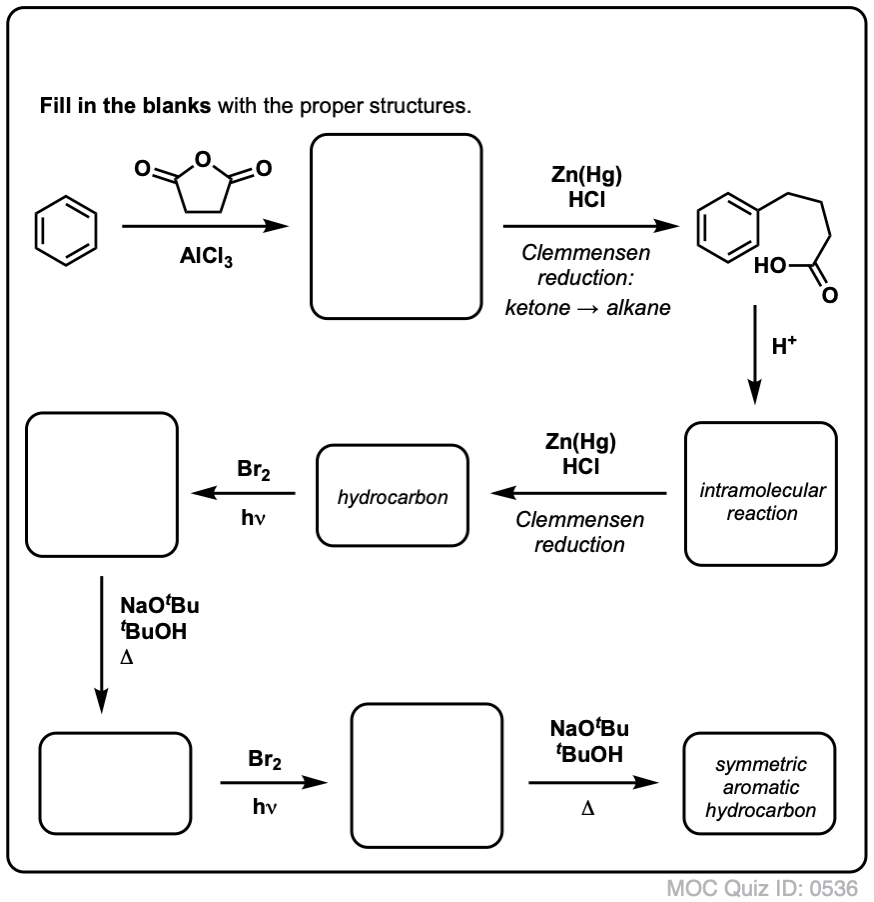
In base a quanto sopra, ecco un rapido quiz per voi. Come potresti convertire la tetralina (sotto a sinistra) in naftalene (sotto a destra)? Rispondi nelle note.
9. Ossidazione benzilica Con KMnO4 (o H2CrO4)
Siccome il legame C-H benzilico è relativamente debole, si potrebbe giustamente chiedere se altri tipi di reazioni (oltre alla bromurazione) possono essere eseguite in questa posizione.
Si può certamente! Un primo esempio è l’ossidazione benzilica – dove un legame C-H benzilico viene rotto e si forma un legame C-O benzilico.
Ora: esistono reagenti abbastanza delicati per l’ossidazione benzilica che sono l’equivalente chimico di solleticare il legame C-H con una piuma, con conseguente aldeide o chetone benzilico.
Questo non è il tipo di ossidazione benzilica che è coperto in un tipico corso introduttivo di chimica organica!
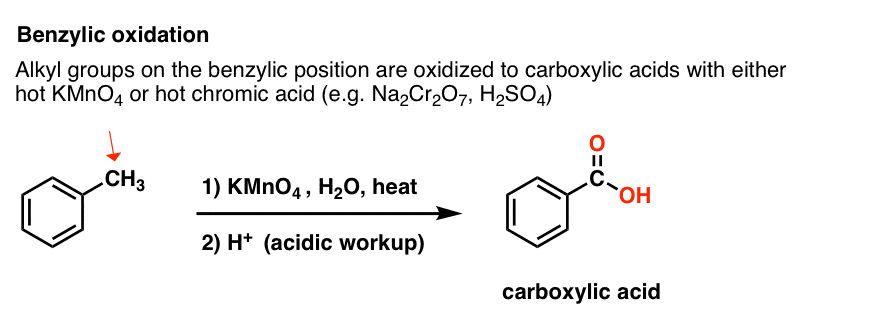
Invece, il reagente principale per l’ossidazione benzilica che è coperto nella maggior parte dei libri di testo introduttivi è il permanganato di potassio caldo (KMnO4). Anche l’acido cromico caldo (H2CrO4, che si forma combinando un sale dicromato come Na2Cr2O7 con un acido forte come H2SO4) può essere usato per questi scopi.
KMnO4 non è delicato. Il KMnO4 non è gentile. Il KMnO4 non è gentile.
Una soluzione di KMnO4 caldo è come una borsa piena di piranha arrabbiati che strappano tutta la carne della tua molecola e lasciano solo le ossa. (A pensarci bene, è un po’ come il tuo fegato!)
Il KMnO4 caldo rompe ogni legame C-H benzilico e lo converte in un legame C-O. Dal toluene, per esempio, il prodotto è l’acido benzoico (un acido carbossilico).
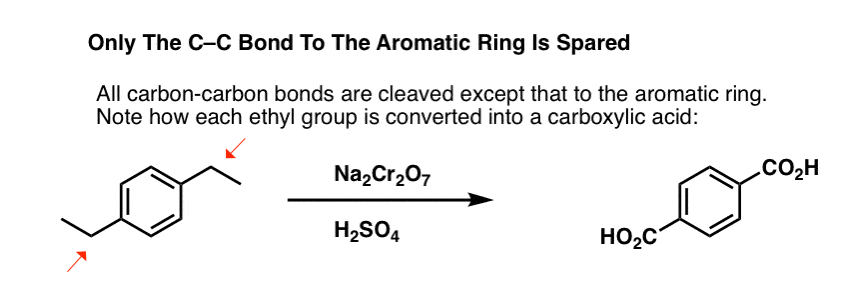
Ma non rompe solo i legami C-H benzilici. Oh no. Si occupa anche dei legami C-C; almeno quelli che non sono direttamente attaccati a un anello fenilico. Per esempio, il para-dietilbenzene viene convertito in acido para-benzene-dicarbossilico.
Nota che il legame alchilico C-C deve essere scisso perché questa ossidazione possa avvenire! (è probabile che sia ossidato fino al gas CO2).
Un’interessante variazione è su una molecola ciclica come la tetralina; il risultato è l’acido dicarbossilico.
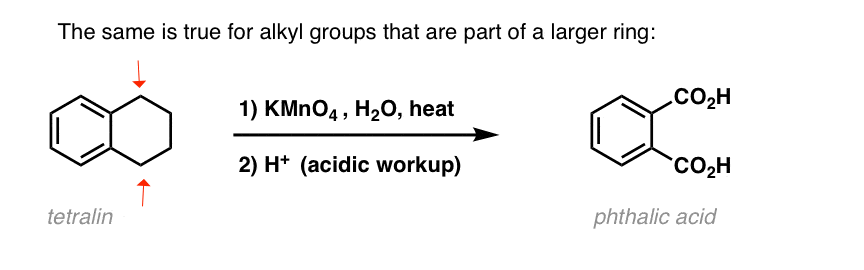
Questo acido dicarbossilico è chiamato acido ftalico.
10. L’ossidazione benzilica richiede un legame C-H benzilico
Come per la bromurazione benzilica, nessuna reazione avviene se non c’è un legame C-H sulla posizione benzilica. Per esempio, la reazione fallisce completamente con il t-butilbenzene:
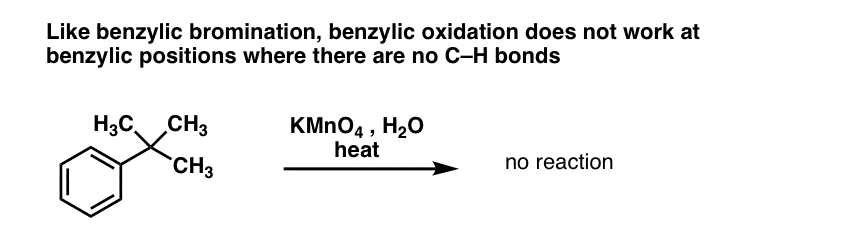
Il meccanismo completo dell’ossidazione benzilica è troppo complesso, lungo e incerto per essere mostrato qui, ma il primo passo è quasi certamente la scissione omolitica del legame C-H dal Mn=O per formare il radicale benzilico.
Perché è importante?
L’ossidazione benzilica con KMnO4 è una reazione dura, ma può avere i suoi usi. Funziona meglio con molecole semplici che non hanno gruppi funzionali delicati e possono sopportare un trattamento molto rude.
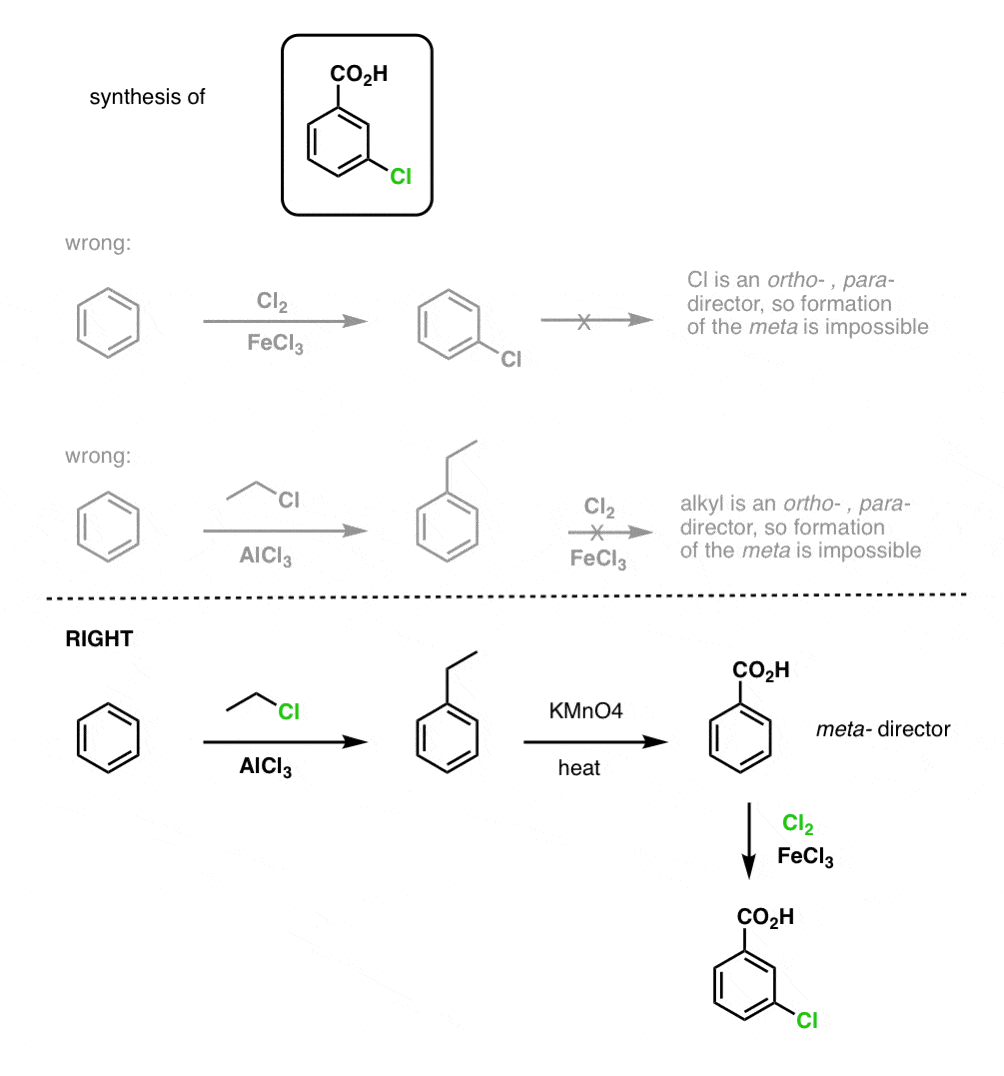
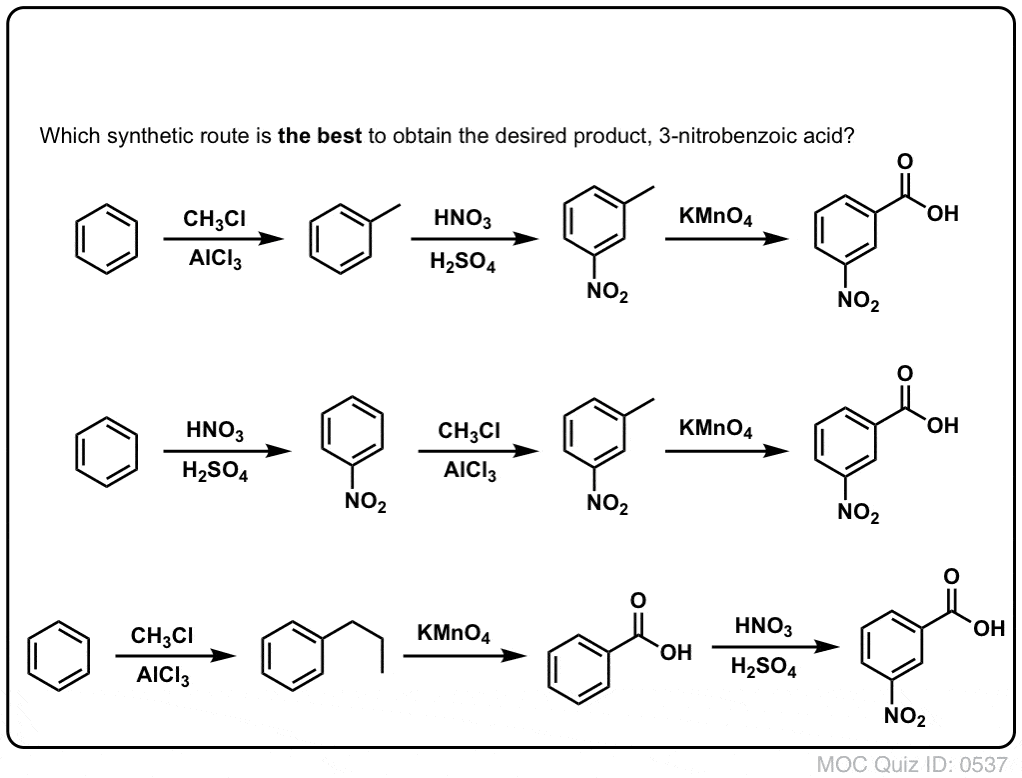
La prima cosa da notare è che gli acidi carbossilici non possono essere messi direttamente su un anello benzenico tramite l’acilazione di Friedel-Crafts, quindi l’alchilazione seguita da ossidazione è un utile workaround.
La seconda funzione utile nella sintesi è il fatto che l’ossidazione benzilica converte un direttore o- p- (un gruppo alchilico) in un meta-direttore.
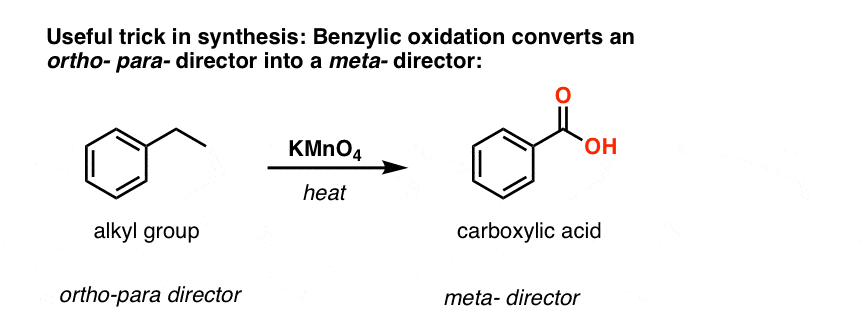
Per esempio, di fronte alla sintesi della seguente molecola, come si procede? (suggerimento: comporta un’ossidazione benzilica ad un certo punto).
Avremo molto di più da dire sulla sintesi dei composti aromatici in qualche altro post.
Prossimo: Riduzione dei carbonili benzilici – le riduzioni Clemmensen e Wolff-Kishner
Note
“Cavolo” può anche essere usato come termine gergale in chimica per “tutta quella roba sulla molecola che si può tranquillamente ignorare” per qualsiasi motivo. Per esempio, la briostatina è una bestia di una molecola che promette di essere un agente anticancro. Il problema è che ci vuole una tonnellata di un raro briozoo per ottenere una quantità decente di briostatina, e questo non è abbastanza per una sperimentazione clinica sugli esseri umani. Così diversi gruppi hanno lavorato per fare “bryologs” più semplici, più facili da sintetizzare, dove si sbarazzano del “cavolo” che non è essenziale per l’attività antitumorale.
Br2 generalmente non reagisce con anelli aromatici senza un catalizzatore acido Lewis. Tuttavia, se è presente un forte gruppo attivante (come OH, NR2, ecc.) può verificarsi una certa bromurazione dell’anello, specialmente a temperature elevate.
Curiosità: “L’ossidazione benzilica” è la risposta al puzzle del perché il metilbenzene (toluene) non è così potente come il benzene. Questo perché il tuo fegato ha enzimi citocromo p450 (contenenti specie di ferro ad alto stato di ossidazione) che possono ossidare il gruppo CH3 benzilico all’acido carbossilico più solubile in acqua, permettendogli di essere eliminato dai tuoi reni.
Questo richiede due ossidazioni e due eliminazioni. Un modo prudente per farlo è quello di ossidare (cioè brominare) una volta, e poi eliminare per dare un alchene. L’alchene potrebbe poi essere sottoposto a bromurazione di nuovo (usando NBS, in modo da evitare la bromurazione del doppio legame) per dare un’altra bromurazione (prodotto di bromurazione benzilico mostrato qui, ma anche allilico fattibile) che potrebbe essere trattato con base per dare naftalene aromatico.
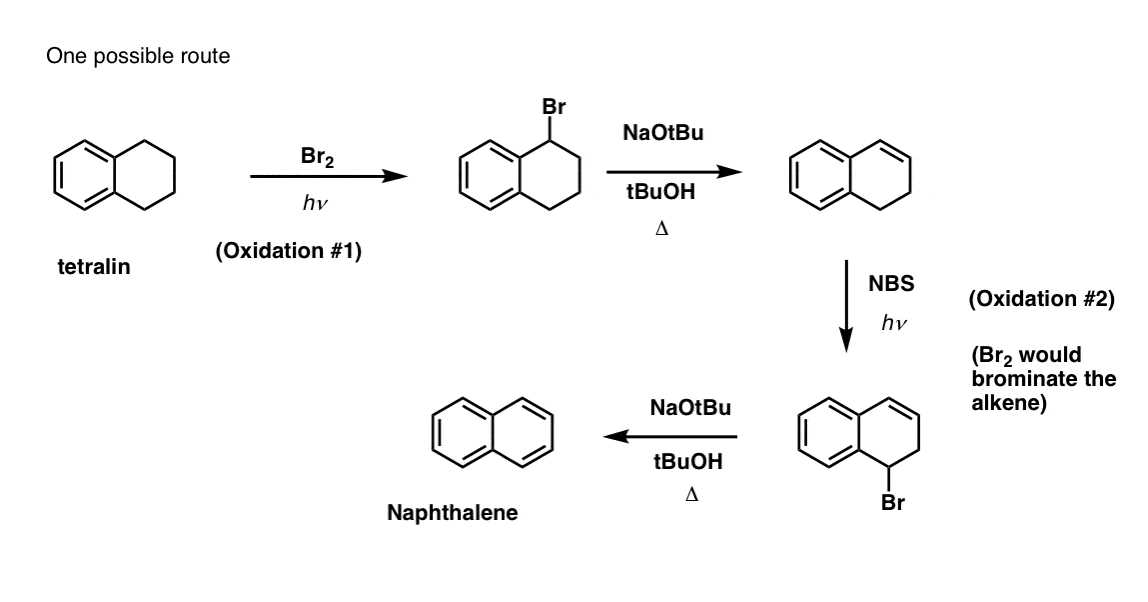
(in pratica, risulta che entrambe le brominazioni possono essere fatte allo stesso tempo usando Br2 ad alta temperatura. Il trattamento con la base può poi produrre naftalene).
Risposta alla domanda 2 del quiz.
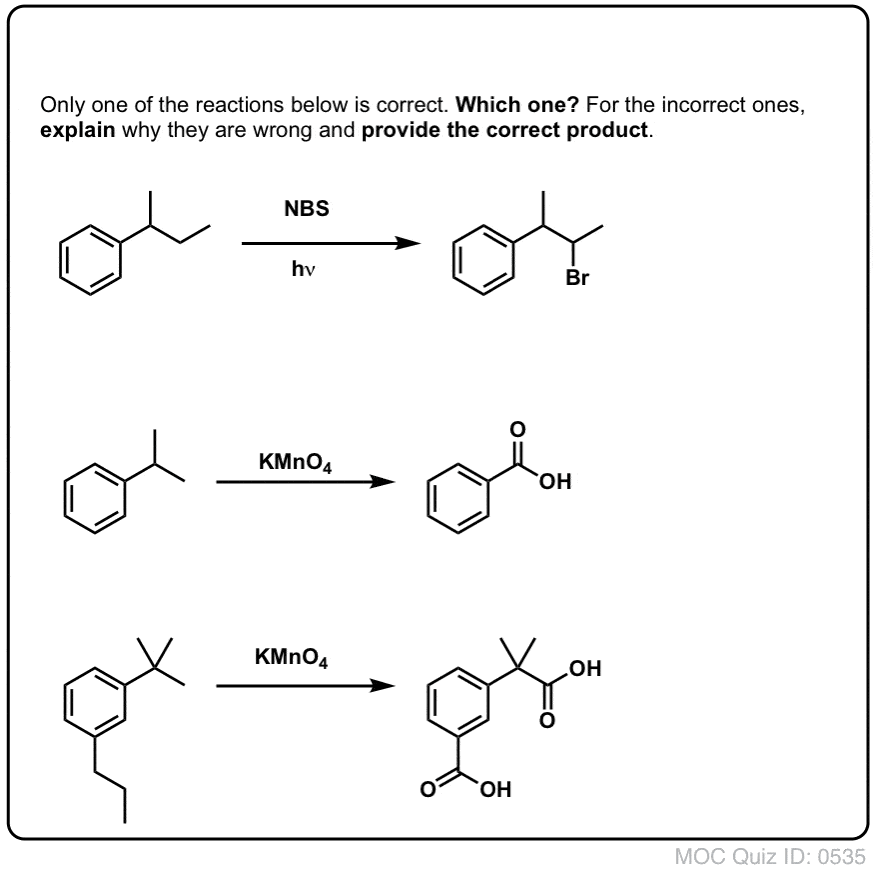
Quiz Yourself!
 Clicca per girare
Clicca per girare
 Clicca per girare
Clicca per girare 
 Clicca per girare
Clicca per girare 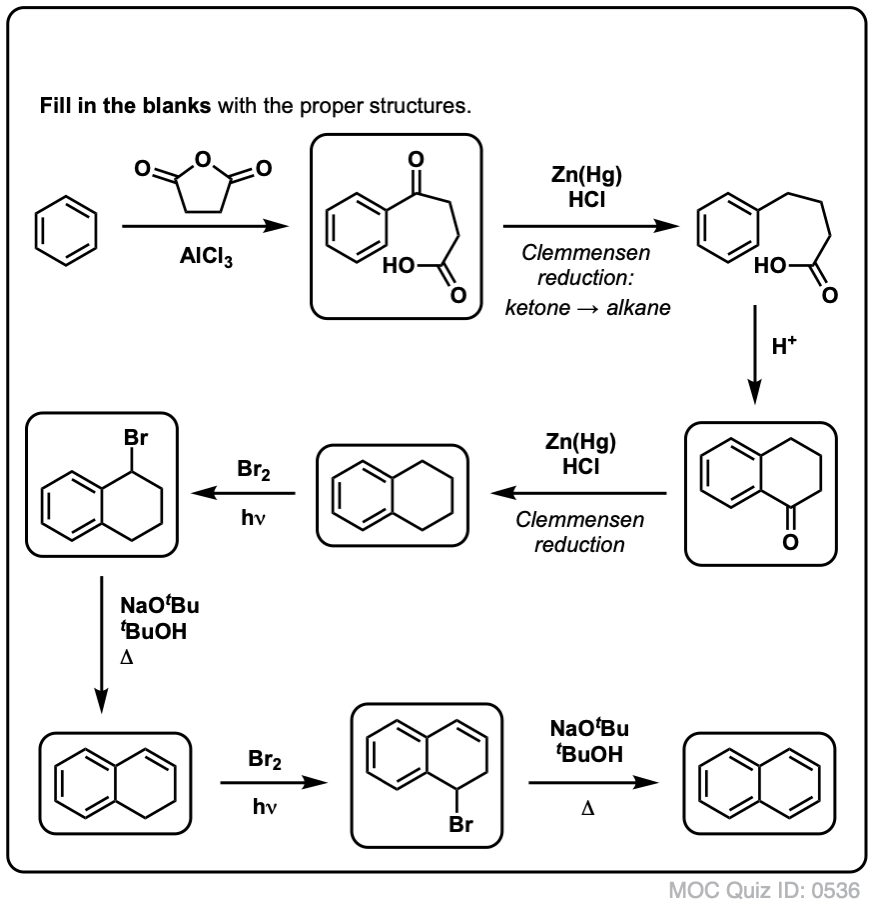
 Clicca per girare
Clicca per girare 
(Avanzato) Riferimenti e ulteriori letture
Benzilazione:
Questa reazione è anche conosciuta come reazione di Wohl-Ziegler.
- Bromierung ungesättigter Verbindungen mit N-Brom-acetamid, ein Beitrag zur Lehre vom Verlauf chemischer Vorgänge
Wohl
Chem. Ber. 1919, 52 (1), 51-63
DOI: 10.1002/cber.19190520109 - Die Halogenierung ungesättigter Substanzen in der Allylstellung
Ziegler, A. Späth, E. Schaaf, W. Schumann, E. Winkelmann
Just. Lieb. Ann. Chem. 1942, 551 (1), 80-119
DOI: 10.1002/jlac.19425510103
Le prime due pubblicazioni su questa reazione. Wohl usò la N-bromoacetamide come agente brominante, non la NBS. Ziegler ha poi condotto uno studio dettagliato e ha riportato che l’NBS potrebbe essere usato come agente brominante conveniente per la bromurazione allilica. - Dibenzocyclooctene: Sintesi multigramma di un ligando bidentato
Géraldine Franck, Marcel Brill, and Günter Helmchen
Org. Synth. 2012, 89, 55-65
DOI: 10.15227/orgsyn.089.0055 - Brominazioni benziliche con N-Bromosuccinimide in (Trifluorometil)benzene
Diana Suarez, Gilles Laval, Shang-Min Tu, Dong Jiang, Claire L. Robinson, Richard Scott, Bernard T. Golding
Synthesis 2009 (11): 1807-1810
DOI: 1055/s-0029-1216793
La referenza #3 presenta una tipica bromurazione benzilica usando NBS in CCl4, che è stato largamente abbandonato a causa di preoccupazioni sulla tossicità. La referenza #4 mostra che PhCF3 può essere usato come solvente al posto di CCl4 per la brominazione benzilica. - Brominazioni con N-Bromosuccinimide e composti correlati. La reazione di Wohl-Ziegler.
Carl Djerassi
Chemical Reviews 1948, 43 (2), 271-317
DOI: 10.1021/cr60135a004
Una vecchia recensione su questa reazione del noto chimico Carl Djerassi, il cui maggior contributo alla salute globale fu lo sviluppo del noretindrone – il primo contraccettivo femminile. - N-Bromosuccinimide. III. Corso stereochimico della bromurazione benzilica
H. J. Dauben Jr. e Layton L. McCoy
Journal of the American Chemical Society 1959, 81 (20), 5404-5409
DOI: 10.1021/ja01529a038
Uno studio meccanico sulla stereochimica della bromurazione benzilica. Osservando la formazione di bromuri benzilici racemici da substrati procirali, l’intermediazione dei radicali in questa reazione viene ulteriormente rafforzata.Gli stessi riferimenti della bromurazione allilica possono essere riproposti qui: - Mechanisms of Benzylic Bromination
Glen A. Russell, Charles. DeBoer, and Kathleen M. Desmond
Journal of the American Chemical Society 1963 85 (3), 365-366
DOI: 1021/ja00886a040
La bromurazione benzilica segue lo stesso meccanismo della bromurazione alilica, come spiega questo articolo.L’NBS (N-Bromosuccinimide) è un reagente conveniente per la bromurazione a radicali liberi, e i seguenti articoli sono studi meccanicistici che coinvolgono l’NBS: - The Mechanism of Benzylic Bromination with N-Bromosuccinimide
R. E. Pearson and J. C. Martin
Journal of the American Chemical Society 1963 85 (3), 354-355
DOI: 10.1021/ja00886a029
Questi articoli del Prof J. C. Martin (UIUC) sono stati scritti all’inizio della sua carriera, prima che egli facesse il lavoro per cui è più noto (studi su molecole ‘ipervalenti’, incluso lo sviluppo del ‘Dess-Martin Periodinane’). - L’identità delle specie che trasportano la catena nelle brominazioni con N-Bromosuccinimide: Selettività delle N-Bromosuccinimidi sostituite verso i Tolueni sostituiti
R. E. Pearson and J. C. Martin
Journal of the American Chemical Society 1963, 85 (20), 3142-3146
DOI: 10.1021/ja00903a021 - N-bromosuccinimmide. Meccanismi di bromurazione allilica e reazioni correlate
J. H. Incremona e James Cullen Martin
Journal of the American Chemical Society 1970, 92 (3), 627-634
DOI: 10.1021/ja00706a034 - Radicale succinimidile come trasportatore di catena. Meccanismo della bromurazione allilica
J. C. Day, M. J. Lindstrom, and P. S. Skell
Journal of the American Chemical Society 1974, 96 (17), 5616-5617
DOI: 10.1021/ja00824a074 - Bromurazione radicale di cicloesene in CCl4 da bromo: Addition versus Substitution
D. W. McMillen and John B. Grutzner
The Journal of Organic Chemistry 1994, 59 (16), 4516-4528
DOI: 10.1021/jo00095a029
Questo articolo descrive accurati studi cinetici che dimostrano che una bassa concentrazione di Br2 (come quella fornita da NBS impuro) favorirà la sostituzione radicale rispetto ad una reazione di addizione polare. - o-XYLYLENE DIBROMIDE
Emily F. M. Stephenson
Org. Synth. Vol. 34, p.100 (1954)
DOI: 10.15227/orgsyn.034.0100
Una procedura affidabile per la bromurazione benzilica con Br2 in Organic Syntheses. - Bromurazione di Tetralin. Sintesi breve ed efficiente di 1,4-Dibromonaftalene
Osman Çakmak, Ismail Kahveci, Íbrahim Demirtaş, Tuncer Hökelek e Keith Smith
Czech. Chem. Commun. 2000, 65, 1791-1804
DOI: 10.1135/cccc20001791
Una sintesi conveniente di 1,4-dibromonaftalene da tetralina, via bromurazione benzilica.Ossidazione benzilica:
Esistono molte strategie per l’ossidazione benzilica, incluso l’uso di soluzioni concentrate di KMnO4 o acido cromico. - Studi cinetici dell’ossidazione di composti aromatici da permanganato di potassio. Parte IV. n- e isopropilbenzene
C. F. Cullis e J. W. Ladbury
J. Chem. Soc. 1955, 4186-4190
DOI: 10.1039/JR9550004186 - DERIVATI DELLA PIPERIDINA X. I FENYLPIPERIDYLCARBINOLI
Kenneth E. Crook e S. M. McElvain
Journal of the American Chemical Society 1930, 52 (10), 4006-4011
DOI: 1021/ja01373a035
Se c’è un altro sostituente sulla posizione benzilica, allora l’ossidazione con dà un chetone invece di un acido carbossilico. - Ossidazioni Permanganato eterogenee. 7. The Oxidation of Aliphatic Side Chains
Nazih A. Noureldin, Dongyuan Zhao, and Donald G. Lee
The Journal of Organic Chemistry 1997, 62 (25), 8767-8772
DOI: 1021/jo971168e
I reagenti possono essere adsorbiti su supporti solidi per rendere le reazioni più facili da condurre e ridurre i rifiuti. In questo caso, rendendo eterogeneo il reagente KMnO4, la reattività cambia leggermente, e questo può essere sfruttato per alcune ossidazioni chemoselettive.Molti altri reagenti possono essere usati per l’ossidazione benzilica, ecco una selezione: - Ossidazione selettiva al carbonio adiacente ai sistemi aromatici con IBX
K. C. Nicolaou, Phil S. Baran, and Yong-Li Zhong
Journal of the American Chemical Society 2001, 123 (13), 3183-3185
DOI: 10.1021/ja004218x
Un primo articolo del (ora rockstar della sintesi totale) Prof. Phil Baran (The Scripps Research Institute, La Jolla, CA) mentre era ancora un dottorando nel gruppo del Prof. Nicolaou. Questo usa IBX (un reagente I(V) ipervalente) per fare ossidazioni benziliche, che avvengono tramite un meccanismo radicale. Questa è una reazione utile con un ampio campo di applicazione del substrato, come esemplificato da 25 esempi nel documento. - Ossidazione benzilica diretta e selettiva di alchileni tramite astrazione C-H usando bromuri di metalli alcalini
Katsuhiko Moriyama, Misato Takemura, e Hideo Togo
Lettere organiche 2012, 14 (9), 2414-2417
DOI: 10.1021/ol300853z
Questo usa Oxone come ossidante terminale per l’ossidazione benzilica. - Sintesi di alcoli benzilici tramite ossidazione C-H
Lalita Tanwar, Jonas Börgel, e Tobias Ritter
J. Am. Chem. Soc. 2019, 141, 17983-17988
DOI: 10.1021/jacs.9b09496
Questo utilizza il perossido di mesile come ossidante per l’ossidazione selettiva di posizioni benziliche ad alcoli. Si forma il mesilato benzilico, che può essere idrolizzato all’alcol. - Ossidazione elettrochimica benzilica dei legami C-H
Jason A. Marko, Anthony Durgham, Stacey Lowery Bretz, e Wei Liu
Chem. Commun, 2019, 55, 937-940
DOI: 10.1039/C8CC08768G
L’ossidazione benzilica può essere effettuata anche tramite elettrochimica. - Reazioni di ossidazione allilica e benzilica con clorito di sodio
Samuel M. Silvestre, Jorge A. R. Salvador
Tetrahedron 2007, 63 (11), 2439-2445
DOI: 10.1016/j.tet.2007.01.012
NaClO2 è poco costoso e può essere usato anche come ossidante.
Lascia un commento