Prolungamento dell’intervallo QT corretto: un nuovo predittore di rischio cardiovascolare nei pazienti con sindrome coronarica acuta non ST-Elevation | Revista Española de Cardiología
Il Dicembre 27, 2021 da adminINTRODUZIONE
Uno studio recentemente pubblicato ha modificato il concetto classico della cascata ischemica, dimostrando, nel 100% dei casi studiati, che il primo evento ad avere luogo in ischemia è il prolungamento dell’intervallo QT corretto (QTc).1 Il prolungamento anomalo dell’intervallo QTc è stato segnalato in pazienti con angina instabile (UA)2 o infarto miocardico acuto (AMI) con elevazione del segmento ST. Inoltre, questa variabile è stata trovata per essere un predittore indipendente di morte aritmica dopo AMI.4,5 In linea con questa osservazione, lo studio ACTION ha dimostrato che, nei pazienti con malattia coronarica, un intervallo QTc più lungo di 430 millisecondi era un predittore di morte paragonabile a 3-vessel disease (odds ratio , 1.52 vs OR, 1.14)6; tuttavia, questo studio è stato eseguito in pazienti con malattia coronarica stabile. L’intervallo QTc prolungato rilevato in pazienti con UA o AMI7,8 è tornato a valori normali 48 ore dopo una rivascolarizzazione miocardica soddisfacente. È stato ipotizzato che la normalizzazione di questo intervallo nei pazienti che sono stati sottoposti ad angioplastica è un marcatore di riperfusione soddisfacente.9
Di recente abbiamo riportato che il prolungamento dell’intervallo QTc è un marcatore di rischio indipendente nei pazienti con UA.10 L’obiettivo di questo studio è stato quello di dimostrare il valore prognostico di un intervallo QTc prolungato in pazienti ammessi all’unità di cura coronarica con una diagnosi di sindrome coronarica acuta non-ST-elevazione (NSTEACS) e con un normale elettrocardiogramma (ECG) che non mostra evidenza di cambiamenti ischemici acuti.
METODI
Pazienti
Dal gennaio 1995, abbiamo studiato 426 pazienti consecutivi ammessi all’Unità di Cura Coronarica dell’Hospital Interzonal General de Agudos Eva Perón (un ospedale universitario provinciale per acuti specializzato in casi altamente complessi e medicina generale) a Buenos Aires, Argentina, allo scopo di studiare il comportamento dell’intervallo QTc nell’UA e nell’AMI non di elevazione ST, classificato come IIB o IIIB secondo i criteri di Braunwald. Definiamo UA come: dolore anginoso tipico, senza elevazione dei marcatori biochimici, con o senza cambiamenti ECG. Livelli di troponina T cardiaca (cTnT) 30,04 ng/mL o una frazione di creatinchinasi MB (CK-MB) >5%, determinati entro 24 ore dall’ammissione, sono stati considerati anormali e sono serviti per differenziare i pazienti con un certo grado di necrosi da quelli in cui non c’era alcuna prova biochimica di questa complicazione (UA).
In nessun caso c’era documentazione elettrocardiografica di AMI ad elevazione ST (transmurale), secondo i criteri ACC/AHA.12 Desideriamo sottolineare che abbiamo incluso solo i pazienti con ECG normale (n=39) o senza cambiamenti ischemici di nuova insorgenza (n=16), rispetto a un ECG eseguito nei 6 mesi precedenti, per rispettare l’obiettivo specifico di questo studio. Gli ultimi 16 pazienti in cui l’ECG non era normale avevano sequele di AMI (n=13), emiblocco anteriore sinistro (n=2), o blocco di branca destro completo (n=1). Questa indagine è stata condotta con l’intenzione di estendere le nostre precedenti osservazioni nei pazienti con UA che presentavano cambiamenti ischemici acuti sull’ECG di ammissione.10
L’uso sistematico della determinazione della cTnT non è stato introdotto nel nostro ospedale fino al 12 novembre 2001; quindi, 328 casi in cui questo parametro non era stato misurato non potevano essere inclusi nel protocollo. Dei restanti 98 pazienti, abbiamo escluso 41 con onde T negative di nuova insorgenza, 1 con grave insufficienza cardiaca e 1 con una durata del complesso QRS di 30,12 secondi. Altri criteri di esclusione presi in considerazione per la selezione dei pazienti sono stati: angina instabile secondaria, angina pectoris post-AMI, grave malattia valvolare o cardiomiopatia, concentrazione sierica di potassio £3,5 mEq/mL, trattamento con qualsiasi agente antiaritmico o farmaco che avrebbe potuto modificare l’intervallo QTc al momento dell’ammissione, e aritmie come la sindrome di Wolff-Parkinson-White, fibrillazione atriale, flutter atriale e battiti prematuri ventricolari o atriali. I 55 pazienti rimasti dopo l’applicazione dei criteri di esclusione hanno costituito la popolazione dello studio. L’origine coronarica della malattia è stata confermata dall’angiografia coronarica in 29 casi (52,7%), mentre 14 pazienti (25,5%) avevano una storia di malattia coronarica, e i restanti 12 (21,8%) sono stati sottoposti a test funzionali per provocare l’ischemia. Per quanto riguarda i 29 pazienti in cui è stata eseguita l’angiografia coronarica per valutare la gravità della malattia coronarica, sono state osservate lesioni ostruttive significative in 25, e arterie coronarie normali in 4.
La funzione ventricolare è stata considerata normale quando sono stati soddisfatti 2 dei seguenti 3 criteri: a) una frazione di accorciamento del 325%; b) una separazione settale del punto E della valvola mitrale c) accordo tra 2 ecocardiografi esperti che la funzione sistolica era conservata.
Tutti i pazienti inclusi nello studio (16 dei quali avevano alte concentrazioni di cTnT) avevano angina pectoris primaria. All’ammissione, tutti hanno ricevuto un trattamento convenzionale con aspirina, eparina, nitroglicerina per via endovenosa e atenololo. La dose di beta-bloccanti considerata utile era quella che raggiungeva una frequenza cardiaca che non superava la frequenza di base di più del 10% dopo una manovra per indurre la tachicardia.
L’ECG a dodici derivazioni è stato eseguito all’ammissione in ospedale in ogni caso, e i campioni di sangue sono stati raccolti più di 6 ore dopo l’inizio del più recente episodio di dolore anginoso. Il livello di cTnT è stato determinato mediante chemiluminescenza utilizzando reagenti approvati disponibili in commercio. Concentrazioni di 30,04 ng/mL sono state considerate indice di danno miocardico. Inoltre, all’ammissione, la stratificazione del rischio è stata eseguita in ogni paziente secondo il punteggio TIMI (Thrombolysis in Myocardial Infarction) per NSTEACS.13
Tutti i pazienti hanno dato il loro consenso informato scritto prima di essere inclusi nello studio, che è stato approvato dal comitato etico locale.
Caratteristiche cliniche, follow-up e obiettivi dello studio
Le variabili incluse al momento dell’arruolamento nello studio erano: età, sesso, altezza, peso, pressione arteriosa, storia di infarto miocardico, ipertensione, diabete mellito, fumo, ipercolesterolemia, storia familiare di malattia coronarica, malattia cerebrovascolare e precedente angioplastica coronarica. Nessun paziente aveva una malattia vascolare periferica. Sono stati registrati anche i farmaci assunti prima dell’inclusione nello studio.
Dopo la caratterizzazione di base, tutti i pazienti sono stati sottoposti a 1 mese di follow-up post-dimissione.
Gli eventi clinici osservati nei 30 giorni successivi alla dimissione dall’ospedale, che costituivano l’endpoint combinato, erano: morte cardiaca, infarto miocardico non fatale (definito secondo i criteri ACC/AHA: aumento dei livelli di enzimi cardiaci, cambiamenti elettrocardiografici caratteristici e dolore toracico tipico della durata di almeno 20 minuti), e la necessità di rivascolarizzazione percutanea o chirurgica a causa di angina ricorrente, un test funzionale positivo nella provocazione dell’ischemia, o criteri indicativi di alto rischio clinico o emodinamico.
Misurazione dell’intervallo QT corretto
Due sperimentatori indipendenti ed esperti (FG e SL), che non erano coinvolti nel processo decisionale, hanno eseguito la misurazione manuale dell’intervallo QTc utilizzando uno strumento portatile e una lente di ingrandimento, come descritto in uno studio precedente condotto dal nostro gruppo.10 Abbiamo analizzato le misurazioni registrate per ogni paziente al momento dell’ammissione, 12, 18 e 24 ore dopo e, successivamente, ogni giorno. L’intervallo QTc più lungo ottenuto dalle misurazioni effettuate nell’ECG eseguito dal momento dell’ammissione a 24 ore dopo è stato preso come valore finale. Le registrazioni elettrocardiografiche hanno coinvolto 12 derivazioni e guadagno standard, e sono state ottenute con un ECG Schiller Cardiovit AT-1 (Schiller AG, Baar, Svizzera) e, a seconda delle circostanze cliniche di ciascun paziente, i tracciati sono stati acquisiti in presenza di dolore o dopo che questo si era attenuato. L’intervallo QT è stato misurato dall’inizio del complesso QRS alla fine dell’onda T, definita come il punto in cui l’onda T ritorna alla linea isoelettrica, o il nadir tra l’onda T e l’onda U, quando quest’ultima è presente. In tutti gli ECG, l’intervallo QT è stato misurato nelle derivazioni precordiali V2, V3 e V4 per due motivi: in primo luogo, l’onda T acquisisce la sua massima ampiezza in queste derivazioni e, in secondo luogo, esse coincidono anche con l’accordo più stretto tra i due osservatori.14,15 Le misurazioni registrate nelle 3 derivazioni sono state mediate e questo valore è stato considerato rappresentare la durata dell’intervallo QT per quell’ECG, come misurato da uno dei due ricercatori. Successivamente, la media calcolata da ciascuno dei 2 sperimentatori è stata nuovamente mediata e questo valore finale è stato preso in considerazione per l’analisi. La variabilità tra questi osservatori è stata calcolata sulla base del rischio relativo, che è stato determinato utilizzando la formula (A-B)/(´0.5)´100, dove A e B sono gli intervalli QTc nelle misurazioni effettuate da ciascuno dei 2 osservatori.16 Per ottenere l’intervallo QT corretto per la frequenza cardiaca, è stata utilizzata la formula di Bazett.17 Gli intervalli QT corretti con durate maggiori o uguali a 0,45 secondi negli uomini e maggiori o uguali a 0,47 secondi nelle donne sono stati considerati anormalmente prolungati.
Analisi statistica
I risultati delle variabili continue con distribuzione normale sono espressi come media più o meno la deviazione standard (SD) e le variabili continue con distribuzione non normale sono espresse come mediana (intervallo interquartile). Il test di Kolgorov-Smirnov è stato utilizzato per analizzare la normalità della distribuzione delle variabili continue, che sono state confrontate per mezzo del test t non appaiato o del test U di Mann-Whitney, come appropriato. Le proporzioni sono state confrontate utilizzando il test χ2 o il test esatto di Fisher se il numero di valori attesi era 30,04 ng/mL e un intervallo QTc di 0,458 secondi (il miglior punto di cut-off fornito dalla curva caratteristica operativa del ricevitore).
Le differenze sono state considerate statisticamente significative se l’ipotesi nulla poteva essere rifiutata a un livello di confidenza superiore al 95%. Il pacchetto software statistico SPSS 15.0 (SPSS, Inc, Chicago, Illinois, Stati Uniti) è stato utilizzato per tutti i calcoli.
RESULTATI
Al ricovero, 39 pazienti (71%) avevano ECG normali; nei restanti 16 (29%) con una storia di coronaropatia, gli ECG erano anormali, ma non rivelavano cambiamenti ischemici acuti di nuova insorgenza rispetto agli ECG precedenti; 21 pazienti (38%) hanno avuto eventi clinici (Tabella 1) durante il follow-up; mentre i restanti 34 (62%) no. Le caratteristiche cliniche e demografiche dei pazienti in cui sono stati segnalati eventi clinici (gruppo A) e di quelli in cui non lo sono stati (gruppo B) sono riportate nella tabella 2.
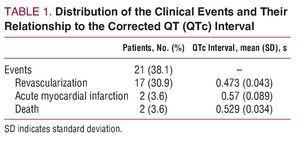
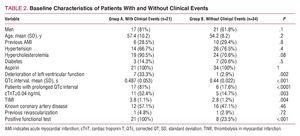
L’intervallo QTc medio era più lungo nel gruppo in cui sono stati riportati eventi (0.487 secondi) rispetto al gruppo senza eventi (0,44 secondi; P=.001).
In base ai valori di riferimento per l’intervallo QTc corrispondenti a ciascun sesso, questo parametro era prolungato in 17 pazienti (81%) nel gruppo A, contro solo 6 (17,6%) nel gruppo B (P=.0001; Tabella 2). Dobbiamo sottolineare che, in accordo con l’analisi della curva ROC, il miglior punto di cut-off per l’intervallo QTc in termini di previsione di eventi clinici era 0,458 secondi, con una sensibilità e una specificità del 76,2% e 88,2%, rispettivamente (area sotto la curva ROC pari a 0,825; Figura 1).

Figura 1. Figura 1. Curva caratteristica operativa del ricevitore (ROC) costruita per stabilire il punto di cut-off per l’intervallo QTc (QT corretto) con la più alta sensibilità e specificità per gli eventi clinici (QTc=0,458 s).
Dopo l’aggiustamento mediante regressione logistica binaria, l’intervallo QTc è risultato essere l’unica variabile di rischio indipendente (OR, 19,8; 95% intervallo di confidenza, 4,8-80,5; P=.001). Il punteggio di rischio TIMI è stato escluso dai predittori indipendenti dell’endpoint combinato (P=.13), così come la cTnT (P=.09). Altre variabili che non erano predittori di eventi in questo modello erano: età (P=.09), sesso (P=.16), fumo (P=.07), ipercolesterolemia (P=.09), diabete mellito (P=.23), ipertensione (P=.51), storia di infarto (P=.88) e disfunzione ventricolare sinistra (P=.06). Va sottolineato che c’era una correlazione positiva e statisticamente significativa tra i livelli di cTnT e l’intervallo QTc (correlazione Pearson = 0,78; P
L’incidenza di eventi era più alta nei pazienti con un punteggio di rischio TIMI superiore alla mediana e con un intervallo QTc di 30,458 secondi, rispetto al resto della popolazione in studio.
DISCUSSIONE
I risultati del presente studio dimostrano per la prima volta che l’intervallo QTc predice eventi cardiovascolari avversi fino a 30 giorni dopo la dimissione dall’ospedale in pazienti con NSTEACS che avevano un ECG normale o nessun cambiamento ischemico all’ammissione.
La rilevanza dei nostri risultati sta nel fatto che, nonostante la registrazione di un ECG normale o l’assenza di cambiamenti ischemici di nuova insorgenza all’ammissione, i pazienti con un intervallo QTc prolungato avevano un rischio 19 volte superiore di eventi cardiovascolari. La misurazione dell’intervallo QTc, aggiunta a quella delle troponine, che sono universalmente riconosciute come biomarcatori prognostici, fornirebbe senza dubbio un forte supporto all’interpretazione della diagnosi e della prognosi in questa popolazione di pazienti. Sulla base dei nostri risultati, 0,458 secondi dovrebbe essere preso come intervallo QTc indicativo del rischio di un evento cardiovascolare nei pazienti con NSTEACS. Questo cut-off point è molto simile a quello riportato recentemente da Jiménez-Candil et al.18
Se confrontato con i pazienti che non hanno avuto eventi cardiovascolari, quelli che hanno raggiunto l’endpoint combinato di morte, IMA o rivascolarizzazione percutanea o chirurgica fino a 30 giorni dopo la dimissione dall’ospedale avevano intervalli QTc più lunghi. In ogni caso, non escludiamo la possibilità che questi risultati sarebbero variati se avessimo deciso di prolungare il periodo di follow-up.
I nostri risultati confermano ed estendono i nostri risultati precedenti e quelli di Jiménez-Candil et al in pazienti con sindrome coronarica acuta, in cui l’intervallo QTc era un utile marcatore precoce per il rischio cardiovascolare in pazienti con un modello ECG anormale all’ammissione prodotto da ischemia miocardica acuta.10,18
Nel presente studio, abbiamo anche trovato una correlazione positiva tra intervalli QTc prolungati e livelli di cTnT. Quest’ultima osservazione potrebbe suggerire che il prolungamento dell’intervallo QTc non è solo associato all’ischemia miocardica, ma al danno miocardico legato alla presenza di aree limitate di necrosi focale (micronecrosi). In accordo con i nostri risultati, Doven et al19 hanno osservato una relazione diretta tra dispersione del QT e livelli di cTnT in pazienti con UA. Allo stesso modo, Rukshin et al20 hanno riferito che il prolungamento dell’intervallo QTc era più marcato nei pazienti con AMI senza onda Q rispetto a quelli con UA che non mostravano segni di lesioni miocardiche.
Nel 1990, Renkin et al21 hanno documentato la loro esperienza in una serie di pazienti con UA e onda T negativa persistente che indicava la presenza di stordimento miocardico. È interessante notare che l’ECG utilizzato come esempio nel loro articolo, eseguito prima dell’angioplastica coronarica, ha rivelato la presenza di un intervallo QTc prolungato.
Nello stesso anno, Shawl et al2 hanno prodotto la prima pubblicazione che affronta il tema dell’intervallo QTc nei pazienti con UA; si tratta di una serie di pazienti che sono stati sottoposti ad angioplastica coronarica per trattare lesioni critiche prossimali alla coronaria discendente anteriore sinistra, in cui l’ECG prima della procedura ha rivelato un prolungamento dell’intervallo QTc, che è stato riportato alla normalità dopo il trattamento.
Anche se il nostro follow-up era relativamente breve e i risultati a lungo termine possono essere incerti, Jiménez-Candil et al18 hanno recentemente riportato che l’intervallo QTc è risultato essere un predittore di rischio, sia a breve termine che fino a 1 anno, in una serie di 427 pazienti con NSTEACS e diversi tipi di anomalie elettrocardiografiche all’ammissione.
In qualche modo, il tasso di eventi nella nostra serie è stato sorprendente, considerando che, all’ammissione, i pazienti avevano ECG normale o ECG anormale ma nessun cambiamento acuto di nuova insorgenza. Oltre a questa circostanza, avevano anche un basso punteggio medio di rischio TIMI. Tuttavia, tutti i pazienti avevano una serie di fattori di rischio ed erano asintomatici all’ammissione; il decorso clinico del 52,7% di loro indicava la necessità di un’angiografia coronarica, e il 30% aveva avuto un precedente AMI. Ventuno dei pazienti del gruppo A hanno sperimentato eventi clinici, e l’intervallo QTc era prolungato all’ammissione nel 52% di loro. Insieme, queste osservazioni indicano che l’intervallo QTc prolungato può essere un buon predittore di rischio cardiovascolare e un utile strumento diagnostico nei pazienti che sono ammessi in ospedale con NSTEACS e ECG normale.
Una questione di interesse che contraddice le affermazioni pubblicate da altri autori, che hanno riportato l’associazione tra l’aumento della dispersione del QT e l’insorgenza di morte per aritmia cardiaca in pazienti con malattia coronarica, nessuno dei partecipanti al nostro studio aveva una grave aritmia ventricolare o morte aritmica.22 Quindi, il prolungamento dell’intervallo QTc nei nostri pazienti era un predittore del rischio di ischemia, non di aritmia.
Limiti dello studio
Il punto più debole del nostro lavoro è probabilmente il numero di pazienti, e questo potrebbe portare a risultati instabili ed essere la ragione dell’esclusione del punteggio TIMI e della cTnT, entrambi noti predittori prognostici, come variabili indipendenti. La ragione per l’inclusione di 55 pazienti è stata che il reclutamento è stato effettuato in un solo centro e i soggetti dovevano essere individui con NSTEACS che, all’ammissione, avevano un ECG normale o non presentavano cambiamenti di nuova insorgenza quando il confronto è stato fatto con un precedente ECG eseguito nei 6 mesi precedenti. Quest’ultimo punto è stato decisivo quando si è trattato di selezionare i pazienti. Ha reso necessario il ricorso allo studio di un endpoint combinato, con la consapevolezza che se la morte fosse stata l’unica considerazione, la popolazione avrebbe potuto essere molto più ampia.
Anche il periodo di follow-up è stato breve (fino a 30 giorni dopo la dimissione dall’ospedale), poiché il nostro obiettivo fin dall’inizio era quello di valutare l’intervallo QTc come un predittore di rischio subito dopo la dimissione, senza escludere la possibilità di variazioni nei risultati se avessimo proposto un periodo di follow-up più lungo. In ogni caso, sarà necessario, in futuro e con una serie più ampia di pazienti, confermare questi risultati, che possono essere stati influenzati da altri fattori, non contemplati in questa popolazione di pazienti.
CONCLUSIONI
I nostri dati indicano che il prolungamento dell’intervallo QTc in pazienti con NSTEACS che hanno un ECG normale o che non mostra cambiamenti ischemici acuti di nuova insorgenza è un predittore indipendente di rischio cardiovascolare, e che 0,458 secondi può essere il punto di cut-off da prendere in considerazione.
Lo scopo di questo studio è quello di richiamare l’attenzione su un nuovo approccio che può essere reso disponibile in qualsiasi ambiente cardiaco di emergenza. Tuttavia, siamo consapevoli del fatto che saranno necessari studi che coinvolgono un maggior numero di pazienti per confermare e confrontare il valore predittivo dell’intervallo QTc.
ABBRAVIATIONS
AMI: infarto miocardico acuto
cTnT: troponina cardiaca T
ECG: elettrocardiogramma
NSTEACS: sindrome coronarica acuta non a media tensione
QTc: intervallo QT corretto
ROC: caratteristica operativa del ricevitore
SD: deviazione standard
TIMI: trombolisi nell’infarto miocardico UA: angina instabile
Lascia un commento