Non si può avere soddisfazione: Disfotopsie post-cataratta
Il Dicembre 25, 2021 da adminLa chirurgia della cataratta di oggi ha un grande successo nel migliorare la visione e la qualità della vita dei pazienti. Tuttavia, una piccola percentuale di pazienti rimane insoddisfatta dopo la procedura, anche se il risultato è un’acuità visiva di 20/20. Uno studio ha scoperto che la causa principale dell’insoddisfazione post-chirurgica in una popolazione pseudofachica normale era la disfotopsia – virtualmente sconosciuta due decenni fa.1
La disfotopsia è ancora solo vagamente familiare alla maggior parte degli optometristi; tuttavia, con la sua incidenza in aumento, è importante per noi essere in grado di gestire efficacemente i casi di disfotopsia con i chirurghi quando è necessario intervenire.
Il termine disfotopsia è usato per descrivere una varietà di sintomi visivi che risultano dalla luce che si riflette sulla lente intraoculare (IOL) sulla retina.2 Le disfotopsie sono generalmente divise in due categorie: positive e negative. I cambiamenti visivi positivi comportano sintomi di artefatti luminosi, mentre le disfotopsie negative sono percepite come ombre o aree scure nel campo visivo.3 I pazienti possono riferire abbagliamento, starburst, aloni o ombre quando descrivono i loro sintomi visivi.
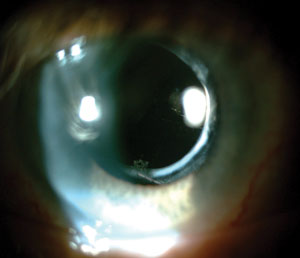
L’introduzione del materiale acrilico per lenti intraoculari ha contribuito a ridurre significativamente il tasso di opacizzazione capsulare posteriore dopo la chirurgia della cataratta.
È difficile stimare la prevalenza delle disfotopsie. Gli studi riportano un range che va da un minimo dell’1,5% a un massimo del 67% per le disfotopsie positive, con la maggior parte dei dati che mostrano numeri più moderati (dal 12% al 35%).4-6 Le disfotopsie negative sono meno prevalenti e si pensa che si verifichino solo nello 0,5%-2,4% dei pazienti.5,7 Nella grande maggioranza dei casi, i sintomi scompaiono diverse settimane dopo l’intervento a causa del processo di neuroadattamento. Il neuroadattamento può verificarsi in risposta a un disturbo visivo monoculare o binoculare indesiderato.8 La plasticità neurale intrinseca del cervello aiuta la corteccia visiva a negare l’effetto di un modello indesiderato.8,9 Questo può spiegare perché gli effetti significativi a lungo termine si osservano solo in una piccola percentuale della popolazione pseudofachica.
Evoluzione delle IOL
Per comprendere l’aumento dell’incidenza delle disfotopsie positive, è importante considerare l’evoluzione delle IOL. Il primo materiale comunemente accettato per le lenti intraoculari fu il polimetilmetacrilato (PMMA), che di solito coincideva con un design della lente a bordi arrotondati. I vantaggi del materiale PMMA includevano il basso costo e la durata all’interno dell’occhio.10 Le lenti PMMA causano poche o nessuna disfotopsia, il che è supportato dal fatto che le disfotopsie erano praticamente sconosciute quando il PMMA era il materiale IOL di scelta.2 Queste lenti sono raramente utilizzate oggi a causa dell’incapacità del materiale di piegarsi, che richiede una grande incisione durante la chirurgia e un alto tasso di opacizzazione capsulare posteriore (PCO) dovuto al design del bordo.11
Perché incisioni più grandi aumentano il rischio di infezioni e complicazioni dell’iride, e i ricercatori hanno scoperto che il design del bordo arrotondato è un fattore di rischio prominente per la PCO, sono stati introdotti, con grande successo, materiali acrilici e siliconici flessibili con design verticale e a spigoli vivi. Poiché la crescente evidenza indica che le IOL con bordi appuntiti comportano tassi più bassi di PCO rispetto a quelle con bordi arrotondati, le geometrie delle lenti a bordi appuntiti sono ora utilizzate più frequentemente di quelle a bordi arrotondati.12
Il materiale acrilico ha ridefinito la chirurgia della cataratta con la sua capacità di piegarsi e adattarsi attraverso piccole incisioni, riducendo inoltre notevolmente il tasso di PCO.13,14 A causa di questi vantaggi, le IOL acriliche sono le lenti più comunemente impiantate oggi negli Stati Uniti. Tuttavia, i materiali delle lenti acriliche hanno creato una successiva tendenza all’aumento dell’incidenza delle disfotopsie.2
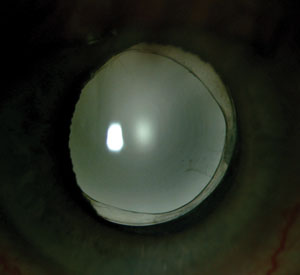
Disfotopsie positive
Diversi studi hanno valutato il ruolo del materiale della IOL nella formazione di disfotopsie positive. Gli investigatori ipotizzano che le disfotopsie positive siano causate dalla luce parassita proiettata sulla retina, che peggiora se questa luce parassita è concentrata in un’area particolare. Uno studio ha esaminato la luce riflessa dalle superfici delle IOL e ha scoperto che quando la luce iniziale colpisce la retina e si disperde fuori dall’occhio, parte di essa viene riflessa dalla superficie posteriore della IOL di nuovo sulla retina.15 I ricercatori hanno scoperto che i materiali con indici di rifrazione più elevati aiutano a concentrare una maggiore quantità di luce su un’area più piccola della retina, provocando i sintomi. Le lenti acriliche hanno in genere un indice di rifrazione più alto rispetto alle lenti in PMMA o silicone, a ulteriore sostegno delle conclusioni dei ricercatori.
Un altro studio sostiene che la maggiore riflettività superficiale delle lenti acriliche causa più sintomi rispetto alle lenti in silicone o PMMA.16 I ricercatori hanno sostenuto la loro affermazione sostituendo le IOL acriliche di otto pazienti sintomatici con IOL in silicone o PMMA, che hanno alleviato i sintomi della disfotopsia. Altri casi riportati hanno risultati simili, ma non sono stati fatti studi su larga scala.4,16
Oltre al materiale della lente, anche il design del bordo della IOL è stato implicato nello sviluppo di disfotopsie positive.17 Le disfotopsie erano un evento raro quando venivano utilizzate geometrie con bordi arrotondati, ma uno spostamento dell’industria verso bordi affilati ha portato a una maggiore incidenza di disfotopsie. Utilizzando l’analisi al computer, i ricercatori hanno scoperto che sia le IOL a bordi taglienti che quelle a bordi arrotondati producono luce parassita, ma solo il design a bordi taglienti concentra i raggi di luce parassita in un arco sulla retina, causando i sintomi.18 I design a bordi arrotondati diffondono la luce in modo più uniforme su tutta la retina, minimizzando l’effetto.
Disfotopsia negativa
La disfotopsia negativa è una complicazione visiva molto meno studiata e compresa della disfotopsia positiva. I pazienti di solito si lamentano di un’ombra scura nel campo visivo temporale. Si manifesta tipicamente dopo l’impianto di IOL a camera posteriore in-the-bag.19 Numerose teorie tentano di identificare una causa per la disfotopsia negativa; i sospetti includono i parametri e l’ottica della IOL, le cicatrici dell’incisione corneale, il coinvolgimento del bordo della capsulotomia anteriore e la distanza della IOL dall’iride.7,16,17,20
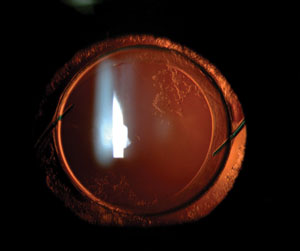
IOL in borsa con PCO lieve. Alcuni chirurghi hanno migliorato le disfotopsie negative di alcuni pazienti sostituendo una IOL in-the-bag con una IOL fissata al solco. I sintomi di disfotopsia negativa non sono mai stati eliminati semplicemente posizionando una IOL diversa all’interno del sacco capsulare al posto dell’originale.
Uno degli studi più promettenti ha utilizzato un software per computer per simulare disfotopsie negative in modelli di occhi normali.19 I ricercatori hanno scoperto che le ombre si formavano nella retina periferica quando i raggi di luce subivano modifiche al bordo tagliente posteriore della lente. L’analisi al computer ha mostrato la formazione di scotomi ad anello, che sarebbero evidenti solo temporalmente sul campo visivo di un paziente, poiché il naso blocca l’aspetto nasale.
I ricercatori hanno determinato che diversi fattori ottici sono necessari per la formazione di disfotopsie negative.19 I più significativi di questi fattori sono: una pupilla piccola; un posizionamento di una lente acrilica a una distanza superiore a 0,06 mm ma inferiore a 1,23 mm dietro la pupilla; un design a spigoli vivi; e una retina nasale funzionale che si estende anteriormente all’ombra. I fattori secondari includono un alto indice di rifrazione del materiale IOL e la posizione nasale della pupilla rispetto all’asse ottico dell’occhio.19
Sono stati tentati diversi trattamenti per ridurre la disfotopsia negativa. I ricercatori hanno riferito che uno scambio di IOL con una riduzione della distanza iris-IOL ha contribuito a ridurre i sintomi della disfotopsia negativa.20 Risultati simili sono stati osservati in un altro studio, che ha rilevato che lo scambio di una IOL in-the-bag con una lente fissata al solco ha portato alla risoluzione dei sintomi in cinque occhi di cinque donne diverse.21 La ricerca mostra anche che la cattura ottica inversa e l’impianto di IOL secondaria piggyback possono risolvere i sintomi della disfotopsia negativa.22
Alcuni studi riportano la risoluzione parziale o completa dei sintomi dopo la capsulotomia anteriore con laser YAG della porzione nasale della capsula anteriore.23,24 Questa evidenza non è in accordo con l’ipotesi di uno studio precedente che l’eventuale opacizzazione e traslucenza della capsula anteriore aiuti a ridurre la percezione delle ombre disperdendo la luce in quella regione della retina.19 Rispetto ad altri studi, questa spiegazione spiega perché l’incidenza delle disfotopsie negative diminuisca drasticamente due o tre anni dopo l’intervento. Le disfotopsie negative sono ancora poco conosciute e sono necessari altri studi su questo argomento.
Gestione
Le disfotopsie sono la principale fonte di insoddisfazione del paziente dopo l’intervento di cataratta.1 Nella maggior parte dei casi diminuiscono con il tempo, ma alcuni pazienti hanno gravi sintomi a lungo termine.7 È importante che gli optometristi riconoscano le disfotopsie, in quanto siamo parte integrante dell’educazione del paziente e del comanagement con un chirurgo. L’anamnesi deve essere condotta con molta attenzione, iniziando con domande aperte. La ricerca di sintomi specifici può suscitare una risposta positiva da parte di alcuni pazienti, anche in assenza di problemi significativi. L’iper-focalizzazione su questi problemi può rendere i sintomi soggettivamente più fastidiosi per i pazienti.
È vitale capire che la chirurgia della cataratta non dovrebbe essere considerata come un trattamento “tagliabiscotti” che può risolvere tutti i problemi visivi di tutti i pazienti. I singoli occhi possono rispondere alla chirurgia in un modo unico – alcuni di loro sviluppando disfotopsie visivamente significative.
Non esiste attualmente una strategia di gestione concordata per i sintomi positivi della disfotopsia. Gli oculisti dovrebbero educare i pazienti che, nella maggior parte dei casi, essi si placano dopo il periodo postoperatorio iniziale e i disturbi visivi dovrebbero scomparire senza ulteriori trattamenti.7
Se i sintomi gravi persistono dopo quattro-sei settimane, si può considerare la sostituzione della lente intraoculare; tuttavia, dovrebbe essere l’ultima risorsa. La tempistica è importante quando si considera una sostituzione della IOL, e un intervento precoce può essere più facile per il chirurgo e comporta meno rischi per il paziente. L’aptica di alcune lenti può diventare fibrosa o iniziare a erodere attraverso il bordo della capsula nel solco, anche diverse settimane dopo l’intervento.25 Le lenti intraoculari possono anche sviluppare una forte aderenza alla capsula, rendendo difficile per il chirurgo la dissezione dal sacco capsulare.26 Se lo scambio di IOL viene effettuato abbastanza presto dopo l’estrazione iniziale della cataratta, il chirurgo può utilizzare l’incisione corneale chiara originale.25 Si noti che se si considera uno scambio di lenti intraoculari, la capsulotomia YAG dovrebbe essere evitata, poiché la capsula posteriore aperta richiede una vitrectomia durante la procedura di scambio di IOL.25
Alcuni pazienti con gravi disfotopsie negative hanno trovato sollievo dallo scambio di IOL con cattura ottica inversa, fissazione del solco e inserimento di IOL piggyback.20-22 La capsulotomia anteriore YAG ha anche dimostrato di aiutare a risolvere i sintomi delle disfotopsie negative.23,24
Molto è ancora da studiare in quest’area della chirurgia della cataratta, ma la consapevolezza di queste complicazioni è importante, in quanto possono causare una significativa insoddisfazione del paziente.
Il Dott. Wainwright VAMC e Pacific Cataract and Laser Institute a Kennewick, Wash.
1. Kinard K, Jarstad A, Olson R. Correlazione della qualità visiva con soddisfazione e funzione in una coorte normale di pazienti pseudofachici. J Cataract Refract Surg. 2013;39:590-7.
2. Schwiegerling J. Recenti sviluppi nella disfotopsia pseudofachica. Curr Opin Ophthalomol. 2006;17:27-30.
3. Hood CT, Sugar A. Reclami soggettivi dopo la chirurgia della cataratta: cause comuni e strategie di gestione. Curr Opin Ophthalmol. 2015;26:45-9.
4. Ellis MF. Disegno della lente intraoculare a spigoli vivi come causa di abbagliamento permanente. J Cataract Refract Surg. 2001;27:1061-4.
5. Meacock WR, Spalton DJ, Khan S. L’effetto della testurizzazione del bordo della lente intraoculare sui sintomi di abbagliamento postoperatorio: uno studio prospettico randomizzato, in doppia maschera. Arch Ophthalol. 2002;120:1294-8.
6. Tester R, Pace NL, Samore M, Olson RJ. Disfotopsia in pazienti fachici e pseudofachici: incidenza e relazione al tipo di lente intraoculare. J Cataract Refract Surg. 2000;26:810-6.
7. Osher RH. Disfotopsia negativa: studio a lungo termine e possibile spiegazione dei sintomi transitori. J Cataract Refract Surg. 2008;34:1699-1707.
8. Kershner RM. Neuroadattamento e IOL premium: Cosa pensa il cervello? Ophthalmology Management. 2011;15(12):51-4.
9. Kent C, Kershner RM, Mainster M, McDonald JE. Neuroadattamento multifocale: L’allenamento può aiutare il cervello? Rev Ophthalmol. 2010;17(3):24-31.
10. Bellucci R. Un’introduzione alle lenti intraoculari: materiale, ottica, aptica, design e aberrazione. Cataratta. Serie di corsi ESASO. Basilea, Karger, 2013;3:38-55.
11. Auffarth GU, Brezin A, Caporossi A, et al. Confronto dei tassi di capsulotomia Nd:YAG dopo facoemulsificazione di lenti intraoculari in PMMA, silicone o acrilico in quattro paesi europei. Ophthalmic Epidemiol. 2004;11(4):319-29.
12. Cheng J, Wei R, Cai J, et al. Efficacia di diversi materiali di lenti intraoculari e design del bordo ottico nella prevenzione dell’opacizzazione capsulare posteriore: una meta-analisi. Am J Opthalmol. 2007;143:428-36.
13. Hollick EJ, Spalton DJ, Ursell PG, et al. L’effetto delle lenti intraoculari in polimetilmetacrilato, silicone e poliacrilico sull’opacizzazione capsulare posteriore 3 anni dopo la chirurgia della cataratta. Ophthalmology. 1999;106:49-54.
14. Yan Q, Perdue N, Sage EH. Risposte differenziali delle cellule epiteliali del cristallino umano alle lenti intraoculari in vitro: dischi acrilici idrofobici contro PMMA o silicone. Graefe’s Arch Clin Exp Ophthalmol. 2005;243:1253-62.
15. Erie JC, Bandhauer MH, McLaren JW. Analisi dell’abbagliamento postoperatorio e della geometria della lente intraoculare. J Cataract Refract Surg. 2001;27:614-21.
16. Davison JA. Disfotopsia positiva e negativa in pazienti con lenti intraoculari acriliche. J Cataract Refract Surg. 2000;26:1346-55.
17. Peng Q, Visessook N, Apple DJ, et al. Prevenzione chirurgica dell’opacizzazione della capsula posteriore. Parte 3: Effetto barriera ottica della lente intraoculare come seconda linea di difesa. J Cataract Refract Surg. 2000;26:198-213.
18. Holladay JT, Lang A, Portney V. Analisi dei fenomeni di abbagliamento dei bordi nelle geometrie dei bordi delle lenti intraoculari. J Cataract Refract Surg. 1999;25:748-52.
19. Holladay JT, Zhao H, Reisin CR. Disfotopsia negativa: l’enigmatica penombra. J Cataract Refract Surg. 2012;38:1251-65.
20. Vamosi P, Csakany B, Nemeth J. Scambio di lenti intraoculari in pazienti con sintomi di disfotopsia negativa. J Cataract Refract Surg. 2010;36:418-24.
21. Burke TR, Benjamin L. Impianto di lente intraoculare fissata al solco per la gestione della disfotopsia negativa. J Cataract Refract Surg. 2014;40:1469-72.
22. Masket S, Fram NR. Disfotopsia negativa pseudofachica: gestione chirurgica e nuova teoria dell’eziologia. J Cataract Refract Surg. 2011;37:1199-1207.
23. Cooke DL, Kasko S, Platt LO. Risoluzione della disfotopsia negativa dopo la capsulotomia anteriore laser. J Cataract Refract Surg. 2013;39:1107-9.
24. Folden DV. Capsulectomia anteriore con laser al neodimio:YAG: opzione chirurgica nella gestione della disfotopsia negativa. J Cataract Refract Surg. 2013;39:1110-5.
25. Grayson, D. I pro e i contro dell’espianto della lente. Rev Ophthalmol. 2011;18(10):36.
26. Leysen I, Bartholomeeusen E, Coeckelbergh T, Tassignon MJ. Esiti chirurgici dello scambio di lenti intraoculari. Studio di cinque anni. J Cataract Refract Surg. 2009;35:1013-8.
Lascia un commento