Masse equivalenti di acidi, basi e sali
Il Ottobre 4, 2021 da adminScienza > Chimica > Concetto di massa atomica e massa equivalente >Masse equivalenti di acidi, basi e sali
In questo articolo, studieremo la determinazione della massa equivalente di acido, base e sale.
Massa equivalente degli acidi:
Un grammo di massa equivalente di un acido è quella massa di esso che contiene un grammo di massa equivalente di atomi di idrogeno sostituibili.
Quindi la massa equivalente di un acido dipende dagli atomi di idrogeno sostituibili che contiene per mole. Il numero di atomi di idrogeno sostituibili presenti in una molecola di acido è chiamato basicità dell’acido.

Illustrazione – 1:
Massa molecolare di HCl = 1 + 35,5 = 36.5

Illustrazione – 2:
Massa molecolare di H2SO4 = 2 + 32 + 64 = 98
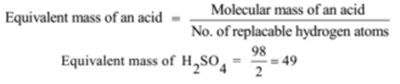
Massa equivalente della base:
Una massa equivalente in grammi di una base è quella massa di essa che contiene una massa equivalente in grammi del radicale idrossile.
Quindi la massa equivalente di una base dipende dal numero di radicali idrossili che contiene per mole. Il numero di radicali idrossili presenti in una molecola di una base è chiamato acidità della base.

Illustrazione – 1:
Massa molecolare di NaOH = 23 + 16 + 1 = 40

Illustrazione – 2:
Massa molecolare di Ca(OH)2= 40 + (16+1) x 2 = 74

Massa equivalente dei sali:
Massa equivalente di un sale semplice è quella massa di esso che contiene un grammo equivalente di metallo o un radicale
Illustrazione – 1:
Massa molecolare di KCl = 39 + 35.5 = 74,5
In questo caso, KCl contiene 1 grammo equivalente di K e 1 grammo equivalente di Cl. Hene massa equivalente di KCl è 74,5 / 1 = 74,5.
Illustrazione – 2:
Massa molecolare di AlCl3 = 27 + 35,5 x 3 = 133,5
In questo caso AlCl2 contiene 1 grammo equivalente di Al e 3 grammi equivalenti di Cl. Hene massa equivalente di KCl è 133,5 / 3 = 44,5.
Illustrazione – 3:
Massa equivalente di un sale è anche quella massa di esso, che si combinerà con un grammo equivalente di un’altra sostanza.
Per trovare la massa equivalente di Na2CO3
Na2CO3 reagisce con HCl come
Na2CO3 + 2HCl → 2 NaCl + CO2 + H2O
Massa molecolare di Na2CO3 = 23 x 2 + 12 x 1 + 16 x 3 = 106
un grammo equivalente di Na2CO3 reagisce con 2 grammi equivalenti di HCl. Quindi la massa equivalente di Na2CO3 è 106 / 2 = 53.
Massa equivalente di agenti ossidanti e riducenti:

Nota:
I metalli con valenza variabile mostrano masse equivalenti variabili a seconda della loro valenza nel composto. Per es. negli ossidi FeO, Fe2O3 e Fe3O4 le masse equivalenti di Fe sono 28,18,6 e 21 rispettivamente.
Gram equivalente:
La massa equivalente espressa in grammi è chiamata massa equivalente in grammi (GEM)
Milliequivalente:
Un milliequivalente è un millesimo di una massa equivalente di qualsiasi sostanza è la massa equivalente espressa in milligrammi. È l’unità che viene usata per esprimere la concentrazione di elettroliti nei fluidi dei tessuti di animali e piante.
Lascia un commento