Combinazione di Ledipasvir e Sofosbuvir per il trattamento dell’infezione da virus dell’epatite C di genotipo 1: Systematic Review and Meta-Analysis | Annals of Hepatology
Il Gennaio 20, 2022 da adminIntroduzione
Tra i circa 80 milioni di individui nel mondo con infezione cronica da virus dell’epatite C (HCV), circa il 46% è infettato da HCV di genotipo 1, il più difficile da trattare con regimi a base di interferone.1 A causa del basso tasso di successo del trattamento e dei previsti effetti collaterali dell’interferone peghilato (PegIFN) e della riba-virina (RBV) per il trattamento dei pazienti con infezione da HCV, sono stati fatti sforzi per sviluppare regimi di trattamento senza IFN.2,3
I regimi contenenti inibitori della proteasi (PI) per pazienti con infezione da HCV di genotipo 1 sono stati introdotti nel 2011. Tuttavia, ci sono state alcune interazioni farmaco-farmaco associate ai regimi contenenti PI e inoltre devono essere usati con PegIFN e hanno avuto molti effetti collaterali.4 Il trattamento dei pazienti con infezione da HCV di genotipo 1 è stato rivoluzionato dall’introduzione dei recenti agenti antivirali ad azione diretta (DAA), tra cui Sofosbuvir (SOF), un inibitore analogo dell’uridina nucleotide della polimerasi HCV NS5B e Ledipasvir (LDV), un inibitore della proteina NS5A codificata da HCV.5,6 La migliore opzione di trattamento è quella che ha il più alto tasso di risposta virologica sostenuta (SVR) con minimi effetti avversi nella più breve durata del trattamento. La combinazione di SOF/LDV per 12 o 24 settimane con o senza RBV ha migliorato il tasso di SVR fino al 95%-100% in pazienti naïve al trattamento e con IFN-esperienza con infezione da HCV di genotipo 1.7 È necessario determinare esattamente il tasso di SVR per il trattamento con SOF/LDV in combinazione con o senza RBV per una durata di 12 o 24 settimane. Inoltre, occorre valutare l’effetto di alcuni fattori come la cirrosi, la storia precedente di trattamento e le sostituzioni associate alla resistenza NS5A (RAS) sul tasso di SVR con il regime menzionato.
È stata intrapresa una meta-analisi degli studi attualmente disponibili allo scopo di valutare l’efficacia antivirale della terapia di combinazione SOF/LDV per 12 o 24 settimane con o senza RBV in pazienti con infezione da HCV di genotipo 1.
Materiale e metodiRisorse di dati e strategie di ricerca
In questa meta-analisi, abbiamo cercato in modo completo e sistematico nei database elettronici tra cui PubMed, Scopus, Science Direct e Web of Science utilizzando strategie di ricerca appropriate per ogni database. Le parole chiave delle nostre strategie di ricerca si sono concentrate sui protocolli di trattamento: SOF, LDV e le loro alternative appropriate. Inoltre, per trovare qualsiasi possibile letteratura grigia esistente abbiamo fatto una ricerca su Google scholar e dopo aver trovato titoli correlati, abbiamo continuato la nostra ricerca fino a trovare 200 titoli seriali non correlati. Inoltre, i riferimenti delle pubblicazioni recuperate sono stati cercati anche per identificare eventuali pubblicazioni mancanti nella ricerca elettronica. La nostra ultima ricerca è stata eseguita il 2 settembre 2015 e non è stata considerata alcuna limitazione di lingua. Un aggiornamento della nostra ricerca è stato effettuato il 16 marzo 2016.
Criteri di ammissibilità
Sono stati inclusi in questa meta-analisi tutti i lavori che hanno valutato l’effetto della terapia di combinazione con SOF/LDV con o senza RBV per 12 o 24 settimane sulla SVR, 12 settimane dopo la fine del trattamento (SVR12) tra i pazienti con infezione da HCV genotipo 1. Gli studi con i dati per l’analisi intention-to-treat sono stati inclusi, altrimenti l’articolo è stato escluso. I seguenti elementi sono stati considerati come criteri di esclusione: pazienti in emodialisi, pazienti con una precedente storia di trattamento a base di SOF, pazienti con infezione simultanea da virus dell’immunodeficienza umana (HIV), pazienti con cirrosi scompensata (Child-Pugh B e C8) e storia di trapianto di fegato o rene.
Selezione degli studi, valutazione della qualità ed estrazione dei dati
Sulla base della linea guida PRISMA per la segnalazione delle revisioni sistematiche,9 tutti gli articoli dai risultati della ricerca sono stati rivisti indipendentemente da due persone (MSR-Z e KH) ad ogni livello di screening (titolo, abstract e full-text). Alla fine di ogni livello di screening, qualsiasi disaccordo tra questi due autori è stato risolto tramite discussione reciproca. Tuttavia, i disaccordi rimasti sono stati risolti per consenso e discussione con altri colleghi (BB, SMA e HS).
Lo strumento di valutazione del rischio di bias di Cochrane è stato utilizzato per la valutazione della qualità di ogni articolo incluso10 e sono stati valutati i seguenti rischi di bias: generazione di sequenza casuale (bias di selezione), occultamento dell’assegnazione (bias di selezione), accecamento del partecipante e del personale (bias di performance), accecamento della valutazione dell’esito (bias di rilevamento), co-interventi, dati di esito incompleti (attrito), segnalazione selettiva (bias di segnalazione), analisi intention-to-treat, similarità del gruppo al basale, conformità, tempi di valutazione dell’esito e altri bias. Sulla base di questa valutazione, ogni rischio di bias per ogni documento è stato valutato come alto, non chiaro e basso. I rischi alti e poco chiari sono stati valutati come zero e il rischio basso come uno. Gli articoli con un punteggio superiore a 6 sono stati classificati come studi a basso rischio. Anche in questo caso, qualsiasi differenza o disaccordo è stato risolto tramite discussione reciproca.
Sono stati estratti i seguenti dati per i partecipanti di ciascun braccio degli studi inclusi: sesso, genotipo HCV, cirrosi, polimorfismi vicino a IFNL3 (rs12979860), storia di trattamento precedente, durata del trattamento, età, indice di massa corporea (BMI) e livello di HCV RNA prima del trattamento. Inoltre, sono stati raccolti alcuni dati per ogni studio tra cui l’anno di pubblicazione, la dimensione del campione e il nome del paese.
Analisi dei dati
L’intervallo di confidenza (CI) per il tasso di SVR in ogni studio è stato calcolato in base al metodo di Jeffrey e la quantità media dei limiti superiore e inferiore del CI è stata considerata come stima puntuale per SVR.11 Il test di eterogeneità è stato eseguito utilizzando χ2 e I-squared (range da 0% a 100%). Il valore P inferiore a 0,1 è stato considerato statisticamente significativo per il χ2. In base al risultato del test di eterogeneità, abbiamo utilizzato modelli a effetti fissi o casuali per determinare il pool di SVR12, l’intervallo di confidenza al 95% e il valore P. Il metodo Trim and fill è stato applicato per superare i possibili bias di pubblicazione esistenti.12 STATA 10 è stato utilizzato per eseguire tutte le parti dell’analisi dei dati.
RisultatiSelezione degli studi
Un totale di 606 articoli sono stati identificati tramite la ricerca nel database. Dopo aver rimosso i duplicati, 459 articoli sono rimasti per lo screening. La figura 1 mostra il numero di articoli ad ogni livello di screening. Altri due articoli sono stati trovati tramite l’aggiornamento della ricerca. Venti articoli a testo completo sono stati valutati per l’ammissibilità e infine dieci articoli sono stati inclusi nella nostra sintesi quantitativa (meta-analisi).
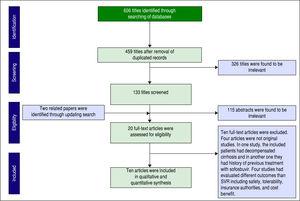
Screening degli articoli basato sulla dichiarazione PRISMA.
Valutazione del rischio di bias
Considerando la tabella 1, tutti gli studi inclusi sono stati classificati a basso rischio (con un punteggio superiore a 7) e quindi nessuno studio è stato escluso in base alla valutazione della qualità.
Valutazione del rischio di bias per gli studi inclusi.
| Primo autore (Riferimento) | Generazione di sequenze casuali (Selection bias) | Allocazione occulta (Selection bias) | Binding di partecipante e del personale (Perfomance bias) | Binding of outcome assessment (Detection bias) | Incompletezza dei dati di outcome (Attrition) | Selective reporting (Reporting bias) | Cointerventi | Analisi dell’intenzione di trattare | Similitudine del gruppo al basale | Compliance | Tempistica delle valutazioni di risultato | Altri bias | Score | Conclusione |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Afdhal, N.31 | ? | ? | + | + | – | – | – | – | – | – | – | – | 8 | Basso |
| Afdhal, N. 7 | ? | ? | + | + | – | – | – | – | – | – | – | – | 8 | Basso |
| Gane, E.J.13 | + | ? | + | + | – | – | – | – | – | – | – | – | 8 | Low |
| Lawitz, E.19 | – | – | + | + | – | – | – | + | – | – | – | – | 9 | Low |
| Kowdley, K.6 | ? | ? | + | + | – | – | – | – | – | – | – | – | 8 | Basso |
| Bourliere, M.21 | – | – | – | – | – | – | – | + | – | – | – | – | 11 | Basso |
| Mizokami, M.20 | – | – | + | + | – | – | – | – | – | – | – | – | 10 | Low |
| Stedman, C.A.M.14 | + | + | + | + | – | – | – | – | – | – | – | – | 8 | Low |
| Kohli, M.15 | ? | ? | + | + | – | – | – | – | – | – | – | – | 8 | Low |
| Chuang W.L.22 | ? | ? | + | + | – | – | – | – | – | – | – | – | 8 | Basso |
Caratteristiche degli studi inclusi
In base allo scopo di questo studio, abbiamo mostrato le caratteristiche di ogni braccio degli studi inclusi nella tabella 2 (combinazione di SOF/LDV) e nella tabella 3 (combinazione di SOF/LDV/RBV).
Caratteristiche degli studi inclusi per la combinazione di Sofosbuvir più Ledipasvir.
| Primo Autore (Riferimento) | Storia del trattamento precedente | Anno di pubblicazione | Paese | Dimensione del campione | Età media (SD o range) | Sesso maschile (%) | BMI medio (SD o range) | Durata del trattamento (settimane) | HCV RNA medio, Log IU/mL (SD) | Cirrosi (%) | rs12979860 CC/CT+TTa | Genotipo HCV 1a/1bb |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Afdhal, N.31 | TE | 2014 | USA | 109 | 56 (24-67) | 74 (68) | 29 (19-47) | 12 | 6.5 (0,44) | 22 (20) | 0,1 | 3,73 |
| Afdhal, N.7 | TN | 2014 | USA | 214 | 52 (18-75) | 127 (59) | 27 (18-41) | 12 | 6.4 (0,69) | 34 (16) | 0,34 | 2,18 |
| Gane, E.J.13 | TE | 2014 | Nuova Zelanda | 10 | 61 (4.9) | 10 (100) | 31 (6.8) | 12 | 6.5 (0.6) | 10 (100) | 0.11 | 4 |
| Kowdley, K.6 | TN | 2014 | USA | 216 | 53 (20-71) | 128 (59) | 28 (19-45) | 12 | 6.4 (0,8) | 0 (0) | 0,35 | 3,9 |
| Lawitz, E.19 | TN | 2014 | USA | 19 | 46 (11,6) | 11 (58) | 28,1 (5.8) | 12 | 6.1 (0.8) | 0 (0) | 0.05 | 8.5 |
| Lawitz, E.19 | TE | 2014 | USA | 19 | 54 (6,6) | 15 (79) | 31,4 (4.7) | 12 | 6.3 (0.5) | 11 (58) | 0.11 | 18 |
| Kohli, A.15 | TN | 2015 | USA | 20 | 57 (8) | 14 (70) | 25 (4) | 12 | NA | fino al 20% | 0.33 | 1.22 |
| Mizokami, M.20 | MIX | 2015 | Giappone | 171 | 60 (9.2) | 69 (40) | 23.3 (3.6) | 12 | 6.6 (0.5) | 41 (24) | 1.011 | 0.042 |
| Chuang, W.L.22 | TN | 2016 | Taiwan | 42 | 54 (30-75) | 13 (31) | 24 (19-36) | 12 | 6.6 (0,68) | 5 (12) | 5 | 0,10 |
| Chuang, W.L.22 | TE | 2016 | Taiwan | 43 | 55 (33-7) | 23 (55) | 24 (20-30) | 12 | 6.6 (0,55) | 4 (9) | 1,26 | 0,16 |
| Afdhal, N.31 | TE | 2014 | USA | 109 | 56 (25-68) | 74 (68) | 28 (19-41) | 24 | 6.4 (0,57) | 22 (20) | 0,17 | 3,54 |
| Afdhal, N.7 | TN | 2014 | USA | 217 | 53 (22-80) | 139 (64) | 27 (18-48) | 24 | 6.3 (0,68) | 33 (15) | 0,31 | 2,14 |
| Bourliere, M.21 | TE | 2015 | Francia | 78 | 57 (10,7) | 56 (72) | 26,3 (4.2) | 24 | 6.5 (0.6) | 77 (100) | 0.08 | 1.85 |
Caratteristiche degli studi inclusi per la combinazione di sofosbuvir più ledipasvir e ribavirina.
| Primo Autore (Riferimento) | Storia del trattamento precedente | Anno di pubblicazione | Paese | Dimensione del campione | Età media (SD o range) | Sesso maschile (%) | BMI medio (SD o range) | Durata del trattamento (settimane) | HCV RNA medio, Log IU/mL (SD) | Cirrosi (%) | rs12979860 CC/CT+TT* | Genotipo HCV 1a/1b** |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Afdhal,N.31 | TE | 2014 | USA | 111 | 57 (27-75) | 71 (64) | 28 (19-45) | 12 | 6.4 (0,54) | 22 (20) | 0,11 | 3,82 |
| Afdhal,N.7 | TN | 2014 | USA | 217 | 52 (18-78) | 128 (59) | 27 (18-42) | 12 | 6.4 (0,64) | 33 (15) | 0,53 | 2,55 |
| Gane, E.J.13 | TN | 2014 | Nuova Zelanda | 25 | 45 (9,2) | 8 (32) | 25.2 (4.3) | 12 | 5.9 (0.9) | 0 (0) | 0.56 | 4 |
| Gane, E.J.13 | TE | 2014 | Nuova Zelanda | 9 | 50 (13) | 7 (78) | 25.6 (2.3) | 12 | 25.6 (2.3) | 0 (0) | 0 | 8 |
| Gane, E.J.13 | TE | 2014 | Nuova Zelanda | 9 | 57 (5.2) | 8 (89) | 27.3 (0.5) | 12 | 27.3 (0.5) | 9 (100) | 0.2 | 3.5 |
| Lawitz, E.19 | TE | 2014 | USA | 21 | 52 (9.8) | 14 (67) | 31.5 (7.3) | 12 | 6.2 (0.4) | 11 (52) | 0.05 | 3.2 |
| Mizokami, M.20 | MIX | 2015 | Giappone | 170 | 59 (9,5) | 73 (43) | 23,3 (3.1) | 12 | 6.6 (0.5) | 35 (21) | 0.86 | 0.024 |
| Stedman, C.A.M.14 | MIX | 2015 | Nuova Zelanda | 14 | 54 (NA) | 12 (86) | 27 (34-20) | 12 | 6.5 (5.6-7.5) | 1 (7) | 0.4 | 2.5 |
| Bourliere, M.21 | TE | 2015 | Francia | 77 | 56 (7,4) | 58 (75) | 27,9 (5.5) | 12 | 6.5 (0.5) | 76 (98.7) | 0.05 | 1.71 |
| Afdhal, N.31 | TE | 2014 | USA | 111 | 55 (28-70) | 68 (61) | 29 (19-50) | 24 | 6.5 (0,60) | 22 (20) | 0,19 | 3,82 |
| Afdhal, N.7 | TN | 2014 | USA | 217 | 53 (24-77) | 119 (54) | 26 (18-48) | 24 | 6.3 (0,65) | 36 (17) | 0,5 | 2,01 |
Valutazione dell’esito del trattamento
Abbiamo calcolato la SVR12 per quattro regimi di trattamento dell’HCV, tra cui 12 settimane di SOF/LDV (A), 24 settimane di SOF/LDV (B), 12 settimane di SOF/LDV/RBV (C) e 24 settimane di SOF/LDV/RBV (D). Il riassunto dei risultati di queste meta-analisi è stato mostrato nella tabella 4.
- –
Regime di trattamento A (12 settimane di sofosbuvir più ledipasvir). Sono stati trovati dieci bracci in otto studi che hanno valutato il regime A (tabella 2). C’era una significativa eterogeneità tra i risultati dei bracci di studio (χ2 = 35.01, P Figura 2A). Sia il test di Begg (P = 0,074) che il test di regressione lineare di Egger (P
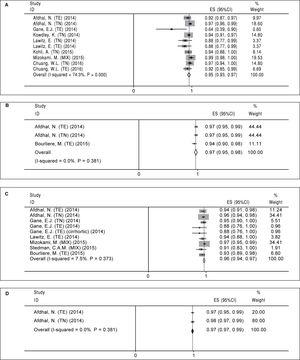 Figura 2.
Figura 2.Pooled SVR12 per Sofosbuvir più Ledipasvir Regime per durata del trattamento e aggiunta di Ribavirina. A. SVR12 raggruppati per 12 settimane di trattamento con sofosbuvir più ledipasvir. B. SVR12 raggruppati per 24 settimane di trattamento con sofosbuvir più ledipasvir. C. SVR12 per 12 settimane di trattamento con sofosbuvir più ledipasvir e ribavirina. D. Pooled SVR12 per 24 settimane di trattamento con sofosbuvir più ledipasvir e ribavirina. TE: esperienza di trattamento. TN: treatment naïve.
(0.39MB).- –
Regime di trattamento B (24 settimane di sofosbuvir più ledipasvir). Per il regime di trattamento B abbiamo trovato solo tre bracci in tre articoli (tabella 2). Nessuna eterogeneità significativa è stata trovata per quanto riguarda gli studi correlati a questo regime (χ2 = 1,92, P = 0,38, I-squared = 0%). Sulla base di un modello a effetti fissi, la SVR12 raggruppata per il regime B era del 97% (95%CI = 95%-98%) (Figura 2B). Dato il numero degli studi inclusi era piccolo (n = 3) non abbiamo eseguito test correlati per bias di pubblicazione.
- –
Regime di trattamento C (12 settimane di sofosbuvir più ledipasvir e ribavirina). Nove bracci di studio in sette articoli sono stati trovati per questo tipo di regime (tabella 3). Poiché non è stata trovata alcuna eterogeneità significativa (χ2 = 8,64, P = 0,37, I-squared = 7,5%), è stato utilizzato il modello a effetti fissi e il pooling SVR12 calcolato come 96% (95%CI = 94%-97%) (Figura 2C). C’era un bias di pubblicazione basato su entrambi i test di Begg (P = 0,009) e di regressione lineare di Egger (P = 0,001). Sulla base del metodo “trim and fill”, la SVR12 raggruppata è stata calcolata al 96% (95%CI = 94%-97%).
- –
Regime di trattamento D (24 settimane di sofosbuvir più ledipasvir e ribavirina). Come mostra la tabella 3, c’erano due bracci di studio in due articoli per questo regime. Non c’era un’eterogeneità significativa per quanto riguarda i risultati di questi due studi (χ2 = 0,77, P = 0,38, I-squared = 0%) e secondo il modello a effetti fissi, il pooling SVR12 è stato calcolato come 98% (95%CI = 97%-99%) (Figura 2D). A causa del piccolo numero di studi inclusi (n = 2) non abbiamo potuto eseguire i relativi test di bias di pubblicazione.
Tabella 4.Sommario delle meta-analisi del tasso di risposta virologica sostenuta per la combinazione di sofosbuvir e ledipasvir.
Regime Uso di rebavirina Durata del trattamento (settimane) Tasso di SVR (%) 95%CI (%) A No 12 95 93-97 B No 24 97 95-98 C Sì 12 96 94-97 D Sì 24 98 97-99 SVR: risposta virologica sostenuta. CI: intervallo di confidenza.Effetto dei parametri di base sulla risposta virologica sostenuta
- –
Cirrosi. Nella maggior parte dei bracci di studio per questi quattro regimi di trattamento menzionati, tutti i pazienti erano cirrotici o non cirrotici e quindi non abbiamo potuto eseguire una meta-analisi di odds ratio (OR). Tuttavia, abbiamo combinato i dati di ogni braccio relativi a ciascun regime di trattamento e infine abbiamo calcolato l’OR per l’effetto della cirrosi sulla SVR12 utilizzando il metodo Peto. Considerando la Figura 3A, solo nel regime di trattamento A, la cirrosi aveva un effetto significativo sulla SVR12 (OR = 0,21, 95%CI = 0,07-0,66).
 Figura 3.
Figura 3.Effetto della cirrosi e della precedente storia di trattamento sulla risposta virologica sostenuta per il regime sofosbuvir più ledipasvir. A. Effetto della cirrosi sulla risposta virologica sostenuta. B. Effetto della precedente storia di trattamento sulla risposta virologica sostenuta.
(0.17MB).- –
Precedente storia di trattamento. Abbiamo valutato l’effetto della precedente storia di trattamento su SVR12. La Figura 3B mostra i dati combinati relativi a ciascun regime di trattamento e gli OR (secondo il metodo Peto) relativi all’effetto della storia precedente di trattamento. Sulla base di questa analisi, la storia precedente del trattamento non ha avuto alcun effetto significativo sulla SVR12 in tutti i regimi.
- –
Sostituzioni associate alla resistenza NS5A. I dati riguardanti le RAS di NS5A sono stati estratti dagli studi inclusi che hanno valutato le RAS al basale. Poiché i dati su questo problema non erano disponibili per la valutazione di ogni regime (A, B, C e D), inevitabilmente abbiamo studiato l’effetto dei RAS sul regime principale SOF/ LDV con o senza RBV per 12 o 24 settimane. I dati di tre articoli non sono stati inclusi in questa analisi; Gane, et al.13 a causa dell’aggiunta di un altro farmaco (GS-9669) al regime SOF/LDV in due bracci di studio, Stedman, et al.14 a causa dei dati non disponibili sulla valutazione dei RAS sulla SVR e Kohli, et al.15 a causa della segnalazione di dati inadeguati sul numero di pazienti con SVR e RAS NS5A. Inoltre, Kowdley e colleghi6 hanno valutato l’effetto di SOF/LDV per 8 settimane in un braccio del loro studio e poiché non abbiamo potuto separare i dati riportati sui RAS di NS5A e sulla SVR da questo braccio, abbiamo estratto tutti i dati da questo studio e li abbiamo inclusi in questa meta-analisi. Secondo la Figura 4, NS5A RASs ha avuto un significativo effetto di riduzione sulla SVR nel regime SOF/LDV (OR = 0,31, 95% CI = 0,2-0,5). Non c’era eterogeneità tra i risultati degli studi per quanto riguarda il rilevamento di NS5A RAS al basale e la risposta al trattamento. Inoltre, sulla base dei test di Begg (P = 0,65) e di Egger (P = 0,67), non è stato trovato alcun bias di pubblicazione.
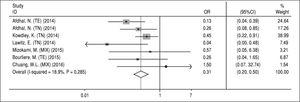 Figura 4.
Figura 4.Effetto delle sostituzioni associate alla resistenza NS5A sulla risposta virologica sostenuta per il regime sofosbuvir più ledipasvir.
(0.12MB).Discussione
L’attuale meta-analisi ha dimostrato l’elevata efficacia della terapia di combinazione SOF/LDV nei pazienti con infezione cronica da epatite C di genotipo 1. Il precedente standard di cura per il trattamento dell’infezione da HCV di genotipo 1 era costituito da PegIFN e RBV con un tasso di SVR inferiore al 60% nei pazienti con infezione da HCV di genotipo 1 e il trattamento accompagnato da molti effetti collaterali.16
Il riconoscimento delle proteine chiave nel ciclo di replicazione dell’HCV ha fornito l’opportunità di colpire queste proteine e inibire la produzione di virioni.17 I regimi di trattamento dell’HCV hanno avuto una lunga storia, passando dai regimi basati su IFN a quelli senza IFN. Questo ha fornito un regime di trattamento con un alto tasso di SVR, una breve durata del trattamento e un numero ridotto di eventi avversi. L’obiettivo di avere un regime di trattamento senza IFN per l’infezione da HCV di genotipo 1 è stato raggiunto con l’introduzione e l’approvazione del regime SOF/LDV nel 2014.18
Il SOF/LDV può essere usato con o senza RBV e in diverse durate di trattamento (12 o 24 settimane).7 Alcuni fattori importanti possono essere considerati per scegliere il regime appropriato, come l’esistenza di cirrosi e la controindicazione all’RBV. Tuttavia, il costo di questo regime è un altro fattore considerevole per la scelta della durata del trattamento. È interessante notare che nello studio attuale è stato dimostrato che le SVR in tutti i regimi di 12 o 24 settimane con o senza RBV erano uguali e superiori al 95%, tra cui: 95% per 12 settimane di trattamento con SOF/LDV, 97% per 24 settimane di trattamento con SOF/LDV, 96% per 12 settimane di trattamento con SOF/LDV/RBV e 98% per 24 settimane di trattamento con SOF/LDV/RBV. È vero che l’aggiunta di RBV a SOF/LDV o il prolungamento di SOF/LDV a 24 settimane può portare a un leggero aumento della SVR12 dal 95% al 96% tuttavia, nello studio attuale, è stato osservato che la cirrosi (Child-Pugh A) può avere un impatto (OR = 0,21) sulla SVR12 proprio nel regime di 12 settimane di trattamento con SOF/LDV. Di conseguenza, raccomandiamo di trattare i pazienti cirrotici (Child-Pugh A) con SOF/LDV/RBV per 12 settimane o con SOF/LDV per 24 settimane in base alla controindicazione del RBV e alla questione del prezzo, mentre sembra che il trattamento dei pazienti non cirrotici con SOF/LDV per 12 settimane sia accettabile. In questa meta-analisi, è stato osservato l’impatto della precedente storia di trattamento (diversa dai regimi a base di SOF) sul successo del trattamento in nessuno dei quattro regimi di SOF/LDV. Di conseguenza, la selezione della durata del trattamento o l’aggiunta di RBV al regime SOF/LDV sulla base della storia di un precedente trattamento con PegIFN/RBV o con regimi contenenti PI non è raccomandata.
In questo studio, abbiamo raccolto i dati per la valutazione dell’impatto di NS5A RAS al basale sul successo del trattamento, tuttavia in nessuno di questi studi i dati per la valutazione della resistenza sono stati stratificati rispetto al regime di trattamento. Di conseguenza, i dati per tutti i bracci di ogni studio sono stati inclusi in questa meta-analisi. Questa meta-analisi ha trovato il RASs basale del gene NS5A dell’HCV come parametro che ha influenzato il tasso di risposta al trattamento. Vale la pena di notare che la maggior parte dei pazienti con fallimento del trattamento presentava NS5A RAS al momento del fallimento del trattamento, il che dimostra il ruolo principale di NS5A RAS nel fallimento del trattamento dei pazienti trattati con LDV.6,7,19-22 Tuttavia, l’utilità clinica della valutazione di NS5A RASs prima di iniziare il trattamento non è ancora definita, forse a causa dell’alto tasso di risposta al trattamento con SOF/LDV e della specificità molto bassa della valutazione di NS5A RASs per la previsione del fallimento del trattamento.
L’introduzione di altri DAAs e regimi senza IFN e la loro approvazione per il trattamento dei pazienti con infezione da HCV di genotipo 1 è proseguita dopo l’approvazione di SOF/LDV. Nel dicembre 2014, è stata approvata la combinazione di Ombitas-vir/Paritaprevir-r/Dasabuvir (3 antivirali ad azione diretta; 3D) per l’infezione da HCV di genotipo 1 con un’efficacia superiore al 95%.23 Nel gennaio 2016, è stata approvata la terapia di combinazione con Grazoprevir/Elbasvir (GZR/EBR) con un tasso SVR del 95% circa.24 Dato che SOF ha un metabolismo renale, questo agente antivirale non può essere somministrato nella malattia renale cronica (clearance della creatinina 2) e il 3D e il GZR/EBR sono le alternative per il trattamento dei pazienti con malattia renale cronica e infezione da HCV genotipo 1.25,26 Inoltre, altre combinazioni di DAA come SOF/Daclatasvir (27) e SOF/Velpatasvir28 sono disponibili come regimi di trattamento pan-genotopico.
In conclusione, il trattamento dell’HCV di genotipo 1 con la combinazione SOF/LDV dà come risultato un’elevata (≥ 95%) risposta al trattamento. La decisione di aggiungere RBV a SOF/LDV e/o di prolungare SOF/LDV può essere presa in base alla presenza di cirrosi, alle controindicazioni di RBV e alla questione dei costi. Una maggiore identificazione delle persone con infezione da HCV e un maggiore accesso al trattamento per loro possono contribuire all’eliminazione dell’HCV.29 Il prossimo obiettivo nel campo del trattamento dell’HCV è lo sviluppo di nuovi regimi terapeutici dell’HCV senza RBV con una promettente risposta al 100% del trattamento e nessuna reazione farmacologica.30
Riconoscimenti
Contributo degli autori: Concetto e disegno dello studio: Mohammad Saeid Rezaee-Zavareh, Bita Behnava, Seyed Moayed Alavian e Heidar Sharafi; acquisizione dei dati: Mohammad Saeid Rezaee-Zavareh e Khashayar Hesa-mizadeh; analisi e interpretazione dei dati: Mohammad Saeid Rezaee-Zavareh, Mohammad Gholami-Fesharaki e Heidar Sharafi; redazione del manoscritto: Mohammad Saeid Rezaee-Zavareh, Khashayar Hesamizadeh, Mohammad Gholami-Fesharaki e Heidar Sharafi; revisione critica del manoscritto per importanti contenuti intellettuali: Bita Behnava e Seyed Moayed Alavian.
Dichiarazione degli interessi personali degli autori
Nessuno dichiarato.
Dichiarazione degli interessi finanziari
Nessuno dichiarato.
- –
- –
Lascia un commento