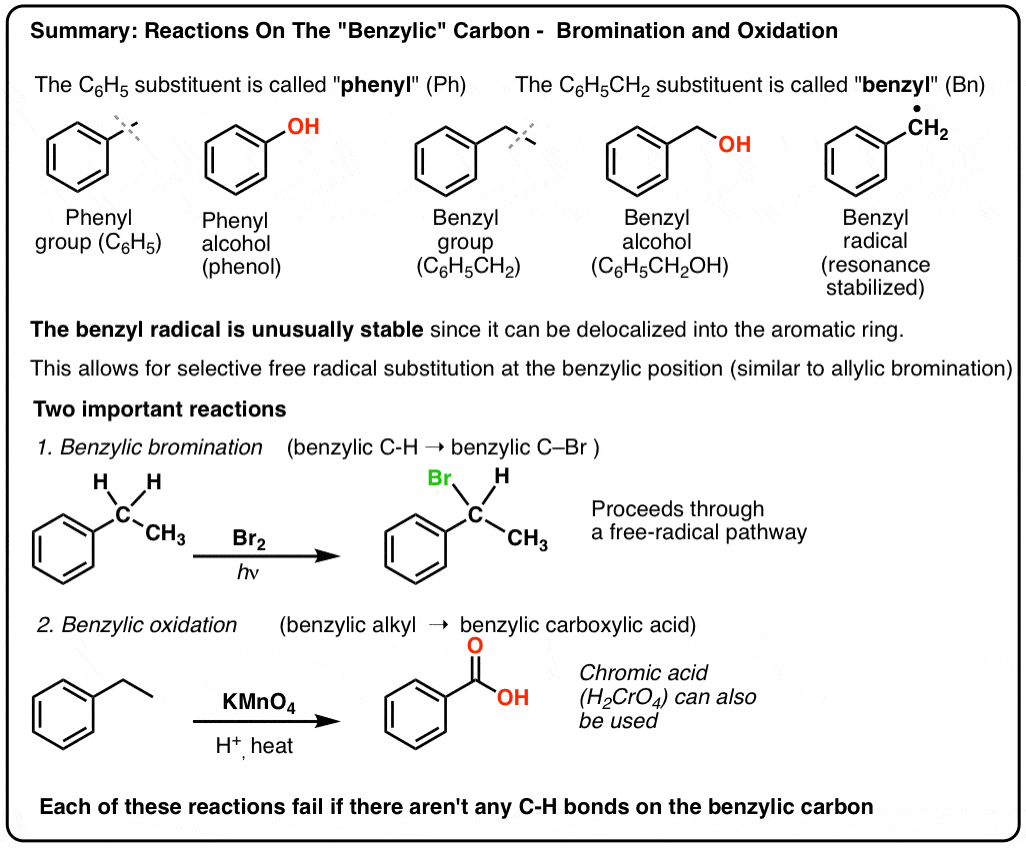
Reakciók a “benzil” szénen: brómozás és oxidáció
On október 12, 2021 by adminAz aromás gyűrűvel szomszédos szén – a “benzil” szén – számos hasznos és érdekes reakcióban vehet részt. Ma két kulcsfontosságú példára mutatunk be példákat és mechanizmusokat: a benzil-brómozásra és a benzil-oxidációra. Íme a gyors összefoglaló:
Tartalomjegyzék
- Alkilcsoportok = “durvaság”
- A benzolgyűrűvel szomszédos alkilcsoportokban van valami különleges
- “Fenil” vs “benzil” : Mi a különbség?
- A benzilgyökök rezonancia által stabilizáltak; a fenilgyökök nem.
- A benzil (és az allil) C-H kötések gyengék, más alkil C-H kötésekhez képest
- Benzil brómozás
- Mikor nem működik a “benzil brómozás”?
- A benzil-brómozás alkalmazásai
- Benzil-oxidáció KMnO4-gyel (vagy H2CrO4-vel)
- A benzil-oxidációhoz benzil C-H kötés szükséges
- Miért fontos ez?
- Jegyzetek
- Teszteld magad!
- (Haladó) Hivatkozások és további olvasmányok
Alkilcsoportok = “nyersanyag”
A táplálkozásban “nyersanyagnak” nevezzük az élelmiszerekben található összes cellulózt és rostot, amelyek csak úgy átfutnak a szervezeten anélkül, hogy ténylegesen megemésztődnének.
Ez nagyjából leírja az alkilcsoportok viselkedését az általunk tanult szerves kémiai reakciók túlnyomó többségében. A kémiájuk “unalmas”. Lehet, hogy ők alkotják a molekula gerincét és általános szerkezetét, de a C-H kötéseik inertek a legtöbb reakciókörülményre.
Sőt, ha nem számítjuk az égést, az alkilcsoportok nagyjából egyetlen reakciója, amit a bevezető szerves kémiában tárgyalunk, a szabadgyökös szubsztitúció. És még ez a reakció is eléggé szelektálatlan, különösen, ha szabadgyökös klórozással van dolgunk.
Láttuk, hogy ez alól az “unalmas” viselkedés alól kivételt képez az úgynevezett “allylikus” C-H kötések szabadgyökös brómozása . Az “allylikus” pozíció egy olyan szén, amely egy kettős kötés szomszédságában van (nem maga a kettős kötésen lévő C-H! az egy “vinilikus” C-H).
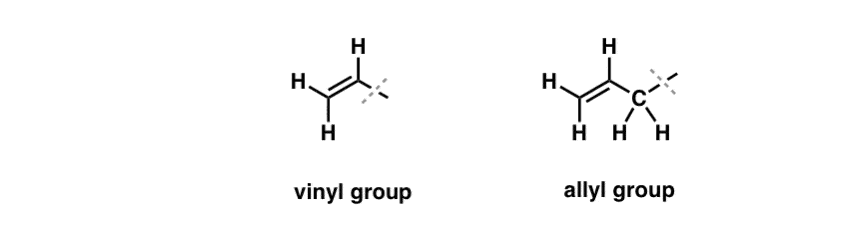
Mitől olyan különleges az “allylikus” pozíció? Az allillikus gyökök, karbokationok és anionok jelentősen stabilizálódnak a rezonancia révén. Az allillikus gyök, karbokation vagy anion orbitálja igazodhat a szomszédos pi-kötés p-orbitáljaihoz, ami egy nagyobb “pi-rendszert” eredményez, és a töltés nagyobb területre oszlik el.
Van valami különleges a benzolgyűrűvel szomszédos alkilcsoportokban
Mi az oka ennek a kis emlékutazásnak? Nos, nemrég egy kis időt töltöttünk a Friedel-Crafts alkilezési reakció áttekintésével, és nem szeretném azt a benyomást kelteni, hogy egy benzolgyűrű mellé alkilcsoportot tenni szintetikus zsákutca.
Az alkilcsoportoknak nem kell inertnek lenniük! Az allilszénhidrogénekhez hasonlóan a benzolgyűrűkkel szomszédos alkilcsoportok különösen reaktívak, és ennek mindenféle fontos alkalmazása lehet.
Két fontos reakcióval foglalkozunk ebben a bejegyzésben:
- Benzilbrómozás – az aromás gyűrűhöz szomszédos alkilcsoport szabadgyökös brómozása
- Benziloxidáció – a benzolhoz szomszédos alkilcsoport teljes oxidációja karbonsavvá.
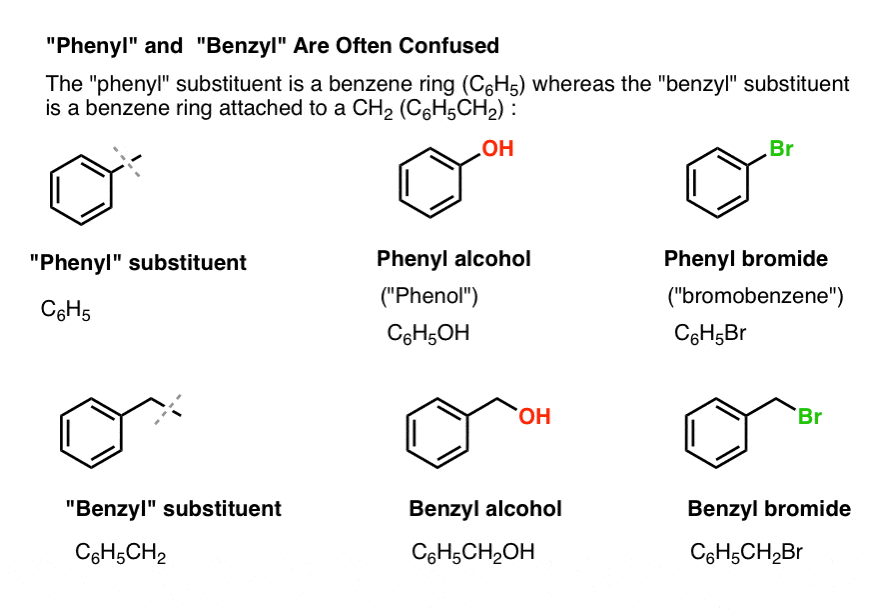
3. “Fenil” vs “benzil” : Mi a különbség?
Először is, egy gyors ügymenet. Tegyünk félre néhány fontos nómenklatúrát, mert a “fenil” és a “benzil” sok zavart okoz:
- A fenilcsoport (vagy fenilszubsztituens) a benzol egy hidrogénnel csökkentve: C6H5 . A gyűrűben lévő szénatomok fenil szénatomok, a fenil szénatomokhoz kapcsolódó hidrogének pedig fenil C-H kötések. Ez analóg a vinilhez (lásd fentebb).
- A benzilcsoport metilbenzol mínusz egy hidrogén: C6H5CH2 . A gyűrűvel szomszédos szén a benzilszén, a benzilszénhez kapcsolódó hidrogéneket pedig benzilhidrogéneknek nevezzük. Ez analóg az allyllal (fent).
4. A benzilgyökök rezonancia által stabilizáltak; a fenilgyökök nem.
A fenilnek a vinillel és a benzilnek az allyllal való analógiája a gyökeik (valamint a karbokationjaik és anionjaik) stabilitására is kiterjed.
- A fenilgyökök nem stabilizálódnak rezonanciával, mivel a gyököt tartalmazó orbitál derékszögben áll a pi-rendszer orbitáljaival, és nincs átfedés közöttük. Az sp2-hibridizált szénatomokon lévő gyökök általában kevésbé stabilak, mint az alkilszénatomokon lévő gyökök. (Lásd a posztot: A szabad gyököket destabilizáló három tényező )
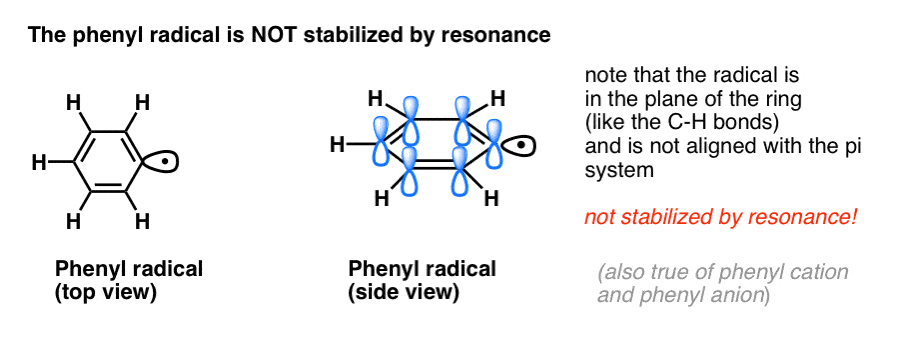
- A benzilgyökök szokatlanul stabilak, mivel a gyököt tartalmazó orbitál a benzolgyűrű pi-rendszeréhez igazodhat, akárcsak alliklikus rokonaiknál (ez igaz a benzil-kationokra és -anionokra is).
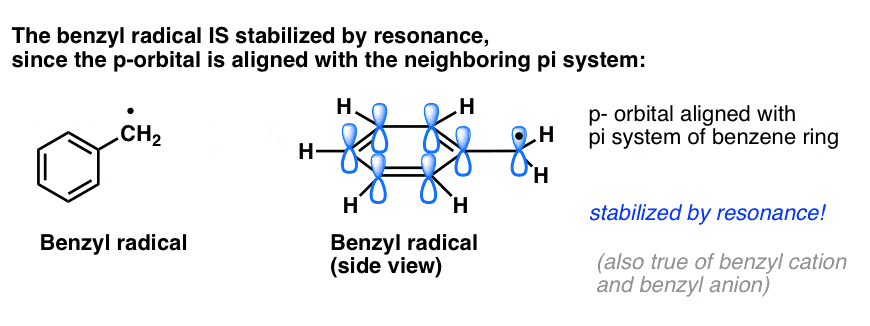
A benzil (és az allillikus) C-H kötések gyengék, más alkil C-H kötésekhez viszonyítva
A benzil C-H kötések kötéserőssége (alias BDE-k, vagy kötésdisszociációs energiák) körülbelül 90 kcal/mol, ami lényegesen gyengébb, mint a tercier C-H (kötéserősség 93 kcal/mol), a szekunder C-H (96 kcal/mol) és az elsődleges C-H (100 kcal/mol) kötések. (A fenil C-H kötések erőssége körülbelül 113 kcal/mol, ami ismét a fenilgyökök instabilitását tükrözi ).
Mivel a kötés disszokációs energiái a C-H kötés homolitikus hasadásának könnyűségét tükrözik (azaz mennyire könnyű a kötést két szabad gyökké disszociálni), ez egy másik módja annak, hogy azt mondjuk, hogy a benzilgyökök különösen könnyen képződnek a többi alkilgyökhöz képest.
Már korábban láttuk, hogy ugyanez igaz az allil C-H kötésekre is . Az “allillikus brómozás” során az alkilcsoporton a kettős kötéssel szomszédos egyik C-H kötést N-bromszukcinimid (NBS) és fény (hν) segítségével C-Br kötéssé alakítjuk át :
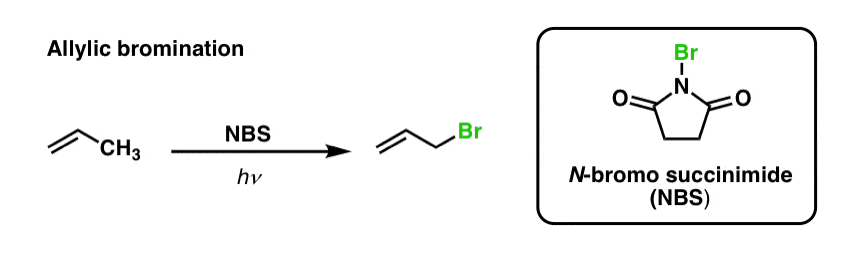
A reakció az allillikus C-H kötés gyengébb erőssége (89 kcal/mol) miatt szelektív az allillikus C-H kötésekre az elsődleges, másodlagos és harmadlagos C-H kötések jelenlétében.
Benzil-brominálás
Hasonló folyamat működik a “benzil” szénatomok esetében is. Használhatunk NBS-t (mint fentebb) vagy egyszerűen csak Br2-t, mivel az aromás gyűrűk közel sem olyan reaktívak Br2-vel, mint a kettős kötések.
Mihelyt kialakul (“hő” vagy “fény” hatására, amely a reakciót a Br-Br homolitikus disszociációjával indítja el), a brómgyök, Br- képes a gyengébb benzil C-H kötéseket megbontani anélkül, hogy az erősebb alkil C-H kötéseket érintené.
Itt vannak például a toluolnal, valamint az izopropilbenzollal való reakciójának termékei. Vegyük észre, hogy CSAK a benzilszén brómozódik. Minden más békén marad!
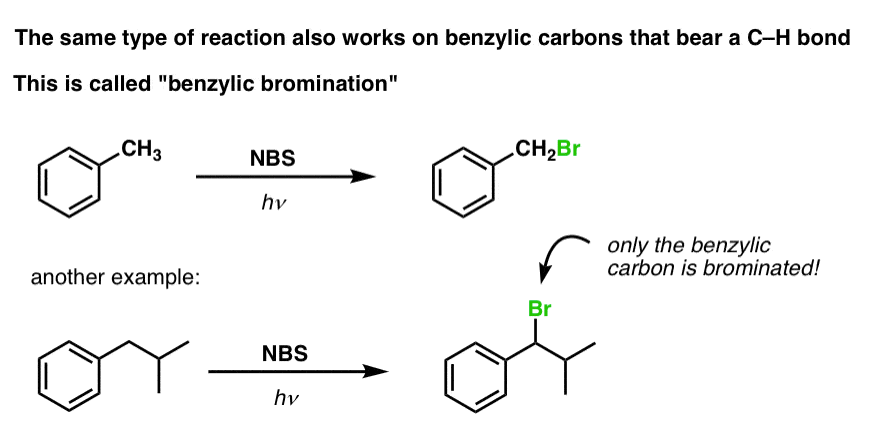
A benzil-brómozás mechanizmusa lényegében megegyezik az allil-bromozáséval, a beindítási, terjedési és befejezési lépésekkel. (A mechanizmus felugró képének megtekintéséhez kattintson ide.)
(További megbeszélésért lásd ezt a bejegyzést: Allylikus brómozás )
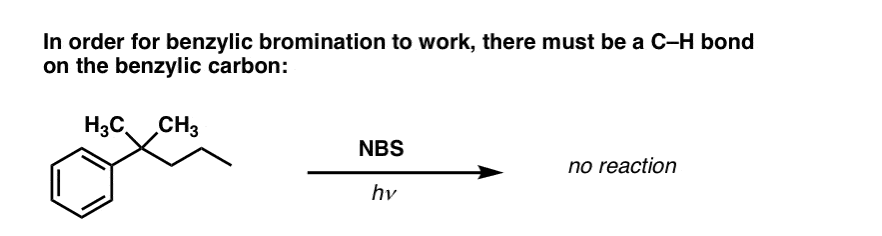
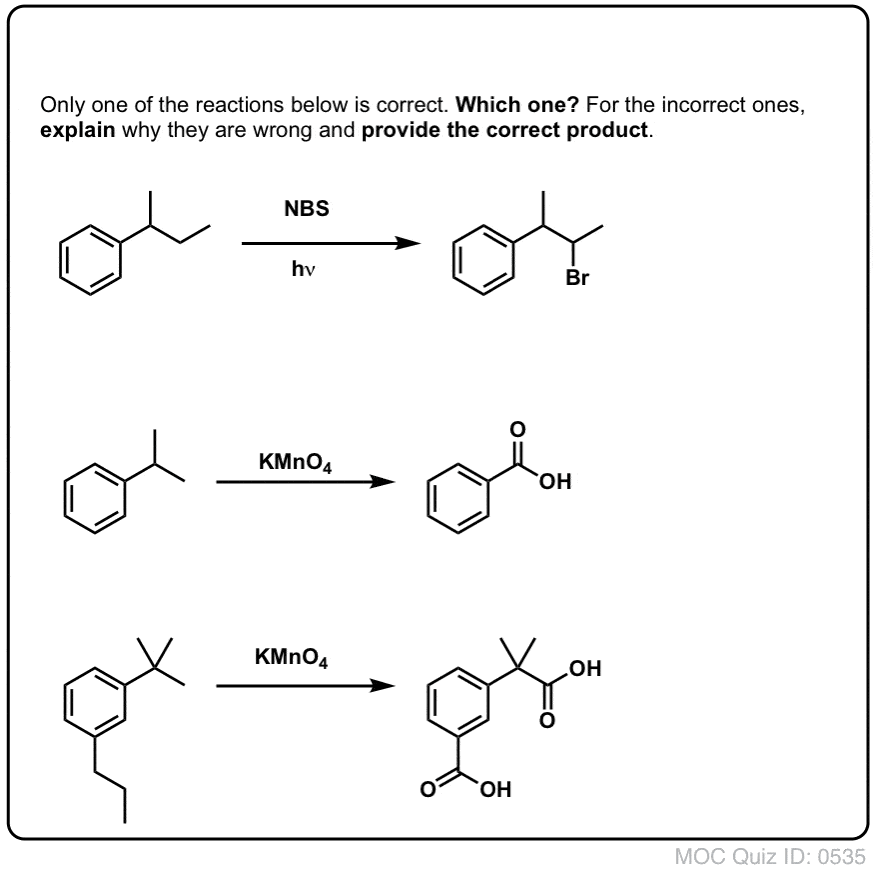
Mikor NEM működik a “benzil-bromozás”?
Mivel a reakció kulcsa a (viszonylag stabil) benzilgyök képződése, a benzil-brominálás kudarcot vall olyan szubsztrátokon, ahol ennek a gyöknek a C-H kötés felbontásával történő előállítása lehetetlen.
Nézzük meg például az alábbi példát. Hogyan lehetséges benzilgyök keletkezése, ha a benzilszénhez három alkilcsoport kapcsolódik? Nem lehet – és a reakció meghiúsul.
A benzilbrómozás alkalmazásai
Miért lehet tehát hasznos a benzilbrómozás?
Nos, lehetővé teszi számunkra, hogy az alkil-halogenidek összes olyan reakcióját, amelyet az Org 1-ben tárgyaltunk – főként szubsztitúciót és eliminációt – alkalmazzuk olyan termékek előállítására, amelyeket Friedel-Crafts reakciókkal nehéz lenne közvetlenül egy aromás gyűrűre telepíteni.
Elképzelhető például, hogy a benzil-brómozással SN2-reakciót indítunk el, pl. egy Friedel-Crafts-alkilezést követően:
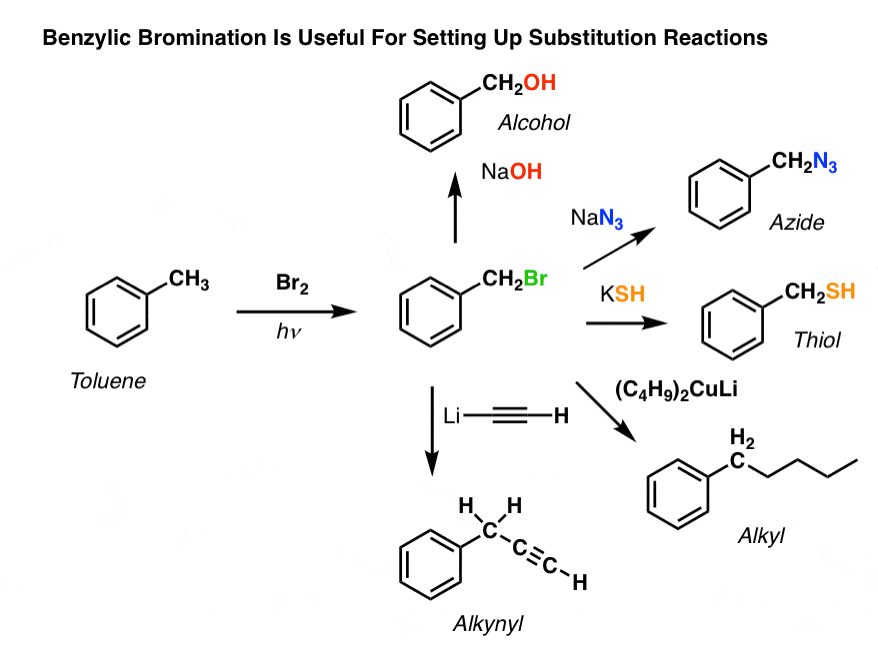
Nézzük, hogy egy jó távozócsoport benzil-helyzetbe való telepítése mindenféle lehetőséget biztosít számunkra különböző funkciós csoportok telepítésére?
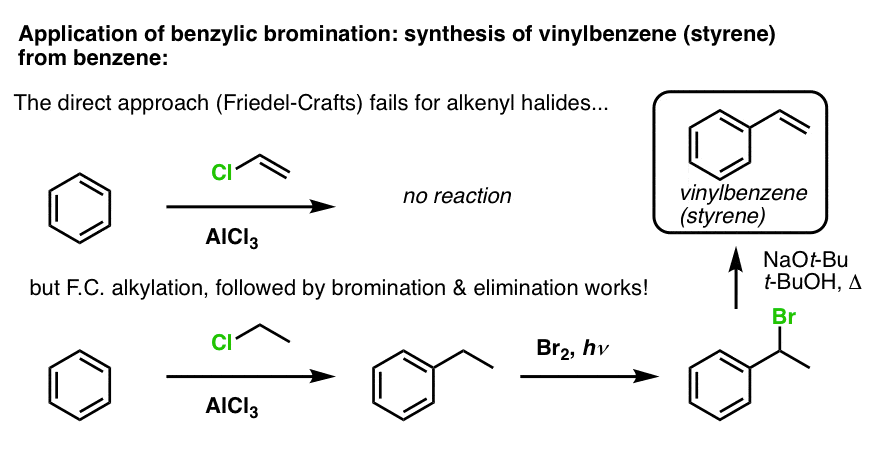
Egy másik példa a sztirol szintézise benzolból. Első pillantásra úgy tűnhet, hogy a legközvetlenebb megközelítés a vinil-klorid és a benzol Friedel-Crafts reakciója. De a Friedel-Crafts nem működik alkenil-halogenidek (más néven vinil-halogenidek) esetén! (a vinil-karbokationok kevésbé stabilak, mint az alkil-karbokationok).
Ezt az úttorlaszt úgy tudjuk megkerülni, hogy etil-kloriddal Friedel-Crafts-alkilezést végzünk, majd benzilbrómozást, majd eliminációt végzünk (E2-n keresztül, valami NaOtBu/t-BuOH-val), hogy az alként kapjuk:
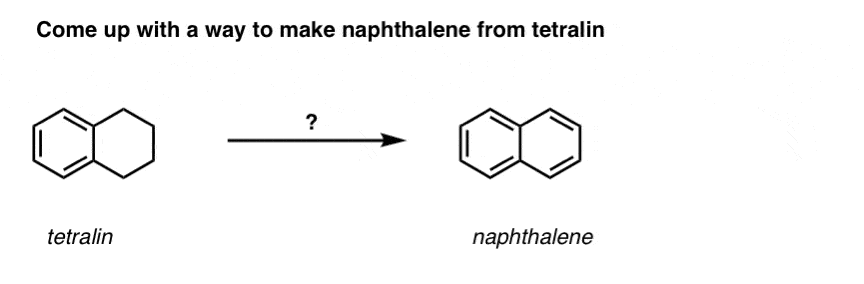
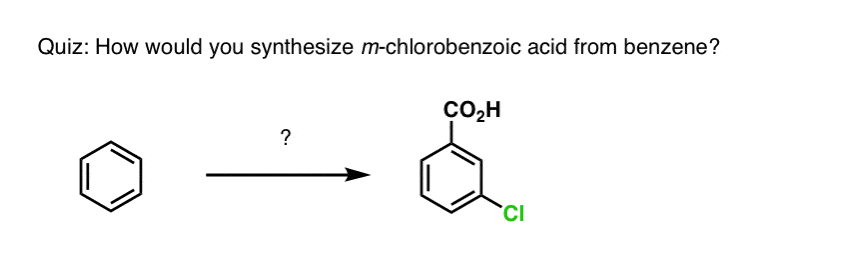
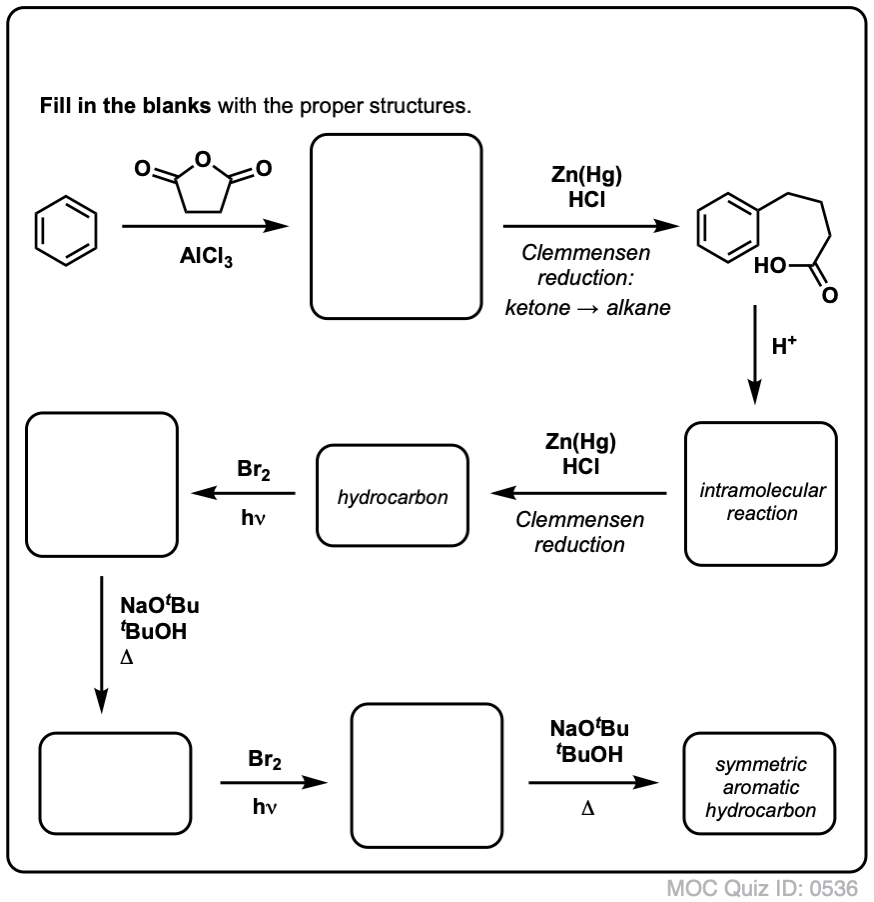
A fentiek alapján íme egy gyors kvíz. Hogyan lehetne a tetralint (balra lent) naftalénné (jobbra lent) alakítani? Válaszoljatok a lábjegyzetekben.
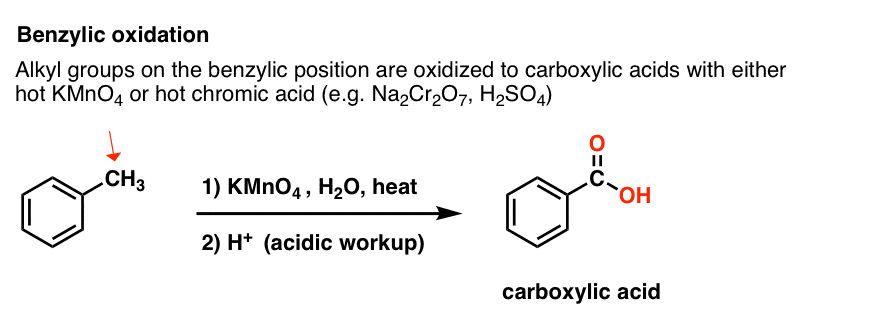
9. Benzil-oxidáció KMnO4-gyel (vagy H2CrO4-vel)
Mivel a benzil C-H kötés viszonylag gyenge, joggal kérdezhetjük, hogy más típusú reakciók (a brómozáson kívül) végrehajthatók-e ebben a helyzetben.
Egyértelműen igen! Kiváló példa erre a benzil-oxidáció – ahol a benzil C-H kötés megszakad és egy benzil C-O kötés keletkezik.
Most: a benzil-oxidációhoz léteznek meglehetősen kíméletes reagensek, amelyek kémiai megfelelője a C-H kötés tollal való lecsiklandozásának, ami benzil-aldehidet vagy ketonokat eredményez .
Ez nem az a fajta benzil-oxidáció, amelyet egy tipikus bevezető szerves kémia kurzuson tárgyalnak!
Ehelyett a benzil-oxidáció fő reagensét, amelyet a legtöbb bevezető tankönyv tárgyal, a forró kálium-permanganát (KMnO4) jelenti. A forró krómsav (H2CrO4, amely egy dikromát só, mint a Na2Cr2O7 és egy erős sav, mint a H2SO4 kombinálásával keletkezik) szintén használható ilyen célokra.
A KMnO4 nem finom. A KMnO4 nem finom. A KMnO4 nem kedves.
A forró KMnO4 oldat olyan, mint egy zsák tele dühös piranhákkal, amelyek letépik az összes húst a molekuládról, és csak a csontokat hagyják hátra. (Ha jobban belegondolok, olyan, mint a májad! )
A forró KMnO4 minden benzil C-H kötést elszakít és C-O kötéssé alakít. A toluolból például benzoesav (egy karbonsav) keletkezik.
De nem csak a benzil C-H kötéseket bontja meg. Dehogyis. A C-C kötések után is megy; legalábbis azok után, amelyek nem közvetlenül fenilgyűrűhöz kapcsolódnak. Például a para-dietilbenzolból para-benzol-dikarbonsavvá alakul át.
Megjegyezzük, hogy az alkil C-C kötésnek le kell szakadnia ahhoz, hogy ez az oxidáció megtörténhessen! (valószínűleg egészen CO2 gázzá oxidálódik).
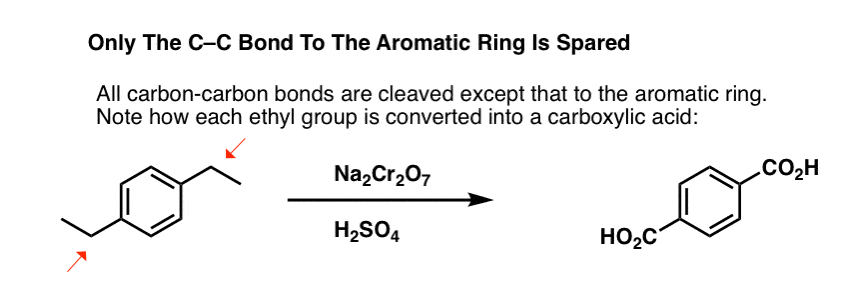
Egy érdekes variáció egy olyan ciklikus molekulán, mint a tetralin; az eredmény a dikarbonsav.
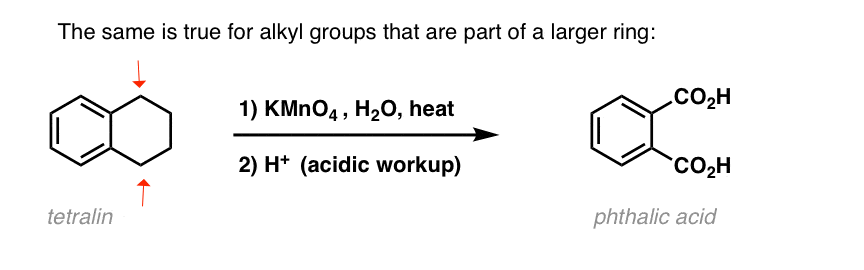
Ezt a dikarbonsavat ftalinsavnak nevezik.
10. A ftalinsav egy ciklikus molekulán, például a tetralinon is elvégezhető. A benzil-oxidációhoz benzil C-H kötés szükséges
A benzil-brómozáshoz hasonlóan a reakció nem megy végbe, ha a benzil-helyen nincs C-H kötés. Például t-butilbenzollal a reakció teljesen meghiúsul:
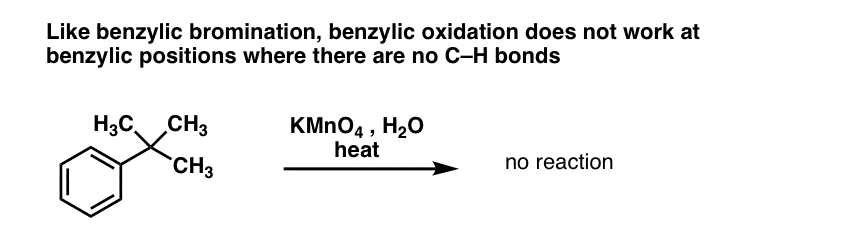
A benzil-oxidáció teljes mechanizmusa túl bonyolult, hosszadalmas és bizonytalan ahhoz, hogy itt bemutassuk, de az első lépés szinte biztosan a C-H kötés homolitikus hasadása a Mn=O által a benzilgyök kialakulásához.
Miért fontos ez?
A KMnO4-gyel történő benzil-oxidáció kemény reakció, de megvan a maga haszna. A legjobban olyan egyszerű molekulákkal működik, amelyek nem rendelkeznek kényes funkciós csoportokkal, és elviselnek egy nagyon durva kezelést.
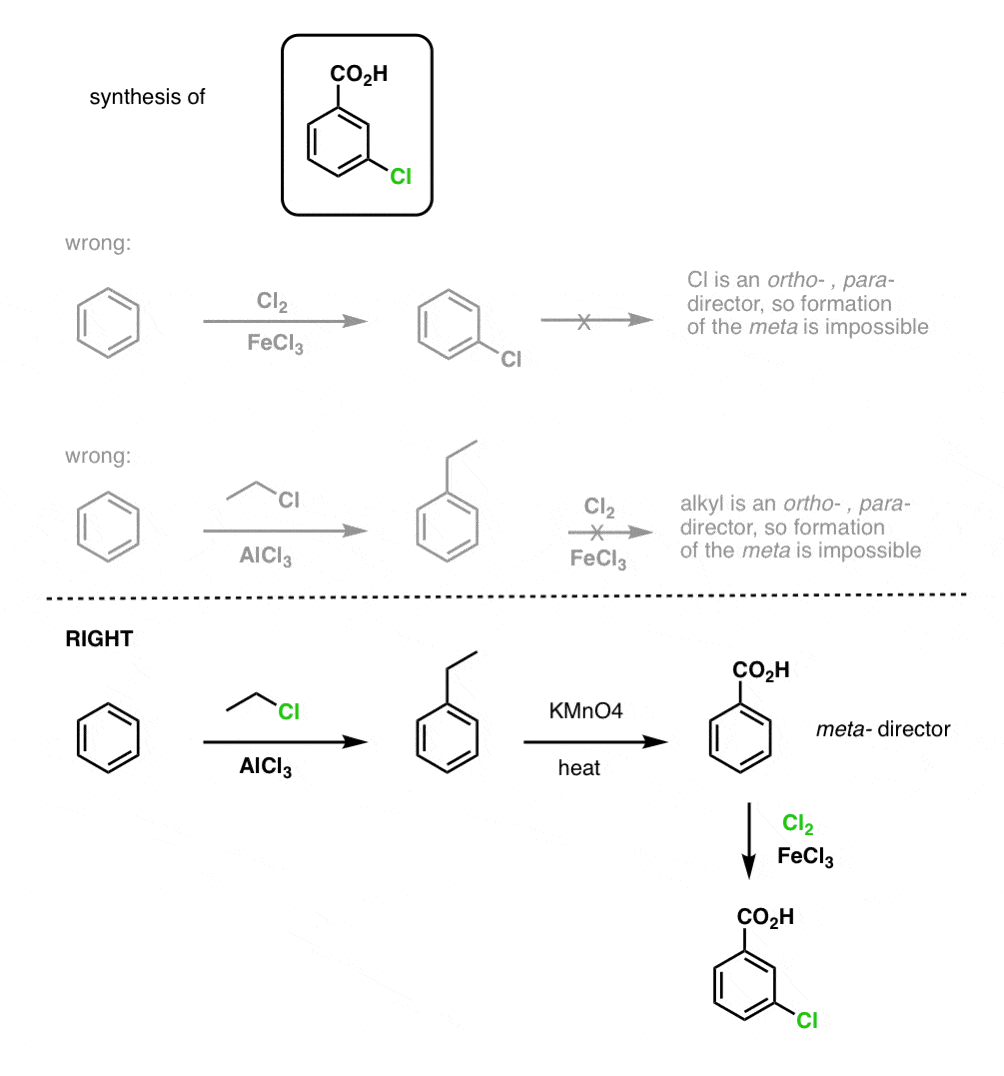
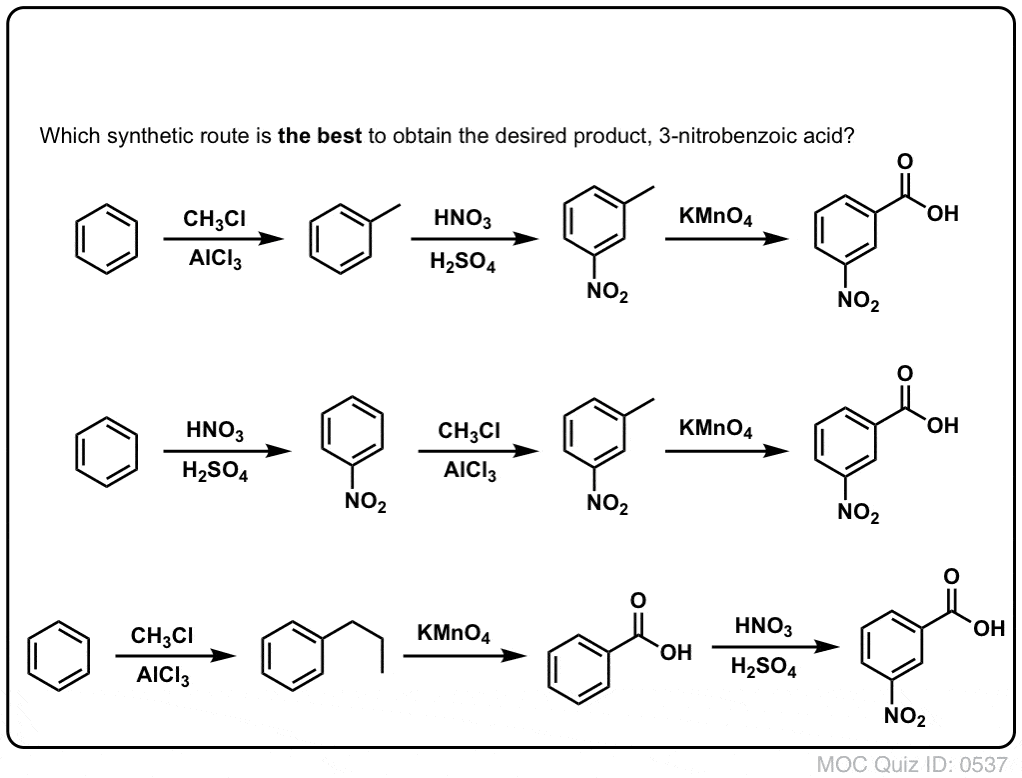
Az első dolog, amit meg kell jegyezni, hogy a karbonsavakat nem lehet közvetlenül egy benzolgyűrűre helyezni a Friedel-Crafts acilezésen keresztül, ezért az alkilezés, majd az oxidáció egy hasznos megoldás.
A második hasznos funkció a szintézisben az, hogy a benzil-oxidáció egy o- p- rendezőt (egy alkilcsoportot) meta- rendezővé alakít át.
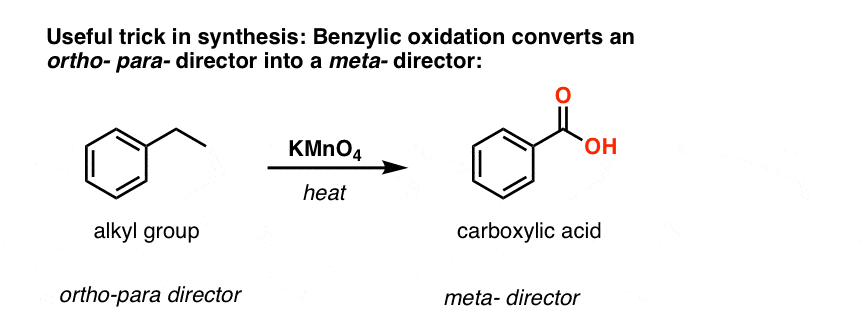
Például a következő molekula szintézisével szembesülve, hogyan járunk el? (tipp: valamilyen ponton benzil-oxidációval jár).
Az aromás vegyületek szintéziséről még sokat fogunk beszélni néhány további bejegyzésben.
Következő: Benzil-karbonilok redukciója – a Clemmensen- és a Wolff-Kishner-redukció
Jegyzetek
A “káposzta” a kémiában szlengkifejezésként is használatos “mindazokra a dolgokra a molekulán, amelyeket bármilyen okból nyugodtan figyelmen kívül lehet hagyni”. Például a briosztatin egy olyan szörnyeteg molekula, amely ígéretes rákellenes szerként mutatkozik. A baj csak az, hogy egy ritka bryozoából egy tonna kell ahhoz, hogy megfelelő mennyiségű bryostatinhoz jussunk, és ez nem elég egy emberen végzett klinikai kísérlethez. Ezért több csoport dolgozik egyszerűbb, könnyebben szintetizálható “bryológok” előállításán, ahol megszabadulnak a daganatellenes aktivitáshoz nem nélkülözhetetlen “káposztatintól”.
A Br2 általában nem reagál aromás gyűrűkkel Lewis-sav katalizátor nélkül. Ha azonban egy erős aktiváló csoport van jelen (pl. OH, NR2 stb.), akkor a gyűrű némi brómozása bekövetkezhet, különösen emelkedett hőmérsékleten.
Vicces tény: A “benzil-oxidáció” a válasz arra a rejtélyre, hogy a metilbenzol (toluol) miért nem közel olyan erős rákkeltő, mint a benzol. Ez azért van, mert a májadban vannak citokróm p450 enzimek (amelyek magas oxidációs állapotú vasfajokat tartalmaznak), amelyek képesek a benzil-CH3 csoportot a vízben jobban oldódó karbonsavvá oxidálni, lehetővé téve, hogy a vesék kiürítsék.
Ehhez két oxidációra és két eliminációra van szükség. Az óvatos megoldás az, hogy egyszer oxidálsz (azaz brómozolsz), majd eliminálsz, hogy alként kapj. Az alként ezután ismét brómozásnak lehetne alávetni (NBS-t használva, hogy elkerüljük a kettős kötés brómozását), hogy újabb brómozást kapjunk (az itt bemutatott benzil-bromozási termék, de az allikol is megvalósítható), amelyet bázissal kezelve aromás naftalint kapjunk.
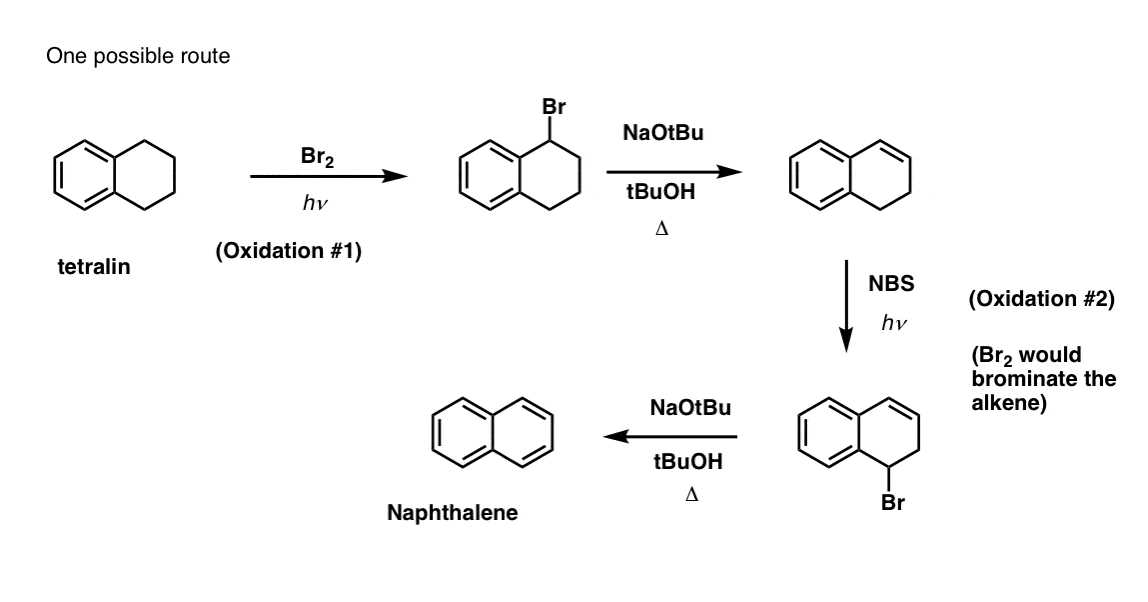
(a gyakorlatban kiderült, hogy mindkét brómozás egyszerre is elvégezhető Br2 segítségével, magas hőmérsékleten. A bázissal történő kezeléssel ezután naftalint kaphatunk).
Válasz a 2. kvízkérdésre.
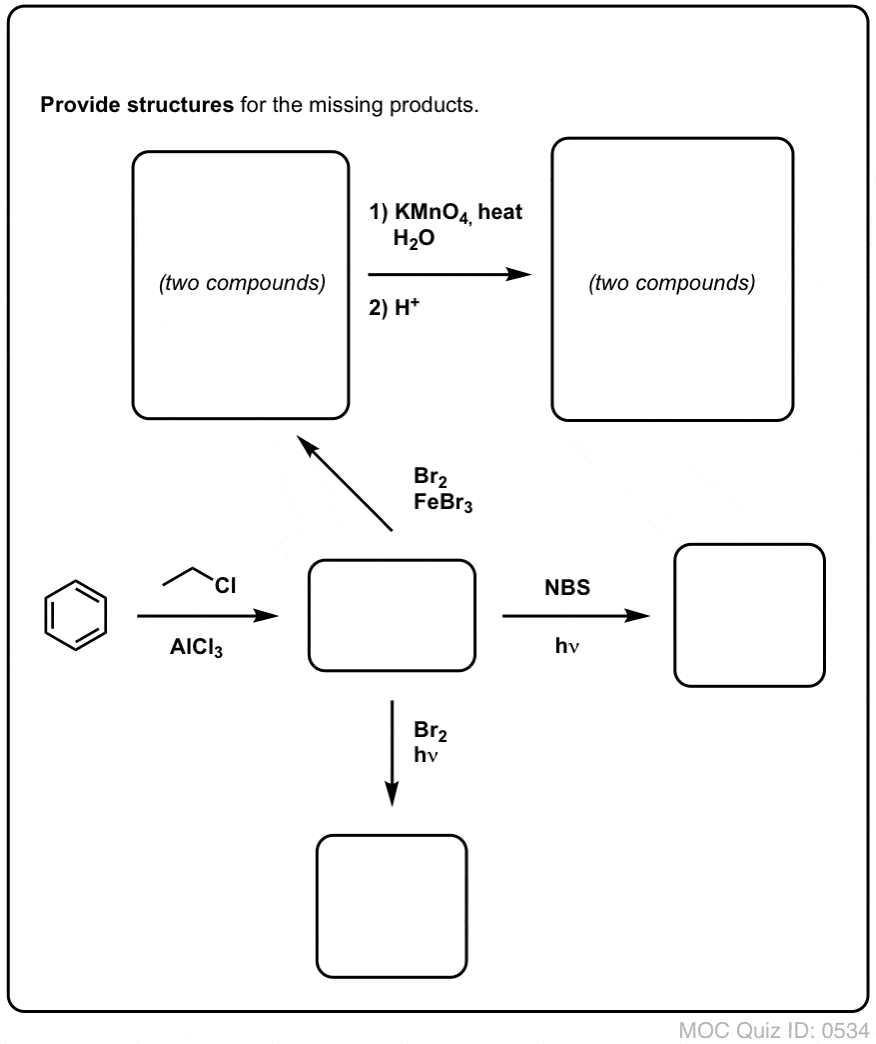
Kvíz!
 Click to Flip
Click to Flip 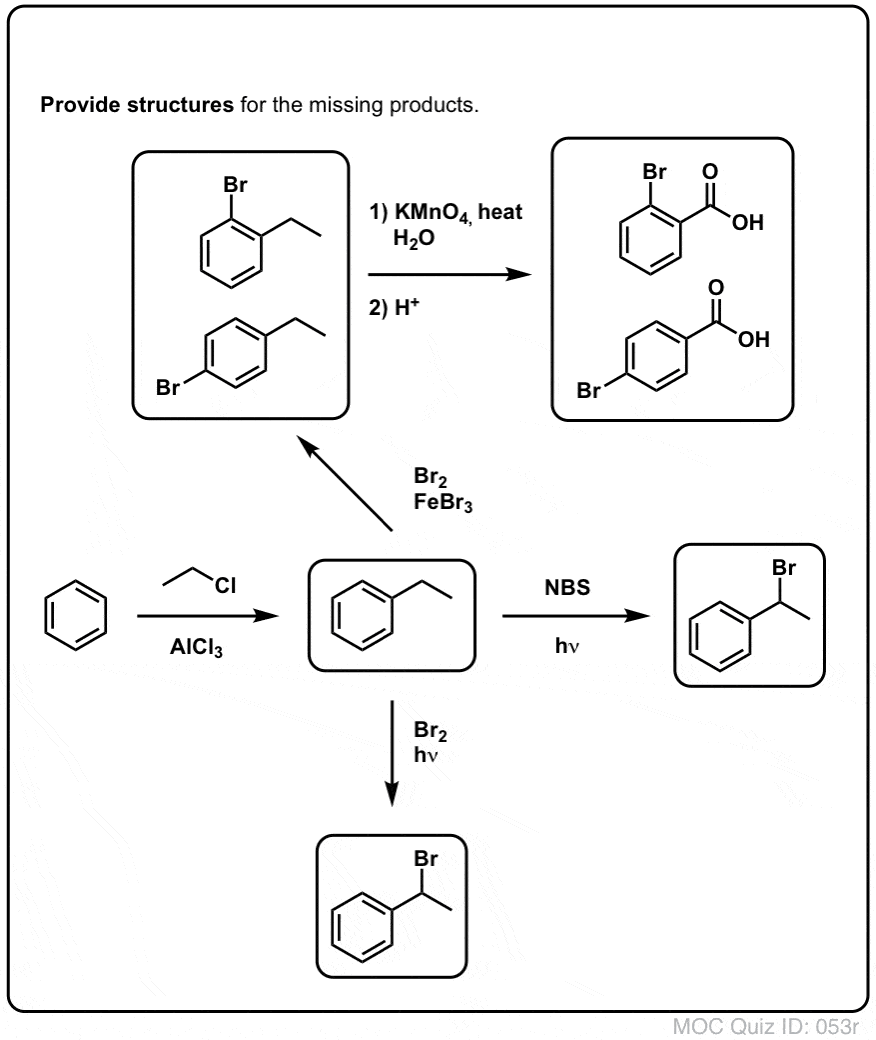
 Click to Flip
Click to Flip 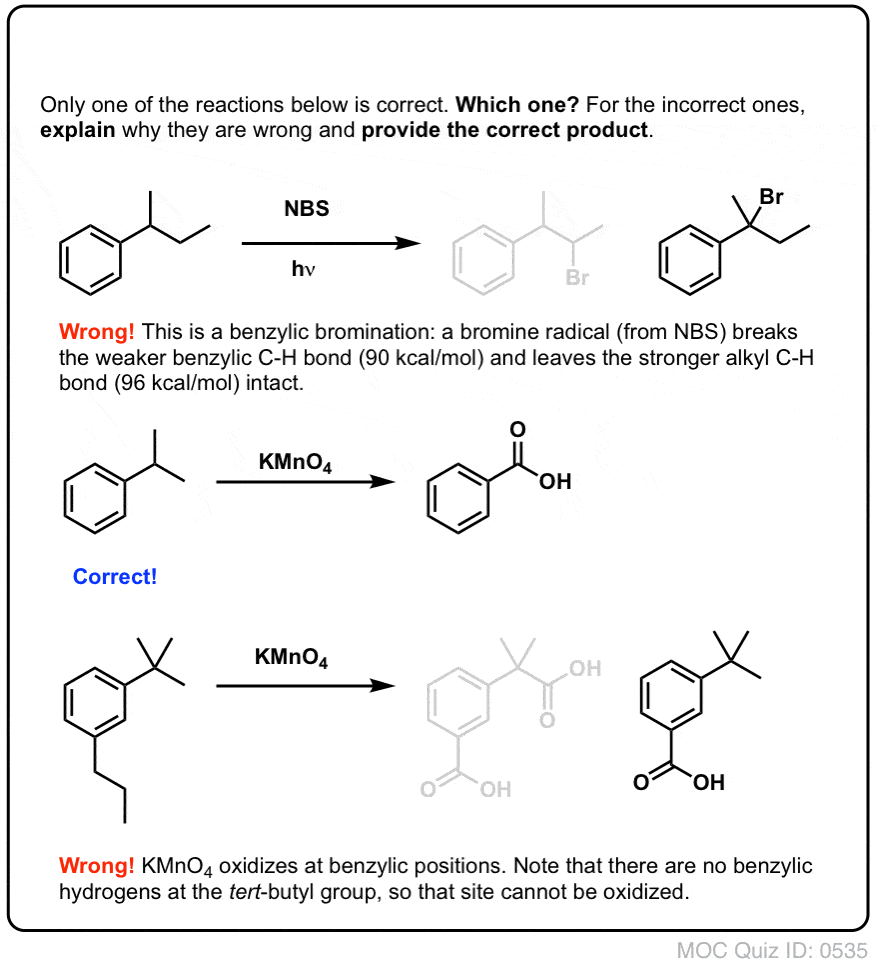
 Click to Flip
Click to Flip 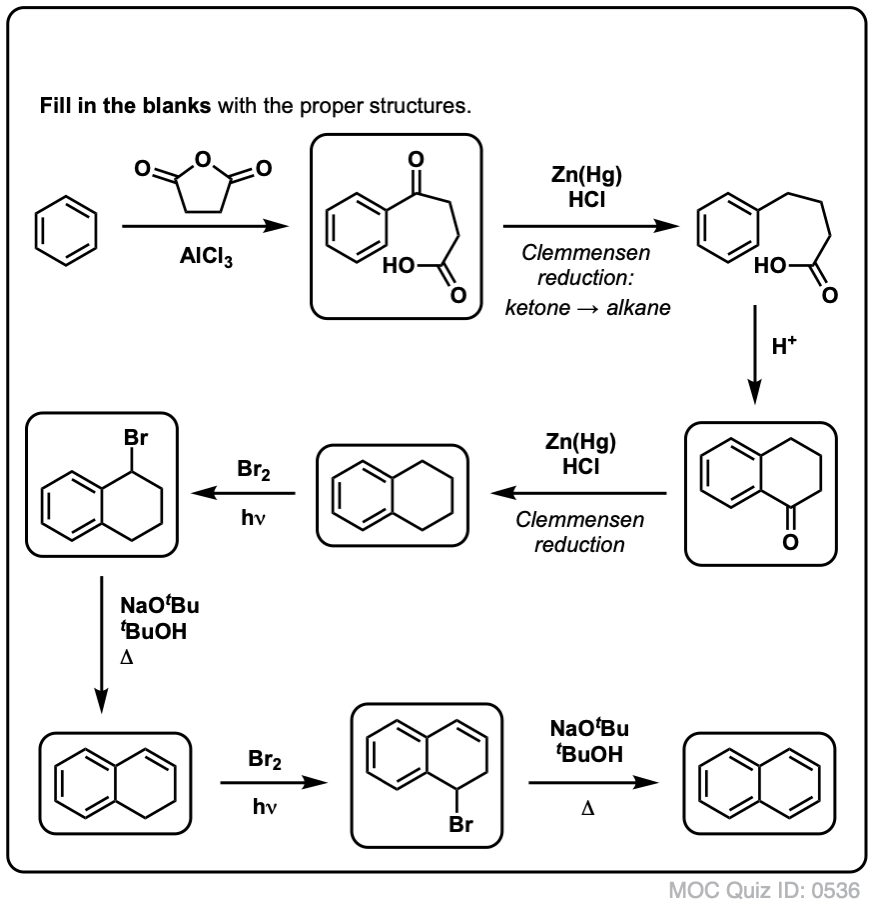
 Click to Flip
Click to Flip 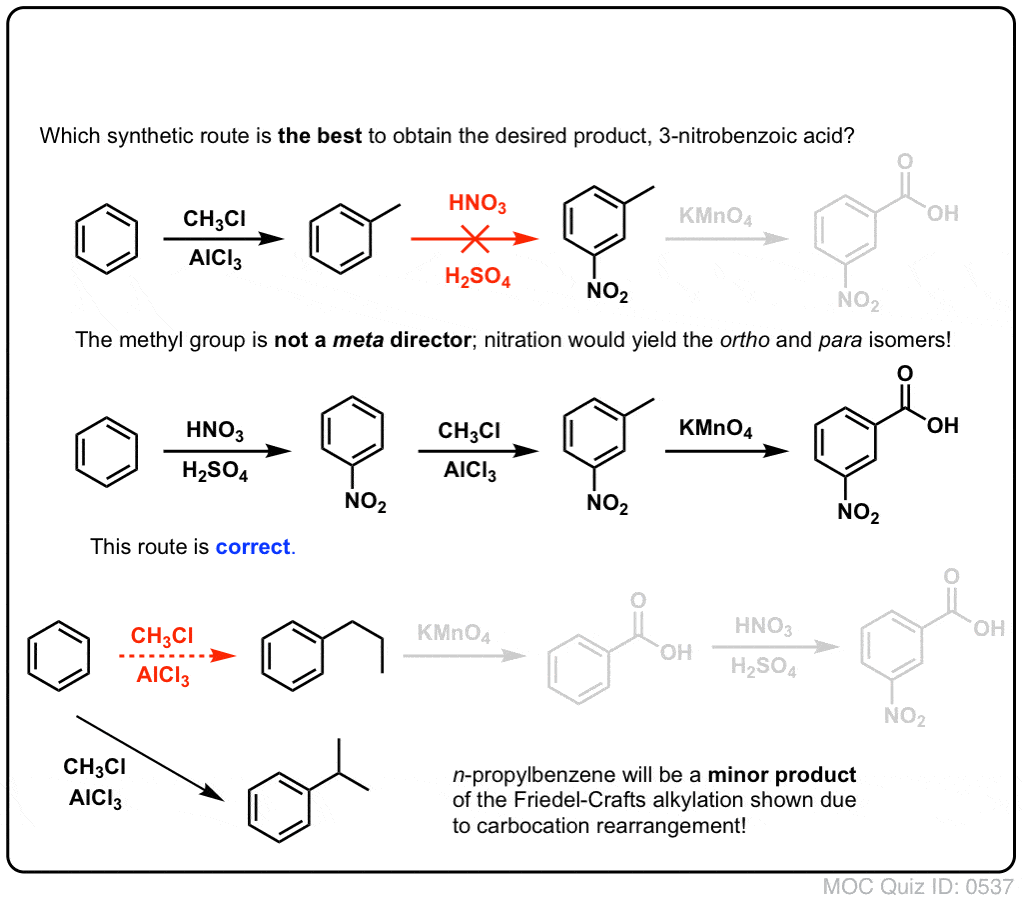
(Advanced) References and Further Reading
Benzil-brómozás:
Ezt a reakciót Wohl-Ziegler-reakciónak is nevezik.
- Bromierung ungesättigter Verbindungen mit N-Brom-acetamid, ein Beitrag zur Lehre vom Verlauf chemischer Vorgänge
Wohl
Chem. Ber. 1919, 52 (1), 51-63
DOI: 10.1002/cber.19190520109 - Die Halogenierung ungesättigter Substanzen in der Allylstellung
Ziegler, A. Späth, E. Schaaf, W. Schumann, E. Winkelmann
Just. Lieb. Ann. Chem. 1942, 551 (1), 80-119
DOI: 10.1002/jlac.19425510103
A reakcióról szóló első két publikáció. Wohl N-bromacetamidot használt brómozószerként, nem NBS-t. Ziegler ezután részletes vizsgálatot végzett, és arról számolt be, hogy az NBS alkalmas brómozószerként használható az allillikus brómozáshoz. - Dibenzociklooktén: Multi-gramm Synthesis of a Bidentate Ligand
Géraldine Franck, Marcel Brill, and Günter Helmchen
Org. Synth. 2012, 89, 55-65
DOI: 10.15227/orgsyn.089.0055 - Benzil-brominációk N-bromszukcinimiddel (trifluor-metil)benzolban
Diana Suarez, Gilles Laval, Shang-Min Tu, Dong Jiang, Claire L. Robinson, Richard Scott, Bernard T. Golding
Synthesis 2009 (11): 1807-1810
DOI: 1055/s-0029-1216793
A 3. hivatkozás egy tipikus benzil-brominálást mutat be NBS alkalmazásával CCl4-ben, amelyet a toxicitási aggályok miatt nagyrészt kivontak a forgalomból. A 4. hivatkozás azt mutatja, hogy a PhCF3 oldószerként használható a CCl4 helyett benzil-bromozáshoz. - Brómozások N-bromszukcinimiddel és rokon vegyületekkel. The Wohl-Ziegler Reaction.
Carl Djerassi
Chemical Reviews 1948, 43 (2), 271-317
DOI: 10.1021/cr60135a004
Egy régi áttekintés erről a reakcióról Carl Djerassi neves vegyésztől, akinek a világegészségügyhöz való jelentős hozzájárulása a noretindron – az első női fogamzásgátló – kifejlesztése volt. - N-Bromosuccinimide. III. A benzil-brómozás sztereokémiai menete
H. J. Dauben Jr. és Layton L. McCoy
Journal of the American Chemical Society 1959, 81 (20), 5404-5409
DOI: 10.1021/ja01529a038
Egy mechanisztikus tanulmány a benzil-brominálás sztereokémiájáról. A racém benzil-bromidok prokirális szubsztrátokból történő képződésének megfigyelésével tovább erősödik a gyökök közvetítő szerepe ebben a reakcióban.” Ugyanezek a hivatkozások az allil-brominációról itt is átvehetők: - Mechanisms of Benzylic Bromination
Glen A. Russell, Charles. DeBoer, and Kathleen M. Desmond
Journal of the American Chemical Society 1963 85 (3), 365-366
DOI: 1021/ja00886a040
A benzil-brominálás ugyanazt a mechanizmust követi, mint az allyl-brominálás, amint azt ez a cikk kifejti.Az NBS (N-bromszukcinimid) kényelmes reagens a szabadgyökös brómozáshoz, és a következő tanulmányok az NBS-t alkalmazó mechanisztikus tanulmányok: - The Mechanism of Benzylic Bromination with N-Bromosuccinimide
R. E. Pearson és J. C. Martin
Journal of the American Chemical Society 1963 85 (3), 354-355
DOI: 10.1021/ja00886a029
J. C. Martin professzor (UIUC) e munkái pályafutása elején születtek, még azelőtt, hogy elvégezte volna azt a munkát, amelyről a leginkább ismert (a “hipervalens” molekulák tanulmányozása, beleértve a “Dess-Martin Periodinane” kifejlesztését). - A lánchordozó fajok azonossága N-bromszukcinimiddel történő brómozásokban: szubsztituált N-bromszukcinimidek szelektivitása szubsztituált toluolok felé
R. E. Pearson és J. C. Martin
Journal of the American Chemical Society 1963, 85 (20), 3142-3146
DOI: 10.1021/ja00903a021 - N-bromszukcinimid. Az allylikus brómozás és kapcsolódó reakciók mechanizmusa
J. H. Incremona és James Cullen Martin
Journal of the American Chemical Society 1970, 92 (3), 627-634
DOI: 10.1021/ja00706a034 - Succinimidyl radical as a chain carrier. Az allillikus brómozás mechanizmusa
J. C. Day, M. J. Lindstrom, and P. S. Skell
Journal of the American Chemical Society 1974, 96 (17), 5616-5617
DOI: 10.1021/ja00824a074 - Cyclohexen radikális brómozása CCl4-ben bróm által: Addíció kontra szubsztitúció
D. W. McMillen és John B. Grutzner
The Journal of Organic Chemistry 1994, 59 (16), 4516-4528
DOI: 10.1021/jo00095a029
Ez a cikk gondos kinetikai vizsgálatokat ír le, amelyek azt mutatják, hogy a Br2 alacsony koncentrációja (mint amilyet a tisztátalan NBS biztosít) a radikális szubsztitúciónak kedvez a poláris addíciós reakcióval szemben. - o-XILILÉN-DIBROMID
Emily F. M. Stephenson
Org. Synth. Vol. 34, p.100 (1954)
DOI: 10.15227/orgsyn.034.0100
A reliable procedure for benzylic bromination with Br2 in Organic Syntheses. - Tetralin brómozása. Az 1,4-Dibromonaftalin rövid és hatékony szintézise
Osman Çakmak, Ismail Kahveci, Íbrahim Demirtaş, Tuncer Hökelek és Keith Smith
Cseh. Chem. Commun. 2000, 65, 1791-1804
DOI: 10.1135/cccccc20001791
Az 1,4-dibromonaftalin kényelmes szintézise tetralinból, benzilikus brómozással. benzilikus oxidáció:
A benzilikus oxidációra számos stratégia létezik, beleértve a KMnO4 vagy krómsav koncentrált oldatainak használatát. - Aromás vegyületek kálium-permanganáttal történő oxidációjának kinetikai vizsgálata. IV. rész: n- és izo-propilbenzol
C. F. Cullis és J. W. Ladbury
J. Chem. Soc. 1955, 4186-4190
DOI: 10.1039/JR9550004186 - PIPERIDINSZÁRmazékok X. A FENYLPIPERIDILKARBINOLOK
Kenneth E. Crook és S. M. McElvain
Journal of the American Chemical Society 1930, 52 (10), 4006-4011
DOI: 1021/ja01373a035
Ha a benzil-pozícióban van egy másik szubsztituens, akkor az oxidáció során a karbonsav helyett keton keletkezik. - Heterogén permanganát-oxidációk. 7. Aliphatikus oldalláncok oxidációja
Nazih A. Noureldin, Dongyuan Zhao, and Donald G. Lee
The Journal of Organic Chemistry 1997, 62 (25), 8767-8772
DOI: 1021/jo971168e
A reagenseket szilárd hordozókra lehet adszorbeálni a reakciók könnyebb lebonyolítása és a hulladék csökkentése érdekében. Ebben az esetben a KMnO4 reagens heterogénné tételével a reaktivitás kissé megváltozik, és ezt ki lehet használni néhány kemoszelektív oxidációhoz.Sok más reagens is használható benzil-oxidációhoz, íme egy válogatás: - Szelektív oxidáció aromás rendszerek szénnel szomszédos rendszerekben IBX
K. C. Nicolaou, Phil S. Baran, and Yong-Li Zhong
Journal of the American Chemical Society 2001, 123 (13), 3183-3185
DOI: 10.1021/ja004218x
Egy korai cikk (a totálszintézis mai rocksztárja) Phil Baran professzortól (The Scripps Research Institute, La Jolla, CA), amikor még Nicolaou professzor csoportjának PhD hallgatója volt. Ez IBX-et (egy hipervalens I(V) reagens) használ benzil-oxidációkhoz, amelyek gyökös mechanizmuson keresztül történnek. Ez egy hasznos reakció széles szubsztrátkörrel, amit a dolgozatban 25 példával szemléltetnek. - Direct and Selective Benzylic Oxidation of Alkylarenes via C-H Abstraction Using Alkali Metal Bromides
Katsuhiko Moriyama, Misato Takemura, and Hideo Togo
Organic Letters 2012, 14 (9), 2414-2417
DOI: 10.1021/ol300853z
Ez Oxone-t használja terminális oxidálószerként a benzil-oxidációhoz. - Synthesis of Benzylic Alcohols by C-H Oxidation
Lalita Tanwar, Jonas Börgel, and Tobias Ritter
J. Am. Chem. Soc. 2019, 141, 17983-17988
DOI: 10.1021/jacs.9b09496
Mezilperoxidot használunk oxidálószerként a benzil-pozíciók alkoholokká történő szelektív oxidációjához. A benzil-mezilát keletkezik, amely az alkoholra hidrolizálható. - C-H kötések elektrokémiai benzil-oxidációja
Jason A. Marko, Anthony Durgham, Stacey Lowery Bretz és Wei Liu
Chem. Commun, 2019, 55, 937-940
DOI: 10.1039/C8CC08768G
A benzil-oxidáció elektrokémiai úton is végrehajtható. - Alil- és benzil-oxidációs reakciók nátrium-klorittal
Samuel M. Silvestre, Jorge A. R. Salvador
Tetrahedron 2007, 63 (11), 2439-2445
DOI: 10.1016/j.tet.2007.01.012
A NaClO2 olcsó, és oxidálószerként is használható.
Vélemény, hozzászólás?