Ledipasvir és sofosbuvir kombinációja a hepatitis C vírus 1-es genotípusú fertőzés kezelésére: Systematic Review and Meta-Analysis | Annals of Hepatology
On január 20, 2022 by adminBevezetés
A világ mintegy 80 millió krónikus hepatitis C-vírus (HCV) fertőzésben szenvedő egyedei közül körülbelül 46%-uk az 1-es genotípusú HCV-vel fertőzött, amely az interferon-alapú kezelésekkel legnehezebben kezelhető.1 A HCV-fertőzött betegek kezelésében alkalmazott pegilált interferon (PegIFN) és ribavirin (RBV) alacsony kezelési sikerességi aránya és várható mellékhatásai miatt erőfeszítéseket tettek az IFN-mentes kezelési sémák kifejlesztésére.2,3
A HCV 1-es genotípusú fertőzésben szenvedő betegek esetében 2011-ben vezették be a proteázgátló (PI) tartalmú kezeléseket. A PI-tartalmú kezelésekhez azonban gyógyszer-gyógyszer kölcsönhatások társultak, továbbá a PegIFN-nel együtt kell alkalmazni őket, és számos mellékhatásuk volt.4 A HCV 1-es genotípusú fertőzésben szenvedő betegek kezelését forradalmasította a legújabb közvetlen hatású antivirális szerek (DAA-k) bevezetése, beleértve a sofosbuvirt (SOF); a HCV NS5B polimeráz uridin nukleotid analóg gátlója és a ledipasvir (LDV); a HCV által kódolt NS5A fehérje inhibitora.5,6 A legjobb kezelési lehetőség az, amely a legmagasabb tartós virológiai válasz (SVR) arányt biztosítja minimális mellékhatásokkal, a legrövidebb kezelési időtartam mellett. A 12 vagy 24 hétig tartó SOF/LDV kombináció RBV-vel vagy anélkül növelte az SVR arányt 95%-100%-ra a kezelés-naiv és IFN-experenciával rendelkező, HCV 1-es genotípusú fertőzésben szenvedő betegeknél.7 A 12 vagy 24 hetes időtartamú, RBV-vel vagy anélkül kombinált SOF/LDV-vel történő kezelés SVR arányának pontos meghatározására van szükség. Ezenkívül értékelni kell néhány tényező, például a cirrózis, a korábbi kezelés és az NS5A rezisztencia-asszociált szubsztitúciók (RAS) hatását az SVR-arányra az említett sémával.
A jelenleg rendelkezésre álló tanulmányok metaanalízisét végeztük el azzal a céllal, hogy értékeljük a 12 vagy 24 hetes SOF/LDV kombinációs kezelés antivirális hatékonyságát RBV-vel vagy anélkül, HCV 1-es genotípusú fertőzésben szenvedő betegeknél.
Anyag és módszerekAdatforrások és keresési stratégiák
Ezzel a metaanalízissel átfogó és szisztematikus keresést végeztünk az elektronikus adatbázisokban, köztük a PubMed, a Scopus, a Science Direct és a Web of Science adatbázisok megfelelő keresési stratégiáit alkalmazva. Keresési stratégiáinkban a kulcsszavak középpontjában a kezelési protokollok álltak; SOF, LDV és megfelelő alternatíváik. Továbbá, az esetlegesen létező szürke szakirodalom megtalálása érdekében keresést végeztünk a Google scholarban, és a kapcsolódó címek megtalálása után folytattuk a keresést, amíg 200 nem kapcsolódó sorozatcímet nem találtunk. Ezenkívül a visszakeresett publikációk hivatkozásait is átnéztük az elektronikus keresés során esetlegesen kimaradt publikációk azonosítása érdekében. Utolsó keresésünket 2015. szeptember 2-án végeztük, és nem vettünk figyelembe nyelvi korlátozást. A keresésünk frissítését 2016. március 16-án végeztük el.
Felvételi kritériumok
Ez a metaanalízisbe minden olyan cikket bevontunk, amely a 12 vagy 24 héten át RBV-vel vagy anélkül végzett SOF/LDV kombinált terápia hatását értékelte az SVR-re, 12 héttel a kezelés befejezése után (SVR12) HCV 1-es genotípusú fertőzésben szenvedő betegek körében. A intention-to-treat elemzéshez szükséges adatokkal rendelkező tanulmányokat vonták be, ellenkező esetben a cikket kizárták. A következő elemeket tekintettük kizárási kritériumoknak: hemodialízisben részesülő betegek, SOF-alapú kezelésben részesült betegek, humán immundeficiencia vírussal (HIV) egyidejűleg fertőzött betegek, dekompenzált cirrózisban (Child-Pugh B és C8) szenvedő betegek és máj- vagy veseátültetésben szenvedő betegek.
Tanulmányok kiválasztása, minőségértékelés és adatkivonás
A szisztematikus áttekintések jelentésére vonatkozó PRISMA-irányelv9 alapján a keresési eredményekből származó összes tanulmányt két személy (MSR-Z és KH) egymástól függetlenül, a szűrés minden szintjén (cím, absztrakt és teljes szöveg) felülvizsgálta. Az egyes szűrési szintek végén a két szerző közötti nézeteltéréseket kölcsönös megbeszéléssel oldották meg. A fennmaradó nézeteltéréseket azonban konszenzussal és más kollégákkal (BB, SMA és HS) folytatott megbeszéléssel oldották meg.
Cochrane torzításkockázat-értékelő eszközét használták az egyes bevont tanulmányok10 minőségének értékelésére, és a következő torzítási kockázatokat értékelték: véletlenszerű szekvencia létrehozása (szelekciós torzítás), allokáció elrejtése (szelekciós torzítás), a résztvevők és a személyzet elvakítása (teljesítménytorzítás), az eredményértékelés elvakítása (észlelési torzítás), együttes beavatkozások, hiányos eredményadatok (lemorzsolódás), szelektív jelentés (jelentési torzítás), intention-to-treat elemzés, a csoportok hasonlósága a kiinduláskor, compliance, az eredményértékelések időzítése és egyéb torzítások. Ezen értékelés alapján az egyes tanulmányok torzításkockázatát magasra, nem egyértelműre és alacsonyra értékelték. A magas és a nem egyértelmű kockázatot nullával, az alacsony kockázatot pedig eggyel értékelték. A 6-nál nagyobb pontszámmal rendelkező cikkeket alacsony kockázatú tanulmányoknak minősítették. Az esetleges eltéréseket vagy nézeteltéréseket ismét kölcsönös megbeszéléssel oldották fel.
A bevont tanulmányok egyes karjainak résztvevőiről a következő adatokat vették ki; nem, HCV-genotípus, cirrózis, IFNL3 közeli polimorfizmusok (rs12979860), korábbi kezelés története, kezelés időtartama, életkor, testtömegindex (BMI) és HCV RNS-szint a kezelés előtt. Továbbá összegyűjtöttünk néhány adatot az egyes tanulmányokra vonatkozóan, beleértve a publikáció évét, a minta méretét és az ország nevét.
Adatelemzés
Az SVR-arányra vonatkozó konfidenciaintervallumot (CI) minden tanulmányban a Jeffrey-módszer alapján számoltuk ki, és a CI felső és alsó határának átlagos összegét tekintettük az SVR pontbecslésnek.11 A heterogenitás vizsgálatát χ2 és I-négyzet segítségével végeztük (0% és 100% közötti tartományok). A χ2 esetében a 0,1-nél kisebb P-értéket statisztikailag szignifikánsnak tekintettük. A heterogenitási teszt eredményének megfelelően fix vagy véletlen hatású modelleket használtunk az összevont SVR12 , a 95%-os konfidenciaintervallum és a P-érték meghatározásához. Az esetlegesen meglévő publikációs torzítás leküzdésére a trim and fill módszert alkalmaztuk.12 Az adatelemzés minden részének elvégzésére a STATA 10-et használtuk.
EredményekTanulmányok átvilágítása
Az adatbázisban való keresés során összesen 606 tanulmányt azonosítottunk. A duplikációk eltávolítása után 459 tanulmány maradt szűrésre. Az 1. ábra mutatja a tanulmányok számát az egyes szűrési szinteken. A keresés frissítésével két további cikket is találtunk. A teljes szövegű cikkek közül húszat értékeltünk alkalmasság szempontjából, és végül tíz cikket vontunk be a kvantitatív szintézisünkbe (metaanalízis).
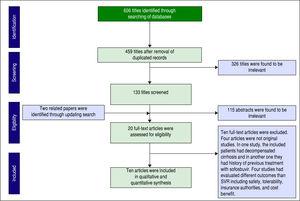
A cikkek szűrése a PRISMA-nyilatkozat alapján.
A torzítás kockázatának értékelése
Az 1. táblázatot figyelembe véve minden bevont tanulmány alacsony kockázatúnak minősült (7-nél nagyobb pontszámot véve), ezért a minőségi értékelés alapján egyetlen tanulmányt sem zártunk ki.
A bevont tanulmányok torzítási kockázatának értékelése.
| Előső szerző (hivatkozás) | Véletlenszerű szekvenciakészítés (szelekciós torzítás) | Az allokáció elrejtése (szelekciós torzítás) | Vakítás a (Perfomance bias) | A kimenetel értékelésének elvakítása (Detection bias) | Teljesítményadatok hiánya (Attrition) | Szelektív jelentés (Reporting bias) | Co-beavatkozások | Intention to treat analysis | Group similarity at baseline | Compliance | Timing of outcome assesments | Other biases | Score | Conclusion | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Afdhal, N.31 | ? | ? | + | + | – | – | – | – | – | – | – | – | – | 8 | Low |
| Afdhal, N. 7 | ? | ? | + | + | – | – | – | – | – | – | – | – | – | 8 | Low |
| Gane, E.J.13 | + | ? | + | + | – | – | – | – | – | – | – | – | – | 8 | Low |
| Lawitz, E.19 | – | – | + | + | – | – | – | + | – | – | – | – | 9 | Low | |
| Kowdley, K.6 | ? | ? | + | + | – | – | – | – | – | – | – | – | – | 8 | Low |
| Bourliere, M.21 | – | – | – | – | – | – | – | + | – | – | – | – | 11 | Low | |
| Mizokami, M.20 | – | – | + | + | – | – | – | – | – | – | – | – | – | 10 | Low |
| Stedman, C.A.M.14 | + | + | + | + | – | – | – | – | – | – | – | – | – | 8 | Low |
| Kohli, M.15 | ? | ? | + | + | – | – | – | – | – | – | – | – | 8 | Low | |
| Chuang W.L.22 | ? | ? | + | + | – | – | – | – | – | – | – | – | 8 | alacsony |
A bevont tanulmányok jellemzői
A vizsgálat célja alapján, a bevont tanulmányok egyes karjainak jellemzőit a 2. táblázatban (SOF/LDV kombináció) és a 3. táblázatban (SOF/ LDV/RBV kombináció) mutattuk be.
A bevont tanulmányok jellemzői a sofosbuvir és a ledipasvir kombinációjára vonatkozóan.
| Előső szerző (hivatkozás) | A korábbi kezelés története | Megjelenés éve | ország | . | Mintaméret | Átlagos életkor (SD vagy tartomány) | Férfi nem (%) | Átlagos BMI (SD vagy tartomány) | Kezelés időtartama (Wks) | Átlagos HCV RNS, Log IU/mL (SD) | Cirrózis (%) | rs12979860 CC/CT+TTa | HCV genotípus 1a/1bb |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Afdhal, N.31 | TE | 2014 | USA | 109 | 56 (24-67) | 74 (68) | 29 (19-47) | 12 | 6.5 (0.44) | 22 (20) | 0.1 | 3.73 | |
| Afdhal, N.7. | TN | 2014 | USA | 214 | 52 (18-75) | 127 (59) | 27 (18-41) | 12 | 6.4 (0.69) | 34 (16) | 0.34 | 2.18 | |
| Gane, E.J.13 | TE | 2014 | Új-Zéland | 10 | 61 (4.9) | 10 (100) | 31 (6.8) | 12 | 6.5 (0.6) | 10 (100) | 0.11 | 4 | |
| Kowdley, K.6. | TN | 2014 | USA | 216 | 53 (20-71) | 128 (59) | 28 (19-45) | 12 | 6.4 (0.8) | 0 (0) | 0.35 | 3.9 | |
| Lawitz, E.19 | TN | 2014 | USA | 19 | 46 (11.6) | 11 (58) | 28.1 (5.8) | 12 | 6.1 (0.8) | 0 (0) | 0.05 | 8.5 | |
| Lawitz, E.19 | TE | 2014 | USA | 19 | 54 (6.6) | 15 (79) | 31.4 (4.7) | 12 | 6.3 (0.5) | 11 (58) | 0.11 | 18 | |
| Kohli, A.15 | TN | 2015 | USA | 20 | 57 (8) | 14 (70) | 25 (4) | 12 | NA | még 20% | 0.33 | 1.22 | |
| Mizokami, M.20 | MIX | 2015 | Japán | 171 | 60 (9.2) | 69 (40) | 23.3 (3.6) | 12 | 6.6 (0.5) | 41 (24) | 1.011 | 0.042 | |
| Chuang, W.L.22 | TN | 2016 | Taiwan | 42 | 54 (30-75) | 13 (31) | 24 (19-36) | 12 | 6.6 (0.68) | 5 (12) | 5 | 0.10 | |
| Chuang, W.L.22 | TE | 2016 | Taiwan | 43 | 55 (33-7) | 23 (55) | 24 (20-30) | 12 | 6.6 (0.55) | 4 (9) | 1.26 | 0.16 | |
| Afdhal, N.31 | TE | 2014 | USA | 109 | 56 (25-68) | 74 (68) | 28 (19-41) | 24 | 6.4 (0.57) | 22 (20) | 0.17 | 3.54 | |
| Afdhal, N.7. | TN | 2014 | USA | 217 | 53 (22-80) | 139 (64) | 27 (18-48) | 24 | 6.3 (0.68) | 33 (15) | 0.31 | 2.14 | |
| Bourliere, M.21 | TE | 2015 | Franciaország | 78 | 57 (10.7) | 56 (72) | 26.3 (4.2) | 24 | 6,5 (0,6) | 77 (100) | 0,08 | 1,85 |
A bevont tanulmányok jellemzői a sofosbuvir plusz ledipaszvir és ribavirin kombinációjára vonatkozóan.
| Előső szerző (hivatkozás) | A korábbi kezelés története | Megjelenés éve | Ország | Mintaméret | Átlagos életkor (SD vagy tartomány) | Férfi nem (%) | Átlagos BMI (SD vagy tartomány) | Kezelés időtartama (Wks) | Átlagos HCV RNS, Log IU/mL (SD) | Cirrózis (%) | rs12979860 CC/CT+TT* | HCV genotípus 1a/1b** |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Afdhal,N.31 | TE | 2014 | USA | 111 | 57 (27-75) | 71 (64) | 28 (19-45) | 12 | 6.4 (0.54) | 22 (20) | 0.11 | 3.82 |
| Afdhal,N.7 | TN | 2014 | USA | 217 | 52 (18-78) | 128 (59) | 27 (18-42) | 12 | 6.4 (0.64) | 33 (15) | 0.53 | 2.55 |
| Gane, E.J.13 | TN | 2014 | Új-Zéland | 25 | 45 (9.2) | 8 (32) | 25.2 (4.3) | 12 | 5.9 (0.9) | 0 (0) | 0.56 | 4 |
| Gane, E.J.13 | TE | 2014 | Új-Zéland | 9 | 50 (13) | 7 (78) | 25.6 (2.3) | 12 | 25.6 (2.3) | 0 (0) | 0 | 8 |
| Gane, E.J.13 | TE | 2014 | Új-Zéland | 9 | 57 (5.2) | 8 (89) | 27.3 (0.5) | 12 | 27.3 (0.5) | 9 (100) | 0.2 | 3.5 |
| Lawitz, E.19 | TE | 2014 | USA | 21 | 52 (9.8) | 14 (67) | 31.5 (7.3) | 12 | 6.2 (0.4) | 11 (52) | 0.05 | 3.2 |
| Mizokami, M.20 | MIX | 2015 | Japán | 170 | 59 (9.5) | 73 (43) | 23.3 (3.1) | 12 | 6,6 (0,5) | 35 (21) | 0,86 | 0,024 |
| Stedman, C.A.M.14. | MIX | 2015 | Új-Zéland | 14 | 54 (NA) | 12 (86) | 27 (34-20) | 12 | 6.5 (5.6-7.5) | 1 (7) | 0.4 | 2.5 |
| Bourliere, M.21 | TE | 2015 | Franciaország | 77 | 56 (7.4) | 58 (75) | 27.9 (5.5) | 12 | 6.5 (0.5) | 76 (98.7) | 0.05 | 1.71 |
| Afdhal, N.31. | TE | 2014 | USA | 111 | 55 (28-70) | 68 (61) | 29 (19-50) | 24 | 6.5 (0.60) | 22 (20) | 0.19 | 3.82 |
| Afdhal, N.7. | TN | 2014 | USA | 217 | 53 (24-77) | 119 (54) | 26 (18-48) | 24 | 6.3 (0.65) | 36 (17) | 0.5 | 2.01 |
A kezelés eredményének értékelése
A négy HCV-kezelési séma – köztük 12 hetes SOF/LDV (A), 24 hetes SOF/LDV (B), 12 hetes SOF/LDV/RBV (C) és 24 hetes SOF/LDV/RBV (D) – összevont SVR12 értékét számítottuk ki. E metaanalízisek eredményeinek összefoglalása a 4. táblázatban látható.
- –
A kezelési séma A (12 hetes sofosbuvir plusz ledipasvir). Nyolc vizsgálatban tíz olyan kart találtak, amely az A kezelési sémát értékelte (2. táblázat). A vizsgálati karok eredményei között jelentős heterogenitás volt (χ2 = 35,01, P ábra 2A). Mind a Begg-teszt (P = 0,074), mind az Egger-féle lineáris regressziós teszt (P
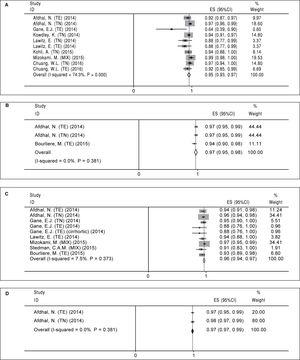 2. ábra.
2. ábra.A szófoszbuvir plusz ledipaszvír séma összevont SVR12 értéke a kezelés időtartama és a ribavirin hozzáadása szerint. A. Összevont SVR12 a 12 hetes sofosbuvir plusz ledipaszvir kezelés esetén. B. Összevont SVR12 24 hetes sofosbuvir plusz ledipasvir kezelés esetén. C. Összevont SVR12 12 hetes sofosbuvir plusz ledipaszvir és ribavirin kezelés esetén. D. Összevont SVR12 24 hetes kezelés esetén a sofosbuvir plusz ledipaszvir és ribavirin alkalmazásával. TE: kezelési tapasztalatok. TN: kezelési naiv.
(0.39MB). - –
B kezelési séma B (24 hetes sofosbuvir plus ledipaszvir). A B kezelési séma esetében három közleményben csak három kart találtunk (2. táblázat). Nem találtunk szignifikáns heterogenitást az ezzel a kezelési sémával kapcsolatos tanulmányok tekintetében (χ2 = 1,92, P = 0,38, I-négyzet = 0%). A fix hatású modell alapján az összevont SVR12 a “B” kezelés esetében 97% (95%CI = 95%-98%) volt (2B ábra). Mivel a bevont tanulmányok száma kicsi volt (n = 3), nem végeztünk kapcsolódó vizsgálatokat a publikációs torzításra vonatkozóan.
- –
C kezelési séma (12 hetes sofosbuvir plusz ledipaszvir és ribavirin). Kilenc vizsgálati kart találtak hét közleményben erre a kezelési sémára vonatkozóan (3. táblázat). Mivel nem találtak szignifikáns heterogenitást (χ2 = 8,64, P = 0,37, I-négyzet = 7,5%), fix hatású modellt alkalmaztak, és az SVR12 összevont értékét 96%-ban (95%CI = 94%-97%) számították ki (2C ábra). Mind a Begg- (P = 0,009), mind az Egger-féle lineáris regressziós teszt (P = 0,001) alapján publikációs torzítás volt. A trim and fill módszer alapján az összevont SVR12 96% (95%CI = 94%-97%) volt.
- –
D kezelési séma (24 hetes sofosbuvir plusz ledipaszvir és ribavirin). Amint a 3. táblázat mutatja, két tanulmányban két vizsgálati kar szerepelt ennél a sémánál. E két vizsgálat eredményei tekintetében nem volt szignifikáns heterogenitás (χ2 = 0,77, P = 0,38, I-négyzet = 0%), és a rögzített hatású modell szerint az összevont SVR12 98% (95%CI = 97%-99%) volt (2D ábra). A bevont tanulmányok kis száma (n = 2) miatt nem tudtuk lefuttatni a publikációs torzítással kapcsolatos kapcsolódó teszteket.
A sofosbuvir és ledipasvir kombinációjára vonatkozó tartós virológiai válasz arányára vonatkozó metaanalízisek összefoglalása.
| Rendszer | Ribavirin alkalmazása | Kezelés időtartama (Wks) | . | SVR arány (%) | 95%CI (%) |
|---|---|---|---|---|---|
| A | Nem | 12 | 95 | 93-97 | |
| B | Nem | 24 | 97 | 95-98 | |
| C | Igen | 12 | 96 | 94-97 | |
| D | Igen | 24 | 98 | 97-99 |
A kiindulási paraméterek hatása a tartós virológiai válaszra
- –
Cirrhosis. Az említett négy kezelési séma legtöbb vizsgálati ágában az összes beteg cirrózisos vagy nem cirrózisos volt, ezért nem tudtuk lefuttatni az esélyhányados (OR) metaanalízisét. Az egyes kezelési sémákhoz kapcsolódóan azonban egyesítettük az egyes karok adatait, és végül Peto módszerrel kiszámítottuk a cirrózis SVR12-re gyakorolt hatásának OR értékét. A 3A. ábrát figyelembe véve csak az A kezelési séma esetében volt szignifikáns hatása a cirrózisnak az SVR12-re (OR = 0,21, 95%CI = 0,07-0,66).
 3. ábra.
3. ábra.A cirrózis és a korábbi kezelés hatása a tartós virológiai válaszra a sofosbuvir plusz ledipasvir séma esetén. A. A cirrózis hatása a tartós virológiai válaszra. B. A korábbi kezelési előzmények hatása a tartós virológiai válaszra.
(0.17MB).- –
Previous history of treatment. Értékeltük a korábbi kezelési előzmények hatását az SVR12-re. A 3B. ábra az egyes kezelési sémákra vonatkozó kombinált adatokat és a korábbi kezelési előzmények hatására vonatkozó (Peto-módszer szerinti) VAGY-értékeket mutatja. Ezen elemzés alapján a korábbi kezelési előzményeknek nem volt szignifikáns hatása az SVR12-re minden kezelési séma esetében.
- –
NS5A rezisztenciával összefüggő szubsztitúciók. Az NS5A RAS-okra vonatkozó adatokat azokból a bevont tanulmányokból nyertük, amelyek a kiindulási RAS-okat értékelték. Mivel erre vonatkozó adatok nem álltak rendelkezésre az egyes kezelési sémák (A, B, C és D) értékeléséhez, elkerülhetetlenül a RAS-ok hatását vizsgáltuk a 12 vagy 24 hétig tartó SOF/ LDV főkezelésre RBV-vel vagy anélkül. Három közlemény adatait nem vettük be ebbe az elemzésbe; Gane és munkatársai13 azért, mert két vizsgálati ágban egy másik gyógyszert (GS-9669) adtak a SOF/LDV-kezeléshez, Stedman és munkatársai14 azért, mert nem álltak rendelkezésre adatok a RAS-ok SVR-re vonatkozó értékeléséről, Kohli és munkatársai15 pedig azért, mert nem közöltek megfelelő adatokat az SVR-rel és NS5A RAS-okkal rendelkező betegek számáról. Továbbá Kowdley és munkatársai6 a tanulmányuk egyik ágában értékelték a 8 hetes SOF/LDV hatását, és mivel nem tudtuk elkülöníteni az NS5A RAS-okra és az SVR-re vonatkozó adatokat ebből az ágból, ezért az összes adatot kivontuk ebből a tanulmányból, és bevontuk őket ebbe a metaanalízisbe. A 4. ábra szerint az NS5A RAS-ok szignifikánsan csökkentő hatással voltak az SVR-re SOF/LDV-kezelésben (OR = 0,31, 95% CI = 0,2-0,5). A vizsgálatok eredményei között nem volt heterogenitás az NS5A RAS-ok kiinduláskori kimutatása és a kezelési válasz tekintetében. A Begg- (P = 0,65) és Egger-teszt (P = 0,67) alapján szintén nem találtak publikációs torzítást.
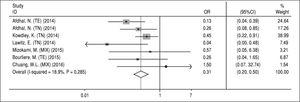 4. ábra.
4. ábra.Az NS5A rezisztenciával összefüggő szubsztitúciók hatása a sofosbuvir plusz ledipasvir kezelés tartós virológiai válaszára.
(0.12MB).Diszkusszió
A jelenlegi metaanalízis kimutatta a SOF/LDV kombinációs terápia magas hatékonyságát krónikus hepatitis C genotípus 1 fertőzésben szenvedő betegeknél. A HCV 1-es genotípusú fertőzés kezelésének korábbi standardja a PegIFN és RBV volt, amely a HCV 1-es genotípusú fertőzésben szenvedő betegeknél kevesebb mint 60%-os SVR arányt eredményezett, és a kezelést számos mellékhatás kísérte.16
A HCV replikációs ciklusában kulcsfontosságú fehérjék felismerése lehetőséget adott arra, hogy ezeket a fehérjéket célba vegyük és gátoljuk a virionok termelődését.17 A HCV kezelési sémák hosszú története az IFN-alapútól az IFN-mentes sémákig tartott. Ez magas SVR-aránnyal, rövid kezelési időtartammal és kevés mellékhatással járó kezelési sémát biztosított. A HCV 1-es genotípusú fertőzés IFN-mentes kezelési sémájának célját a SOF/LDV séma 2014-es bevezetésével és jóváhagyásával sikerült elérni.18
A SOF/LDV alkalmazható RBV-vel vagy anélkül és különböző kezelési időtartamban (12 vagy 24 hét).7 Néhány fontos tényezőt figyelembe lehet venni a megfelelő séma kiválasztásakor, mint például a cirrózis megléte és az RBV ellenjavallata. A kezelés időtartamának megválasztásakor azonban a kezelés költsége is jelentős tényező. Érdekes módon a jelenlegi vizsgálatban kimutatták, hogy az SVR minden 12 vagy 24 hetes, RBV-vel vagy anélkül végzett kezelés esetén egyenlő és 95% feletti volt, beleértve: 95% a 12 hetes SOF/LDV kezelés esetén, 97% a 24 hetes SOF/LDV kezelés esetén, 96% a 12 hetes SOF/LDV/RBV kezelés esetén és 98% a 24 hetes SOF/LDV/RBV kezelés esetén. Igaz, hogy az RBV hozzáadása a SOF/LDV-hez vagy a SOF/LDV 24 hétre történő meghosszabbítása az SVR12 kismértékű növekedését eredményezheti 95%-ról 96%-ra, azonban a jelenlegi vizsgálatban megfigyelték, hogy a cirrózis (Child-Pugh A) hatással lehet (OR = 0,21) az SVR12-re csak a 12 hetes SOF/LDV-kezelés esetén. Ennek eredményeképpen a cirrózisos betegek (Child-Pugh A) 12 hetes SOF/LDV/RBV vagy 24 hetes SOF/LDV kezelését javasoljuk az RBV ellenjavallata és az ár kérdése alapján, míg a nem cirrózisos betegek 12 hetes SOF/LDV kezelését elfogadhatónak tűnik. Ebben a metaanalízisben a korábbi (nem SOF-alapú) kezelések hatását a kezelés sikerességére a négy SOF/LDV-séma egyikénél sem figyelték meg. Ennek eredményeképpen a kezelés időtartamának megválasztása vagy az RBV hozzáadása a SOF/LDV-kezeléshez a korábbi PegIFN/RBV- vagy PI-tartalmú kezelési sémák alapján nem ajánlott.
Ebben a tanulmányban összegyűjtöttük az NS5A RAS kiindulási szintjének a kezelés sikerére gyakorolt hatásának értékelésére szolgáló adatokat, azonban a rezisztencia értékelésére szolgáló adatokat egyik tanulmányban sem rétegezték a kezelési séma tekintetében. Ennek eredményeképpen az egyes tanulmányok összes karjának adatait bevontuk ebbe a metaanalízisbe. Ez a metaanalízis megállapította, hogy a HCV NS5A génjének kiindulási RAS-értéke mint paraméter befolyásolta a kezelésre adott válasz arányát. Érdemes megjegyezni, hogy a kezelés sikertelenségében szenvedő betegek többsége NS5A RAS-t hordozott a kezelés sikertelenségének időpontjában, ami azt mutatja, hogy az NS5A RAS-ok jelentős szerepet játszanak az LDV-vel kezelt betegek kezelésének sikertelenségében.6,7,19-22. Az NS5A RAS-ok kezelés megkezdése előtti értékelésének klinikai hasznosságát azonban még nem határozták meg, talán a SOF/LDV-re adott magas terápiás válaszarány és az NS5A RAS-ok értékelésének nagyon alacsony specificitása miatt a kezelés kudarcának előrejelzésére.
A többi DAA és IFN-mentes kezelés bevezetése és ezek engedélyezése a HCV 1-es genotípusú fertőzésben szenvedő betegek kezelésére a SOF/LDV engedélyezését követően folytatódott. 2014 decemberében engedélyezték az Ombitas-vir/Paritaprevir-r/Dasabuvir (3 közvetlen hatású antivirális szer; 3D) kombinációt HCV 1-es genotípusú fertőzés kezelésére több mint 95%-os hatékonysággal.23 2016 januárjában engedélyezték a Grazoprevir/Elbasvir (GZR/EBR) kombinációs terápiát mintegy 95%-os SVR-aránnyal.24 Tekintettel arra, hogy a SOF-nak vese-metabolizmusa van, ez az antivirális szer nem adható krónikus vesebetegségben (kreatinin clearance 2), és a 3D és a GZR/EBR az alternatívák a krónikus vesebetegségben és HCV 1-es genotípusú fertőzésben szenvedő betegek kezelésére.25,26 Ezen túlmenően a DAA-k egyéb kombinációi, mint a SOF/Daclatasvir (27) és a SOF/ Velpatasvir28 pángenotípusos kezelési sémaként állnak rendelkezésre.
Összefoglalva, a HCV 1-es genotípusának SOF/LDV kombinációval történő kezelése magas (≥ 95%) kezelési választ eredményez. Az RBV hozzáadásáról a SOF/LDV-hez és/vagy a SOF/LDV meghosszabbításáról a cirrózis jelenléte, az RBV kontraindikációja és a költségkérdés alapján lehet dönteni. A HCV-fertőzöttek fokozottabb azonosítása és számukra a kezeléshez való jobb hozzáférés biztosítása segíthet a HCV felszámolásában.29 A HCV-kezelés területén a következő cél az RBV nélküli új HCV-terápiás sémák kifejlesztése, amelyek ígéretes 100%-os terápiás választ és gyógyszer-gyógyszer reakciót nem eredményeznek.30
A köszönetnyilvánítás
A szerzők hozzájárulása: A tanulmány koncepciója és tervezése: Mohammad Saeid Rezaee-Zavareh, Bita Behnava, Seyed Moayed Alavian és Heidar Sharafi; adatgyűjtés: Mohammad Saeid Rezaee-Zavareh és Khashayar Hesa-mizadeh; az adatok elemzése és értelmezése: Mohammad Saeid Rezaee-Zavareh, Mohammad Gholami-Fesharaki és Heidar Sharafi; a kézirat szerkesztése: Mohammad Saeid Rezaee-Zavareh, Khashayar Hesamizadeh, Mohammad Gholami-Fesharaki és Heidar Sharafi; a kézirat kritikai felülvizsgálata a fontos szellemi tartalom szempontjából: Bita Behnava és Seyed Moayed Alavian.
A szerzők személyes érdekeltségi nyilatkozata
Nincs bejelentve.
Finanszírozási érdekeltségi nyilatkozat
Nincs bejelentve.
Nincs bejelentve.
- –
Vélemény, hozzászólás?