Assessing Cell Health: Életképesség és proliferáció
On október 11, 2021 by adminI. rész: Életképességi és proliferációs vizsgálatok
Élettartam és proliferáció
A sejtek két különböző jellemzője az életképesség és a proliferáció. Az életképesség az élő sejtek számát méri egy populációban, míg a proliferáció a sejtosztódást. Meg kell jegyezni, hogy nem minden életképes sejt osztódik. Bár a proliferáció könnyen értelmezhető életképességként, a proliferáció hiánya nem tekinthető automatikusan a sejtpusztulás jelének.
Az életképesség és a proliferáció értékelése
1. Membránáteresztő képesség
A halott és haldokló sejtek jellemzője a sejt- és magmembránok lebomlása. Számos életképességi vizsgálat a sejthalálnak ezt a jellemzőjét használja fel az életképes és a nem életképes sejtek megkülönböztetésére.
Poláris, sejtáteresztő nukleinsavfestékek, mint a DAPI, a propídium-jodid (PI) és a 7-AAD festik az elhalt sejteket, mivel ezek a festékek csak a károsodott membránnal rendelkező sejtekbe tudnak bejutni. A PI az RNS-t és a DNS-t is megköti, míg a 7-AAD és a DAPI csak a DNS-sel lép kölcsönhatásba. Ezek a festékek enzimatikus aktivitást kimutató vizsgálatokkal kombinálva használhatók, mint például a következő szakaszban tárgyalt észteráz-szubsztrátokkal, vagy sejtáteresztő életképességi indikátorokkal, hogy egyszerre jelöljenek élő és elhalt sejteket. A PI, DAPI és 7-AAD próbák fluoreszcens mikroszkóppal, áramlási citométerrel (1. ábra) vagy mikrolemez olvasóval leolvashatók.
A.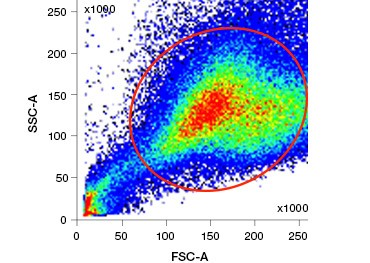
B.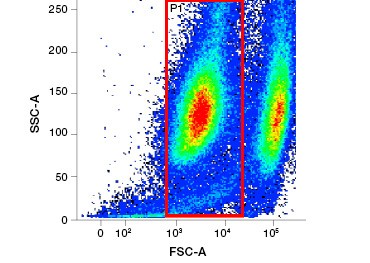
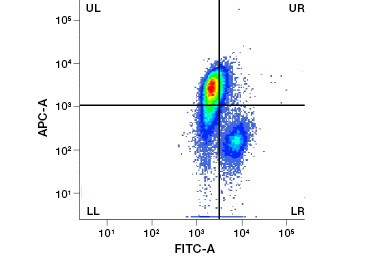
1. ábra. A propidium-jodid festés javítja az érdekes sejtek azonosítását. Az élő sejtek előre- és oldalsó szórással történő kapuzása nem feltétlenül elegendő az elhalt sejtek eltávolításához, és a nem specifikus kötődés továbbra is jelen lehet (A). Az életképességi festékek, például a propidium-jodid használata segíthet a nem specifikus kötődés kiküszöbölésében (B). A J774 makrofágokat CD11b-re és CD3-ra festettük, a piros kör és téglalap jelzi az élő sejtek kapuzási stratégiáját.
Az időzítés kritikus e festékek használatakor, mivel a festés során a festett sejtek frakciója növekszik, mivel a sejtek tovább halnak. Meg kell jegyezni, hogy e festékek egyike sem fixálható. A fixálást igénylő alkalmazásokhoz az etídium-monoazidok vagy az amin-reaktív fehérjefestékek kiváló választásnak bizonyulnak.
A sejteket nem áteresztő fehérjefestékek kiváló alternatívát jelentenek a nukleinsavfestékekkel szemben, mivel kevésbé toxikusak. Az amin-reaktív festékek a gerjesztési és emissziós spektrumok széles skálájával rendelkeznek, és így nagyobb rugalmasságot tesznek lehetővé az áramlási citometriás és mikroszkópos panelek kialakításában, mint a DNS-festékek. E fehérjefestékek másik előnye, hogy fixálhatók (2. ábra).
A.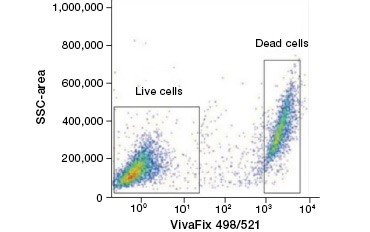
B.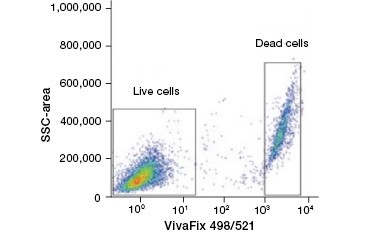
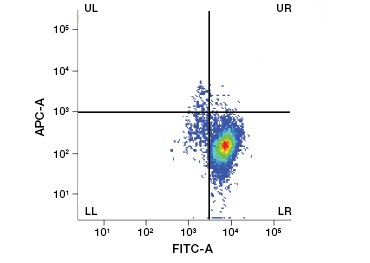
2. ábra. A fehérjefestékek megkülönböztetik az élő és az elhalt sejteket. A VivaFix™ Cell Viability Assay használatával az élő és az elhalt sejtpopulációk azonosíthatók, majd ezt követően áramlási citometriával elemezhetők a fixált (A) és a nem fixált (B) sejtekben.
A gyakori fehérjefesték, a trypan-kék használatakor különös figyelmet kell fordítani arra, hogy ez a festék az idő múlásával sejtspecifikus módon festi meg az életképes sejteket. Ezért kritikus fontosságú a trypan-kék protokollok optimalizálása minden egyes sejttípusra és kísérletre.
Mindegyik festék használható egyes sejteken és szöveteken, és kiértékelhető fluoreszcens mikroszkópiával vagy áramlási citometriával, bár a trypan-kék festést gyakrabban értékelik a sejtek kézi, hemocitométerrel és mikroszkóppal történő megszámlálásával.
A sejtáteresztő nukleinsavfestékekkel ellentétben a sejtáteresztő nukleinsavfestékek, mint például az akridin-narancs, könnyen átdiffundálnak a sejtmembránokon, és így megfestik az életképes sejtek DNS-ét. A nem életképes sejtek nem festődnek hatékonyan, mivel sérült membránjaik hagyják, hogy a festék könnyen diffundáljon ki belőlük. Az akridin-narancs kettős fluoreszcenciájú festék, amely zöld fluoreszcenciát bocsát ki, ha dsDNS-hez kötődik, és vörös fluoreszcenciát, ha ssDNS-hez és RNS-hez kötődik. Ha az akridin-narancsot DNS-kötő festékként használja, ne feledje, hogy nem kötődik hatékonyan a kondenzált kromatinhoz. A 6. szakaszban tárgyaltak szerint ez a festék a sejtek lizoszómák savas pH-értékének fenntartására való képességének értékelésére is használható, ami a sejtek életképességének egy másik mutatója. A sejtáteresztő nukleinsavfestékek felhasználhatók az életképes sejtpopulációk azonosítására és számszerűsítésére mikroszkópiával, áramlási citometriával vagy mikrolemezes vizsgálattal.
A sejtáteresztő és sejtáteresztő festékek az érdeklődésre számot tartó fehérjék elleni fluoreszcensen jelölt antitestekkel kombinálva használhatók, így minden kísérletbe egyszerűen be lehet vonni a létfontosságú életképességi kontrollokat. A membránintegritás értékelésére szolgáló festékek használatakor kulcsfontosságú szempont, hogy a különböző sejttípusok eltérő membránáteresztőképességi jellemzőkkel rendelkeznek. Például egyes sejtáteresztő DNS-festékek könnyen megfestik az elhalt eukarióta sejteket, de nem képesek megfesteni a károsodott membránnal rendelkező prokariótákat.
A membránintegritás enzimatikus vizsgálatokkal is értékelhető. Népszerű választás a citoplazmatikus enzim, a laktát-dehidrogenáz (LDH) sejtpusztuláskor a táptalajba történő szivárgásának vizsgálata. Az LDH kolorimetriás vizsgálatokat mikrolemez formátumban lehet elvégezni és ELISA mikrolemez olvasóval leolvasni.
A membrándezintegráció krómfelszabadulási vizsgálatokkal is mérhető. Itt a sejteket a kísérleti kezelés előtt 51Cr-ral előzetesen jelöljük. A króm a sejtfehérjékhez kötődik, és a sejtpusztuláskor felszabadul a táptalajba. A szabad és a megkötött 51Cr mennyiségének szcintillációs számlálóval történő meghatározásával a sejthalál kvantitatív módon mérhető. A sejtek előzetesen fluoreszcens festékkel is jelölhetők. Ezek a módszerek néha nagy háttérrel küzdenek a jelölések spontán felszabadulása miatt; csak olyan alkalmazásokban hasznosak, amelyek lehetővé teszik az érdeklődő sejtek előzetes jelölését.
2. Enzimatikus aktivitás
Az életképes és nem életképes sejtek közötti másik kulcsfontosságú különbség az, hogy az életképes sejtek enzimatikusan aktívak. Az általános enzimatikus aktivitás indikátoraként általában az olyan szubsztrátokkal, mint a karboxifluoreszcein-diacetát (CFDA) mért észteráz-aktivitást használják. A CFDA egy nem fluoreszkáló, sejtáteresztő festék, amelyet a csak az életképes sejtekben jelen lévő, nem specifikus intracelluláris észterázok hidrolizálnak a fluoreszkáló karboxifluoreszcein molekulává. Mivel a karboxifluoreszcein negatív töltésű, az életképes sejtekben nemkovalens módon visszatartódik, ami zöld fluoreszcenciát eredményez.
A CFDA-SE a CFDA egy olyan származéka, amely hidrolízis után jobban visszatartódik. Termékének, a CFSE-nek szukcinimidil-észter csoportjai vannak, amelyek kovalens kötéseket képeznek az intracelluláris fehérjék primer aminjaival, lehetővé téve a sejtek életképességének hosszú távú nyomon követését. Mivel a CFSE kovalens módon megmarad a sejtekben, megbízhatóbb mutatója a sejtek életképességének és népszerű mérőszáma a sejtproliferációnak, mivel fluoreszcenciája minden sejtosztódással felére csökken (3. ábra). A CFDA-SE-t olyan proliferációs festékekkel fejlesztették tovább, amelyek nagyobb sejtmegtartással rendelkeznek, nagyobb felbontást biztosítanak a sejtosztódásról, és a gerjesztési és emissziós spektrumok széles skáláján állnak rendelkezésre, hogy lehetővé tegyék a többszínű fluoreszcens alkalmazásokba, például az áramlási citometriába való beépítést.
A.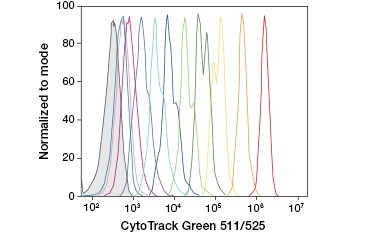
B.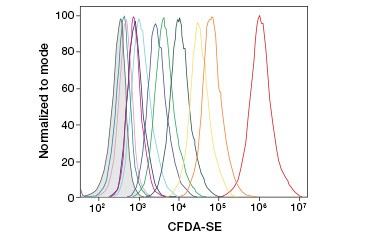
3. ábra. Sejtgenerációk követése áramlási citometriával. A CytoTrack™ Green 511/525 Cell Proliferation Assay-vel tíz, a CFDA-SE-vel pedig akár nyolc sejtgeneráció is felbontható (A).
Más fluoreszcens észteráz szubsztrátok, például kalcein-származékok és BCECF állnak rendelkezésre különböző tulajdonságokkal, beleértve a gerjesztési/emissziós spektrumok különbségeit is. Mivel a BCECF fluoreszcenciája pH-érzékeny, a citoszolikus pH változását is nyomon követheti.
A sejtáteresztő esteráz szubsztrátokat használva az életképesség fluoreszcens mikroszkópiával és áramlási citometriával értékelhető. Ezek a szubsztrátok szövetmintákhoz is alkalmazhatók, vagy nagy áteresztőképességű mikrolemezes vizsgálatokban használhatók.
3. Anyagcsere-aktivitás
A sejtek életképességének másik gyakori mérőszáma a metabolikus aktivitás, amely oxidálható és redukálható szondák segítségével értékelhető.
A resazurin egy népszerű oxidációs-redukciós (redox) indikátor. Ez a sejtáteresztő festék közvetlenül a sejttenyésztési közeghez adható, ami gyors és kényelmes vizsgálatot tesz lehetővé. A metabolikusan aktív sejtekben a kék és gyengén fluoreszkáló reszazurin redukálódik, és egy rózsaszín és erősen fluoreszkáló molekulát, resorufint képez. Ez a változás fluoreszcens és kolorimetriás vizsgálatokkal egyaránt nyomon követhető. Mivel a fluoreszcencia mennyisége egyenesen arányos az élő, lélegző sejtek számával, a rezazurint széles körben használják a sejtek életképességének kvantitatív mérésére. A rezazurin kényelmes, érzékenyebb és stabilabb, valamint nem toxikus alternatívája más redoxindikátoroknak, például az MTT és XTT tetrazoliumsóknak. A tetrazoliumsó-alapú vizsgálatokkal ellentétben, amelyek kolorimetrikusak és csak mikrolemez-olvasóval olvashatók le, a rezazurin életképességi vizsgálatok leolvashatók áramlási citometriával vagy fluoreszcens mikroszkópiával. A rezazurin és a tetrazoliumsók különösen hasznosak a nagy áteresztőképességű alkalmazásokban, mivel az életképesség mikrolemezekben mikrolemez-olvasóval értékelhető (4. ábra). Az XTT-t gyakran választják az MTT helyett a nagyobb áteresztőképességű alkalmazásokhoz, mert az MTT-vel ellentétben vízben oldódó festéket ad, így kiküszöböli az MTT-méréseknél elengedhetetlen szolubilizációs lépést. A rezazurin és a tetrazoliumsók a leggyakrabban az adherens sejtek és az oldatban lévő sejtek életképességének értékelésére használatosak.
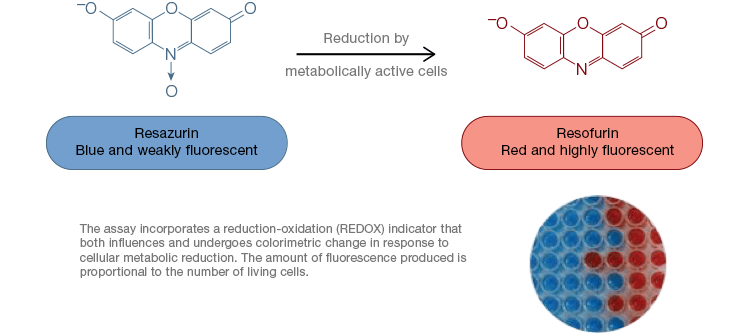
4. ábra. A nem mérgező rezazurin oxidációs próbák könnyen skálázhatók a nagy áteresztőképességű alkalmazásokhoz. Az alamarBlue oxidációja metabolikusan aktív sejtekben kolorimetrikus változást eredményez kékről vörösre, valamint a fluoreszcencia növekedését.
A dihidrorodaminok, -kalceinek és -fluoreszceinek redukált rodamin-, -kalcein- és -fluoreszcein-származékok, amelyek sejtáteresztő és színtelenek. Ezeket a vegyületeket az élő sejtekben és szövetekben jelen lévő reaktív oxigénfajok könnyen oxidálják fluoreszcens alapfestékké.
A metabolikus aktivitást mérő életképességi vizsgálatok másik osztálya a lumineszcens ATP-vizsgálatok. Ezek a sejtek által lízis során felszabaduló ATP-t számszerűsítik. Nem igényelnek hosszú inkubációs időt, rendkívül érzékenyek, és általában mikrolemez olvasóval olvashatók.
A metabolikus aktivitást mérő próbák használatakor figyelembe kell venni, hogy a metabolikus aktivitás különböző sejttenyésztési körülmények között eltérő lehet. Ezért megfelelő kontrollokat kell beépíteni, hogy ezeket a különbségeket figyelembe lehessen venni.
4. DNS-szintézis/replikáció
Az életképesség másik mérőszáma és a proliferáció értékelésének népszerű módszere a BrdU beépülésének számszerűsítése az újonnan szintetizált DNS-be. A BrdU-tartalmú DNS-t konjugált BrdU-antitestekkel vagy konjugált másodlagos antitesttel kombinált BrdU-antitestekkel azonosítják (5. ábra). Ezek a vizsgálatok sokféle leolvasást tesznek lehetővé, mivel az antitestek különböző típusú indikátorokhoz (fluorofórok, peroxidázok stb.) kapcsolhatók. A specifikus sejtmarkerek antitest-jelölése lehetővé teszi a specifikus proliferáló populációk megkülönböztetését is. A mintákat az inkubáció után rögzítik, majd áramlási citometriával, fluoreszcens mikroszkópiával, immunhisztokémiával vagy mikrolemez olvasóval elemzik. Áramlási citometria segítségével a sejtek a sejtciklus G0/G1, S vagy G2/M fázisába sorolhatók a teljes DNS-tartalmuk alapján. A kromogén peroxidáz szubsztrátok használata lehetővé teszi a vizsgálatok fluorométer nélküli leolvasását. A BrdU helyett -TdR használatával pedig ezek a próbák átalakíthatók radiociklusos leolvasássá.
A.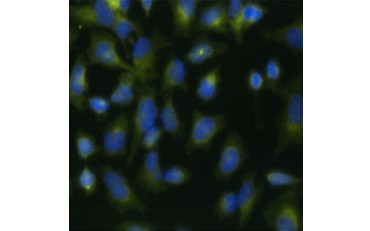
B.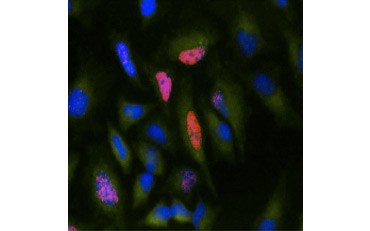
5. ábra. A BrdU beépülésének vizualizálása. A HeLa sejteket 10 µg BrdU-val kezeltük 1 órán keresztül (B) vagy kezeletlenül hagytuk (A). A sejteket Bu20a klónú Bu20a egér Anti-BrdU ellenanyaggal (MCA2483; 1:25 hígítás) festettük, másodlagos ellenanyagként kecske Anti-egér IgG (H/L) DyLight 549 konjugált ellenanyagot (piros) (STAR117D549GA; 1:50 hígítás) használtunk. A citoplazmát Nyúl Anti-GAPDH ellenanyaggal (AHP1628; 1:100 hígítás) festettük, másodlagos ellenanyagként pedig Juh Anti-Rabbit IgG DyLight 488 konjugált ellenanyagot (zöld) (STAR36D488GA; 1:50 hígítás) használtunk. A PureBlu™ DAPI-t (1351303) nukleáris ellenfestékként használtuk.
5. Proliferációs markerek expressziója
Egyes fehérjékről ismert, hogy a sejtproliferáció során megnő az expressziójuk. A Ki-67 például az osztódó sejtek sejtmagjában expresszálódik, de G0 és G1 alatt nem mutatható ki (6. ábra). Hasonlóképpen, a hiszton H3 foszforiláció is használható az M fázisban lévő sejtek azonosítására. Más általánosan használt proliferációs markerek közé tartozik a proliferáló sejtmag antigén (PCNA) és a minikromoszóma fenntartó 2 (MCM2). Ezek elleni antitestek használatával más kulcsfontosságú proliferációs markerek vagy sejtvonal-markerek ELISA, áramlási citometria, immunhisztokémia, fluoreszcens mikroszkópia és Western blotting segítségével vizsgálhatók.
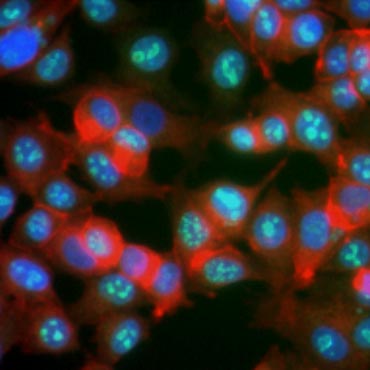
6. ábra. A Ki-67 elleni antitestek azonosítják a proliferáló sejteket. MCF-7 sejtek festése humán anti-Ki-67-gyel (HCA006, zöld), ellenfestve falloidinnal (piros) és Hoechsttel (kék).
6. Membránpotenciál és pH
Az élő sejtek aktívan fenntartják az iongradienst a membránjukon keresztül, transzmembránpotenciált generálva. Amikor egy sejt elhal, ezek az iongradiensek megszakadnak. Ez potenciometriás festékekkel értékelhető. A JC-1 egy általánosan használt potenciometriás festék. Egészséges sejtekben a JC-1 a mitokondriumokban lokalizálódik, ahol vörös fluoreszcens aggregátumokat képez. A mitokondriális membránpotenciál lebomlásakor a JC-1 az egész sejtben diffundál, és zöld fluoreszcens monomerként létezik. A tetrametilródamin-etilészterek (TMRE) és a tetrametilródamin-metilészterek (TMRM) a JC-1-hez hasonlóan egészséges sejtekben a mitokondriumokban, haldokló sejtekben pedig a citoplazmában lokalizálódnak. A JC-1-től eltérően ezek a festékek nem mutatnak eltolódást az emissziós spektrumukban. Ehelyett a mitokondriumok külső membránjának permeabilizációja a TMRM/TMRE vörös fluoreszcenciájának csökkenését eredményezi.
Az egészséges sejtek képesek alacsony pH-t létrehozni és fenntartani a sejt savas organellumaiban, például a lizoszómában. Ez olyan acidotróp festékekkel mérhető, mint az akridin-narancs és a semleges vörös. Az akridin-narancs használatakor figyelembe kell venni, hogy ez a festék a DNS-t és az RNS-t is megköti. Egyszálú nukleotidokhoz kötődve az akridin-narancs pirosan fluoreszkál; kétszálú DNS-hez kötődve zöldesen fluoreszkál; a lizoszómában lévő DNS-hez kötődve pedig narancsosan fluoreszkál.
A választott módszertől függetlenül rendkívül fontos, hogy az itt leírt vizsgálatok elvégzésekor megfelelő kontrollokat alkalmazzunk, mivel a kísérleti körülmények és a sejttípus megváltoztathatja egyes vizsgálatok teljesítményét. Mindig tartalmazzon pozitív és negatív kontrollokat. Ha oldószerben lévő szondákat használunk, az oldószer hatásainak figyelembevétele érdekében vegyük figyelembe a járművel kezelt kontrollokat is. Használjon alkalmazásspecifikus kontrollokat olyan tényezők ellenőrzésére, mint az autofluoreszcencia az immunfluoreszcencia és az áramlási citometriás kísérleteknél, valamint a Western blottinghoz szükséges terhelési kontrollok.
A Bio-Rad sejtéletképességi és proliferációs tesztjeivel kapcsolatos információkért látogasson el a sejtek egészségi állapotát vizsgáló oldalunkra.
Olvassa el a sejtek egészségének felmérése című II. részt: Az alamarBlue a Trek Diagnostic Systems védjegye. A DyLight a Thermo Fisher Scientific védjegye.
Vélemény, hozzászólás?