Une méta-analyse du métronidazole et de la vancomycine pour le traitement de l’infection à Clostridium difficile, stratifiée par la gravité de la maladie | The Brazilian Journal of Infectious Diseases
On janvier 20, 2022 by adminIntroduction
L’infection à Clostridium difficile (CDI) est prévalente dans les établissements de soins de santé dans l’ensemble du monde développé1 et peut entraîner des complications graves, un séjour hospitalier plus long et des coûts médicaux supplémentaires2. Au cours des 15 dernières années, on a constaté une augmentation marquée de l’incidence et du taux de mortalité de l’ICD en Europe, au Canada et aux États-Unis. Cette augmentation est principalement attribuable à l’émergence d’une nouvelle souche hypervirulente de BI/NAP1/027, apparue respectivement en 2003 en Amérique du Nord et en 2005 en Europe. Les données provenant de 28 hôpitaux communautaires du sud des États-Unis suggèrent que C. difficile a remplacé le Staphylococcus aureus résistant à la méticilline comme étiologie la plus courante des infections associées aux soins de santé.3 Le métronidazole et la vancomycine sont les antibiotiques les plus couramment utilisés pour l’ICD, dont l’efficacité a historiquement été jugée similaire.4,5 En 1995, les Centers for Disease Control and Prevention des États-Unis ont recommandé de réduire l’utilisation de la vancomycine dans les hôpitaux car elle pouvait contribuer à augmenter la prévalence des entérocoques résistants à la vancomycine (ERV).6 Depuis, le métronidazole était couramment utilisé comme traitement de première intention de l’ICD. Depuis lors, le métronidazole était couramment utilisé comme traitement de première intention de l’ICD. Avec l’émergence et la prévalence de la souche hypervirulente de C. difficile (BI/NAP1/027), les infections sont devenues plus graves et la comparaison entre le métronidazole et la vancomycine a été réévaluée7,8, en particulier lorsqu’elle est utilisée pour traiter les patients atteints d’ICD grave. Zar et al. ont mené le premier essai prospectif, randomisé, en double aveugle, contrôlé par placebo et monocentrique comparant le métronidazole et la vancomycine pour l’ICD. Les résultats ont montré que le métronidazole et la vancomycine étaient aussi efficaces l’un que l’autre, mais que la vancomycine était supérieure pour les patients atteints d’ICD sévère.9 Leurs conclusions ont été d’une importance capitale et ont permis de suggérer une mise à jour des directives de pratique clinique. Ces directives recommandaient d’utiliser le métronidazole pour l’ICD légère ou modérée et la vancomycine pour l’ICD grave, qui était déterminée par la gravité des symptômes.10-13 Cependant, dans une étude de Zar et al, 22 participants ont été exclus de l’analyse et, selon une analyse ITT stricte des 82 patients atteints d’une maladie grave et assignés au hasard, le taux de guérison initial n’était pas significativement différent entre la vancomycine et le métronidazole (79 % contre 66 %, p=0,22).3,14 Ensuite, Le et al. ont rapporté un taux de réponse clinique plus élevé chez les patients atteints d’une maladie grave avec la vancomycine, mais seule une minorité de patients avait reçu de la vancomycine (n=8).15 Récemment, Johnson et al. ont rapporté des taux de réussite clinique similaires chez les patients atteints d’une ICD grave traités par vancomycine ou métronidazole, mais le métronidazole était inférieur à la vancomycine pour tous les patients atteints d’ICD.16 De plus, Pepin et al. ont suggéré que la perte de supériorité de la vancomycine par rapport au métronidazole coïncidait avec l’émergence du NAP1/027.17 Par conséquent, nous avons réalisé une méta-analyse en stratifiant les patients en fonction de la gravité de la maladie, afin d’étudier l’efficacité du métronidazole par rapport à la vancomycine, et de rechercher quel agent était supérieur pour traiter la maladie légère ou sévère.
Matériels et méthodesSources de données
Une recherche systématique de la littérature dans MEDLINE via Pubmed (1978 au 31 octobre 2014), Embase (1978 au 31 octobre 2014) et le Cochrane Central Register of Controlled Trials (bibliothèque Cochrane) a été menée pour identifier les études pertinentes. Les principaux termes de recherche étaient « métronidazole et vancomycine et clostridium difficile » ; « métronidazole et vancomycine et colite pseudomembraneuse » ; « métronidazole et vancomycine et diarrhée associée aux antibiotiques ». Toutes les références des articles initialement identifiés, y compris les articles de synthèse pertinents, ont été recherchées manuellement et examinées. Les résumés présentés dans des conférences scientifiques qui n’étaient pas disponibles pour nous n’ont pas été recherchés.
Sélection des études
Deux examinateurs (X.ZH.D et N.B.) ont indépendamment recherché les articles et examiné les études pertinentes pour une évaluation plus approfondie. Une étude était considérée comme éligible s’il s’agissait d’un ECR ou d’une étude de cohorte prospective, si elle portait sur des patients adultes atteints d’ICD, y compris une maladie légère et/ou sévère ; si elle étudiait la sécurité ou l’efficacité du métronidazole et de la vancomycine ; si elle rapportait des données spécifiques concernant la guérison clinique et microbiologique, la mortalité et les événements indésirables. Les études à l’aveugle ou non et les conceptions randomisées ou non randomisées ont toutes été incluses. Les études expérimentales basées sur des variables pharmacocinétiques ou pharmacodynamiques ont été exclues. Les essais cliniques impliquant une thérapie d’association de médicaments ont également été exclus.
Évaluation qualitative
L’évaluation de la qualité méthodologique des ECR et des études de cohorte incluses dans la méta-analyse a été effectuée indépendamment par deux examinateurs (X.ZH.D et N.B.) conformément à la liste de contrôle élaborée par Downs et Black18. Cet outil a évalué les études randomisées et non randomisées en fournissant à la fois un score global de la qualité de l’étude et un profil de scores pour l’évaluation de la qualité des rapports, de la validité externe, de la validité interne (biais, confusion) et de la puissance. Les études de haute qualité ont obtenu 15 points ou plus, tandis que les études de faible qualité ont obtenu 14 points ou moins.
Extraction des données
Deux examinateurs ont extrait indépendamment les données de chaque étude à l’aide d’un formulaire d’examen préétabli. En cas de désaccord entre les deux examinateurs, un troisième examinateur a extrait les données jusqu’à l’obtention d’un consensus. Les données extraites de chaque étude étaient les suivantes (i) année de publication ; (ii) population de patients ; (iii) nombre de patients ; (iv) agents antimicrobiens et dosages utilisés ; (v) résultats cliniques et microbiologiques ; et (vi) mortalité toutes causes confondues. Nous avons utilisé une analyse ITT, définie comme incluant tous les patients assignés au hasard.
Résultats analysés
La guérison clinique initiale, la guérison soutenue, la guérison microbiologique, la récidive et la mortalité toutes causes confondues ont été utilisées comme mesures de résultats pour cette méta-analyse. Nous avons utilisé la définition de la guérison clinique initiale et de la récidive rapportée dans les études individuelles et avons enregistré les différences entre les études. Les résultats ont également été analysés en fonction des populations suivantes : (i) tous les patients, y compris ceux atteints d’ICD légère et sévère ; (ii) les patients atteints d’ICD légère ; (iii) les patients atteints d’ICD sévère ; et (iv) les patients atteints de colite pseudo-membraneuse (CPM).
Analyse des données et méthodes statistiques
Les analyses statistiques ont été effectuées avec le programme Review Manager, version 5.2 (Cochrane Collaboration). L’hétérogénéité entre les études a été évaluée par le test d’hétérogénéité χ2 (p
0,05 a été défini pour indiquer une hétérogénéité significative) et la mesure d’incohérence I2. Les rapports de risque (RR) et les intervalles de confiance (IC) à 95 % pour les résultats ont été calculés par le modèle à effet fixe (FEM) s’il n’y avait pas d’hétérogénéité statistiquement significative entre les études incluses. Dans le cas contraire, le modèle à effet aléatoire (REM) était utilisé. Des analyses de sous-groupes ont été réalisées en fonction de la gravité de la maladie.RésultatsEtudes cliniques sélectionnées
Le diagramme de flux (Fig. 1) montre le processus détaillé de sélection des études incluses dans cette méta-analyse. La recherche documentaire a permis d’identifier 2945 résumés. Nous avons obtenu 47 articles complets pour une évaluation détaillée. Parmi les 41 études exclues, trois articles ont été exclus parce qu’ils faisaient partie d’ECR déjà inclus dans cette méta-analyse, un essai a été exclu parce qu’il s’agissait d’une étude pharmacocinétique,19 d’autres études ont été exclues en raison de conceptions d’études différentes, comme l’absence de régime de contrôle, l’association avec d’autres antibiotiques,20,21 des résultats différents,22 ou des types de patients différents,23 etc. Ainsi, six études ont finalement été incluses dans cette méta-analyse : deux études de cohorte15,24 et quatre ECR.4,5,9,16
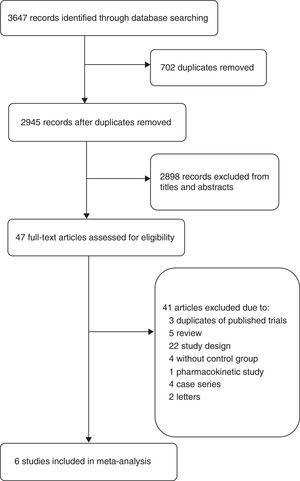
Diagramme de flux des études incluses.
Caractéristiques des études
Les principales caractéristiques des études analysées sont présentées dans le tableau 1. Les études incluses étaient de haute qualité (deux ECR avaient un score de 23, deux un score de 20, et deux études de cohorte un score de 17). Deux ECR ont été menés en utilisant des modèles randomisés, en double aveugle et contre placebo,9,16 tandis que les deux autres n’ont utilisé que la randomisation.4,5 Trois études ont été menées aux États-Unis,4,9,15 deux études ont été menées en Autriche,5,24 tandis qu’une seule étude comprenant deux ECR a été menée aux États-Unis et en Europe, respectivement.16 La définition de l’ICD, la guérison clinique initiale et la récurrence sont présentées dans le tableau supplémentaire 1. La définition de l’ICD incluait invariablement un test de dépistage de la toxine C. difficile, des micro-organismes ou de la CMP associé à une diarrhée. Cependant, les définitions de la diarrhée variaient légèrement, mais la plupart des études faisaient référence à la diarrhée comme étant des selles non formées au moins trois fois sur une période de 24h.5,9,15,16 Les résultats de la guérison clinique initiale et de la récurrence ont été rapportés dans toutes les études avec des définitions légèrement différentes. Par exemple, cinq études4,5,9,15,16 ont considéré la guérison clinique initiale si la diarrhée disparaissait dans les 6 à 8 jours de traitement, alors que Zar9 et Wenisch5 intègrent un résultat négatif d’une mesure de la toxine C. difficile ou de la protéine C-réactive. La plupart ont considéré qu’il y avait récidive lorsque les symptômes réapparaissaient et/ou que des résultats microbiologiques positifs étaient confirmés au cours d’un suivi de 21 à 30 jours après la résolution initiale des symptômes.4,5,9,15,16 La guérison durable a été définie comme la guérison clinique en l’absence de toute récidive au cours du suivi, qui a été calculée comme la guérison clinique initiale moins les récidives. La guérison rapportée par Wenisch24 a été considérée comme une guérison durable. Les patients atteints d’une ICD modérée dans l’étude de Johnson et al. ont été considérés comme atteints d’une maladie grave, tandis que tous les patients inclus dans l’étude de Wenisch et al. ont été considérés comme atteints d’une maladie légère selon l’évaluation de la gravité de l’ICD utilisée dans les études de Zar9 et les lignes directrices11. En outre, Wenisch et al. n’ont pas indiqué l’allocation de traitement des sept abandons de tous les groupes,5 Johnson et al. ont indiqué que l’analyse incluait tous les patients randomisés qui ont reçu au moins une dose d’antibiotiques et ont eu une évaluation post-dose,16 ce qui pourrait avoir influencé les résultats ITT.
Un tableau supplémentaire lié à cet article peut être trouvé, dans la version en ligne, à http://dx.doi.org/10.1016/j.bjid.2015.03.006.
Cure clinique initiale
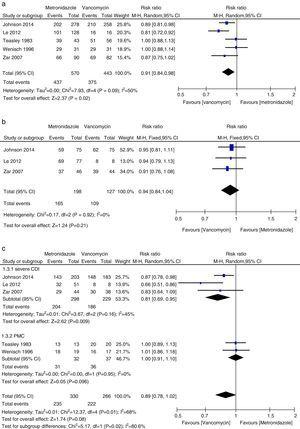
Méta-analyse des taux de guérison clinique initiale comparant le métronidazole à la vancomycine pour toutes les CDI, les CDI légères, les CDI sévères et les CMP.
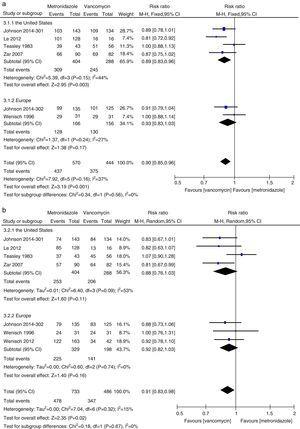
Méta-analyse des taux de guérison clinique initiale et de guérison durable comparant le métronidazole à la vancomycine pour tous les patients atteints d’ICD des États-Unis et d’Europe.
Cure durable Taux de récidive Cure microbiologique
Deux ECR pertinents ont fourni des taux de cure microbiologique, définis comme des résultats négatifs de la culture des selles de suivi après le traitement et du dosage de la cytotoxine pour C. difficile chez les patients traités sans symptômes cliniques.4,5 En ce qui concerne la guérison microbiologique, le traitement au métronidazole était aussi efficace que le traitement à la vancomycine (161 patients, FEM, RR=0,88, IC 95 %=0,64-1,21, p=0,43, Fig. 6).

Méta-analyse de la cure microbiologique comparant le métronidazole à la vancomycine pour l’ICD.
Taux de décès toutes causes confondues
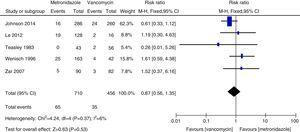
Méta-analyse du taux de décès toutes causes confondues comparant le métronidazole à la vancomycine pour l’ICD.
Discussion
L’ICD est un problème sérieux dans le système de soins de santé avec une incidence croissante dans le monde entier qui peut causer une morbidité et une mortalité importantes.25 Les taux de mortalité rapportés pour les patients atteints d’ICD sévère varient de 9% à 25% ; plus de la moitié de ces décès sont liés à l’ICD.14,26 Il est particulièrement important de traiter les patients atteints d’ICD sévère en utilisant une thérapie antimicrobienne appropriée.
Dans cette méta-analyse, nous avons constaté que la vancomycine était supérieure au métronidazole en termes de guérison clinique initiale et de guérison durable chez les patients atteints d’ICD. Les taux de guérison microbiologique, étaient numériquement plus faibles avec le traitement par métronidazole qu’avec la vancomycine, bien que la différence ne soit pas significative. Les auteurs d’un document de synthèse de 2011 ont trouvé, dans leur analyse groupée, des taux équivalents de guérison clinique initiale avec le métronidazole et la vancomycine, les agents les plus couramment utilisés.27,28 Cette incohérence était principalement due aux différentes études incluses dans chaque revue systématique. Nous avons inclus trois études supplémentaires dans la présente méta-analyse.15,16,24 Lorsque les données ont été analysées en fonction de la gravité de l’ICD, le traitement par vancomycine ou métronidazole ne différait pas chez les patients atteints d’une maladie légère. Cependant, les taux de guérison clinique et de guérison durable avec la vancomycine chez les patients atteints d’ICD grave étaient significativement plus élevés que ceux du groupe métronidazole. Nous n’avons pas trouvé de preuves suffisantes de l’efficacité égale de la vancomycine et du métronidazole chez les patients atteints d’ICP, en raison du petit nombre de patients évalués. La PMC a été utilisée comme un marqueur de maladie sévère.12 Lorsque les patients atteints d’ICD sévère comprenaient les patients atteints de PMC, aucune différence significative n’a été constatée entre le traitement par métronidazole et celui par vancomycine. Bien qu’aucune différence statistique n’ait été observée, une forte tendance vers des taux de guérison clinique initiale et de guérison durable plus élevés a été notée dans le groupe vancomycine, alors qu’elle était la même pour les patients atteints d’une ICD légère. Ainsi, pour les patients atteints d’ICD grave, la vancomycine était supérieure au métronidazole. Venugopal et al. ont démontré que les patients atteints d’ICD sévère étaient plus enclins à passer à la vancomycine, ce qui suggère que ces patients répondaient mal au métronidazole.29 Ces résultats ont été confirmés dans la présente méta-analyse. Les résultats du traitement par le métronidazole étaient médiocres parce que le flux sanguin vers le côlon chez les patients atteints d’une maladie grave pourrait avoir diminué, entraînant une moindre transsudation du métronidazole dans la lumière.30,31 En outre, la fidaxomicine a récemment été approuvée pour le traitement de l’ICD et peut être utilisée comme agent secondaire en cas d’échec de la vancomycine ou du métronidazole, car la fidaxomicine reste détectable dans les échantillons de selles prélevés jusqu’à cinq jours après une dose unique.32 Dans une étude de méta-analyse, la fidaxomicine a montré des taux de guérison clinique similaires à ceux de la vancomycine avec une diminution significative du taux de récidive chez les patients atteints d’ICD sévère et non sévère.33 Par conséquent, pour le traitement initial de l’ICD sévère, la vancomycine orale est le médicament de première intention ; Les taux de récurrence de la vancomycine et du métronidazole étaient en accord général avec les données précédentes et aucune différence significative n’a été trouvée.27,28 Cependant, la vancomycine était associée à des taux de récurrence plus faibles que le métronidazole à la fois chez tous les patients atteints d’ICD et chez ceux atteints d’ICD sévère. Notre étude suggère que le taux de mortalité toutes causes confondues n’était pas significativement différent entre la vancomycine et le métronidazole chez tous les patients atteints d’ICD. Le taux de mortalité toutes causes confondues de tous les patients atteints d’ICD était de 100/1166 (8,5 %), ce qui est inférieur à une étude européenne montrant un taux de mortalité pour tous les cas de 101/455 (22 %) après trois mois.1
Les résultats de la présente méta-analyse doivent être considérés dans le contexte de limitations potentielles. Tout d’abord, l’épidémiologie de C. difficile a rapidement changé, une grande proportion de cas graves et récurrents se produisant dans ces pays par rapport à ce qui avait été rapporté précédemment.1 Cela pourrait entraîner des différences dans les populations étudiées. Deuxièmement, de nouvelles méthodes de diagnostic de l’ICD sont apparues au cours de la dernière décennie. L’utilisation de tests plus sensibles et plus rapides pour le diagnostic de l’ICD est essentielle pour la prise en charge clinique des patients. Bien que les critères de diagnostic n’aient pas été aussi stricts dans certains cas, la réponse au traitement ne différait pas sensiblement au sein d’un même régime médicamenteux ou entre les médicaments.4 Troisièmement, comme cette méta-analyse a inclus un nombre relativement faible d’études, en particulier des ECR, la précision des estimations pourrait avoir été compromise. Quatrièmement, les investigateurs n’étaient pas en aveugle quant à l’allocation des traitements dans les quatre études, ce qui peut avoir introduit un biais dans les résultats d’efficacité rapportés. Cinquièmement, la plupart des études incluses ne garantissaient pas que tous les cas de diarrhée des patients inclus étaient causés par C. difficile, car elles n’excluaient pas la présence d’autres agents pathogènes dans les selles comme cause de la diarrhée.4,5 Sixièmement, le score de gravité n’est toujours pas validé et suffisamment scientifique, et doit être amélioré non seulement pour la standardisation des études futures, mais aussi pour son utilisation en pratique clinique.27,34 Par conséquent, les résultats actuels doivent être confirmés davantage.
En conclusion, malgré les limites de la présente méta-analyse, ces analyses indiquent que la vancomycine offre des avantages significatifs dans le traitement de l’ICD par rapport au métronidazole. Les patients ont bien toléré les deux médicaments et les taux de rechute étaient similaires. Pour les patients atteints d’une ICD légère, le traitement par métronidazole était aussi efficace cliniquement que la vancomycine ; pour les patients atteints d’une ICD sévère, la vancomycine était plus efficace que le métronidazole. Cette différence d’efficacité était plus évidente dans le sous-groupe de l’ICD sévère et soutenait les récentes recommandations d’utiliser la vancomycine comme traitement de première intention pour l’ICD sévère.
Conflits d’intérêts
Les auteurs ne déclarent aucun conflit d’intérêts.
Financement
Cette étude a été soutenue par les grands projets spéciaux nationaux de science et de technologie pour les nouveaux médicaments (n° 2012ZX09303004) et la Fondation municipale des sciences naturelles de Pékin (n° 7132168).
Laisser un commentaire