Remplacement par greffe composite de la racine aortique, de l’aorte ascendante et de l’arc aortique proximal
On septembre 30, 2021 by adminIntroduction et stratégie générale
Il existe plusieurs indications pour réparer la racine aortique et l’aorte ascendante. La plus fréquente est la dilatation anévrismale de la racine aortique ± l’aorte ascendante qui est associée à un dysfonctionnement de la valve aortique (en général une régurgitation). Dans ce cas, les feuillets de la valve aortique peuvent être fondamentalement normaux, mais il y a une perte de la jonction sinotubulaire en raison de la dilatation de l’aorte. Cela peut entraîner une coaptation insuffisante des feuillets et donc une régurgitation valvulaire. Chez d’autres patients, les feuillets de la valve aortique peuvent être anormaux en raison d’une morphologie bicuspide (valve bicuspide vraie ou pseudo-bicuspide) et la maladie est associée à une aorte ascendante élargie. Lorsque l’indication principale pour opérer le patient est la valvulopathie aortique ou la revascularisation du myocarde, l’aorte ascendante est généralement remplacée de façon très large (c’est-à-dire si son diamètre est supérieur à 4,5 cm). Une autre situation qui nécessite la réparation de la racine aortique et de l’aorte ascendante est le patient qui présente une sténose sévère de la valve aortique (valve aortique bicuspide ou tricuspide) et une dilatation post-sténotique de l’aorte ascendante. Chez cette catégorie de patients, si la jonction sinotubulaire est conservée et que le diamètre de la racine aortique au niveau des sinus de Valsalva ne dépasse pas 4 cm, l’auteur procède généralement à un remplacement valvulaire aortique séparé et à un remplacement supracoronaire de l’aorte ascendante par un greffon prothétique.
Au cours de la dernière décennie, l’auteur a été de plus en plus agressif dans le remplacement de l’aorte ascendante complète et a utilisé très libéralement une courte période d’arrêt hypothermique léger pour effectuer l’anastomose distale sans clampage aortique. Les principaux avantages de cette stratégie sont : une réparation plus complète de l’aorte ascendante et une réalisation plus facile de l’anastomose distale au niveau de l’anastomose proximale de l’arc aortique. L’expérience de l’institution de l’auteur avec l’arrêt circulatoire hypothermique modéré (température centrale 28-30°C et température tympanique 22-24°C) a été très encourageante, avec un taux de complications neurologiques inférieur à 2% pour une chirurgie élective.
L’évaluation préopératoire des patients nécessitant une chirurgie de la racine aortique et de l’arc aortique ascendant ± proximal comprend généralement une échocardiographie transthoracique, et soit un angio CT-scan, soit une imagerie par résonance magnétique pour obtenir toutes les informations nécessaires sur l’ensemble de l’aorte thoracique. Une description correcte de la dilatation aortique est nécessaire pour planifier de manière optimale la procédure, en particulier le niveau de l’anastomose distale. Chez les patients de moins de 40 ans et sans calcification des artères coronaires dans le CT-scan cardiaque, l’angiographie n’est pas réalisée. Cependant, cette investigation est réalisée chez tous les patients présentant des facteurs de risque cardiovasculaire importants et chez ceux âgés de plus de 40 ans.
Vignettes cliniques
Dans la première vidéo, la technique de remplacement de la racine aortique par un greffon composite est démontrée (vidéo 1). Le patient était âgé de 45 ans et souffrait d’une dilatation annulo-aortique avec régurgitation sévère de la valve aortique. L’annulus avait un diamètre de 29 mm et il y avait de nombreuses fenestrations au niveau des trois commissures. L’auteur a estimé qu’une procédure de David était indiquée, mais le patient a insisté pour recevoir l’option la plus définitive, à savoir une valve mécanique. Une résection de la racine aortique et de la valve aortique a été effectuée et les orifices coronaires ont été excisés avec un petit rebord de tissu aortique. Un greffon composite de 27 mm a été dimensionné et une fixation au niveau de l’anneau aortique a été réalisée à l’aide de sutures Ethibond 2.0 interrompues et armées de téflon. Les sutures ont été réalisées à partir du côté ventriculaire. Alternativement, les sutures peuvent être réalisées de l’extérieur vers l’intérieur, en laissant les plombs à l’extérieur de l’aorte (ceci est particulièrement utile pour rétrécir un peu l’anneau aortique). Les artères coronaires ont été réimplantées avec des sutures Prolene 6.0 continues, en commençant par l’ostium gauche. Pour contrôler l’hémostase, une cardioplégie est instillée dans le greffon aortique et de la colle de fibrine (Evicel, Ethicon, (New Brunswick, NJ, USA)) peut être utilisée. Enfin, l’anastomose distale est réalisée, le cross-clamp est retiré et une désaération soigneuse est effectuée par une ponction à l’aiguille du greffon prothétique et une insufflation de CO2 dans le champ opératoire.
La deuxième vidéo illustre la technique de remplacement séparé de la valve aortique et du greffon supracoronaire chez un homme de 68 ans, qui présentait une sténose aortique sévère associée à une régurgitation modérée et une dilatation post-sténotique de l’aorte ascendante (vidéo 2). Les dimensions de la racine aortique étaient pratiquement normales avec un diamètre de 3,8 cm au niveau des sinus de Valsalva et la jonction sinotubulaire était bien préservée. A ce niveau, la qualité de la paroi aortique était excellente. Une cardioplégie sélective a été administrée dans les artères coronaires. Le remplacement de la valve aortique a été effectué à l’aide d’une prothèse biologique Edwards Lifesciences (Irvine, Californie, États-Unis) Perimount Magna Ease 25 mm et le remplacement du greffon supracoronaire a été effectué à l’aide d’une prothèse Vascutek Terumo Anteflow (Renfrewshire, Écosse, Royaume-Uni) 28 mm (bras latéral 10 mm). L’anastomose distale a été réalisée en premier, puis le greffon a été coupé à la longueur appropriée et l’anastomose proximale a été réalisée en dernier. Aucun matériau de renforcement n’a été utilisé pour les anastomoses. La durée totale du clampage a été de 52 minutes, y compris un arrêt circulatoire en hypothermie légère de huit minutes et une perfusion cérébrale antégrade de cinq minutes. Le patient s’est bien rétabli et est sorti le sixième jour postopératoire.
Technique opératoire
Contournement cardiopulmonaire et protection du myocarde
Les patients souffrant d’une maladie de la racine aortique et ceux présentant un anévrisme aortique ascendant sont opérés par une sternotomie médiane. Chez la majorité des patients souffrant d’un anévrisme artériosclérotique, toute l’aorte ascendante est généralement dilatée. Si le retour artériel du pontage cardio-pulmonaire est effectué par la canulation aortique, la canule est placée dans la partie la plus crâniale de l’aorte ascendante. Une alternative à la canulation aortique directe, la canulation de l’artère sous-clavière droite est effectuée chez tous les patients présentant une dissection aortique aiguë de type A et chez les patients dont on s’attend à une réentrée sternale difficile en raison d’une nouvelle intervention. La canulation de l’artère fémorale n’est effectuée qu’exceptionnellement, par exemple chez les patients qui ont besoin d’une canulation d’urgence lors d’une régurgitation mécanique. Le drainage veineux est effectué par la canulation de l’oreillette droite à l’aide d’une canule à deux étages. Le pontage cardio-pulmonaire est institué en hypothermie modérée (soit 32°C pour les procédures plus simples ou 28-30°C pour celles où un court arrêt circulatoire est prévu. Un évent pour la cavité cardiaque gauche est placé par la veine pulmonaire supérieure droite, puis par la valve mitrale dans le ventricule gauche chez les patients présentant une insuffisance aortique importante. Il est très important d’éviter la dilatation du ventricule gauche en cas de fibrillation ventriculaire pendant la période de refroidissement. Parfois, le clampage de l’aorte est nécessaire immédiatement après le début de la fibrillation cardiaque. Une fois l’aorte clampée, l’auteur ouvre l’aorte ascendante et administre une cardioplégie antégrade de sang froid directement dans les orifices coronaires. Chez les patients sans régurgitation aortique, la cardioplégie est administrée par une canule de la racine aortique. La cardioplégie par sang froid est répétée à intervalles de 20 à 30 minutes tout au long du cas.
Remplacement de la racine aortique
Les techniques spécifiques de réparation de la racine aortique – par exemple, une procédure de David ou un remplacement par greffe composite (vidéo 1) – sont adaptées à la pathologie et basées sur l’état de la valve aortique, les sinus de Valsalva et l’emplacement des orifices coronaires. En fait, il existe plusieurs techniques opératoires pour réparer la racine aortique et l’indication est traitée individuellement pour chaque patient. Si les sinus aortiques sont de taille normale et que les feuillets de la valve aortique sont malades, le remplacement de la valve aortique combiné au remplacement du greffon supracoronaire est notre approche préférée (vidéo 2). Chez certains patients dont les feuillets de la valve aortique sont normaux, ainsi que les sinus aortiques, le remplacement seul de l’aorte ascendante à l’aide d’un greffon supracoronaire sous-dimensionné est la technique préférée car elle est généralement suffisamment efficace pour traiter la régurgitation valvulaire coexistante légère à modérée en rétrécissant la jonction sinotubulaire.
Si le diamètre des sinus aortiques dépasse 4 cm (chez les patients de moins de 70 ans) et que les feuillets de la valve aortique sont malades, le remplacement de la racine aortique par la technique de Bentall modifiée est indiqué. Chez ces patients, les artères coronaires sont généralement déplacées cranialement par rapport à l’anneau aortique. Avant de commencer la reconstruction, l’auteur résèque généralement complètement l’aorte ascendante et la racine aortique. Les orifices coronaires sont excisés avec un petit anneau de tissu aortique et mobilisés pour permettre une réimplantation sans tension dans la prothèse aortique. La technique d’inclusion n’a pas été utilisée au cours des 20 dernières années, car l’auteur pense que cette technique est plus fréquemment associée à des pseudo-anévrismes des orifices coronaires à moyen ou long terme.
L’intervention commence par la suture proximale de la prothèse du greffon composite à l’anneau aortique à l’aide d’une suture de matelas séparée en Ethibond 2,0 soutenue par de petits plombs en téflon. La première suture est placée au niveau de la commissure entre les sinus coronaires gauche et droit et les suivantes sont suturées dans le sens horaire (Image 1). Les sutures sont placées à travers l’annulus avec les pledgets laissés soit du côté aortique ce qui permet d’éverser l’annulus, mais dans les petits diamètres annulaires. L’auteur préfère suturer ces sutures du côté ventriculaire à l’aorte, donc les plombs se trouvent sous l’anneau aortique. Ensuite, les sutures sont placées à travers l’anneau de couture de la prothèse du greffon composite (Image 2) qui est ensuite parachutée jusqu’à l’annulus aortique (Image 3). Les sutures sont ensuite serrées et la valve est placée dans la voie de sortie du ventricule gauche (ce qui permet une excellente hémostase).
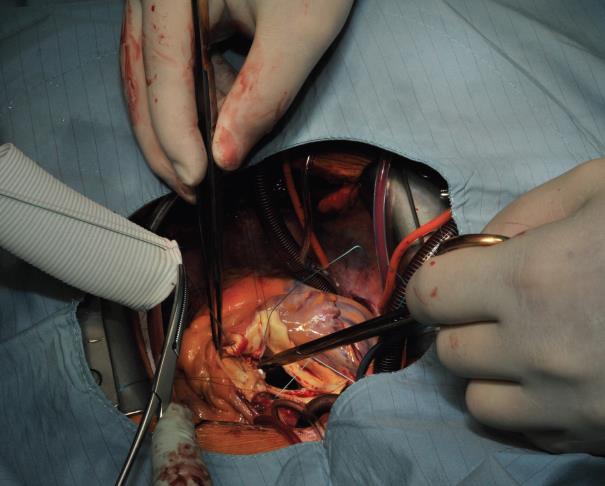
Image 1 : La suture du greffon composite à l’anneau aortique commence au niveau de la commissure entre les sinus coronaires gauche et droit et est poursuivie dans le sens des aiguilles d’une montre en arrière-plan jusqu’au milieu du sinus non coronaire. Par la suite, la technique de l’avant-main est appliquée pour le reste du sinus non coronaire et le sinus coronaire gauche.
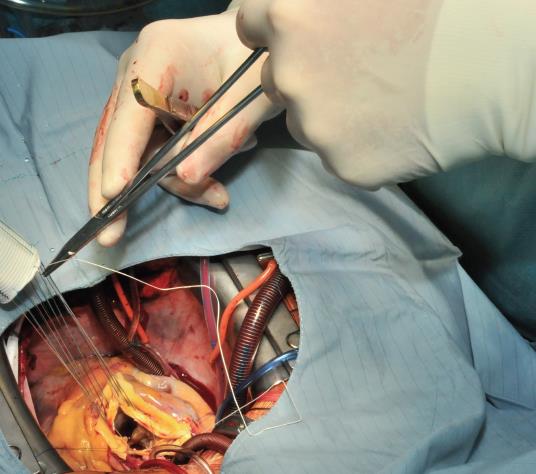
Image 2 : Les sutures sont passées à travers la manchette de couture de la valve. Dans ce cas, les plombs en téflon ont été placés sous l’anneau aortique. Alternativement, les sutures peuvent être réalisées à partir du côté aortique (outside-in) laissant les plaquettes de Téflon en dehors du flux sanguin. Ceci est particulièrement favorable dans le cas où la taille de l’annulus aortique doit être réduite.
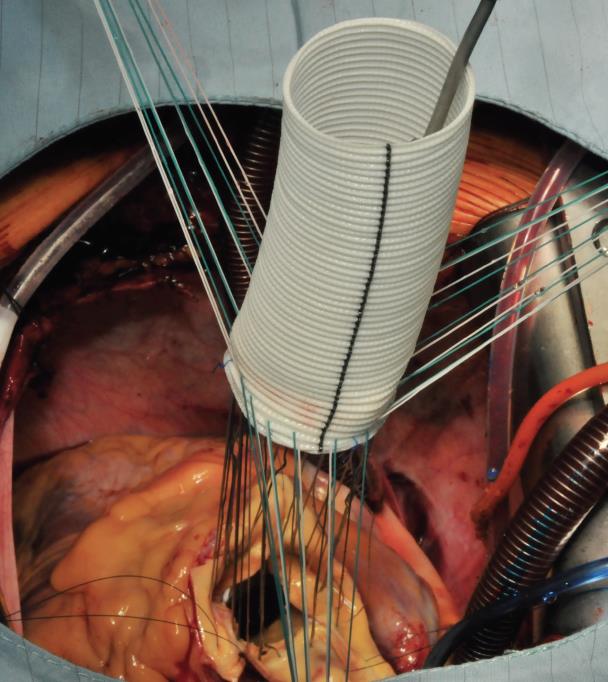
Image 3 : Le greffon composite est ensuite parachuté dans l’annulus aortique (valve mécanique) ou placé en position supra-annulaire lorsqu’une valve bioprothétique a été utilisée. Les sutures sont serrées et coupées. A ce moment, la température centrale a généralement été amenée à 28 ou 30°C pour procéder à l’anastomose distale au niveau de l’arc aortique proximal (ouvert).
Une fois l’anastomose annulaire réalisée, la température du patient a généralement atteint la température centrale visée de 28 à 30°C. Le patient est placé en position de Trendelenburg et le Pentothal est administré. Une fois l’indice bispectral réduit à zéro, la circulation extracorporelle est interrompue. La canule artérielle est retirée de l’aorte ascendante. À ce moment-là, la partie crânienne de l’aorte ascendante est réséquée, puis des cathéters de perfusion sélective sont placés dans les deux artères carotides communes pour une protection cérébrale sélective antérograde. En général, il faut environ 30 secondes à 1 minute pour commencer la perfusion cérébrale. Cette technique de perfusion cérébrale nécessite un débit constant d’environ 500 millilitres par minute, avec une pression de perfusion ne dépassant pas 60 mmHg. Pendant l’arrêt circulatoire hypothermique avec perfusion cérébrale, l’anastomose distale est construite au niveau de l’artère innominée. On utilise généralement une prothèse Vascutek Anteflow qui facilite la recanulation du patient par le bras latéral de la prothèse, dès que l’anastomose distale a été réalisée. Juste avant de relancer la circulation extracorporelle, l’auteur retire les cathéters de perfusion et observe la désaération presque terminée des branches supra-aortiques, de la crosse aortique et de la prothèse qui est clampée juste en dessous du bras latéral. Le contrôle de l’hémostase peut se faire très facilement à ce stade autour de toute l’anastomose.
Par la suite, le travail se poursuit au niveau de la racine aortique. Les anastomoses des orifices coronaires avec le greffon vasculaire sont ensuite réalisées. Il faut d’abord créer un néo-ostium à l’aide d’un cutter thermique (image 4). L’auteur commence toujours par le ré-attachement de l’artère coronaire gauche. Cette anastomose est réalisée à l’aide d’une suture Prolene 6.0 continue. Une bandelette de péricarde bovin n’est utilisée qu’exceptionnellement en cas de boutons coronaires très friables ou en cas de dissection aortique. Pour le chirurgien gaucher, il est assez facile de commencer cette suture continue par l’intérieur de l’orifice coronaire puis par l’extérieur du greffon. La partie postérieure de l’anastomose est construite, puis la suture est changée. Pour la partie antérieure de cette anastomose, la suture est réalisée de l’extérieur de l’orifice coronaire vers l’intérieur de la prothèse vasculaire (Image 5). Lorsque l’orifice coronaire gauche a été réimplanté, on procède de la même manière pour l’artère coronaire droite et l’anastomose est réalisée de la même façon que du côté gauche (Image 6) : ici la suture est réalisée (pour la paroi postérieure) de l’intérieur vers l’extérieur du greffon puis de l’extérieur vers l’intérieur. Une fois les deux anastomoses coronaires réalisées, le greffon est pressurisé à l’aide d’une cardioplégie de sang froid dans la racine aortique et d’un cross-clamp pour le greffon. A ce stade, un peu de colle de fibrine peut être utilisée pour sceller la petite ligne de suture.
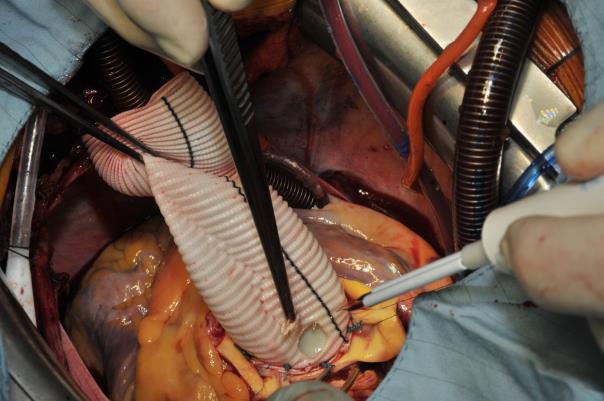
Image 4 : Création du néo-orifice gauche pour rattacher l’artère coronaire gauche, à l’aide d’un cutter thermique.
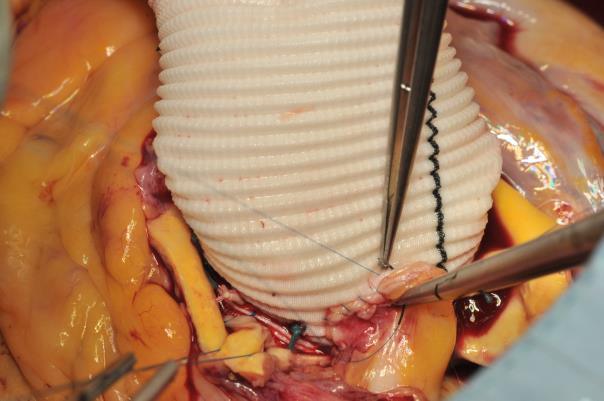
Image 5 : L’ostium coronaire gauche a été rattaché. Je commence l’anastomose au niveau de la paroi postérieure depuis l’intérieur de l’artère coronaire et je suture le greffon depuis l’extérieur. Une fois la moitié de l’anastomose réalisée, l’auteur continue avec l’autre extrémité de la suture et réalise la paroi antérieure de l’extérieur vers l’intérieur de l’artère coronaire et de l’intérieur vers l’extérieur à travers le greffon (le dernier point est démontré sur cette image).
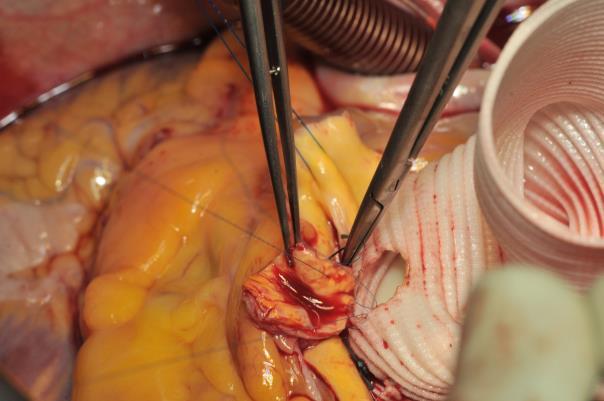
Image 6 : même procédure pour l’artère coronaire droite. L’anastomose pour le chirurgien gaucher est commencée sur la paroi arrière in-out à travers le greffon, puis l’aiguille passée dans le bouton coronaire out-in. Une fois la moitié de l’anastomose réalisée, le travail est poursuivi avec l’autre extrémité de la suture qui est passée à travers le greffon in-out puis à travers l’orifice coronaire.
Avec une mobilisation minimale mais non excessive des artères coronaires, l’implantation directe de ces boutons dans le greffon vasculaire est toujours possible. Dans certains cas très rares mais complexes de réopération, une technique alternative d’implantation des artères coronaires peut être nécessaire, si la mobilisation des boutons peut être dangereuse. Dans ces cas, l’auteur a utilisé la technique classique de Cabrol avec un greffon prothétique de 6 à 8 millimètres pour réimplanter l’artère coronaire correspondante. Plus récemment, l’auteur a préféré l’utilisation d’un court segment de la veine saphène à cette fin. Avant de terminer l’intervention, la prothèse proximale du greffon composite (partie proximale) est anastomosée au segment prothétique provenant de la crosse aortique à l’aide d’une ligne de suture continue Prolene 4,0.
À ce stade, l’aorte ascendante est désaérée à l’aide d’une aiguille et le cross-clamp est retiré. Le patient est toujours en position de Trendelenburg et le désaérage est facilité par l’utilisation d’une insufflation de CO2 dans le champ opératoire (Image 7). Des électrodes épicardiques de stimulateur cardiaque sont placées sur le ventricule et l’oreillette droite et le patient est sevré du pontage cardio-pulmonaire sous stimulation AAI 90/min dès que la température centrale a atteint 35,5 °C.
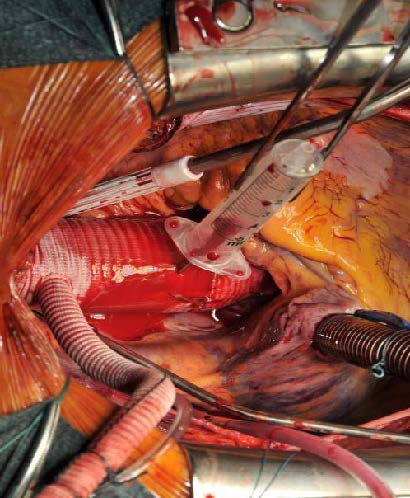
Image 7 : ;Situs peropératoire à la fin de la procédure. La prothèse du greffon composite a été anastomosée avec l’arc proximal – greffon ascendant. Une aiguille est utilisée pour le désaérage. Le patient est en position de Trendelenburg. A gauche le bras latéral anteflow avec la canule artérielle pour le retour de CPB.
Le péricarde est fermé sur la prothèse de greffe, et des drains thoraciques sont mis dans la cavité péricardique et dans l’espace rétrosternal. Le sternum est fermé de façon typique à l’aide de fils. La peau est ensuite fermée par voie intracutanée avec du matériel de suture auto-résorbable. Avant de quitter le bloc opératoire, l’échocardiographie transoesophagienne confirme la qualité de la réparation et vérifie le remplissage du cœur, la fonction de la valve et la contractilité des deux ventricules.
La réparation de la racine aortique à l’aide du greffon composite de remplacement est une technique établie pour les patients chez qui une réparation de la racine épargnant la valve aortique ne convient pas. Le greffon composite est disponible avec le meilleur matériel prothétique disponible sur le marché : les valves bileaflet attachées aux greffons vasculaires qui sont utilisés pour le remplacement aortique isolé (1).
Depuis la description originale par Bentall, de nombreuses modifications de la technique ont été suggérées. La technique contemporaine de réattachement de l’artère coronaire utilisant des anastomoses ouvertes ou boutonnées a été introduite par Nicholas Kouchoukos en 1981 (2). Le perfectionnement des matériaux a considérablement amélioré l’hémostase au niveau du greffon vasculaire et également à la jonction de la manchette de couture de la valve avec la prothèse vasculaire. Par conséquent, la méthode actuelle de greffe composite est la technique ouverte plutôt que la technique d’inclusion du greffon, qui peut encore être recommandée pour les cas les plus complexes (par exemple les réopérations). En cas d’hémostase difficile, un patch péricardique peut être utilisé pour inclure le greffon (la ligne de suture passe de l’artère pulmonaire, au bord supérieur libre du ventricule droit, et du côté droit à la veine cave supérieure). S’il y a une tension sous le patch en raison d’un saignement persistant, l’espace sous le patch peut être dérivé dans l’oreillette droite à l’aide d’un greffon de petit calibre comme une modification de la technique décrite par Cabrol. Avec les améliorations d’aujourd’hui, ceci est extrêmement rare.
L’expérience du remplacement de greffon composite dans l’institution de l’auteur représente environ 80 cas par an avec des pathologies différentes (3). Dans le cadre d’une intervention élective, la mortalité hospitalière a été comparable à celle du remplacement valvulaire aortique isolé et se situe autour de 1,5 à 2,5%. Le risque péri-opératoire est augmenté en cas de dissection aortique mais la réparation radicale de la racine aortique prévient les ré-opérations ultérieures.
Le fait que l’opération soit réalisée par un chirurgien gaucher n’augmentera pas le risque péri-opératoire (4). Dans son rapport sur les chirurgiens gauchers, Adsumilli a révélé les perceptions des chirurgiens gauchers en matière d’adaptation à un monde de droitiers (5). Personnellement, l’auteur ne s’attend pas à ce que les chirurgiens gauchers doivent s’adapter aux techniques décrites par des mentors droitiers. Un mentorat précoce lié à la latéralité à l’école de médecine et pendant l’internat en chirurgie avec la fourniture d’instruments pour gauchers peut réduire les inconvénients que les chirurgiens gauchers peuvent rencontrer pendant l’apprentissage. Cependant, l’auteur a constaté que certaines situations étaient facilitées par le fait d’être gaucher, par exemple la construction de l’anastomose distale sur l’arc ouvert, ainsi que le rattachement de l’artère coronaire gauche à la partie vasculaire du greffon composite.
- Turina M. Remplacement par greffe composite de la racine aortique par la technique du bouton. Manuel multimédia Cardio-thorac Surg 2003, doi : 10.1510/MMCTS.2003.000001.
- Kouchoukos NT, Karp RB. Résection d’un anévrisme de l’aorte ascendante et remplacement de la valve aortique. J Thorac Cardiovasc Surg. 1981;81:142-3.
- Paterick TE, Ammar KA, Jan MF, Loberg R, Buch M, Khandheria BK, Tajik AJ. Aortopathies : étiologies, génétique, diagnostic différentiel, pronostic et prise en charge. Am J Med 2013;126:670-8.
- Bann S, Darzi A. Sélection des individus pour la formation en chirurgie, Am J Surg 2005;190:98.102.
- Adusumilli PS, Kell C, Chang JH, Tuorto S, Leitman IM. Left-handed Surgeons : Are They Left Out ? Current Surgery 2004;61:587-91
.
Laisser un commentaire