Réactions sur le carbone « benzylique » : bromation et oxydation
On octobre 12, 2021 by adminLe carbone adjacent à un cycle aromatique – le carbone « benzylique » – peut participer à plusieurs réactions utiles et intéressantes. Aujourd’hui, nous allons fournir des exemples et des mécanismes pour deux exemples clés : la bromation benzylique et l’oxydation benzylique. Voici le résumé rapide :
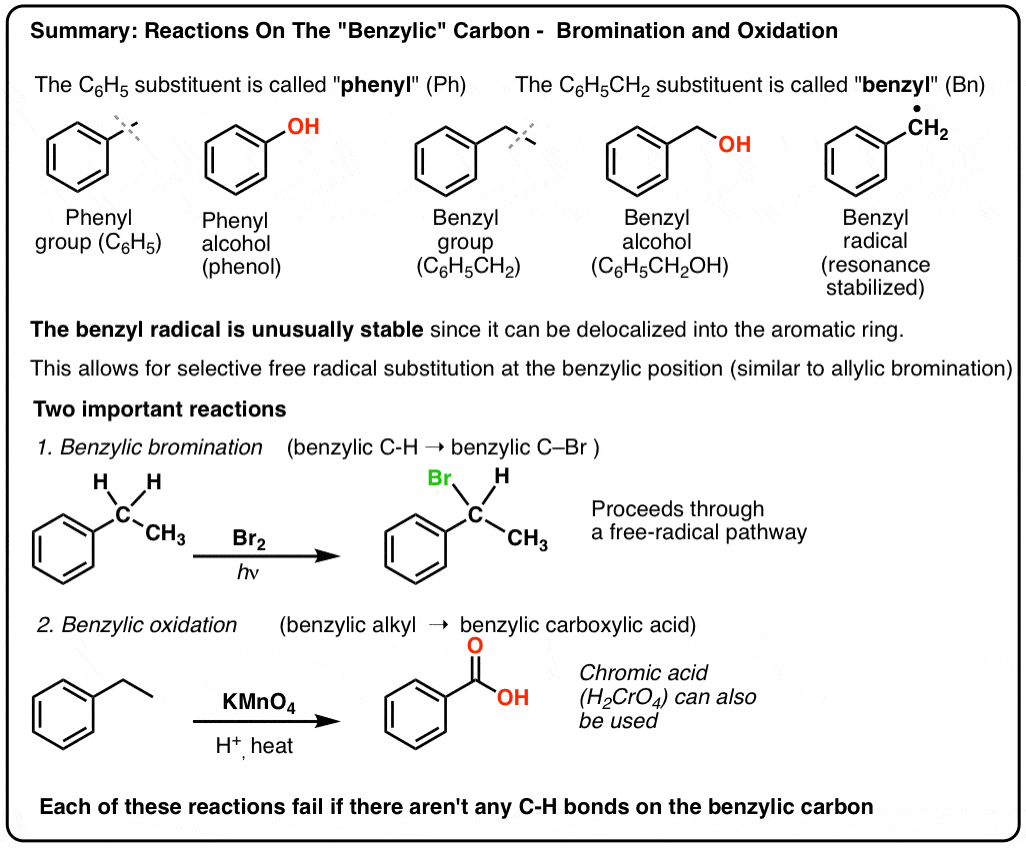
Table des matières
- Groupes alkyles = « Roughage »
- Il y a quelque chose de spécial à propos des groupes alkyles adjacents à un cycle benzénique
- « Phényle » vs « Benzyle » : Quelle est la différence ?
- Les radicaux benzyle sont stabilisés par résonance ; les radicaux phényle ne le sont pas.
- Les liaisons C-H benzyliques (et allyliques) sont faibles, par rapport aux autres liaisons C-H alkyliques
- Bromation benzylique
- Quand la « bromation benzylique » ne fonctionne PAS ?
- Applications de la bromation benzylique
- Oxydation benzylique avec KMnO4 (ou H2CrO4)
- L’oxydation benzylique nécessite une liaison C-H benzylique
- Pourquoi est-ce important ?
- Notes
- Quiz yourself!
- (Advanced) Références et lectures complémentaires
Groupes alkyle = « Roughage »
En nutrition, le « roughage » est ce que vous appelez toute la cellulose et les fibres présentes dans les aliments qui passent juste à travers votre corps sans être réellement digérés.
Cela décrit assez bien le comportement des groupes alkyle dans la grande majorité des réactions de chimie organique que nous avons apprises. Leur chimie est « ennuyeuse ». Ils peuvent comprendre le squelette et la structure globale de la molécule, mais leurs liaisons C-H sont inertes dans la plupart des conditions de réaction.
En fait, si vous ne comptez pas la combustion, à peu près la seule réaction des groupes alkyle que nous couvrons dans l’introduction à la chimie organique est la substitution radicalaire. Et même cette réaction a tendance à être assez peu sélective, en particulier si vous avez affaire à la chloration radicalaire.
Nous avons vu qu’une exception à ce comportement « ennuyeux » peut être trouvée dans la bromation radicalaire des liaisons C-H dites « allyliques » . La position « allylique » est un carbone qui est adjacent à une double liaison (pas un C-H sur la double liaison elle-même ! c’est un C-H « vinylique »).
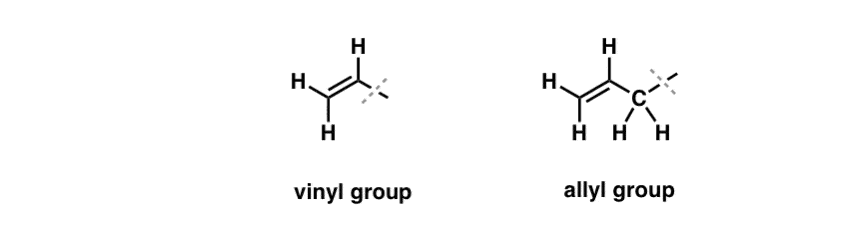
Qu’est-ce qui rend la position « allylique » si spéciale ? Les radicaux, carbocations et anions allyliques sont considérablement stabilisés par résonance. L’orbitale du radical allylique, de la carbocation ou de l’anion peut s’aligner avec les orbitales p de la liaison pi adjacente, ce qui donne un « système pi » plus grand et répartit la charge sur une plus grande surface.
Il y a quelque chose de spécial à propos des groupes alkyles adjacents à un cycle benzénique
Quelle est la raison de ce petit voyage dans le passé ? Eh bien, nous avons récemment passé un petit moment à revoir la réaction d’alkylation de Friedel-Crafts, et je ne veux pas vous donner l’impression que mettre un groupe alkyle sur un cycle benzénique est une impasse synthétique.
Les groupes alkyles n’ont pas besoin d’être inertes ! Comme les carbones allyliques, les groupes alkyle qui sont adjacents aux cycles benzéniques sont particulièrement réactifs, et cela peut avoir toutes sortes d’applications importantes.
Il y a deux réactions importantes que nous couvrirons dans ce post :
- Bromation benzylique – bromation radicalaire du groupe alkyle adjacent à un cycle aromatique
- Oxydation benzylique – oxydation complète d’un groupe alkyle adjacent au benzène en un acide carboxylique.
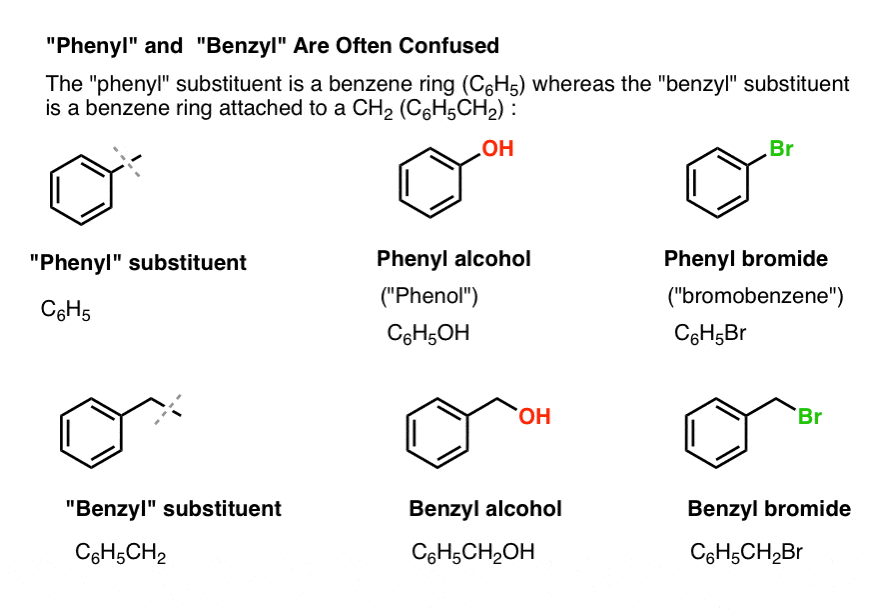
3. « Phényle » vs « Benzyle » : Quelle est la différence ?
D’abord, un ordre du jour rapide. Débarrassons-nous de quelques nomenclatures importantes, car « phényle » et « benzyle » provoquent beaucoup de confusion :
- Un groupe phényle (ou substituant phényle) est du benzène moins un hydrogène : C6H5 . Les carbones du cycle sont des carbones phényles, et les hydrogènes attachés aux carbones phényles sont des liaisons C-H phényles. C’est analogue au vinyle (voir ci-dessus).
- Un groupe benzyle est du méthylbenzène moins un hydrogène : C6H5CH2 . Le carbone adjacent au cycle est le carbone benzylique, et les hydrogènes attachés au carbone benzylique sont appelés hydrogènes benzyliques. C’est un analogue de l’allyle (ci-dessus).
4. Les radicaux benzyle sont stabilisés par résonance ; les radicaux phényle ne le sont pas.
L’analogie du phényle avec le vinyle et du benzyle avec l’allyle s’étend également à la stabilité de leurs radicaux (ainsi que de leurs carbocations et anions).
- Les radicaux phényles ne sont pas stabilisés par résonance, car l’orbitale contenant le radical est à angle droit avec les orbitales du système pi, et il n’y a pas de chevauchement entre elles. Les radicaux sur les carbones hybridés sp2 sont généralement moins stables que les radicaux sur les carbones alkyles. (Voir post : trois facteurs qui déstabilisent les radicaux libres )
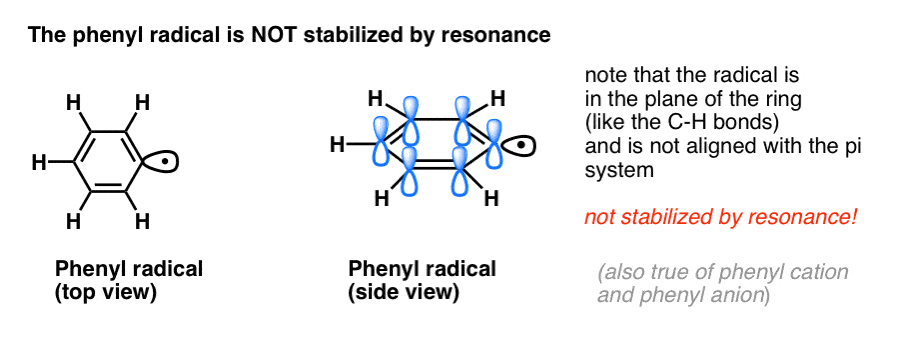
- Les radicaux benzéniques sont exceptionnellement stables car l’orbitale contenant le radical peut s’aligner avec le système pi du cycle benzénique, tout comme chez leurs cousins allyliques (ceci est également vrai pour les cations et anions benzéniques).
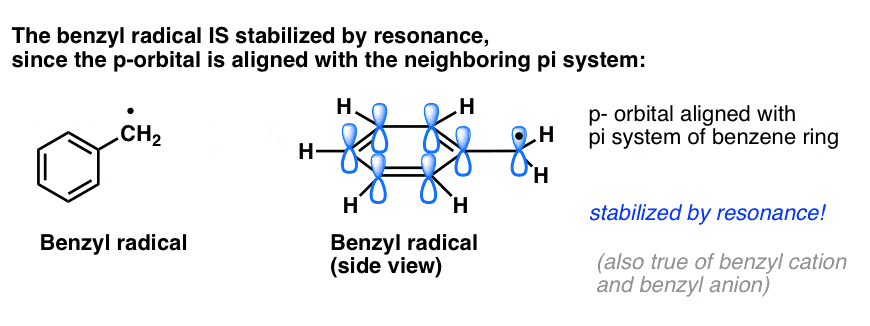
Les liaisons C-H benzyliques (et allyliques) sont faibles, par rapport aux autres liaisons C-H alkyliques
Les liaisons C-H benzyliques ont des forces de liaison (alias BDE, ou énergies de dissociation des liaisons) d’environ 90 kcal/mol, ce qui est considérablement plus faible que les liaisons C-H tertiaires (force de liaison 93 kcal/mol) C-H secondaires (96 kcal/mol) et C-H primaires (100 kcal/mol). (Les liaisons C-H phényliques sont d’environ 113 kcal/mol, reflétant à nouveau l’instabilité des radicaux phényles ).
Puisque les énergies de dissocation des liaisons reflètent la facilité de clivage homolytique de la liaison C-H (c’est-à-dire la facilité de dissocier la liaison en deux radicaux libres), c’est une autre façon de dire que les radicaux benzyliques sont particulièrement faciles à former, par rapport aux autres radicaux alkyles.
Nous avons vu précédemment qu’il en est de même pour les liaisons C-H allyliques . Dans la « bromination allylique », l’une des liaisons C-H sur le groupe alkyle adjacent à une double liaison est convertie en une liaison C-Br, en utilisant le N-bromosuccinimide (NBS) et la lumière (hν) :
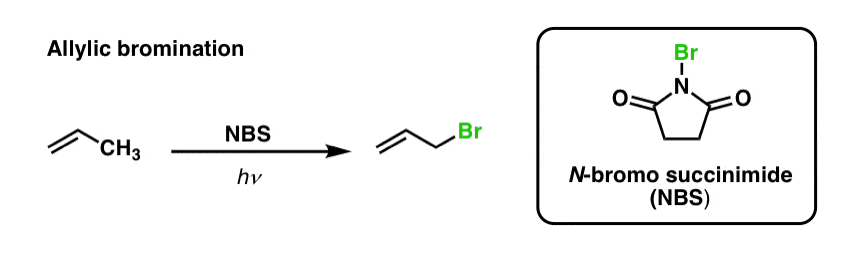
La réaction est sélective pour les C-H allyliques en présence de liaisons C-H primaires, secondaires et tertiaires en raison de la plus faible force de la liaison C-H allylique (89 kcal/mol).
Bromation benzylique
Un procédé similaire fonctionne pour les carbones « benzyliques ». On peut utiliser le NBS (comme ci-dessus) ou simplement Br2, puisque les cycles aromatiques ne sont pas aussi réactifs avec Br2 que les doubles liaisons.
Une fois formé (par la « chaleur » ou la « lumière », qui initie la réaction par dissociation homolytique de Br-Br), le radical brome, Br- peut briser les liaisons C-H benzyliques plus faibles sans toucher les liaisons C-H alkyliques plus fortes.
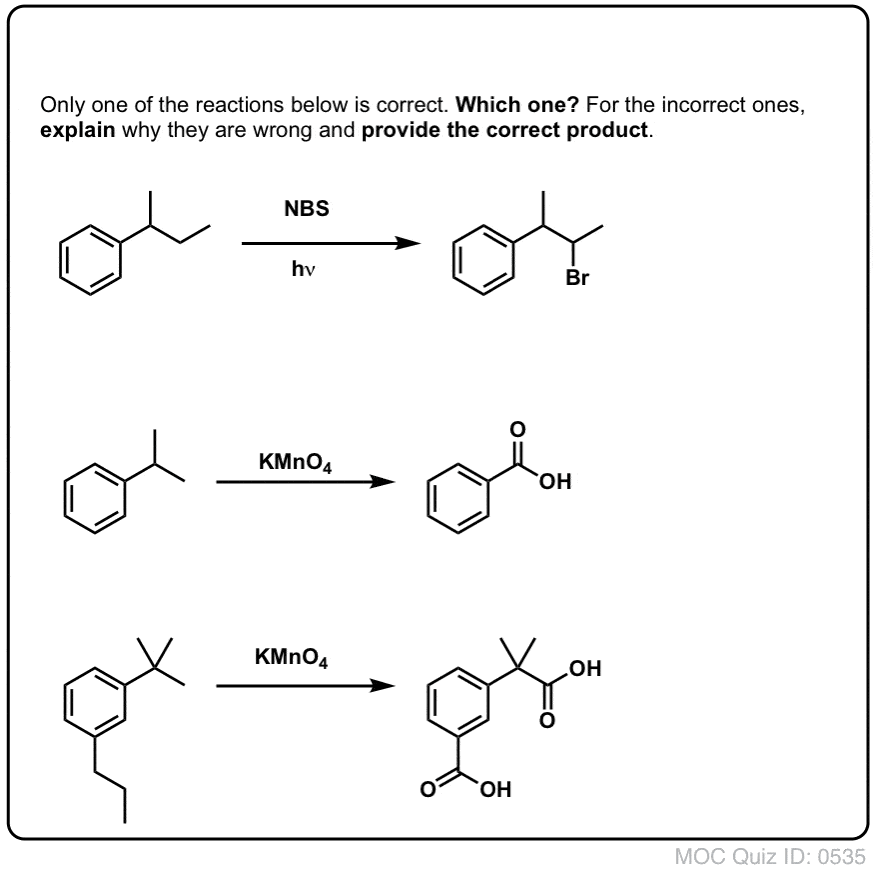
Par exemple, voici les produits de sa réaction avec le toluène, et aussi l’isopropylbenzène. Notez que SEUL le carbone benzylique est bromé. Tout le reste est laissé tranquille!
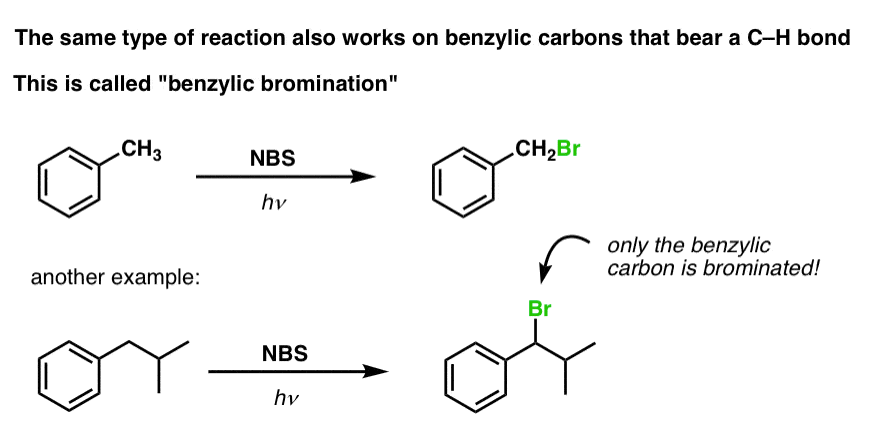
Le mécanisme de la bromation benzylique est essentiellement identique à la bromation allylique, avec des étapes d’initiation, de propagation et de terminaison. (Cliquez ici pour voir une image pop-up du mécanisme.)
(Pour plus de discussion, voir ce post : Bromation allylique )
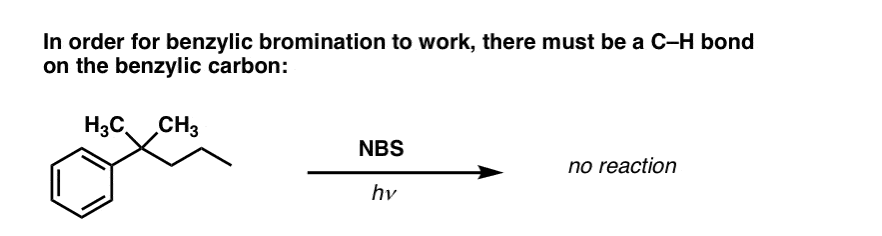
Quand la « bromation benzylique » ne fonctionne PAS ?
Puisque la clé de cette réaction est la formation du radical benzylique (relativement stable), la bromation benzylique échouera sur des substrats où la génération de ce radical via la rupture d’une liaison C-H est impossible.
Par exemple, regardez l’exemple ci-dessous. Comment est-il possible de générer un radical benzylique lorsque le carbone benzylique a trois groupes alkyle attachés ? Ce n’est pas possible – et la réaction échoue.
Applications de la bromation benzylique
Alors, pourquoi la bromation benzylique pourrait-elle être utile ?
Eh bien, elle nous permet d’employer toutes les réactions des halogénures d’alkyle que nous avons couvertes dans l’Org 1 – principalement la substitution et l’élimination – pour fournir des produits qui seraient difficiles à installer directement sur un cycle aromatique par des réactions de Friedel-Crafts.
Par exemple, peut utiliser la bromation benzylique pour mettre en place une réaction SN2, par exemple après une alkylation de Friedel-Crafts :
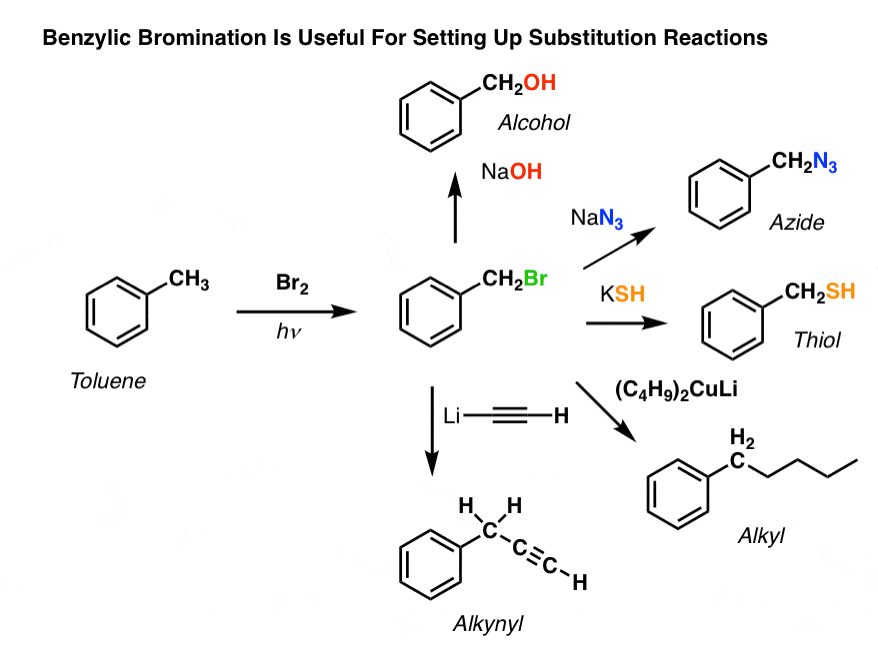
Vous voyez comment l’installation d’un bon groupe partant en position benzylique nous donne toutes sortes d’options pour installer divers groupes fonctionnels ?
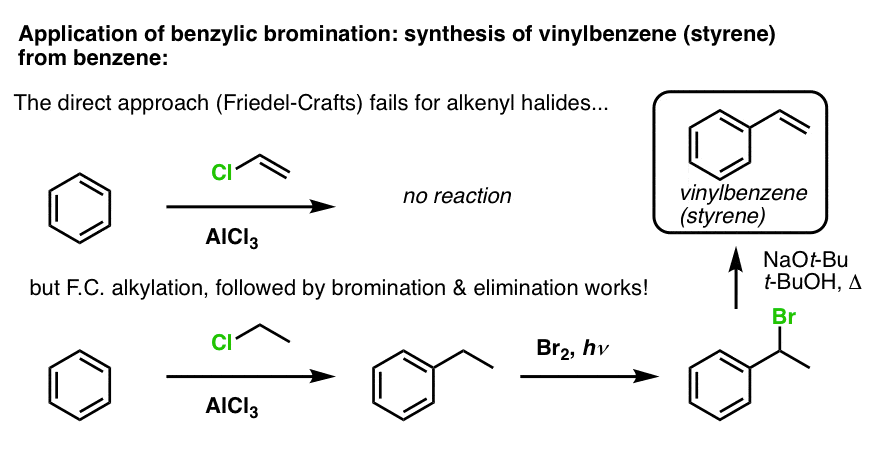
Un autre exemple est la synthèse du styrène à partir du benzène. A première vue, l’approche la plus directe pourrait sembler être la réaction de Friedel-Crafts du chlorure de vinyle avec le benzène. Mais la réaction de Friedel-Crafts ne fonctionne pas pour les halogénures d’alcényle (alias halogénures de vinyle) ! (Les carbocations vinyliques sont moins stables que les carbocations alkyliques).
Nous pouvons contourner ce barrage routier en effectuant une alkylation de Friedel-Crafts avec du chlorure d’éthyle, suivie d’une bromation benzylique puis d’une élimination (via E2, avec quelque chose comme NaOtBu/t-BuOH) pour donner l’alcène :
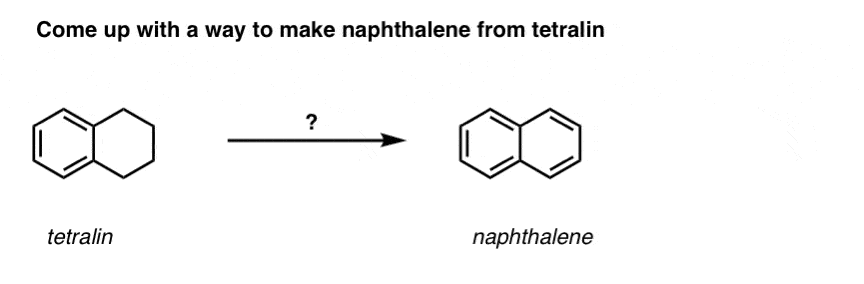
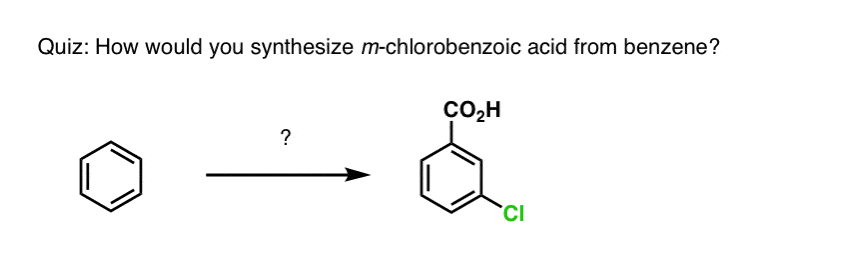
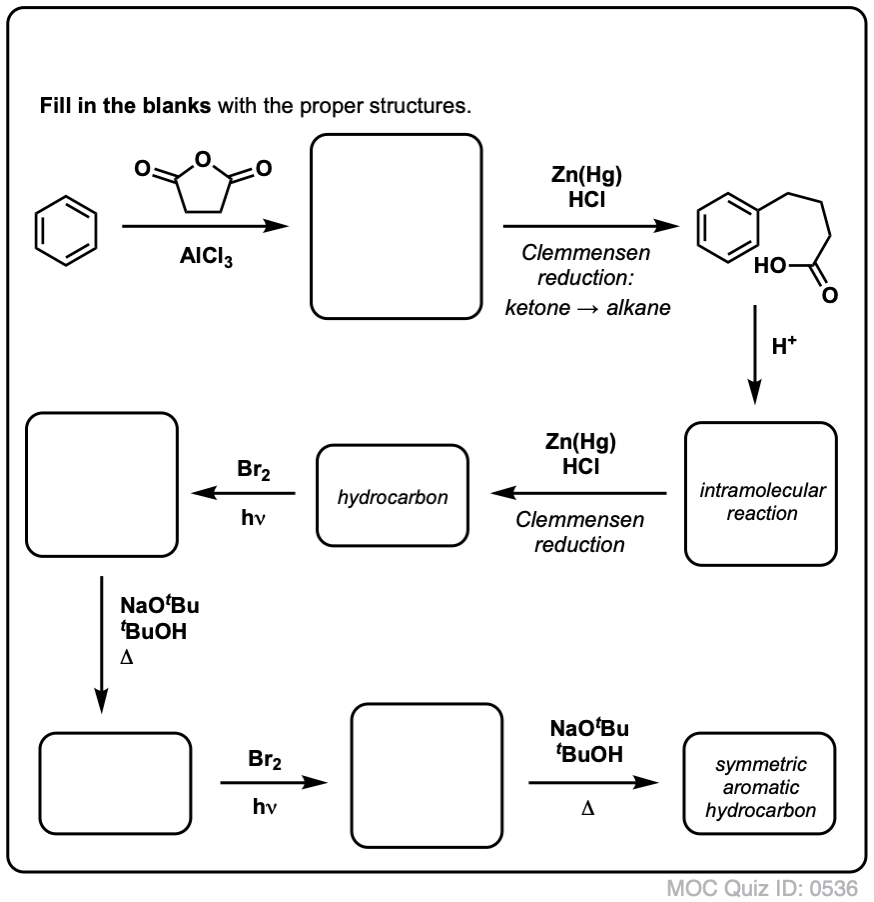
Sur la base de ce qui précède, voici un petit quiz pour vous. Comment pourriez-vous transformer la tétraline (ci-dessous à gauche) en naphtalène (ci-dessous à droite) ? Réponse dans les notes de bas de page.
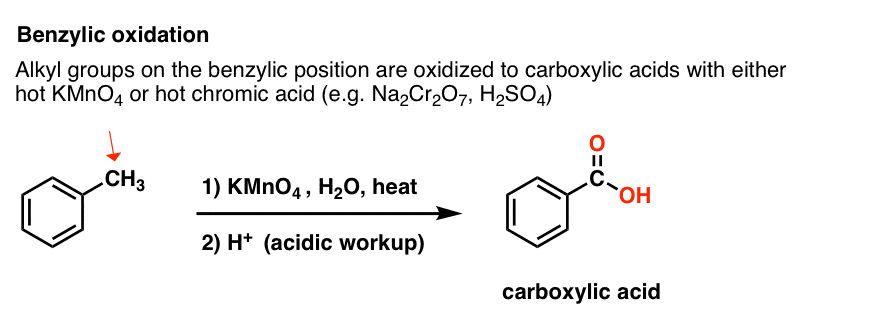
9. Oxydation benzylique Avec KMnO4 (ou H2CrO4)
Puisque la liaison C-H benzylique est relativement faible, on peut à juste titre se demander si d’autres types de réactions (outre la bromation) peuvent être réalisées à cette position.
Elles le peuvent certainement ! Un excellent exemple est l’oxydation benzylique – où une liaison C-H benzylique est rompue et une liaison C-O benzylique est formée.
Maintenant : il existe des réactifs assez doux pour l’oxydation benzylique qui sont l’équivalent chimique de chatouiller la liaison C-H avec une plume, résultant en un aldéhyde ou une cétone benzylique….
Ce n’est pas le type d’oxydation benzylique qui est couvert dans un cours typique d’introduction à la chimie organique !
Au contraire, le principal réactif pour l’oxydation benzylique qui est couvert dans la plupart des manuels d’introduction est le permanganate de potassium chaud (KMnO4). L’acide chromique chaud (H2CrO4, qui est formé en combinant un sel de bichromate comme Na2Cr2O7 avec un acide fort comme H2SO4) peut également être utilisé à ces fins.
Le KMnO4 n’est pas subtil. KMnO4 n’est pas doux. KMnO4 n’est pas gentil.
Une solution de KMnO4 chaude est comme un sac plein de piranhas en colère qui arracheront toute la chair de votre molécule et ne laisseront que les os derrière eux. (En y pensant, c’est un peu comme votre foie ! )
Le KMnO4 chaud brisera chaque liaison C-H benzylique et la convertira en une liaison C-O. A partir du toluène, par exemple, le produit est l’acide benzoïque (un acide carboxylique).
Mais il ne casse pas seulement les liaisons C-H benzyliques. Oh non. Il s’attaque aussi aux liaisons C-C ; du moins celles qui ne sont pas directement attachées à un cycle phényle. Par exemple, le para-diéthylbenzène est transformé en acide para-benzène-dicarboxylique.
Notez que la liaison C-C de l’alkyle doit être clivée pour que cette oxydation ait lieu ! (il est probablement oxydé jusqu’au gaz CO2).
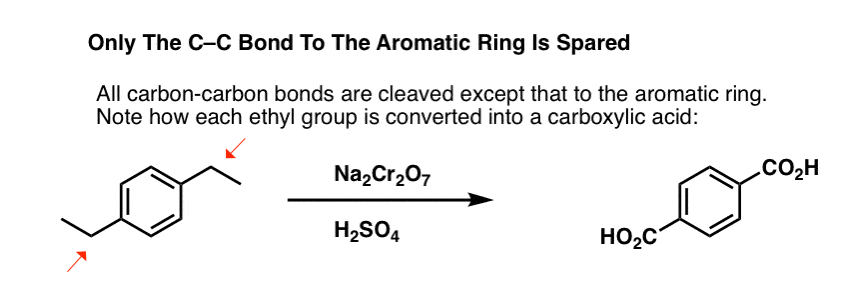
Une variation intéressante se fait sur une molécule cyclique comme la tétraline ; le résultat est l’acide dicarboxylique.
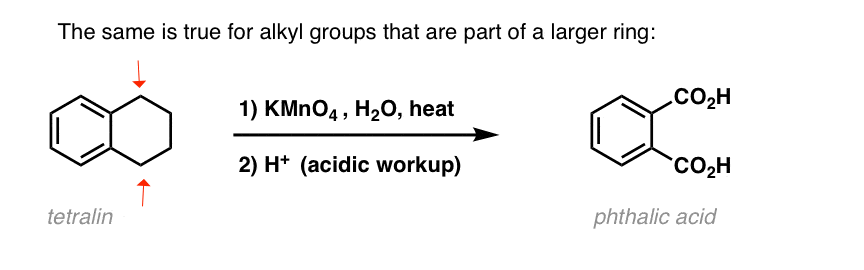
cet acide dicarboxylique est appelé acide phtalique.
10. L’oxydation benzylique nécessite une liaison C-H benzylique
Comme pour la bromation benzylique, aucune réaction ne se produit s’il n’y a pas de liaison C-H sur la position benzylique. Par exemple, la réaction échoue complètement avec le t-butylbenzène :
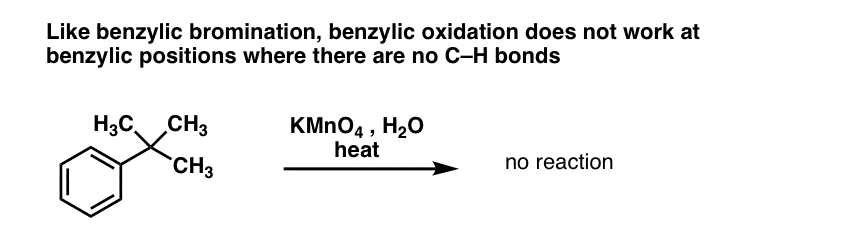
Le mécanisme complet de l’oxydation benzylique est trop complexe, long et incertain pour être montré ici, mais la première étape est presque certainement le clivage homolytique de la liaison C-H par le Mn=O pour former le radical benzylique.
Pourquoi est-ce important ?
L’oxydation benzylique avec KMnO4 est une réaction brutale, mais elle peut avoir ses utilités. Elle fonctionne mieux avec des molécules simples qui n’ont pas de groupes fonctionnels délicats et qui peuvent supporter un traitement très rude.
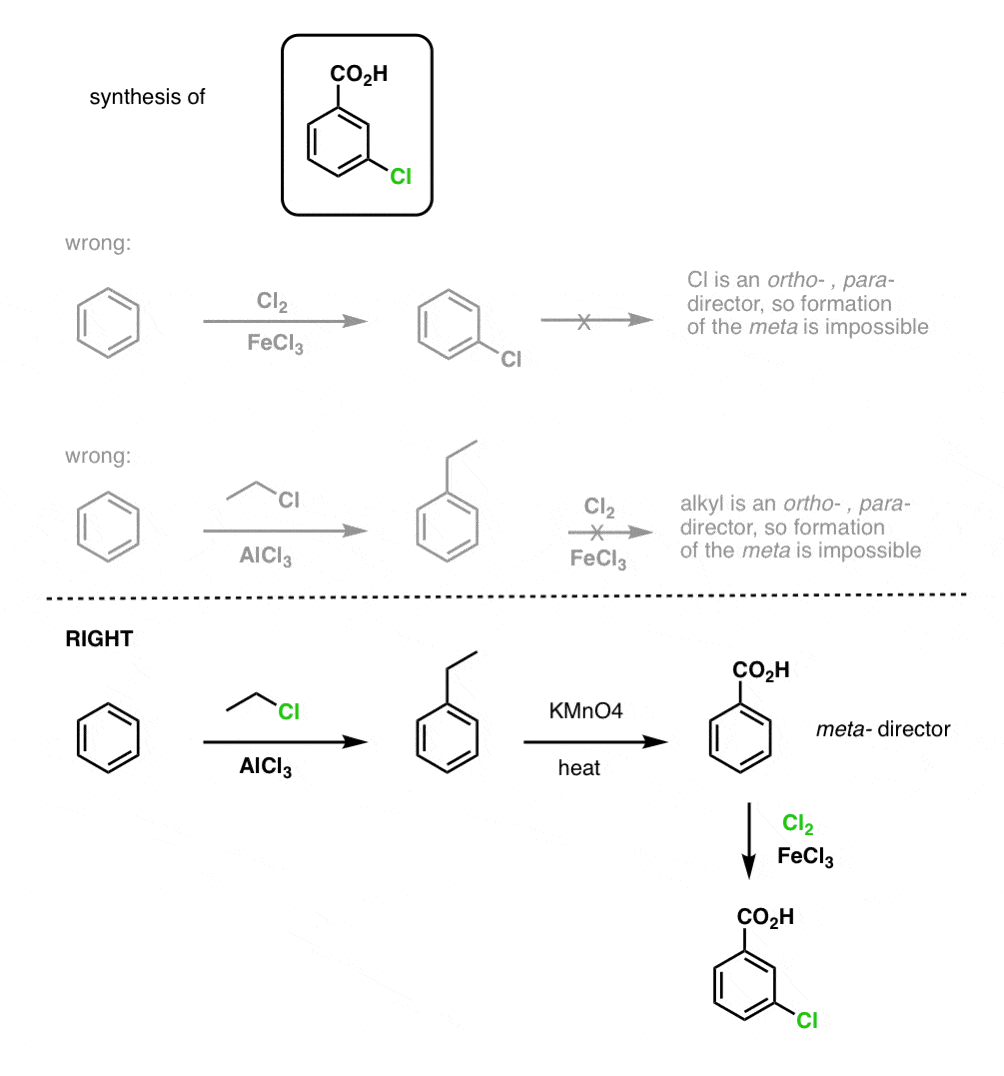
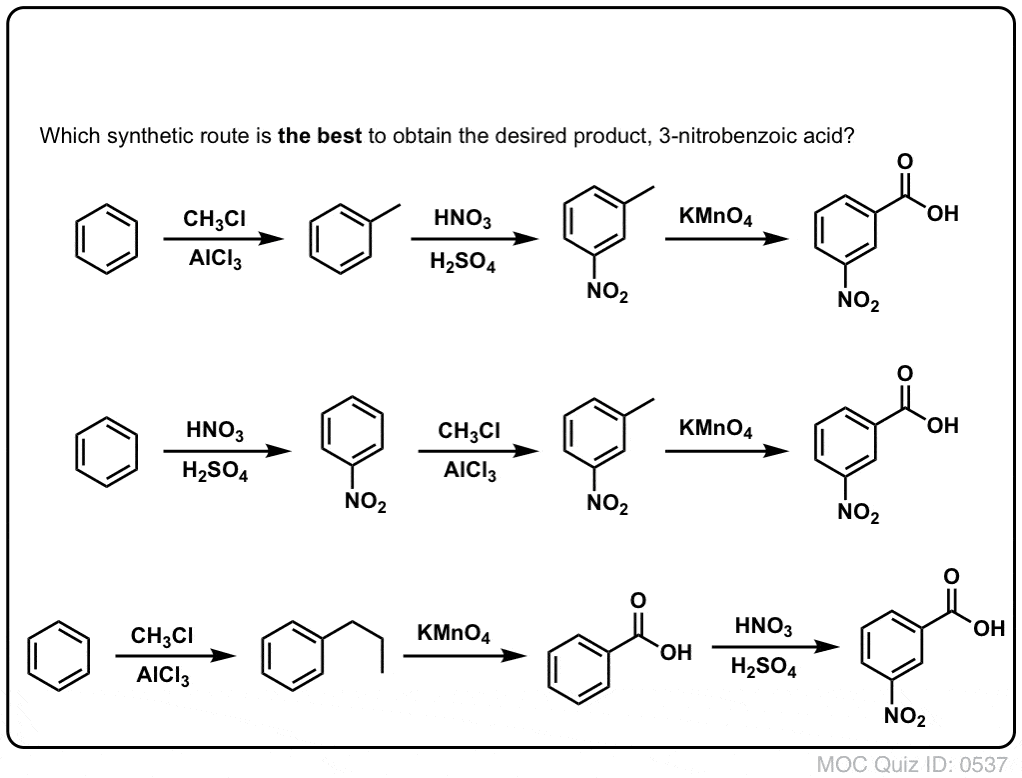
La première chose à noter est que les acides carboxyliques ne peuvent pas être placés directement sur un cycle benzénique via l’acylation de Friedel-Crafts, donc l’alkylation suivie de l’oxydation est une solution de rechange utile.
La deuxième fonction utile en synthèse est le fait que l’oxydation benzylique convertit un directeur o- p- (un groupe alkyle) en un méta-directeur.
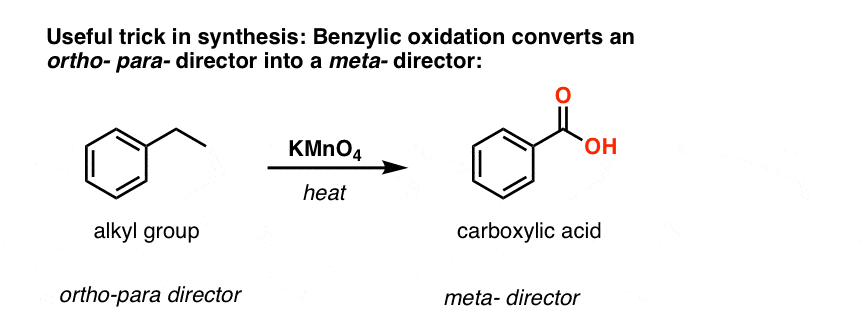
Par exemple, confronté à la synthèse de la molécule suivante, comment procéder ? (indice : elle implique une oxydation benzylique à un moment donné).
Nous aurons beaucoup plus à dire sur la synthèse des composés aromatiques dans quelques posts supplémentaires.
Suivant : Réduction des carbonyles benzyliques – les réductions de Clemmensen et de Wolff-Kishner
Notes
« Chou » peut également être utilisé comme un terme d’argot en chimie pour « tous ces trucs sur la molécule que vous pouvez ignorer en toute sécurité » pour une raison quelconque. Par exemple, la bryostatine est une bête molécule qui semble prometteuse comme agent anticancéreux. Le problème est qu’il faut une tonne d’un bryozoaire rare pour obtenir une quantité décente de bryostatine, ce qui n’est pas suffisant pour un essai clinique sur des humains. Plusieurs groupes ont donc travaillé à la fabrication de « bryologs » plus simples et plus faciles à synthétiser, où ils se débarrassent du « chou » qui n’est pas essentiel à l’activité antitumorale.
Br2 ne réagit généralement pas avec les cycles aromatiques sans un catalyseur acide de Lewis. Cependant, si un groupe activateur fort est présent (comme OH, NR2, etc), une certaine bromation du cycle peut se produire, en particulier à des températures élevées.
Fait amusant : « l’oxydation benzénique » est la réponse à l’énigme de la raison pour laquelle le méthylbenzène (toluène) est loin d’être un cancérigène aussi puissant que le benzène. C’est parce que votre foie possède des enzymes cytochrome p450 (contenant des espèces de fer à haut état d’oxydation) qui peuvent oxyder le groupe CH3 benzylique en acide carboxylique plus soluble dans l’eau, ce qui lui permet d’être éliminé par vos reins.
Cela nécessite deux oxydations et deux éliminations. Une façon prudente de le faire est d’oxyder (c’est-à-dire de bromer) une fois, puis d’éliminer pour donner un alcène. L’alcène pourrait alors être soumis à une nouvelle bromation (en utilisant le NBS, de façon à éviter la bromation de la double liaison) pour donner une autre bromation (produit de bromation benzylique montré ici, mais allylique également réalisable) qui pourrait être traitée avec une base pour donner du naphtalène aromatique.
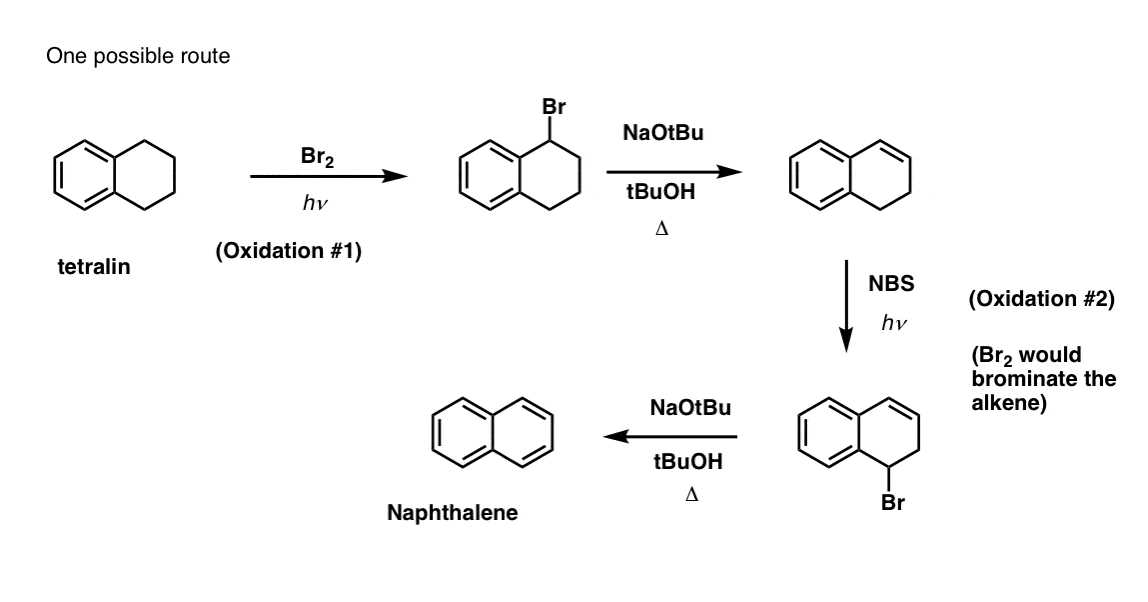
(en pratique, il s’avère que les deux bromations peuvent être faites en même temps en utilisant Br2 à haute température. Un traitement avec une base peut alors donner du naphtalène).
Réponse à la question 2 du quiz.
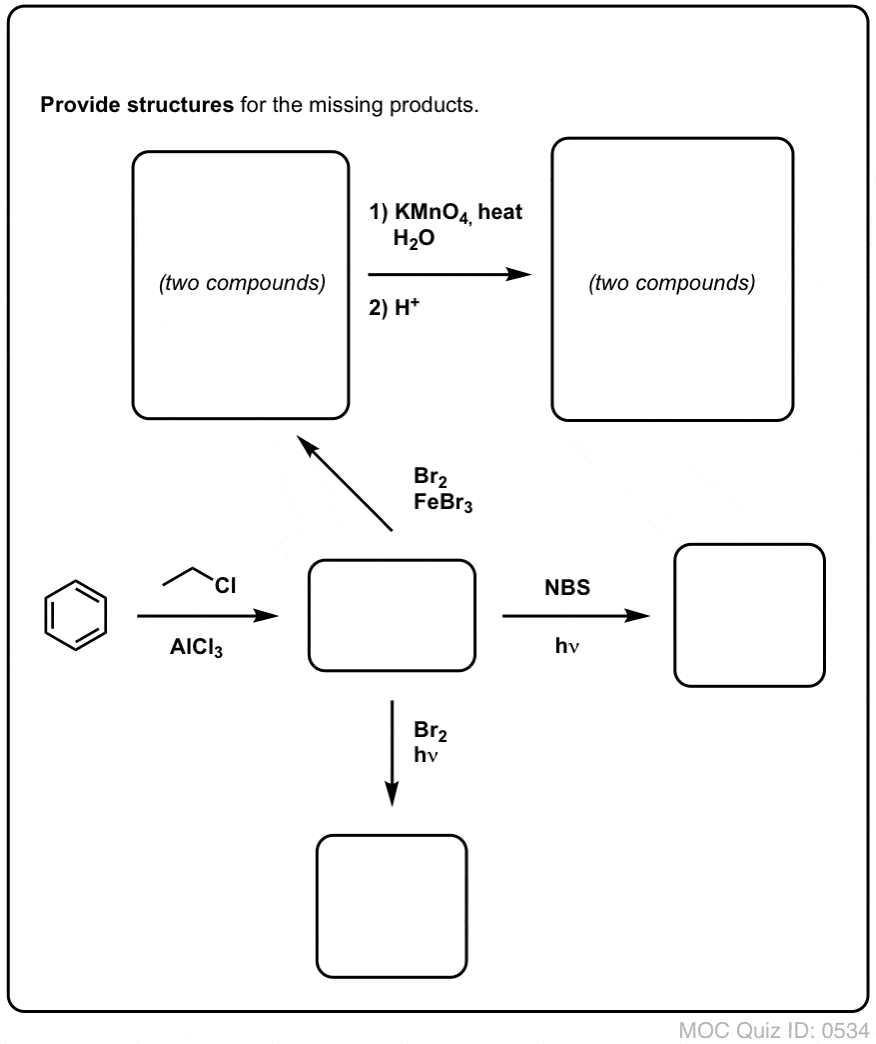
Quiz Yourself !
 Cliquez pour retourner
Cliquez pour retourner 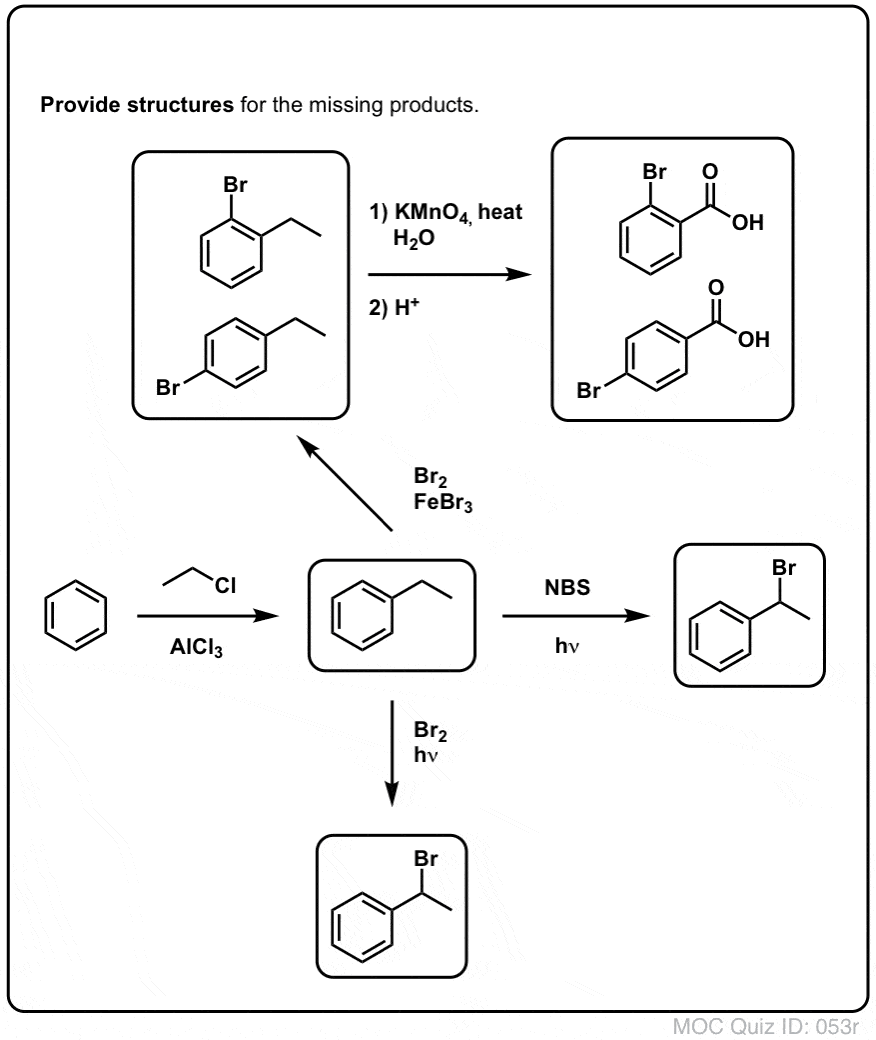
 Cliquez pour retourner
Cliquez pour retourner 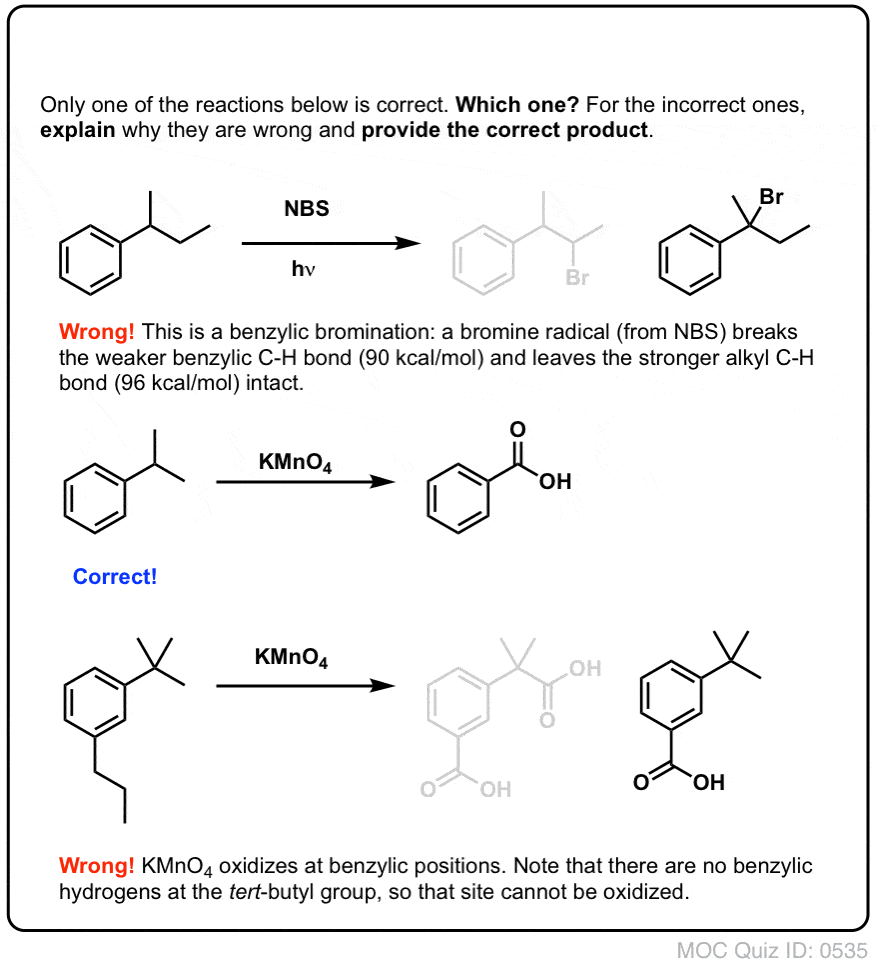
 Cliquer pour retourner
Cliquer pour retourner 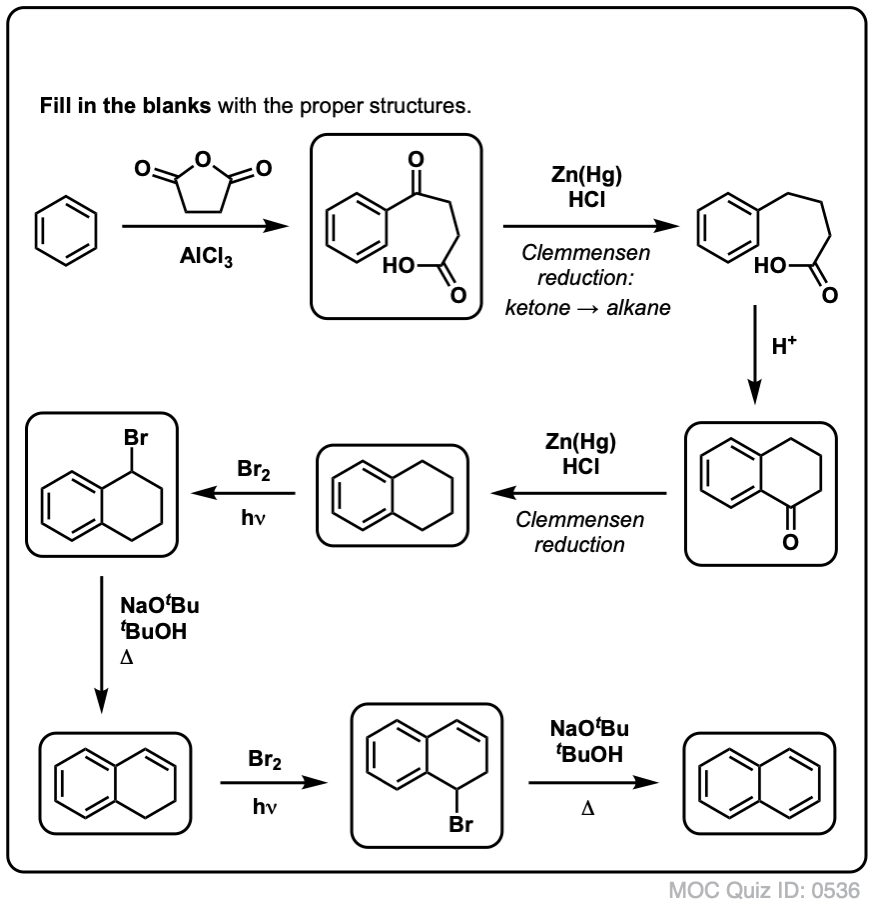
.
 Cliquez pour Flip
Cliquez pour Flip 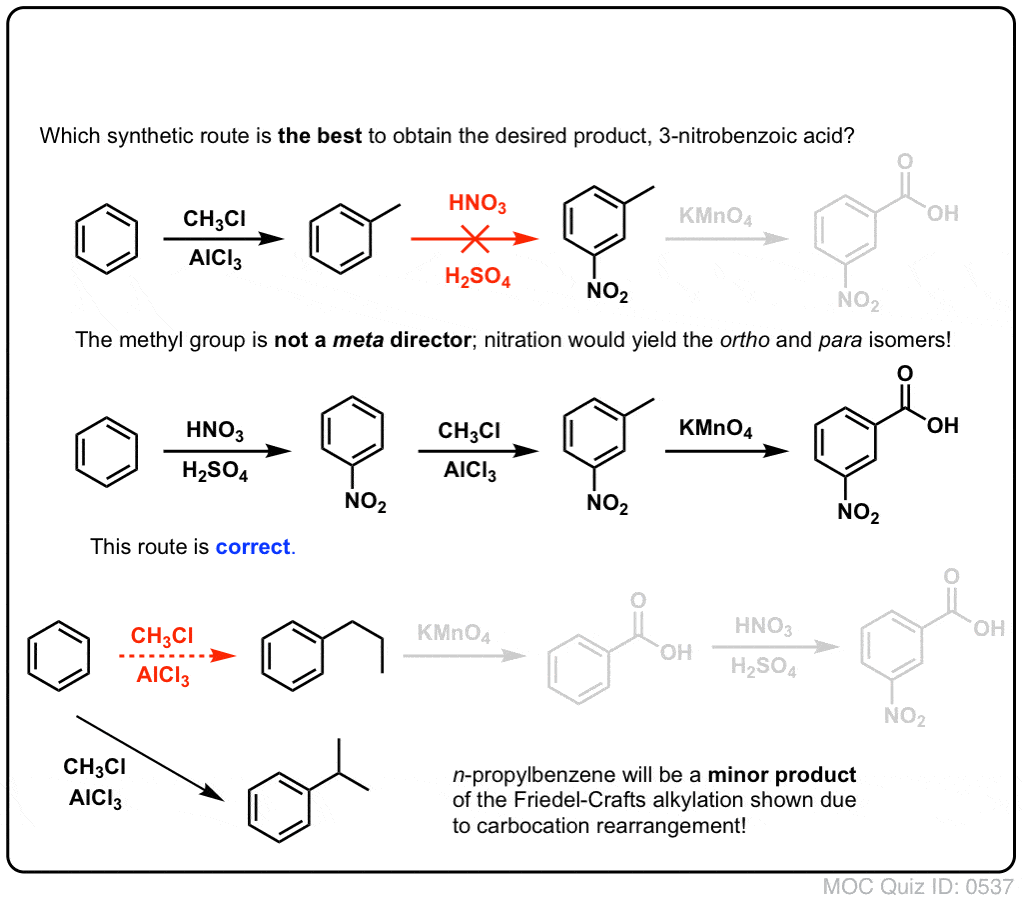
(Advanced) Références et lectures complémentaires
Bromation benzylique :
Cette réaction est également connue sous le nom de réaction de Wohl-Ziegler.
- Bromierung ungesättigter Verbindungen mit N-Brom-acetamid, ein Beitrag zur Lehre vom Verlauf chemischer Vorgänge
Wohl
Chem. Ber. 1919, 52 (1), 51-63
DOI : 10.1002/cber.19190520109 - Die Halogenierung ungesättigter Substanzen in der Allylstellung
Ziegler, A. Späth, E. Schaaf, W. Schumann, E. Winkelmann
Just. Lieb. Ann. Chem. 1942, 551 (1), 80-119
DOI : 10.1002/jlac.19425510103
Les deux premières publications sur cette réaction. Wohl a utilisé le N-bromoacétamide comme agent de bromation, et non le NBS. Ziegler a ensuite réalisé une étude détaillée et a rapporté que le NBS pouvait être utilisé comme agent de bromation pratique pour la bromation allylique. - Dibenzocyclooctène : Synthèse multigrammes d’un ligand bidenté
Géraldine Franck, Marcel Brill, et Günter Helmchen
Org. Synth. 2012, 89, 55-65
DOI : 10.15227/orgsyn.089.0055 - Brominations benzyliques avec le N-Bromosuccinimide dans le (Trifluorométhyl)benzène
Diana Suarez, Gilles Laval, Shang-Min Tu, Dong Jiang, Claire L. Robinson, Richard Scott, Bernard T. Golding
Synthesis 2009 (11) : 1807-1810
DOI : 1055/s-0029-1216793
La référence n°3 présente une bromation benzylique typique utilisant le NBS dans le CCl4, qui a été largement abandonné en raison de préoccupations liées à la toxicité. La référence #4 montre que le PhCF3 peut être utilisé comme solvant à la place du CCl4 pour la bromation benzylique. - Bromations avec le N-Bromosuccinimide et les composés apparentés. La réaction de Wohl-Ziegler.
Carl Djerassi
Chemical Reviews 1948, 43 (2), 271-317
DOI : 10.1021/cr60135a004
Une ancienne revue sur cette réaction par le célèbre chimiste Carl Djerassi, dont la contribution majeure à la santé mondiale a été le développement de la noréthindrone – le premier contraceptif féminin. - N-Bromosuccinimide. III. Parcours stéréochimique de la bromation benzylique
H. J. Dauben Jr. et Layton L. McCoy
Journal of the American Chemical Society 1959, 81 (20), 5404-5409
DOI : 10.1021/ja01529a038
Une étude mécaniste sur la stéréochimie de la bromation benzylique. En observant la formation de bromures benzyliques racémiques à partir de substrats prochiraux, l’intermédiation des radicaux dans cette réaction est encore renforcée.Les mêmes références de la bromation allylique peuvent être repurposées ici: - Mécanismes de la bromation benzylique
Glen A. Russell, Charles. DeBoer, et Kathleen M. Desmond
Journal of the American Chemical Society 1963 85 (3), 365-366
DOI : 1021/ja00886a040
La bromation benzylique suit le même mécanisme que la bromation allylique, comme l’explique cet article.Le NBS (N-Bromosuccinimide) est un réactif pratique pour la bromation par radicaux libres, et les articles suivants sont des études mécanistiques impliquant le NBS: - Le mécanisme de la bromation benzylique avec le N-Bromosuccinimide
R. E. Pearson et J. C. Martin
Journal of the American Chemical Society 1963 85 (3), 354-355
DOI : 10.1021/ja00886a029
Ces articles du professeur J. C. Martin (UIUC) ont été rédigés au début de sa carrière, avant qu’il ne réalise les travaux pour lesquels il est le plus connu (études sur les molécules « hypervalentes », y compris le développement du « périodinane de Dess-Martin »). - L’identité de l’espèce porteuse de chaîne dans les bromations avec le N-Bromosuccinimide : sélectivité des N-Bromosuccinimides substitués envers les toluènes substitués
R. E. Pearson et J. C. Martin
Journal of the American Chemical Society 1963, 85 (20), 3142-3146
DOI : 10.1021/ja00903a021 - N-bromosuccinimide. Mécanismes de la bromation allylique et des réactions connexes
J. H. Incremona et James Cullen Martin
Journal of the American Chemical Society 1970, 92 (3), 627-634
DOI : 10.1021/ja00706a034 - Radical succinimidyle comme porteur de chaîne. Mécanisme de bromation allylique
J. C. Day, M. J. Lindstrom, et P. S. Skell
Journal of the American Chemical Society 1974, 96 (17), 5616-5617
DOI : 10.1021/ja00824a074 - Bromation radicalaire du cyclohexène dans CCl4 par le brome : Addition versus Substitution
D. W. McMillen et John B. Grutzner
The Journal of Organic Chemistry 1994, 59 (16), 4516-4528
DOI : 10.1021/jo00095a029
Cet article décrit des études cinétiques minutieuses qui démontrent qu’une faible concentration de Br2 (telle que celle fournie par le NBS impur) favorisera la substitution radicale par rapport à une réaction d’addition polaire. - o-XYLYLENE DIBROMIDE
Emily F. M. Stephenson
Org. Synth. Vol. 34, p.100 (1954)
DOI : 10.15227/orgsyn.034.0100
Un procédé fiable pour la bromation benzylique avec Br2 dans Synthèses organiques. - Bromation de la tétraline. Synthèse courte et efficace du 1,4-Dibromonaphtalène
Osman Çakmak, Ismail Kahveci, Íbrahim Demirtaş, Tuncer Hökelek et Keith Smith
Czech. Chem. Commun. 2000, 65, 1791-1804
DOI : 10.1135/cccc20001791
Synthèse commode du 1,4-dibromonaphtalène à partir de la tétraline, par bromation benzylique.Oxydation benzylique:
Il existe beaucoup de stratégies pour l’oxydation benzylique, notamment l’utilisation de solutions concentrées de KMnO4 ou d’acide chromique. - Etudes cinétiques de l’oxydation des composés aromatiques par le permanganate de potassium. Partie IV. n- et iso-propylbenzène
C. F. Cullis et J. W. Ladbury
J. Chem. Soc. 1955, 4186-4190
DOI : 10.1039/JR9550004186 - DERIVES DE LA PIPERIDINE X. LES PHENYLPIPERIDYLCARBINOLS
Kenneth E. Crook et S. M. McElvain
Journal of the American Chemical Society 1930, 52 (10), 4006-4011
DOI : 1021/ja01373a035
S’il y a un autre substituant sur la position benzylique, alors l’oxydation avec donne une cétone au lieu d’un acide carboxylique. - Oxydations hétérogènes au permanganate. 7. L’oxydation des chaînes latérales aliphatiques
Nazih A. Noureldin, Dongyuan Zhao, et Donald G. Lee
The Journal of Organic Chemistry 1997, 62 (25), 8767-8772
DOI : 1021/jo971168e
Les réactifs peuvent être adsorbés sur des supports solides pour faciliter la conduite des réactions et réduire les déchets. Dans ce cas, en rendant le réactif KMnO4 hétérogène, la réactivité change légèrement, et cela peut être exploité pour certaines oxydations chimiosélectives.Beaucoup d’autres réactifs peuvent être utilisés pour l’oxydation benzylique, voici une sélection: - Oxydation sélective au carbone adjacente aux systèmes aromatiques avec IBX
K. C. Nicolaou, Phil S. Baran, and Yong-Li Zhong
Journal of the American Chemical Society 2001, 123 (13), 3183-3185
DOI : 10.1021/ja004218x
Un article précoce du (maintenant rockstar de la synthèse totale) Prof. Phil Baran (The Scripps Research Institute, La Jolla, CA) alors qu’il était encore un étudiant en doctorat dans le groupe du Prof. Nicolaou. Il utilise IBX (un réactif I(V) hypervalent) pour effectuer des oxydations benzyliques, qui se produisent via un mécanisme radicalaire. Il s’agit d’une réaction utile avec un large éventail de substrats, comme le montrent 25 exemples dans l’article. - Oxydation benzylique directe et sélective des alkylarènes via l’abstraction C-H en utilisant des bromures de métaux alcalins
Katsuhiko Moriyama, Misato Takemura, et Hideo Togo
Organic Letters 2012, 14 (9), 2414-2417
DOI : 10.1021/ol300853z
Ceci utilise Oxone comme oxydant terminal pour l’oxydation benzylique. - Synthèse d’alcools benzyliques par oxydation C-H
Lalita Tanwar, Jonas Börgel, et Tobias Ritter
J. Am. Chem. Soc. 2019, 141, 17983-17988
DOI : 10.1021/jacs.9b09496
Ceci utilise le peroxyde de mésyle comme oxydant pour l’oxydation sélective des positions benzyliques en alcools. Le mésylate de benzyle est formé, qui peut être hydrolysé en alcool. - Oxydation benzylique électrochimique des liaisons C-H
Jason A. Marko, Anthony Durgham, Stacey Lowery Bretz, et Wei Liu
Chem. Commun, 2019, 55, 937-940
DOI : 10.1039/C8CC08768G
L’oxydation benzylique peut également être effectuée par électrochimie. - Réactions d’oxydation allylique et benzylique avec le chlorite de sodium
Samuel M. Silvestre, Jorge A. R. Salvador
Tetrahedron 2007, 63 (11), 2439-2445
DOI : 10.1016/j.tet.2007.01.012
NaClO2 est peu coûteux et peut également être utilisé comme oxydant
.
Laisser un commentaire