Quels sont les deux types d’ions et comment sont-ils différents
On décembre 28, 2021 by adminQuels sont les deux types d’ions et comment sont-ils différents

Ion:
Un ion est un atome (ou un groupe d’atomes) chargé positivement ou négativement. Un ion est formé par la perte ou le gain d’électrons par un atome, il contient donc un nombre inégal d’électrons et de protons.
Exemple : L’ion sodium Na+, l’ion magnésium Mg2+, l’ion chlorure Cl- et l’ion oxyde O2-.
Il existe deux types d’ions :
- cations
- anions.

1. Cation
Un ion chargé positivement est connu sous le nom de cation. Un cation est formé par la perte d’un ou plusieurs électrons par un atome.
Exemple : L’atome de sodium perd 1 électron pour former un ion sodium, Na+, qui est un cation :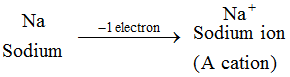 Les ions de tous les éléments métalliques sont des cations.
Les ions de tous les éléments métalliques sont des cations. 2. Anion
2. Anion
Un ion chargé négativement est appelé anion. Un anion est formé par le gain d’un ou plusieurs électrons par un atome.
Exemple : Un atome de chlore gagne 1 électron pour former un ion chlorure, Cl-, qui est un anion.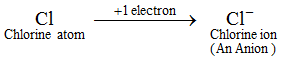 Un anion contient plus d’électrons qu’un atome normal. Un atome normal (ou un atome neutre) contient un nombre égal de protons et d’électrons. Or, comme un anion est formé par l’ajout d’un ou plusieurs électrons à un atome, donc, un anion contient plus d’électrons que de protons. Les ions de tous les éléments non métalliques sont des anions.
Un anion contient plus d’électrons qu’un atome normal. Un atome normal (ou un atome neutre) contient un nombre égal de protons et d’électrons. Or, comme un anion est formé par l’ajout d’un ou plusieurs électrons à un atome, donc, un anion contient plus d’électrons que de protons. Les ions de tous les éléments non métalliques sont des anions. Ions simples
Ions simples
Ces ions qui sont formés à partir d’atomes uniques sont appelés ions simples.
Exemple : L’ion sodium, Na+, est un ion simple car il est formé à partir d’un seul atome de sodium, Na.
Ions composés
Ces ions qui sont formés à partir de groupes d’atomes joints sont appelés ions composés
Exemple : L’ion ammonium NH4+, est un ion composé qui est constitué de deux types d’atomes joints, l’azote et l’hydrogène.
Composés ioniques
Les composés qui sont constitués d’ions sont appelés composés ioniques. Dans un composé ionique, les ions chargés positivement (cations) et les ions chargés négativement (anions) sont maintenus ensemble par les fortes forces d’attraction électrostatiques. Les forces qui maintiennent les ions ensemble dans un composé ionique sont appelées liaisons ioniques ou liaisons électrovalentes. Puisqu’un composé ionique est constitué d’un nombre égal d’ions positifs et d’ions négatifs, la charge globale d’un composé ionique est donc nulle.
Exemple : Le chlorure de sodium (NaCl) est un composé ionique qui est constitué d’un nombre égal d’ions sodium (Na+) chargés positivement et d’ions chlorure (Cl-) chargés négativement.
Certains composés ioniques
|
N°S. |
Nom | Formule |
Ions présents |
|
1 |
Chlorure de sodium | NaCl | Na+ et Cl- |
| 2 | Chlorure de potassium | KCl |
K+ et Cl- |
|
3 |
Chlorure d’ammonium | NH4Cl | NH4+ et Cl- |
|
4 |
Chlorure de magnésium chlorure | MgCl2 | Mg2+ et Cl- |
| 5 | Chlorure de calcium | CaCl2 | Ca2+ et Cl- |
| 6 | Oxyde de magnésium | MgO | Mg2+ et O2- |
| 7 | Oxyde de calcium | CaO | Ca2+ et O2- |
| 8 | Oxyde d’aluminium | Al2O3 | Al3+ et O2- |
| 9 | Hydroxyde de sodium | NaOH | Na+ et OH- |
| 10 | Sulfate de cuivre | CuSO4 | Cu2+ et SO42- |
| 11 | Nitrate de calcium | Ca(NO3)2 |
Ca2+ et NO3- |
.
Laisser un commentaire