Immunologie des cellules T : Les mathématiques de la mémoire
On janvier 20, 2022 by adminLa mémoire immunologique – la capacité de l’organisme à se » souvenir » et à combattre les agents pathogènes précédemment rencontrés – constitue la base de la vaccination, qui est l’une des découvertes les plus importantes de l’histoire de la médecine. Cependant, malgré l’énorme succès de la vaccination, nous ne comprenons toujours pas complètement comment le corps maintient une mémoire immunologique à long terme, et cette lacune dans nos connaissances entrave les tentatives de développement de « vaccins de nouvelle génération » et les efforts de déploiement de cellules immunitaires appelées cellules T contre le cancer.
Le système immunitaire contient de nombreux types de cellules différentes. Certaines de ces cellules peuvent reconnaître des agents pathogènes sans jamais les avoir rencontrés. Cependant, d’autres cellules immunitaires – dont les lymphocytes T – « apprennent sur le tas » : lors de la première rencontre avec un agent pathogène, ces cellules réagissent relativement lentement, mais forment ensuite une « mémoire » pour répondre plus efficacement. Pour mieux comprendre comment la mémoire immunologique à long terme est maintenue, nous devons en savoir plus sur la dynamique des cellules T à mémoire. En particulier, il sera nécessaire de comprendre la contribution relative des processus suivants : le recrutement de nouvelles cellules T (appelées cellules T naïves) dans le pool de cellules T à mémoire ; le renouvellement des cellules T à mémoire par division cellulaire ; et la survie des cellules T à mémoire individuelles. Cependant, la quantification de ces processus est un défi.
Des recherches antérieures utilisant des données de patients atteints de cancer ont indiqué que les cellules T à mémoire ont une durée de vie relativement courte (Michie et al., 1992). Puis, il y a près de 20 ans, les techniques de marquage de l’ADN ont conduit à une percée dans l’étude de la dynamique des cellules T en permettant aux chercheurs de suivre la vitesse à laquelle les cellules T se divisent et meurent (Hellerstein et al., 1999). Ces méthodes ont ensuite été utilisées pour confirmer que les cellules T à mémoire vivent six mois ou moins chez les humains en bonne santé (Westera et al., 2013), alors que les cellules T naïves peuvent vivre jusqu’à neuf ans (Vrisekoop et al., 2008). Ainsi, une longue durée de vie n’est pas une caractéristique essentielle des cellules T à mémoire. Au contraire, la mémoire immunologique, qui peut durer toute une vie (Crotty et Ahmed, 2004), est maintenue par des cellules à durée de vie relativement courte. Cependant, on ne sait toujours pas dans quelle mesure le pool de cellules T à mémoire est maintenu par la division des cellules T à mémoire existantes ou par le recrutement de cellules T naïves dans le pool. On pense que ce dernier processus ne joue qu’un rôle mineur car les cellules T naïves sont très variables, et la probabilité qu’une cellule T naïve donnée entre dans le pool de cellules T à mémoire est donc extrêmement faible.
A présent, dans eLife, des immunologistes de l’Université de Glasgow, de l’Icahn School of Medicine at Mount Sinai et du Royal Free Hospital – Graeme Gossel, Thea Hogan, Daniel Cownden, Benedict Seddon et Andrew Yates – rapportent comment ils ont utilisé deux approches indépendantes pour étudier comment la mémoire des cellules T est maintenue (Gossel et al, 2017). Dans une technique appelée « cartographie du destin temporel », Gossel et al. ont utilisé le busulfan, un médicament anticancéreux, pour tuer les cellules souches hématopoïétiques (c’est-à-dire les cellules souches qui vont devenir des cellules sanguines comme les cellules T) dans la moelle osseuse des souris, tout en laissant intact leur pool de cellules T périphériques. Ils ont ensuite transplanté des cellules de moelle osseuse de souris donneuses, qui ont mûri en cellules T qui ne diffèrent que par un seul marqueur protéique (CD45) exprimé à leur surface. Ainsi, chez ces souris, les chercheurs ont pu distinguer les cellules T nouvellement formées des cellules T originales, et suivre quelles cellules étaient remplacées et mesurer leur dynamique (figure 1A).
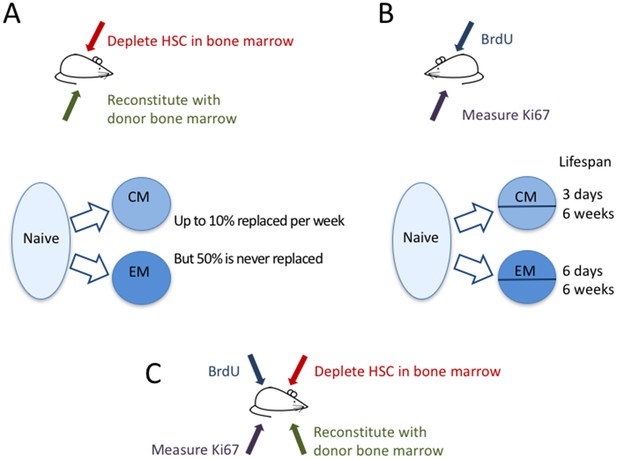
La dynamique des cellules T à mémoire.
Gossel et al. ont utilisé deux approches expérimentales pour étudier la dynamique des cellules T à mémoire chez les souris. (A) Pour quantifier l’afflux de cellules T naïves dans le pool de cellules T à mémoire existantes, ils ont utilisé le médicament busulfan pour tuer sélectivement les cellules souches hématopoïétiques (CSH) dans la moelle osseuse de souris CD45.1+ (flèche rouge), puis ont ajouté de nouvelles cellules dérivées de la moelle osseuse de souris CD45.2+ (flèche verte). Les cellules T naïves (bulle bleu clair) ont remplacé environ 10 % des cellules T à mémoire centrale (CM) et environ 6 % des cellules T à mémoire effectrice (EM) par semaine (flèches bleues). Environ la moitié de la population de cellules T mémoires résidentes n’a jamais été remplacée. (B) Dans une deuxième expérience, l’ADN des cellules T à mémoire a été marqué avec le marqueur BrdU pour mesurer la vitesse à laquelle les cellules des différentes sous-populations de cellules T à mémoire se divisent et meurent. En mesurant le marqueur Ki67 (flèche violette), ils ont pu classer les cellules CM et EM en cellules récemment divisées (Ki67+) et cellules non récemment divisées (Ki67-). Les pools de CM et de EM contenaient des cellules à dynamique rapide et lente : les cellules à courte durée de vie vivaient environ trois jours et six jours, respectivement, tandis que les cellules à longue durée de vie vivaient environ six semaines dans les deux sous-populations. (C) À l’avenir, il pourrait être utile de combiner ces deux approches pour comparer la division cellulaire et la mort des cellules T mémoire récemment recrutées (CD45.2+) et préexistantes (CD45.1+).
© 2007, Seans Potato Business, Wikimedia Commons, Creative Commons Attribution-Share Alike 3.0 Unported. La souris utilisée dans la figure 1 parties A-C est reproduite avec l’autorisation de Seans Potato Business.
Même si les souris n’avaient pas d’infections pour activer les cellules T naïves, il semblait y avoir un grand afflux constant de cellules T naïves dans le pool de cellules T à mémoire. Le pool de cellules T à mémoire comprend différentes sous-populations, dont les cellules T à mémoire centrale et les cellules T à mémoire effectrice, qui peuvent être distinguées par les différents marqueurs protéiques présents à leur surface. Gossel et al. ont découvert que les cellules T naïves remplaçaient environ 10 % des cellules T à mémoire centrale chaque semaine. Pour les cellules T à mémoire effectrice, ce chiffre était d’environ 6 % par semaine chez les jeunes adultes et de 1 % par semaine chez les souris plus âgées. Fait important, ils ont montré qu’en négligeant ce flux important du pool de cellules T naïves vers le pool de mémoire, les études précédentes peuvent avoir considérablement surestimé la durée de vie des cellules T de mémoire.
Malgré ce remplacement rapide des cellules T de mémoire par de nouvelles cellules T naïves, environ 50% du pool de cellules T de mémoire qui s’était formé avant que les souris aient atteint l’âge de huit semaines n’a jamais été remplacé par de nouvelles cellules T naïves. Ainsi, bien qu’une fraction importante du pool de cellules T à mémoire soit remplacée à un rythme élevé tout au long de la vie, une proportion tout aussi importante est conservée dès le plus jeune âge. La question reste posée de savoir si ces cellules T « originelles » ont simplement une longue durée de vie ou si elles sont maintenues par division cellulaire.
Pour mieux comprendre la dynamique des différentes sous-populations de cellules T, Gossel et al. ont marqué l’ADN des cellules en cours de division cellulaire et mesuré la protéine Ki67, que les cellules expriment naturellement pendant la division (figure 1B). Le marqueur Ki67 a ensuite été utilisé comme un » marqueur temporel » qui a marqué les cellules qui s’étaient récemment divisées, tandis que le marquage de l’ADN a été utilisé pour suivre la dynamique des cellules » marquées » et » non marquées « . Gossel et al. montrent pour la première fois que les pools de cellules T de la mémoire centrale et de la mémoire effectrice sont composés de sous-ensembles de cellules T ayant une dynamique intrinsèquement différente. Dans les deux pools, environ la moitié des cellules ne vivent que quelques jours, tandis que l’autre moitié, en moyenne, vit pendant environ six semaines.
Cette étude combine admirablement des expériences quantitatives détaillées avec des modèles mathématiques, et révèle ainsi des informations importantes sur le maintien à long terme des cellules T de mémoire. Cependant, ce travail soulève également de nombreuses questions. Par exemple, il a récemment été démontré que le pool de cellules T à mémoire des souris de laboratoire ressemble davantage à celui des bébés humains qu’à celui des adultes humains (Beura et al., 2016). Si de nouvelles cellules T naïves remplacent jusqu’à 10 % du pool de cellules T à mémoire par semaine, même dans des environnements de laboratoire propres, on peut se demander combien elles remplaceraient chez les humains, qui sont continuellement exposés à des agents pathogènes.
On ne sait toujours pas non plus ce qui pousse ces cellules dans le pool de cellules T à mémoire et si les infections latentes chroniques recrutent continuellement de nouvelles cellules T naïves dans le pool à mémoire. Néanmoins, une fraction substantielle du pool de cellules T à mémoire semble être résistante et ne peut être remplacée par de nouvelles cellules provenant du pool de cellules T naïves. Les recherches futures devraient porter sur ce qui rend ces cellules T résistantes et sur la question de savoir si elles ne peuvent pas être remplacées même pendant les infections. Enfin, on peut se demander quel est l’avantage de combiner un pool de cellules T à mémoire qui n’est jamais remplacé avec un pool qui est rapidement et continuellement remplacé ?
Laisser un commentaire