Frontiers in Neuroanatomy
On janvier 6, 2022 by adminIntroduction
La tractographie du tenseur de diffusion par résonance magnétique (DTT) est largement utilisée pour le suivi des fibres neurales et l’analyse de tractus de fibres spécifiques. La partie importante de l’application de la TNT à in vivo est la façon de définir la région d’intérêt (ROI) pour le processus d’analyse de la TNT. De nombreux chercheurs ont défini des régions d’intérêt sur la base de l’image anatomique et de la carte d’anisotropie fractionnelle (FA) codée en couleur calculée en fonction de leur objectif de recherche, généralement (Hong et al., 2009 ; Kim et Jang, 2013 ; Li et al., 2013). Bien que l’analyse basée sur des ROIs multiples soit utilisée pour ces approches, elles présentent un inconvénient en termes de précision des résultats en raison d’un paramétrage des ROIs dépendant de l’utilisateur. Pour surmonter cet inconvénient, les résultats d’activation de l’IRM fonctionnelle (IRMf) ont été combinés avec l’analyse du TTT (Propper et al., 2010 ; Li et al., 2013). Cette approche combinée permet de définir des ROIs plus précis qu’une définition manuelle des ROIs. Cependant, la taille des zones d’activation de l’IRMf peut être modifiée en fonction de la valeur statistiquement significative et du processus d’acquisition d’images supplémentaire, ce qui entraîne une perte de temps.
Dans cette étude, nous avons appliqué le modèle de l’aire de Brodmann (BA) pour définir les ROI afin d’obtenir une analyse précise du TTT pour le tractus de fibres du fascicule arqué (AF). Parmi les multiples fibres nerveuses du cerveau humain, l’AF est une fibre nerveuse importante qui relie les zones frontales (Broca) et temporales (Wernicke), et elle a été associée aux fonctions du langage. Ainsi, les lésions de l’AF ont provoqué divers types de problèmes de langage tels que l’aphasie de conduction et les déficits de parole (Yamada et al., 2007 ; Jang, 2013 ; Li et al., 2013). Par conséquent, l’identification des caractéristiques anatomiques et de l’emplacement du tractus de la fibre AF dans le cerveau humain normal ou chez les patients atteints d’aphasie est devenue une question importante car elle serait utile aux neuroscientifiques ou aux chercheurs cliniques pour prédire l’état de récupération de la fibre neuronale pour l’aphasie et les études de suivi. De plus, le modèle BA est une sorte de modèle standard, qui montre les régions du cortex humain divisées en 46 zones basées sur des caractéristiques cytoarchitecturales (Thottakara et al., 2006). En appliquant les caractéristiques du modèle BA pour les régions du cortex divisé comme norme, nos approches analytiques permettent de définir des ROI précis et utiles pour les études de TNT. En outre, nous avons généré une carte de probabilité de tractation de fibre de BA pour estimer le chemin de tractation de fibre dans le cerveau.
Matériels et méthodes
Sujets
Treize sujets sains, neuf hommes et quatre femmes, ont participé à cette étude (droitiers, âge moyen : 38,7 ± 6,4 ans, plage d’âge : 26-50 ans). Ils n’avaient aucun antécédent de maladie neurologique ou physique. Tous les participants ont été évalués par un radiologue et un neurologue, et ont été diagnostiqués comme des sujets normaux. Tous les sujets ont compris le but de l’étude et ont donné leur consentement éclairé par écrit. Ce protocole d’étude a été approuvé par le conseil d’examen institutionnel local.
Acquisition et analyse des données
Les données d’imagerie du tenseur de diffusion (DTI) ont été acquises à l’aide d’un scanner RM 1,5 T (Gyroscan Intera, Philips Healthcare, The Best, Pays-Bas) avec une bobine de tête à six canaux à codage de sensibilité en réseau phasé (SENSE) utilisant une séquence d’impulsions d’imagerie écho-planaire (EPI) à écho de spin à un seul coup. Les données d’ITD ont été acquises avec les paramètres suivants : temps de répétition (TR)/temps d’écho (TE) = 10 726/75 ms, champ de vision (FOV) = 221 mm, matrice d’acquisition = 96 × 96, matrice de reconstruction = 128 × 128, épaisseur de coupe = 2,3 mm et facteur SENSE = 2. La pondération de la diffusion a été appliquée selon 32 gradients de sensibilisation à la diffusion non colinéaires et non coplanaires avec une valeur b de 1000 s/mm2. Nous avons acquis 67 coupes transversales contiguës couvrant l’ensemble du cerveau sans aucun intervalle entre les coupes, et l’acquisition de coupes entrelacées a été appliquée pour minimiser la diaphonie causée par l’absence d’intervalle entre les coupes.
Avant l’analyse des données DTI, les effets des courants de Foucault et des mouvements de la tête ont été corrigés en enregistrant toutes les images DWI sur des images non pondérées en fonction de la diffusion (valeur b = 0 s/mm2) en utilisant l’enregistrement affine multi-échelle par FSL (Smith et al., 2004)1. Le logiciel DTI Studio (Département de radiologie, École de médecine de l’Université Johns Hopkins, Baltimore, MD, États-Unis), dont l’affectation des fibres a été réalisée par l’algorithme de suivi continu (FACT) et une approche à ROIs multiples, a été utilisé pour le calcul des cartes de paramètres de diffusion et le suivi des fibres (Wakana et al., 2004 ; Jiang et al., 2006). Pour extraire et évaluer le trajet des fibres AF de chaque sujet, nous avons utilisé deux modèles de cerveau standard, fournis par le logiciel MRIcro2. Le modèle BA fournit un masque de volume qui est subdivisé en 46 régions corticales discrètes, chacune représentant une zone BA différente. Bien que nous utilisions les régions corticales prédéfinies dans le modèle BA, nous pouvons simplement sélectionner ou dessiner la zone spécifique de la région, qui est corrélée avec l’origine du tractus des fibres neuronales, pour la sélection du ROI dans le suivi des fibres. De cette façon, il est possible de minimiser le facteur d’erreur induit par le réglage du ROI par l’utilisateur. En outre, le modèle T1w du MNI a été utilisé pour le processus de normalisation des images cérébrales. Tous les ensembles de données DTI acquis à partir du scanner IRM pour chaque sujet et la carte FA calculée ont une orientation et des informations de localisation légèrement différentes. Par conséquent, certains facteurs erronés induits par des structures et/ou des emplacements différents entre les sujets peuvent être évités en utilisant le processus de normalisation du cerveau. En outre, le processus de normalisation basé sur l’image modèle pour tous les ensembles de données est plus utile pour générer la carte de probabilité des voies des fibres afin de maintenir la cohérence des emplacements. Dans cette étude, le réseau de fibres AF a été analysé uniquement dans l’hémisphère dominant (gauche) de tous les sujets. L’organigramme des procédures de traitement est présenté dans la figure 1A, et a été réalisé dans les ordres suivants : (i) La carte FA du sujet a été calculée à l’aide du logiciel DTI Studio ; (ii) Le gabarit T1w a été coïncidé avec la carte FA de chaque sujet à l’aide du logiciel SPM8 (Wellcome Department of Cognitive Neurology, Londres, Royaume-Uni). En raison de la faible différence de contraste de l’image entre la carte FA et le gabarit T1w, il est possible de minimiser le facteur d’erreur dans le processus de co-registrement ; (iii) Pour effectuer le processus de normalisation entre le gabarit BA et les ensembles de données du tenseur de diffusion, la matrice de transformation, qui a été générée à l’étape (ii), a été appliquée au gabarit BA ; (iv) Deux ROI ont été dessinés dans l’aire de Broca et l’aire de Wernicke sur la base du modèle BA normalisé, et le réseau de fibres AF de chaque sujet a été extrait selon les critères suivants : un voxel dont la valeur FA est inférieure à 0.2 ou l’angle de trajectoire inférieur à 80 degrés ; et (v) des masques binaires des fibres extraites pour chaque sujet ont été générés. Les masques binaires n’ont que deux valeurs : une (voxels pour l’emplacement du tractus fibreux) et zéro (voxels pour l’emplacement du tractus non fibreux). Les masques de tous les sujets ont été normalisés en utilisant le modèle MNI T1w de MRIcro avec un enregistrement affine à 12 paramètres utilisant la matrice de transformation inverse du processus de co-enregistrement original. Ces masques de fibres normalisés ont été additionnés et divisés par le nombre total de sujets pour générer la carte probabiliste des voies de la FA. La carte probabiliste des voies a été superposée au modèle MNI T1w avec une échelle différente selon la valeur de probabilité d’un voxel.
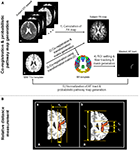
Figure 1. Organigramme des procédures d’analyse des données pour le réglage du ROI dans le suivi des fibres/génération de voies probabilistes (A) et le processus de mesure des emplacements relatifs des fibres (B). Pour la mesure de l’emplacement relatif de l’arcuate fasciculus (AF) dans la carte des voies probabilistes, (a) indique la méthode de mesure du rapport d’emplacement médiolatéral entre Xa et Xb, et (b) indique la méthode de mesure du rapport de la partie antéropostérieure entre Ya et Yb ou Yc. Les processus de mesure des rapports de localisation ont été effectués dans le gabarit T1w de l’Institut neurologique de Montréal (MNI), qui est présenté sur la localisation de la corona radiata.
Pour étudier la localisation du trajet des fibres AF sur chaque sujet, la localisation relative a été mesurée par le rapport occupé du trajet AF à la base de l’hémisphère gauche. Les processus de mesure ont été effectués avec la partie médiolatérale et la partie antéropostérieure en utilisant le chemin probabiliste généré de la voie des fibres AF sur le modèle MNI T1w (Figure 1B). L’emplacement médiolatéral a été mesuré par le rapport entre la longueur de la fissure longitudinale à la limite la plus latérale de l’hémisphère cérébral gauche (Xa) et la longueur de l’emplacement médial à latéral de la partie horizontale de l’AF (Xb) comme suit : (Xa/Xb) × 100. Le rapport de localisation antéropostérieure a été mesuré entre la longueur de la limite la plus antérieure à la limite la plus postérieure (Ya) et la longueur de la limite antérieure à la limite postérieure de la partie verticale de la FA (Yb ou Yc). Le rapport de localisation antéropostérieur, plus détaillé, a été mesuré séparément sur la base de la confluence de la partie horizontale (rapport entre Ya et Yb) et de la partie verticale (rapport entre Ya et Yc) comme suit : (Ya/Yb) × 100 et (Ya/Yc) × 100.
Résultats
Les cartes probabilistes des voies des fibres AF pour tous les groupes de sujets sont présentées dans la figure 2. La gamme d’échelle de couleur indique la probabilité qu’un voxel fasse partie de la voie des fibres de la FA. Dans cette carte probabiliste des voies de transmission des fibres de la FA, le rapport mesuré de la position médiolatérale était de 18 %. Le rapport mesuré de la position antéropostérieure était de 35 % basé sur le point de courbure de la FA. Le rapport a été mesuré avec la partie supérieure à 15 % et la partie inférieure à 20 %, respectivement. D’après les résultats, la partie médiolatérale mesurée de l’AF représente 1/5 de la longueur médiolatérale totale de l’hémisphère sur le modèle MNI T1w. La partie antéropostérieure de l’AF mesurée représentait 1/2 de la longueur totale antéropostérieure de l’hémisphère. En outre, le tractus de fibres de FA extrait qui a été superposé sur le plan d’image transversal du modèle MNI T1w n’a pas permis de montrer complètement la forme globale de la structure du tractus de fibres de FA en raison de la caractéristique de la forme incurvée du tractus de fibres de FA in vivo ; Cependant, notamment, le tractus de fibres AF extrait pour chaque sujet, qui a été créé par l’image de masque dans la procédure d’analyse (Figure 1), et la carte de probabilité reconstruite (Figure 2) ont décrit que le tractus de fibres AF de nos résultats était connecté à deux régions du cerveau entre l’aire de Broca dans le gyrus frontal inférieur et l’aire de Wernicke dans le gyrus temporal supérieur postérieur. En outre, la carte des voies probabilistes générée a clairement montré que les distributions des voies de fibres AF combinées, qui ont été extraites par le modèle BA pour le réglage des ROI de chaque sujet, étaient bien localisées et définies dans le cerveau humain sans aucune erreur de dislocation.
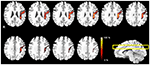
Figure 2. Les cartes de voies probabilistes du tractus des fibres AF dans les emplacements multi-coupes. La barre d’échelle de couleur indique les valeurs probabilistes du tractus de fibres.
Discussion
Le BA est des régions de cortex du cerveau humain bien définies de 46 zones selon leurs fonctions uniques. De nombreux chercheurs ont utilisé le modèle BA pour indiquer les emplacements spécifiques de l’activité cérébrale dans leurs études, comme les patients atteints de maladies neurologiques ou les stratégies de traitement, car le BA différencie les régions non seulement anatomiquement distinctes mais aussi fonctionnellement. En particulier, parmi les BA, l’aire de Broca et l’aire de Wernicke sont connectées par le tractus de fibres neurales AF qui s’enroule autour de la fissure sylvienne et relie les aires temporales et frontales du langage (Rilling et al., 2008 ; Jang, 2013 ; Tak et Jang, 2014). On peut s’attendre à ce que l’AF soit la fibre la plus importante associée aux fonctions du langage, et elle a une forme distincte de courbe combinant différentes directions, contrairement à d’autres fibres telles que le tractus corticospinal (direction représentative des fibres supérieure-inférieure) ou le corps calleux (direction représentative des fibres gauche-droite). Étant donné que le tractus fibreux de l’AF est fortement associé aux patients qui ont des troubles du langage tels que l’aphasie, l’identification de la localisation précise du tractus fibreux de l’AF est très importante dans la perspective clinique. De nombreuses approches utilisant des techniques d’imagerie multimodale et/ou une chirurgie intra-opératoire invasive ont été réalisées pour déterminer les caractéristiques neuro-anatomiques des fibres de la FA et évaluer leur rôle critique dans le contrôle par anticipation et par rétroaction de la production du langage (Duffau et al., 2002 ; Breier et al., 2008 ; Hosomi et al., 2009 ; Marchina et al., 2011 ; Zhao et al., 2012 ; Yamao et al., 2014). La méthode DTT, qui a été introduite dans le passé pour suivre le tractus des fibres nerveuses, est largement utilisée pour démontrer les caractéristiques des fibres nerveuses en utilisant les phénomènes de diffusion calculés des molécules d’eau in vivo. Cette approche est adéquate pour la visualisation du trajet des fibres, et facile à appliquer. Grâce à ces caractéristiques, la méthode DTT et son développement technique ont permis la visualisation in vivo des trajets de fibres associés à la substance blanche. Cependant, bien que l’évaluation des trajets de fibres ait progressé avec la méthode DTT, il reste encore une limitation due à la précision du réglage des ROI dans la DTT.
Dans cette étude, nous avons employé le réglage des ROI non dépendant de l’utilisateur pour la DTT basée sur le modèle BA. Les ROIs définis à partir du modèle BA ont un avantage pour la cohérence du tractus des fibres neurales par rapport aux paramètres ROI dépendants de l’utilisateur. De plus, nous avons normalisé les trajets individuels de la FA par rapport au modèle T1w du MNI afin d’étudier la tendance de la localisation de la FA et sa trajectoire probabiliste dans le cerveau humain. La trajectoire probabiliste pourrait fournir une meilleure estimation des probabilités de connexion des fibres pour un groupe de sujets. Jusqu’à présent, les procédures de sélection du ROI pour l’analyse du TNT étaient généralement effectuées avec un paramétrage du ROI dépendant de l’utilisateur, ce qui pouvait entraîner des erreurs d’analyse dans certaines parties de l’identité et de la reproductibilité, même si le ROI était bien défini par des chercheurs expérimentés. En particulier, l’approche d’analyse globale proposée pour le suivi des fibres neuronales humaines in vivo, qui est réalisée avec la sélection de ROI basée sur le modèle BA, possède une force analytique permettant l’acquisition de trajets de fibres plus précis, indépendamment de toute contamination par des erreurs de définition de ROI par les utilisateurs ou les chercheurs. En termes de maintien de l’identification et de la reproductibilité des résultats, il peut être fourni les accords élevés en raison des deux procédures analytiques principales telles que la normalisation du cerveau et l’extraction de la zone ROI du modèle BA sans aucun réglage manuel. En outre, nos approches pourraient facilement être adaptées à l’analyse pour les études TNT, et conduire à l’analyse de connexion de fibre de BA dans d’autres zones du cerveau avec précision.
Il y a quelques limites de cette étude. Tout d’abord, nous avons une limitation à notre procédure d’analyse DTT en raison de la prise en compte de l’algorithme de suivi des fibres déterministe. Par conséquent, nous pensons que l’application d’autres algorithmes de suivi des fibres basés sur l’algorithme probabiliste de suivi des fibres avec le modèle BA et les études de comparaison seront fournis avec des informations plus utiles pour évaluer le modèle BA basé sur le paramètre ROI dans les recherches cliniques. Deuxièmement, pour le recrutement des sujets, nous n’avons considéré que des sujets normaux avec des populations relativement faibles. Dans l’étude future, avec un grand nombre de sujets et/ou de patients qui avaient des maladies dans le tractus de la fibre AF sera participé, nous croyons que les résultats donnent également plus de fiabilité.
En conclusion, nous avons démontré le suivi de la fibre AF avec le modèle BA pour la sélection ROI et son chemin probabiliste dans le cerveau humain. Nous pensons que les approches analytiques que nous proposons sont suffisamment étendues à d’autres études TNT pour la définition du ROI, et celles-ci peuvent être fournies des informations précises sur le tractus des fibres neuronales et des paramètres de recherche clinique.
Contributions des auteurs
D-HL, D-WL et B-SH ont conçu et coordonné l’étude. D-HL et B-SH ont acquis les données. D-HL et D-WL ont analysé les données. D-HL a rédigé le manuscrit. B-SH a encadré l’étude.
Déclaration de conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
Abréviations
BA, aire de Brodmann ; ROI, région d’intérêt ; AF, arcuate fasciculus ; DTT, tractographie tensorielle de diffusion ; DTI, imagerie tensorielle de diffusion ; MNI, Institut neurologique de Montréal ; FA, anisotropie fractionnelle.
Notes de bas de page
- ^ www.fmrib.ox.ac.uk/fsl, Analysis Group, FMRIB, Oxford, UK.
- ^ www.mricro.com, Chris Rorden, CA, USA.
Breier, J. I., Hasan, K. M., Zhang, W., Men, D., et Papanicolaou, A. C. (2008). Dysfonctionnement du langage après un accident vasculaire cérébral et dommages aux trajets de la matière blanche évalués à l’aide de l’imagerie du tenseur de diffusion. AJNR Am. J. Neuroradiol. 29, 483-487. doi : 10.3174/ajnr.a0846
PubMed Abstract | CrossRef Full Text | Google Scholar
Duffau, H., Capelle, L., Sichez, N., Denvil, D., Lopes, M., Sichez, J. P., et al. (2002). Cartographie peropératoire des voies sous-corticales du langage à l’aide de stimulations directes. Brain 125, 199-214. doi : 10.1093/brain/awf016
PubMed Abstract | CrossRef Full Text | Google Scholar
Hong, J. H., Kim, S. H., Ahn, S. H., et Jang, S. H. (2009). La localisation anatomique de l’arcuate fasciculus dans le cerveau humain : une étude de tractographie du tenseur de diffusion. Brain Res. Bull. 28, 52-55. doi : 10.1016/j.brainresbull.2009.05.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Hosomi, A., Nagakane, Y., Yamada, K., Kuriyama, N., Mizuno, T., Nishimura, T., et al. (2009). Assessment of arcuate fasciculus with diffusion-tensor tractography may predict the prognosis of aphasia in patients with left middle cerebral artery infarcts. Neuroradiologie 51, 549-555. doi : 10.1007/s00234-009-0534-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Jang, S. H. (2013). Études d’imagerie du tenseur de diffusion sur le fascicule arqué chez les patients victimes d’un accident vasculaire cérébral : une revue. Front. Hum. Neurosci. 7:749. doi : 10.3389/fnhum.2013.00749
PubMed Abstract | CrossRef Full Text | Google Scholar
Jiang, H., van Zijl, P. C., Kim, J., Pearlson, G. D., et Mori, S. (2006). DtiStudio : programme de ressources pour le calcul du tenseur de diffusion et le suivi des faisceaux de fibres. Comput. Methods Programs Biomed. 81, 106-116. doi : 10.1016/j.cmpb.2005.08.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Kim, S. H., et Jang, S. H. (2013). Prédiction de l’issue de l’aphasie en utilisant la tractographie du tenseur de diffusion pour le fascicule arqué dans l’accident vasculaire cérébral. AJNR Am. J. Neuroradiol. 34, 785-790. doi : 10.3174/ajnr.a3259
PubMed Abstract | CrossRef Full Text | Google Scholar
Li, Z., Peck, K. K., Brennan, N. P., Jenabi, M., Hsu, M., Zhang, Z., et al. (2013). Tractographie du tenseur de diffusion du fascicule arqué chez les patients atteints de tumeurs cérébrales : comparaison entre les modèles déterministes et probabilistes. J. Biomed. Sci. Eng. 6, 192-200. doi : 10.4236/jbise.2013.62023
PubMed Abstract | CrossRef Full Text | Google Scholar
Marchina, S., Zhu, L. L., Norton, A., Zipse, L., Wan, C. Y., et Schlaug, G. (2011). Impairment of speech production predicted by lesion load of the left arcuate fasciculus. Stroke 42, 2251-2256. doi : 10.1161/STROKEAHA.110.606103
PubMed Abstract | CrossRef Full Text | Google Scholar
Propper, R. E., O’Donnell, L. J., Whalen, S., Tie, Y., Norton, I. H., Suarez, R. O., et al. (2010). A combined fMRI and DTI examination of functional language lateralization and arcuate fasciculus structure : effects of degree versus direction of hand preference. Brain Cogn. 73, 85-92. doi : 10.1016/j.bandc.2010.03.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Rilling, J. K., Glasser, M. F., Preuss, T. M., Ma, X., Zhao, T., Hu, X., et al. (2008). The evolution of the arcuate fasciculus revealed with comparative DTI. Nat. Neurosci. 11, 426-428. doi : 10.1038/nn2072
PubMed Abstract | CrossRef Full Text | Google Scholar
Smith, S. M., Jenkinson, M., Woolrich, M. W., Beckmann, C. F., Behrens, T. E., Johansen-Berg, H., et al. (2004). Advances in functional and structural MR image analysis and implementation as FSL. Neuroimage 23, S208-S219. doi : 10.1016/j.neuroimage.2004.07.051
PubMed Abstract | CrossRef Full Text | Google Scholar
Tak, H. J., et Jang, S. H. (2014). Relation entre l’aphasie et le fascicule arqué chez les patients victimes d’un AVC chronique. BMC Neurol. 14:46. doi : 10.1186/1471-2377-14-46
PubMed Abstract | CrossRef Full Text | Google Scholar
Thottakara, P., Lazar, M., Johnson, S. C., and Alexander, A. L. (2006). Application des modèles d’aires de Brodmann pour la sélection de ROI dans les études de tractographie de la matière blanche. Neuroimage 29, 868-878. doi : 10.1016/j.neuroimage.2005.08.051
PubMed Abstract | CrossRef Full Text | Google Scholar
Wakana, S., Jiang, H., Neage-Poetscher, L. M., van Zijl, P. C., and Mori, S. (2004). Fiber tract-based atlas of human white matter anatomy. Radiology 230, 77-87. doi : 10.1148/radiol.2301021640
PubMed Abstract | CrossRef Full Text | Google Scholar
Yamada, K., Nagakane, Y., Mizuno, T., Hosomi, A., Nakagawa, M., and Nishimura, T. (2007). MR tractography depicting damage to the arcuate fasciculus in a patient with conduction aphasia. Neurology 68:789. doi : 10.1212/01.wnl.0000256348.65744.b2
PubMed Abstract | CrossRef Full Text | Google Scholar
Yamao, Y., Matsumoto, R., Kunieda, T., Arakawa, Y., Kobayashi, K., Usami, K., et al. (2014). Cartographie peropératoire du réseau linguistique dorsal en utilisant la stimulation électrique à impulsion unique. Hum. Brain Mapp. 35, 4345-4361. doi : 10.1002/hbm.22479
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhao, Y., Chen, X., Wang, F., Sun, G., Wang, Y., Song, Z., et al. (2012). Intégration de la navigation des fibres du fascicule arqué basée sur le tenseur de diffusion et de l’IRM peropératoire dans la chirurgie du gliome. J. Clin. Neurosci. 19, 255-261. doi : 10.1016/j.jocn.2011.03.041
PubMed Abstract | CrossRef Full Text | Google Scholar
.
Laisser un commentaire