Clostridium difficile » Bactéries à Gram positif » Dictionnaire des profils pathogènes
On décembre 21, 2021 by adminClostridium difficile
Clostridium difficile est une bactérie anaérobie à Gram positif, productrice de toxines, appartenant à la famille des Clostridiaceae des Clostridiales. Bien que strictement intolérant à l’oxygène, C. difficile est capable de produire des endospores aérotolérantes dans des conditions défavorables, capables de persister dans un environnement ouvert pendant des années. C. difficile est une espèce acommensaliste qui se loge typiquement dans la flore fécale colique d’un assez petit sous-ensemble de la population infantile, le nombre de porteurs diminuant avec l’âge des enfants (Kelly et LaMont, 1998). Lorsqu’il existe en petit nombre, cet organisme reste non pathogène. Cependant, lorsqu’il parvient à coloniser et à donner des populations plus importantes, sa pathogénicité devient la cause fondamentale d’une variété d’infections du colon
.
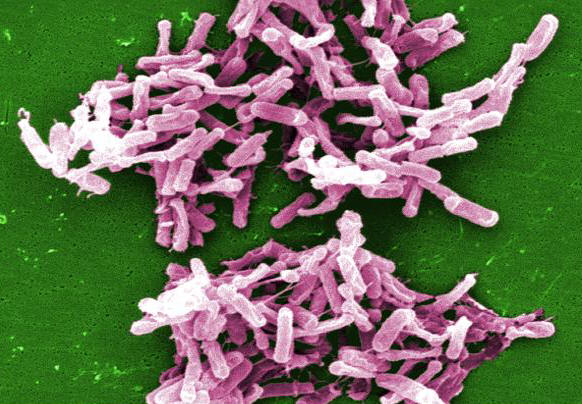
Figure 1. Cette micrographie représente la bactérie Clostridium difficile à partir d’une culture d’échantillon de selles.
L’infection par C. difficile survient de manière opportuniste ; la microflore normale de l’intestin attribue à la défense de l’organisme contre ladomination pathogène et ainsi, la colonisation massive de C. difficile se produit généralement chez lesindividus où la flore colique typique a été perturbée à la suite de l’utilisation d’antibiotiques, les personnes immunodéprimées (patients atteints du SIDA ou du cancer), ou les personnes prenant des soi-disant nettoyants intestinaux.
Le pouvoir pathogène inhérent de C. difficile réside dans sa capacité à produire une toxine. En particulier, cet agent pathogène produit deux cytotoxines puissantes, à savoir la toxine A et la toxine B, qui conduisent finalement à l’infection et à la maladie associées à C. difficile (Mylonakis et al., 2001).
Les toxines A et B sont des glucosyltransférases qui ciblent et inactivent la famille Rho des enzmyes GTPases. La toxine A induit une dépolymérisation de l’actine par un mécanisme corrélé à une diminution de l’ADP-ribosylation des protéines Rho de liaison au GTP de faible masse moléculaire. Une autre toxine, la toxine binaire, a également été décrite, mais son rôle dans la maladie n’est pas encore totalement compris. Cela conduit finalement à la détérioration des composants des cellules épithéliales et inévitablement à la mort cellulaire. De plus, les deux toxines induisent une forte réaction inflammatoire cellulaire et une libération massive de cytokines, ainsi qu’une activation du système nerveux entérique, attirant les neutrophiles sur le site (Jefferson et al., 1999). Le résultat global de la production des toxines A et B est une lésion et une inflammation de la muqueuse colique.
C. difficile se transmet d’une personne à l’autre par la voie fécale-orale. Comme l’organisme forme des spores résistantes à la chaleur, il peut rester dans l’environnement de l’hôpital ou de la maison de retraite pendant de longues périodes. Il peut être cultivé sur presque toutes les surfaces de l’hôpital. Une fois que les spores sont ingérées, elles traversent l’estomac sans encombre en raison de leur résistance aux acides. Elles germent en cellules végétatives dans le côlon lors de l’exposition aux acides biliaires et se multiplient.
L’infection associée à C. difficile est généralement limitée aux régions inférieures
abdominales du tractus gastro-intestinal ; les manifestations cliniques de l’infection à C. difficile varient en termes de gravité, de la diarrhée à l’inflammation aiguë du côlon conduisant à la mort. La colite pseudo-membraneuse (CMP) est la condition la plus communément associée à C.difficile, car elle a été directement liée au fait qu’elle est presque exclusivement causée par une autre personne que C.difficile dans tous les cas. La CMP est caractérisée par une progression de la diarrhée à laquelle la muqueuse colique devient sévèrement enflammée. En plus des symptômes tels que la diarrhée, la fièvre, la distension et la douleur abdominales, la formation d’une pseudomembrane se produit. Cette pseudomembrane est composée de divers composants cellulaires, notamment de fibrine, de mucus, de débris de cellules mortes et de leucocytes. Les pseudomembranes apparaissent dans diverses régions des parois du côlonet, dans les cas mortels, forment une gaine sur toute la muqueuse colique (Mylonakis et al., 2001).
La colite pseudomembraneuse causée par C. difficile est traitée par des antibiotiques spécifiques, tels que la vancomycine ou le métronidazole. Pour réduire les complications, les médecins commencent souvent le traitement en fonction de la présentation clinique avant que les résultats définitifs ne soient disponibles. La connaissance de l’épidémiologie locale de la flore intestinale d’un établissement particulier peut guider le traitement. En outre, la thérapie de réhydratation orale est utile pour retenir les liquides pendant la durée de la diarrhée. Il est intéressant de noter que plusieurs désinfectants couramment utilisés dans les hôpitaux peuvent être inefficaces contre les spores de C. difficile, et peuvent même favoriser la formation de spores. Cependant, les désinfectants contenant de l’eau de Javel sont efficaces pour tuer les organismes et devraient constamment être utilisés comme désinfectant.
Les procédures de culture en laboratoire et de coloration de Gram sont considérées comme trop peu spécifiques pour identifier C. difficile dans les situations cliniques en raison de samorphologie avec d’autres espèces de Clostridia qui composent la microflore normale du côlon. Les tests diagnostiques typiques sélectionnent la présence de la production de toxine A ou de toxine B (Mylonakis et al., 2001). Le test de culture tissulaire pour la spécificité de la cytotoxicité de la toxine B reste l’un des tests les plus sensibles et les plus précis utilisés pour le diagnostic. Les tests immuno-enzymatiques (ELISA) sont également capables d’identifier la toxine A et/ou la toxine B dans les selles, qui sont rapides, spécifiques et les plus fréquemment utilisés pour le diagnostic clinique des infections présumées à C. difficile.
Jefferson, K.K., Smith, M.F. Jr., & Bodak, D.A. (1999). Rôles du calcium intracellulaire et de NF-kappa B dans l’up-regulation induite par la toxine A de Clostridium difficile et la sécrétion de IL-8 à partir de monocytes humains. Journal of Immunology, 163 : 5183-5191.
Kelly, C.P. & LaMont, T. (1998). L’infection à Clostridium difficile. Annual Review of Medicine, 49 : 375-390.
Mylonakis, E., Ryan, E.T., & Calderwood, S.B. (2001). Clostridium difficile-Associated Diarrhea. Archives of Internal Medicine, 161 : 525-533.
Laisser un commentaire