Can’t Get No Satisfaction : Dysphotopsies post-chirurgie de la cataracte
On décembre 25, 2021 by adminLa chirurgie de la cataracte d’aujourd’hui réussit extrêmement bien à améliorer la vision et la qualité de vie des patients. Pourtant, un petit pourcentage de patients reste insatisfait après l’intervention, même si elle permet d’obtenir une acuité visuelle de 20/20. Une étude a révélé que la principale cause d’insatisfaction post-chirurgicale dans une population pseudophaque normale était les dysphotopsies – pratiquement inconnues il y a deux décennies.1
Les dysphotopsies ne sont encore que vaguement familières à la plupart des optométristes ; cependant, avec leur incidence en hausse, il est important que nous soyons capables de comanager efficacement les cas de dysphotopsies avec les chirurgiens lorsqu’une intervention est nécessaire.
Le terme dysphotopsie est utilisé pour décrire une variété de symptômes visuels qui résultent de la réflexion de la lumière sur la lentille intraoculaire (LIO) sur la rétine.2 Les dysphotopsies sont généralement divisées en deux catégories : positives et négatives. Les changements visuels positifs impliquent des symptômes d’artefacts lumineux, tandis que les dysphotopsies négatives sont perçues comme des ombres ou des zones sombres dans le champ visuel.3 Les patients peuvent mentionner des éblouissements, des starbursts, des halos ou des ombres lorsqu’ils décrivent leurs symptômes visuels.
L’introduction du matériau de lentille intraoculaire acrylique a contribué à réduire considérablement le taux d’opacification capsulaire postérieure après une chirurgie de la cataracte.
Il est difficile d’estimer la prévalence des dysphotopsies. Les études font état d’une fourchette allant de 1,5 % à 67 % pour les dysphotopsies positives, la plupart des données indiquant des chiffres plus modérés de 12 % à 35 %).4-6 Les dysphotopsies négatives sont moins répandues et ne se produiraient que chez 0,5 % à 2,4 % des patients.5,7 Dans la grande majorité des cas, les symptômes disparaissent plusieurs semaines après la chirurgie en raison du processus de neuroadaptation. La neuroadaptation peut se produire en réponse à une perturbation visuelle monoculaire ou binoculaire indésirable.8 La plasticité neuronale inhérente du cerveau aide le cortex visuel à annuler l’effet d’un motif indésirable.8,9 Cela peut expliquer pourquoi des effets significatifs à long terme ne sont observés que dans un petit pourcentage de la population pseudophaque.
Évolution des LIO
Pour comprendre l’augmentation de l’incidence des dysphotopsies positives, il est important de considérer l’évolution des LIO. Le premier matériau de lentille intraoculaire communément accepté était le polyméthacrylate de méthyle (PMMA), qui coïncidait généralement avec un design de lentille à bord arrondi. Les avantages du matériau PMMA comprenaient un faible coût et une durabilité à l’intérieur de l’œil.10 Les lentilles PMMA provoquent peu ou pas de dysphotopsies, ce qui est corroboré par le fait que les dysphotopsies étaient pratiquement inconnues lorsque le PMMA était le matériau de choix pour les LIO.2 Ces lentilles sont rarement utilisées aujourd’hui en raison de l’incapacité du matériau à se plier, ce qui nécessite une grande incision pendant la chirurgie, et un taux élevé d’opacification capsulaire postérieure (OPP) en raison de la conception des bords.11
Parce que des incisions plus grandes augmentent le risque d’infection et de complications de l’iris, et que les chercheurs ont constaté que le design à bord arrondi est un facteur de risque important d’OPC, des matériaux flexibles en acrylique et en silicone avec des designs verticaux à bords vifs ont été introduits, avec un grand succès. Étant donné que de plus en plus de preuves indiquent que les LIO à bords vifs entraînent des taux de PCO plus faibles que celles à bords ronds, les conceptions de lentilles à bords vifs sont désormais utilisées plus fréquemment que les conceptions à bords ronds.12
Le matériau de lentille acrylique a redéfini la chirurgie de la cataracte grâce à sa capacité à se plier et à s’adapter à travers de petites incisions, tout en réduisant considérablement le taux de PCO.13,14 En raison de ces avantages, les LIO acryliques sont les lentilles les plus couramment implantées aux États-Unis aujourd’hui. Cependant, les matériaux des lentilles acryliques ont créé une tendance ultérieure d’augmentation de l’incidence des dysphotopsies.2
Dysphotopsies positives
Plusieurs études ont évalué le rôle du matériau de la LIO dans la formation des dysphotopsies positives. Les chercheurs supposent que les dysphotopsies positives sont causées par la projection de lumière parasite sur la rétine, qui s’aggrave si cette lumière parasite est concentrée dans une zone particulière. Une étude s’est penchée sur la lumière réfléchie par les surfaces des LIO et a constaté que lorsque la lumière initiale atteint la rétine et se disperse hors de l’œil, une partie est réfléchie par la surface postérieure de la LIO sur la rétine.15 Les chercheurs ont constaté que les matériaux présentant des indices de réfraction plus élevés contribuent à concentrer une plus grande quantité de lumière sur une plus petite zone de la rétine, ce qui entraîne des symptômes. Les lentilles acryliques ont généralement un indice de réfraction plus élevé que les lentilles en PMMA ou en silicone, ce qui confirme les conclusions des chercheurs.
Une autre étude soutient que la réflectivité de surface accrue des lentilles acryliques provoque plus de symptômes par rapport aux lentilles en silicone ou en PMMA.16 Les chercheurs ont étayé leur affirmation en remplaçant les LIO acryliques de huit patients symptomatiques par des LIO en silicone ou en PMMA, ce qui a atténué les symptômes de dysphotopsie. D’autres rapports de cas présentent des résultats similaires, mais aucune étude à grande échelle n’a été réalisée.4,16
En plus du matériau de la lentille, la conception du bord de la LIO a également été impliquée dans le développement de dysphotopsies positives.17 Les dysphotopsies étaient rares lorsque des conceptions à bords arrondis étaient utilisées, mais une évolution de l’industrie vers des bords tranchants a entraîné des incidences plus élevées de dysphotopsies. En utilisant une analyse informatique, les chercheurs ont découvert que les LIO à bords aigus et ronds produisent de la lumière parasite, mais que seule la conception à bords aigus concentrait les rayons de lumière parasite en un arc sur la rétine, provoquant des symptômes.18 Les conceptions à bords ronds diffusent la lumière plus uniformément sur la rétine, minimisant l’effet.
Dysphotopsies négatives
La dysphotopsie négative est une complication visuelle beaucoup moins étudiée et comprise que la dysphotopsie positive. Les patients se plaignent généralement d’une ombre sombre dans le champ visuel temporal. Elle se manifeste généralement après l’implantation d’une LIO de chambre postérieure dans le sac.19 De nombreuses théories tentent d’identifier une cause à la dysphotopsie négative ; les suspects incluent les paramètres et l’optique de la LIO, les cicatrices d’incision cornéenne, l’implication du bord de la capsulotomie antérieure et la distance entre la LIO et l’iris.7,16,17,20
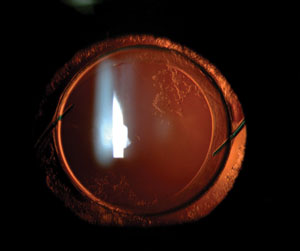
LIO en sac avec PCO légère. Certains chirurgiens ont amélioré les dysphotopsies négatives de certains patients en remplaçant une LIO dans le sac par une LIO fixée au sulcus. Les symptômes de dysphotopsie négative n’ont jamais été éliminés simplement en plaçant une LIO différente à l’intérieur du sac capsulaire à la place de l’originale.
L’une des études les plus prometteuses a utilisé un logiciel informatique pour simuler des dysphotopsies négatives dans des modèles d’yeux normaux.19 Les chercheurs ont constaté que des ombres se formaient dans la rétine périphérique lorsque les rayons lumineux subissaient des modifications au niveau du bord net postérieur de la lentille. L’analyse informatique a montré la formation de scotomes à motifs annulaires, qui ne seraient apparents que temporellement sur le champ visuel d’un patient, car le nez bloque l’aspect nasal.
Les chercheurs ont déterminé que plusieurs facteurs optiques sont nécessaires à la formation de dysphotopsies négatives.19 Les plus significatifs de ces facteurs sont : une petite pupille ; un placement d’une lentille acrylique à une distance de plus de 0,06 mm mais de moins de 1,23 mm derrière la pupille ; un design à bords vifs ; et une rétine nasale fonctionnelle qui s’étend en avant de l’ombre. Les facteurs secondaires comprennent un indice de réfraction élevé du matériau de la LIO et la position nasale de la pupille par rapport à l’axe optique de l’œil.19
Plusieurs traitements différents pour réduire la dysphotopsie négative ont été tentés. Les investigateurs ont rapporté qu’un échange de LIO avec une réduction de la distance iris-LIO a permis de réduire les symptômes de dysphotopsie négative.20 Des résultats similaires ont été observés dans une autre étude, qui a constaté que l’échange d’une LIO dans le sac pour une lentille fixée au sulcus a permis de résoudre les symptômes dans cinq yeux de cinq femmes différentes.21 La recherche montre également que la capture optique inversée et l’implantation secondaire d’une LIO piggyback peuvent résoudre les symptômes de dysphotopsie négative22. Gestion Il est essentiel de comprendre que la chirurgie de la cataracte ne doit pas être considérée comme un traitement « à l’emporte-pièce » qui peut résoudre tous les problèmes visuels de tous les patients. Les yeux individuels peuvent répondre à la chirurgie d’une manière unique – certains d’entre eux en développant des dysphotopsies visuellement significatives. Il n’existe actuellement aucune stratégie de gestion convenue pour les symptômes positifs de dysphotopsie. Les fournisseurs de soins oculaires doivent éduquer les patients sur le fait que, dans la plupart des cas, ils s’atténuent après la période postopératoire initiale, et que les troubles visuels devraient disparaître sans autre traitement.7 Si des symptômes sévères persistent après quatre à six semaines, un échange de lentille intraoculaire peut être envisagé ; cependant, il doit être le dernier recours. Le choix du moment est important lorsqu’on envisage un échange de lentille intraoculaire, et une intervention plus précoce peut être plus facile pour le chirurgien et comporter moins de risques pour le patient. Les haptiques de certaines lentilles peuvent se fibroser ou commencer à s’éroder à travers le bord de la capsule dans le sulcus, même plusieurs semaines après l’opération.25 Les lentilles intraoculaires peuvent également développer une forte adhérence à la capsule, ce qui rend difficile pour le chirurgien de les disséquer du sac capsulaire.26 Si l’échange de LIO est effectué assez tôt après l’extraction initiale de la cataracte, le chirurgien peut utiliser l’incision cornéenne claire d’origine.25 Notez que si un échange de lentille intraoculaire est envisagé, la capsulotomie YAG doit être évitée, car la capsule postérieure ouverte nécessite une vitrectomie pendant la procédure d’échange de LIO.25 Certains patients présentant des dysphotopsies négatives sévères ont été soulagés par l’échange de LIO avec capture optique inversée, fixation du sulcus et insertion de LIO piggyback.20-22 Il a également été démontré que la capsulotomie antérieure à YAG aide à résoudre les symptômes de dysphotopsies négatives.23,24 Il reste encore beaucoup à étudier dans ce domaine de la chirurgie de la cataracte, mais la sensibilisation à ces complications est importante, car elles peuvent entraîner une insatisfaction significative des patients. Le Dr Sukhovolskiy a effectué sa résidence au Jonathan M. Wainwright VAMC et Pacific Cataract and Laser Institute à Kennewick, Wash. 1. Kinard K, Jarstad A, Olson R. Correlation of visual quality with satisfaction and function in a normal cohort of pseudophakic patients. J Cataract Refract Surg. 2013;39:590-7.
Les dysphotopsies sont la principale source d’insatisfaction des patients après une chirurgie de la cataracte.1 Dans la plupart des cas, elles diminuent avec le temps, mais certains patients présentent des symptômes graves à long terme.7 Il est important que les optométristes reconnaissent les dysphotopsies, car nous faisons partie intégrante de l’éducation des patients et de la gestion conjointe avec un chirurgien. L’anamnèse doit être menée très soigneusement, en commençant par des questions ouvertes. La recherche de symptômes spécifiques peut susciter une réponse positive chez certains patients, même en l’absence de problèmes importants. L’hyper-focalisation sur ces problèmes peut rendre les symptômes subjectivement plus gênants pour les patients.
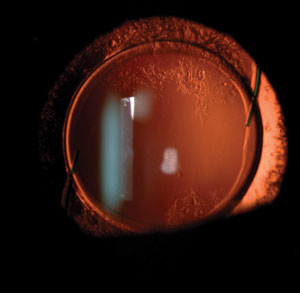
Le changement de lentille intraoculaire peut être difficile des mois ou des années après la chirurgie initiale de la cataracte, car l’haptique de certaines lentilles peut s’éroder à travers le bord de la capsule et leur manipulation peut endommager les zonules.
2. Schwiegerling J. Développements récents dans la dysphotopsie pseudophaque. Curr Opin Ophthalomol. 2006;17:27-30.
3. Hood CT, Sugar A. Plaintes subjectives après une chirurgie de la cataracte : causes communes et stratégies de gestion. Curr Opin Ophthalmol. 2015;26:45-9.
4. Ellis MF. Conception de la lentille intraoculaire à arêtes vives comme cause d’éblouissement permanent. J Cataract Refract Surg. 2001;27:1061-4.
5. Meacock WR, Spalton DJ, Khan S. The effect of texturing the intraocular lens edge on postoperative glare symptoms : a randomized prospective, double-masked study. Arch Ophthalol. 2002;120:1294-8.
6. Tester R, Pace NL, Samore M, Olson RJ. Dysphotopsie chez les patients phakiques et pseudophakiques : incidence et relation avec le type de lentille intraoculaire. J Cataract Refract Surg. 2000;26:810-6.
7. Osher RH. La dysphotopsie négative : étude à long terme et explication possible des symptômes transitoires. J Cataract Refract Surg. 2008;34:1699-1707.
8. Kershner RM. Neuroadaptation et LIO premium : Que pense le cerveau ? Gestion de l’ophtalmologie. 2011;15(12):51-4.
9. Kent C, Kershner RM, Mainster M, McDonald JE. Neuroadaptation multifocale : L’entraînement peut-il aider le cerveau ? Rev Ophthalmol. 2010;17(3):24-31.
10. Bellucci R. Une introduction aux lentilles intraoculaires : matériau, optique, haptique, design et aberration. Cataracte. Série de cours de l’ESASO. Bâle, Karger, 2013;3:38-55.
11. Auffarth GU, Brezin A, Caporossi A, et al. Comparaison des taux de capsulotomie Nd:YAG après phacoémulsification de lentilles intraoculaires en PMMA, silicone ou acrylique dans quatre pays européens. Ophthalmic Epidemiol. 2004;11(4):319-29.
12. Cheng J, Wei R, Cai J, et al. Efficacité de différents matériaux de lentilles intraoculaires et de conceptions de bords optiques dans la prévention de l’opacification capsulaire postérieure : une méta-analyse. Am J Opthalmol. 2007;143:428-36.
13. Hollick EJ, Spalton DJ, Ursell PG, et al. The effect of polymethylmethacrylate, silicone, and polyacrylic intraocular lenses on posterior capsular opacification 3 years after cataract surgery. Ophtalmology. 1999;106:49-54.
14. Yan Q, Perdue N, Sage EH. Réponses différentielles des cellules épithéliales du cristallin humain aux lentilles intraoculaires in vitro : disques acryliques hydrophobes versus PMMA ou silicone. Graefe’s Arch Clin Exp Ophthalmol. 2005;243:1253-62.
15. Erie JC, Bandhauer MH, McLaren JW. Analyse de l’éblouissement postopératoire et du design des lentilles intraoculaires. J Cataract Refract Surg. 2001;27:614-21.
16. Davison JA. Dysphotopsie positive et négative chez les patients porteurs de lentilles intraoculaires en acrylique. J Cataract Refract Surg. 2000;26:1346-55.
17. Peng Q, Visessook N, Apple DJ, et al. Prévention chirurgicale de l’opacification de la capsule postérieure. Part 3 : Intraocular lens optic barrier effect as a second line of defense. J Cataract Refract Surg. 2000;26:198-213.
18. Holladay JT, Lang A, Portney V. Analysis of edge glare phenomena in intraocular lens edge designs. J Cataract Refract Surg. 1999;25:748-52.
19. Holladay JT, Zhao H, Reisin CR. Negative dysphotopsia : The enigmatic penumbra. J Cataract Refract Surg. 2012;38:1251-65.
20. Vamosi P, Csakany B, Nemeth J. Échange de lentilles intraoculaires chez les patients présentant des symptômes de dysphotopsie négative. J Cataract Refract Surg. 2010;36:418-24.
21. Burke TR, Benjamin L. Implantation de lentilles intraoculaires fixées au sulcus pour la gestion de la dysphotopsie négative. J Cataract Refract Surg. 2014;40:1469-72.
22. Masket S, Fram NR. La dysphotopsie négative pseudophaque : prise en charge chirurgicale et nouvelle théorie de l’étiologie. J Cataract Refract Surg. 2011;37:1199-1207.
23. Cooke DL, Kasko S, Platt LO. Résolution de la dysphotopsie négative après capsulotomie antérieure au laser. J Cataract Refract Surg. 2013;39:1107-9.
24. Folden DV. Capsulectomie antérieure au laser Neodymium:YAG : option chirurgicale dans la gestion de la dysphotopsie négative. J Cataract Refract Surg. 2013;39:1110-5.
25. Grayson, D. Les tenants et aboutissants de l’explantation du cristallin. Rev Ophthalmol. 2011;18(10):36.
26. Leysen I, Bartholomeeusen E, Coeckelbergh T, Tassignon MJ. Résultats chirurgicaux de l’échange de lentilles intraoculaires. Five-year study. J Cataract Refract Surg. 2009;35:1013-8.
Laisser un commentaire