Association du lédipasvir et du sofosbuvir pour le traitement de l’infection par le virus de l’hépatite C de génotype 1 : Revue systématique et méta-analyse | Annals of Hepatology
On janvier 20, 2022 by adminIntroduction
Parmi les quelque 80 millions d’individus dans le monde souffrant d’une infection chronique par le virus de l’hépatite C (VHC), environ 46 % sont infectés par le génotype 1 du VHC, le plus difficile à traiter avec les régimes à base d’interféron1. En raison du faible taux de réussite du traitement et des effets secondaires attendus de l’interféron pégylé (PegIFN) et de la Riba-virine (RBV) pour le traitement des patients infectés par le VHC, des efforts ont été faits pour développer des schémas thérapeutiques sans IFN.2,3
Les schémas thérapeutiques contenant des inhibiteurs de protéase (IP) pour les patients infectés par le VHC de génotype 1 ont été introduits en 2011. Le traitement des patients atteints d’une infection par le VHC de génotype 1 a été révolutionné par l’introduction d’agents antiviraux à action directe (AAD) récents, notamment le sofosbuvir (SOF), un analogue de l’uridine nucléotidique inhibiteur de la polymérase NS5B du VHC, et le lédipasvir (LDV), un inhibiteur de la protéine NS5A codée par le VHC5,6. La meilleure option thérapeutique est celle qui présente le taux de réponse virologique soutenue (RVS) le plus élevé, avec des effets indésirables minimes et une durée de traitement la plus courte. L’association SOF/LDV pendant 12 ou 24 semaines, avec ou sans RBV, a permis d’améliorer le taux de RVS jusqu’à 95 %-100 % chez les patients n’ayant jamais été traités et chez ceux ayant déjà reçu l’IFN et infectés par le génotype 1 du VHC.7 Il est nécessaire de déterminer le taux exact de RVS pour le traitement par SOF/LDV en association avec ou sans RBV pendant 12 ou 24 semaines. En outre, l’effet de certains facteurs tels que la cirrhose, les antécédents de traitement et les substitutions associées à la résistance NS5A (RAS) sur le taux de RVS avec le régime mentionné devrait être évalué.
Une méta-analyse des études actuellement disponibles a été entreprise dans le but d’évaluer l’efficacité antivirale du traitement combiné SOF/LDV pendant 12 ou 24 semaines avec ou sans RBV chez les patients atteints d’une infection par le VHC de génotype 1.
Matériel et méthodesRessources de données et stratégies de recherche
Dans cette méta-analyse, nous avons effectué une recherche exhaustive et systématique dans les bases de données électroniques, notamment PubMed, Scopus, Science Direct et Web of Science, en utilisant des stratégies de recherche appropriées pour chaque base de données. Les mots-clés utilisés dans nos stratégies de recherche étaient axés sur les protocoles de traitement : SOF, LDV et leurs alternatives appropriées. En outre, pour trouver toute littérature grise existante, nous avons effectué une recherche sur Google Scholar et après avoir trouvé des titres apparentés, nous avons poursuivi notre recherche jusqu’à ce que nous trouvions 200 titres de série non apparentés. De plus, les références des publications extraites ont également été recherchées pour identifier toute publication manquante dans la recherche électronique. Notre dernière recherche a été effectuée le 2 septembre 2015 et aucune limitation de langue n’a été prise en compte. Une mise à jour de notre recherche a été effectuée le 16 mars 2016.
Critères d’éligibilité
Tout article ayant évalué l’effet d’un traitement combiné avec SOF/LDV avec ou sans RBV pendant 12 ou 24 semaines sur la RVS, 12 semaines après la fin du traitement (RVS12) chez les patients atteints d’une infection par le VHC de génotype 1 a été inclus dans cette méta-analyse. Les études dont les données permettaient une analyse en intention de traiter ont été incluses, sinon l’article a été exclu. Les éléments suivants ont été considérés comme nos critères d’exclusion ; les patients sous hémodialyse, les patients ayant déjà reçu un traitement à base de SOF, les patients ayant une infection simultanée par le virus de l’immunodéficience humaine (VIH), les patients atteints de cirrhose décompensée (Child-Pugh B et C8) et les antécédents de transplantation hépatique ou rénale.
Sélection des études, évaluation de la qualité et extraction des données
Selon la ligne directrice PRISMA pour le compte rendu des examens systématiques,9 tous les articles issus des résultats de recherche ont été examinés indépendamment par deux personnes (MSR-Z et KH) à chaque niveau de sélection (titre, résumé et texte intégral). À la fin de chaque niveau de filtrage, tout désaccord entre ces deux auteurs a été résolu par une discussion mutuelle. Cependant, les désaccords restants ont été résolus par consensus et discussion avec d’autres collègues (BB, SMA et HS).
Les données suivantes pour les participants de chaque bras des études incluses ont été extraites : le sexe, le génotype du VHC, la cirrhose, les polymorphismes près de l’IFNL3 (rs12979860), l’histoire du traitement précédent, la durée du traitement, l’âge, l’indice de masse corporelle (IMC) et le niveau d’ARN du VHC avant le traitement. En outre, certaines données pour chaque étude, y compris l’année de publication, la taille de l’échantillon et le nom du pays, ont été recueillies.
Analyse des données
L’intervalle de confiance (IC) pour le taux de RVS dans chaque étude a été calculé selon la méthode de Jeffrey et la moyenne des limites supérieure et inférieure de l’IC a été considérée comme une estimation ponctuelle de la RVS.11 Le test d’hétérogénéité a été effectué en utilisant le χ2 et le I-carré (plages de 0% à 100%). Une valeur P inférieure à 0,1 a été considérée comme statistiquement significative pour le χ2. Selon le résultat du test d’hétérogénéité, nous avons utilisé des modèles à effet fixe ou aléatoire pour déterminer le RVS12 groupé, l’intervalle de confiance à 95% et la valeur P. La méthode Trim and fill a été appliquée pour surmonter les éventuels biais de publication existants.12 STATA 10 a été utilisé pour effectuer toutes les parties de l’analyse des données.
RésultatsSélection des études
Un total de 606 articles a été identifié via la recherche dans les bases de données. Après avoir éliminé les doublons, 459 articles sont restés pour la sélection. La figure 1 montre le nombre d’articles à chaque niveau de sélection. Deux autres articles ont également été trouvés en actualisant la recherche. Vingt des articles en texte intégral ont été évalués pour leur éligibilité et finalement dix articles ont été inclus dans notre synthèse quantitative (méta-analyse).
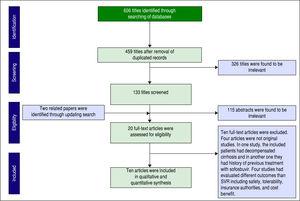
Criblage des articles basé sur la déclaration PRISMA.
Évaluation du risque de biais
Considérant le tableau 1, toutes les études incluses ont été catégorisées comme étant à faible risque (en prenant un score de plus de 7) et donc aucune étude n’a été exclue sur la base de l’évaluation de la qualité.
Évaluation du risque de biais pour les études incluses.
| Premier auteur (Référence) | Génération de séquences aléatoires (Biais de sélection) | Cachette d’attribution (Biais de sélection) | Chez le participant et le personnel (Perfomance). participants et du personnel (Biais de performance) | Binding de l’évaluation des résultats (Biais de détection) | Données incomplètes sur les résultats (Attrition) | Rapport sélectif (Biais de déclaration) | Co-interventions | Analyse de l’intention de traiter | Similitude des groupes au départ | Conformité | Chronologie des évaluations des résultats | Autres biais | Score | Conclusion |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Afdhal, N.31 | ? | ? | + | + | – | – | – | – | – | – | – | – | 8 | Basse |
| Afdhal, N. 7 | ? | ? | + | + | – | – | – | – | – | – | – | – | 8 | Faible |
| Gane, E.J.13 | + | ? | + | + | – | – | – | – | – | – | – | – | 8 | Low |
| Lawitz, E.19 | – | – | + | + | – | – | – | + | – | – | – | – | 9 | Low |
| Kowdley, K.6 | ? | ? | + | + | – | – | – | – | – | – | – | – | 8 | Basse |
| Bourliere, M.21 | – | – | – | – | – | – | – | + | – | – | – | – | 11 | Basse |
| Mizokami, M.20 | – | – | + | + | – | – | – | – | – | – | – | – | 10 | Basse |
| Stedman, C.A.M.14 | + | + | + | + | – | – | – | – | – | – | – | – | 8 | Basse |
| Kohli, M.15 | ? | ? | + | + | – | – | – | – | – | – | – | – | 8 | Basse |
| Chuang W.L.22 | ? | ? | + | + | – | – | – | – | – | – | – | – | 8 | Low |
Charactéristiques des études incluses
Selon l’objectif de cette étude, nous avons montré les caractéristiques de chaque bras des articles inclus dans le tableau 2 (combinaison de SOF/LDV) et le tableau 3 (combinaison de SOF/ LDV/RBV).
Caractéristiques des études incluses pour la combinaison de Sofosbuvir plus Ledipasvir.
| Premier auteur (référence) | Historique du traitement précédent | Année de publication | Pays | Taille de l’échantillon | Age moyen (écart-type ou fourchette) | Sexe masculin (%) | IMC moyen (écart-type ou fourchette) | Durée du traitement (semaines) | ARNHV moyen, Log IU/mL (SD) | Cirrhose (%) | rs12979860 CC/CT+TTa | Génotype 1a/1bb du VHC |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Afdhal, N.31 | TE | 2014 | USA | 109 | 56 (24-67) | 74 (68) | 29 (19-47) | 12 | 6.5 (0,44) | 22 (20) | 0,1 | 3,73 |
| Afdhal, N.7 | TN | 2014 | USA | 214 | 52 (18-75) | 127 (59) | 27 (18-41) | 12 | 6.4 (0,69) | 34 (16) | 0,34 | 2,18 |
| Gane, E.J.13 | TE | 2014 | Nouvelle-Zélande | 10 | 61 (4,9) | 10 (100) | 31 (6.8) | 12 | 6,5 (0,6) | 10 (100) | 0,11 | 4 |
| Kowdley, K.6 | TN | 2014 | USA | 216 | 53 (20-71) | 128 (59) | 28 (19-45) | 12 | 6.4 (0,8) | 0 (0) | 0,35 | 3,9 |
| Lawitz, E.19 | TN | 2014 | USA | 19 | 46 (11,6) | 11 (58) | 28,1 (5.8) | 12 | 6,1 (0,8) | 0 (0) | 0,05 | 8,5 |
| Lawitz, E.19 | TE | 2014 | USA | 19 | 54 (6,6) | 15 (79) | 31,4 (4.7) | 12 | 6,3 (0,5) | 11 (58) | 0,11 | 18 |
| Kohli, A.15 | TN | 2015 | USA | 20 | 57 (8) | 14 (70) | 25 (4) | 12 | NA | jusqu’à 20% | 0.33 | 1,22 |
| Mizokami, M.20 | MIX | 2015 | Japon | 171 | 60 (9,2) | 69 (40) | 23,3 (3.6) | 12 | 6,6 (0,5) | 41 (24) | 1,011 | 0,042 |
| Chuang, W.L.22 | TN | 2016 | Taiwan | 42 | 54 (30-75) | 13 (31) | 24 (19-36) | 12 | 6.6 (0,68) | 5 (12) | 5 | 0,10 |
| Chuang, W.L.22 | TE | 2016 | Taiwan | 43 | 55 (33-7) | 23 (55) | 24 (20-30) | 12 | 6.6 (0,55) | 4 (9) | 1,26 | 0,16 |
| Afdhal, N.31 | TE | 2014 | USA | 109 | 56 (25-68) | 74 (68) | 28 (19-41) | 24 | 6.4 (0,57) | 22 (20) | 0,17 | 3,54 |
| Afdhal, N.7 | TN | 2014 | USA | 217 | 53 (22-80) | 139 (64) | 27 (18-48) | 24 | 6.3 (0,68) | 33 (15) | 0,31 | 2,14 |
| Bourliere, M.21 | TE | 2015 | France | 78 | 57 (10,7) | 56 (72) | 26,3 (4.2) | 24 | 6,5 (0,6) | 77 (100) | 0,08 | 1,85 |
Caractéristiques des études incluses pour la combinaison de sofosbuvir plus ledipasvir et ribavirine.
| Premier auteur (référence) | Historique du traitement précédent | Année de publication | Pays | Taille de l’échantillon | Age moyen (écart-type ou fourchette) | Sexe masculin (%) | IMC moyen (écart-type ou fourchette) | Durée du traitement (semaines) | ARNHV moyen, Log IU/mL (SD) | Cirrhose (%) | rs12979860 CC/CT+TT* | Génotype 1a/1b du VHC** |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Afdhal,N.31 | TE | 2014 | USA | 111 | 57 (27-75) | 71 (64) | 28 (19-45) | 12 | 6.4 (0,54) | 22 (20) | 0,11 | 3,82 |
| Afdhal,N.7 | TN | 2014 | USA | 217 | 52 (18-78) | 128 (59) | 27 (18-42) | 12 | 6.4 (0,64) | 33 (15) | 0,53 | 2,55 |
| Gane, E.J.13 | TN | 2014 | Nouvelle-Zélande | 25 | 45 (9,2) | 8 (32) | 25.2 (4,3) | 12 | 5,9 (0,9) | 0 (0) | 0,56 | 4 |
| Gane, E.J.13 | TE | 2014 | Nouvelle-Zélande | 9 | 50 (13) | 7 (78) | 25.6 (2,3) | 12 | 25,6 (2,3) | 0 (0) | 0 | 8 |
| Gane, E.J.13 | TE | 2014 | Nouvelle-Zélande | 9 | 57 (5,2) | 8 (89) | 27,3 (0.5) | 12 | 27,3 (0,5) | 9 (100) | 0,2 | 3,5 |
| Lawitz, E.19 | TE | 2014 | USA | 21 | 52 (9,8) | 14 (67) | 31,5 (7.3) | 12 | 6,2 (0,4) | 11 (52) | 0,05 | 3,2 |
| Mizokami, M.20 | MIX | 2015 | Japon | 170 | 59 (9,5) | 73 (43) | 23,3 (3.1) | 12 | 6,6 (0,5) | 35 (21) | 0,86 | 0,024 |
| Stedman, C.A.M.14 | MIX | 2015 | Nouvelle-Zélande | 14 | 54 (NA) | 12 (86) | 27 (34-20) | 12 | 6.5 (5,6-7,5) | 1 (7) | 0,4 | 2,5 |
| Bourliere, M.21 | TE | 2015 | France | 77 | 56 (7,4) | 58 (75) | 27,9 (5.5) | 12 | 6,5 (0,5) | 76 (98,7) | 0,05 | 1,71 |
| Afdhal, N.31 | TE | 2014 | USA | 111 | 55 (28-70) | 68 (61) | 29 (19-50) | 24 | 6.5 (0,60) | 22 (20) | 0,19 | 3,82 |
| Afdhal, N.7 | TN | 2014 | USA | 217 | 53 (24-77) | 119 (54) | 26 (18-48) | 24 | 6.3 (0,65) | 36 (17) | 0,5 | 2,01 |
Evaluation des résultats du traitement
Nous avons calculé la RVS12 regroupée pour quatre schémas thérapeutiques du VHC, notamment 12 semaines de SOF/LDV (A), 24 semaines de SOF/LDV (B), 12 semaines de SOF/LDV/RBV (C) et 24 semaines de SOF/LDV/RBV (D). Le résumé des résultats de ces méta-analyses a été présenté dans le tableau 4.
- –
Régime de traitement A (12 semaines de sofosbuvir plus ledipasvir). Dix bras dans huit études ont été trouvés qui ont évalué le régime A (tableau 2). Il y avait une hétérogénéité significative entre les résultats des bras d’étude (χ2 = 35,01, P Figure 2A). Le test de Begg (P = 0,074) et le test de régression linéaire d’Egger (P
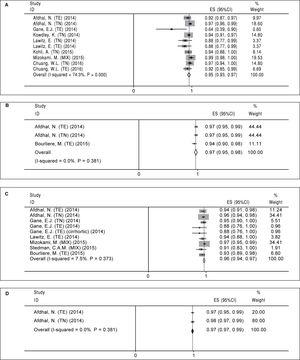 Figure 2.
Figure 2.SVR12 regroupés pour le régime Sofosbuvir plus Ledipasvir par durée de traitement et ajout de ribavirine. A. RVS12 regroupée pour 12 semaines de traitement par sofosbuvir plus ledipasvir. B. Ensemble des SVR12 pour 24 semaines de traitement par sofosbuvir plus lédipasvir. C. Ensemble des cas de RVS12 pour 12 semaines de traitement par sofosbuvir plus lédipasvir et ribavirine. D. Ensemble des SVR12 pendant 24 semaines de traitement par sofosbuvir plus ledipasvir et ribavirine. TE : expérience de traitement. TN : traitement naïf.
(0.39MB). - –
Régime de traitement B (24 semaines de sofosbuvir plus ledipasvir). Pour le schéma thérapeutique B, nous n’avons trouvé que trois bras dans trois articles (tableau 2). Aucune hétérogénéité significative n’a été trouvée concernant les études liées à ce régime (χ2 = 1,92, P = 0,38, I-carré = 0%). Sur la base d’un modèle à effet fixe, la RVS12 regroupée pour le régime B était de 97% (95%CI = 95%-98%) (Figure 2B). Étant donné que le nombre d’études incluses était faible (n = 3), nous n’avons pas effectué de tests connexes pour le biais de publication.
- –
Régime de traitement C (12 semaines de sofosbuvir plus ledipasvir et ribavirine). Neuf bras d’étude dans sept articles ont été trouvés pour ce type de régime (tableau 3). Comme aucune hétérogénéité significative n’a été trouvée (χ2 = 8,64, P = 0,37, I-carré = 7,5 %), un modèle à effet fixe a été utilisé et la RVS12 regroupée a été calculée à 96 % (95 % IC = 94 %-97 %) (Figure 2C). Il y avait un biais de publication selon les tests de régression linéaire de Begg (P = 0,009) et d’Egger (P = 0,001). Sur la base de la méthode du trim and fill, la RVS12 regroupée a été calculée à 96% (95%CI = 94%-97%).
- –
Régime de traitement D (24 semaines de sofosbuvir plus ledipasvir et ribavirine). Comme le montre le tableau 3, il y avait deux bras d’étude dans deux articles pour ce régime. Il n’y avait pas d’hétérogénéité significative concernant les résultats de ces deux études (χ2 = 0,77, P = 0,38, I-carré = 0%) et selon le modèle à effet fixe, la RVS12 regroupée a été calculée à 98% (95%CI = 97%-99%) (Figure 2D). En raison du petit nombre d’études incluses (n = 2), nous n’avons pas pu effectuer les tests connexes de biais de publication.
Résumé des méta-analyses du taux de réponse virologique soutenue pour la combinaison de sofosbuvir et de ledipasvir.
| Regime | Utilisation de la ribavirine | Durée du traitement (Semaines) | Taux de RV (%) | 95%CI (%) |
|---|---|---|---|---|
| A | Non | 12 | 95 | 93-97 |
| B | Non | 24 | 97 | 95-98 |
| C | Oui | 12 | 96 | 94-97 |
| D | Oui | 24 | 98 | 97-99 |
Effet des paramètres de base sur la réponse virologique soutenue
- –
Cirrhose. Dans la plupart des bras d’étude pour ces quatre régimes de traitement mentionnés, l’ensemble des patients étaient cirrhotiques ou non et nous n’avons donc pas pu effectuer une méta-analyse de l’odds ratio (OR). Cependant, nous avons combiné les données de chaque bras liées à chaque régime de traitement et avons finalement calculé l’OR pour l’effet de la cirrhose sur la RVS12 en utilisant la méthode de Peto. En considérant la figure 3A, seulement dans le régime de traitement A, la cirrhose a eu un effet significatif sur le SVR12 (OR = 0,21, 95%CI = 0,07-0,66).
 Figure 3.
Figure 3.Effet de la cirrhose et des antécédents de traitement sur la réponse virologique soutenue pour le régime sofosbuvir plus ledipasvir. A. Effet de la cirrhose sur la réponse virologique soutenue. B. Effet des antécédents de traitement sur la réponse virologique soutenue.
(0.17MB). - –
Antécédents de traitement. Nous avons évalué l’effet des antécédents de traitement sur la RVS12. La figure 3B montre les données combinées relatives à chaque régime de traitement et les OR (selon la méthode de Peto) liés à l’effet des antécédents de traitement. Sur la base de cette analyse, les antécédents de traitement n’ont pas eu d’effet significatif sur la RVS12 dans tous les régimes.
- –
Substitutions associées à la résistance NS5A. Les données concernant les RAS de la NS5A ont été extraites des études incluses qui ont évalué les RAS au départ. Comme les données sur cette question n’étaient pas disponibles pour l’évaluation de chaque régime (A, B, C et D), nous avons inévitablement étudié l’effet des SRA sur le régime principal SOF/ LDV avec ou sans RBV pendant 12 ou 24 semaines. Les données de trois articles n’ont pas été incluses dans cette analyse : Gane et al.13 en raison de l’ajout d’un autre médicament (GS-9669) au régime SOF/LDV dans deux bras d’étude, Stedman et al.14 en raison de l’indisponibilité des données d’évaluation des SRA sur la RVS et Kohli et al.15 en raison de données inadéquates sur le nombre de patients ayant une RVS et les SRA NS5A. De plus, Kowdley et ses collègues6 ont évalué l’effet du SOF/LDV pendant 8 semaines dans un bras de leur étude et comme nous n’avons pas pu séparer les données rapportées sur les RAS NS5A et la RVS de ce bras, nous avons extrait toutes les données de cette étude et les avons incluses dans cette méta-analyse. Selon la figure 4, les SAR NS5A ont eu un effet de réduction significatif sur la RVS dans le régime SOF/LDV (OR = 0,31, IC 95 % = 0,2-0,5). Il n’y avait pas d’hétérogénéité entre les résultats des études concernant la détection des NS5A RAS au départ et la réponse au traitement. De plus, sur la base des tests de Begg (P = 0,65) et d’Egger (P = 0,67), aucun biais de publication n’a été constaté.
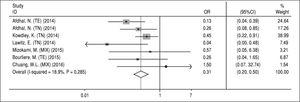 Figure 4.
Figure 4.Effet des substitutions associées à la résistance NS5A sur la réponse virologique soutenue pour le régime sofosbuvir plus ledipasvir.
(0,12MB).
Discussion
La méta-analyse actuelle a montré la haute efficacité de la thérapie combinée SOF/LDV chez les patients atteints d’une infection chronique par le génotype 1 de l’hépatite C. L’ancien traitement standard de l’infection par le génotype 1 du VHC était le PegIFN et le RBV avec un taux de RVS inférieur à 60% chez les patients atteints d’une infection par le génotype 1 du VHC et le traitement s’accompagnait de nombreux effets secondaires.16
La reconnaissance des protéines clés dans le cycle de réplication du VHC a permis de cibler ces protéines et d’inhiber la production de virions.17 Les régimes de traitement du VHC ont connu une longue histoire depuis les régimes à base d’IFN jusqu’aux régimes sans IFN. Les régimes de traitement du VHC ont connu une longue histoire, depuis les régimes à base d’IFN jusqu’aux régimes sans IFN. L’objectif de disposer d’un traitement sans IFN pour l’infection par le VHC de génotype 1 a été atteint avec l’introduction et l’approbation du régime SOF/LDV en 2014.18
Le SOF/LDV peut être utilisé avec ou sans RBV et dans différentes durées de traitement (12 ou 24 semaines).7 Certains facteurs importants peuvent être pris en compte pour choisir le régime approprié, comme l’existence d’une cirrhose et la contre-indication du RBV. Cependant, le coût de ce régime est un autre facteur considérable pour choisir la durée du traitement. Il est intéressant de noter que dans l’étude actuelle, il a été démontré que le taux de RVS dans tous les régimes de 12 ou 24 semaines avec ou sans RBV était égal et supérieur à 95 %, notamment : 95 % pour 12 semaines de traitement avec SOF/LDV, 97 % pour 24 semaines de traitement avec SOF/LDV, 96 % pour 12 semaines de traitement avec SOF/LDV/RBV et 98 % pour 24 semaines de traitement avec SOF/LDV/RBV. Il est vrai que l’ajout de RBV au SOF/LDV ou la prolongation du SOF/LDV jusqu’à 24 semaines peut entraîner une légère augmentation du taux de RVS12 de 95% à 96%. Cependant, dans l’étude actuelle, il a été observé que la cirrhose (Child-Pugh A) peut avoir un impact (OR = 0,21) sur le taux de RVS12 uniquement dans un régime de 12 semaines de traitement par SOF/LDV. En conséquence, nous recommandons de traiter les patients cirrhotiques (Child-Pugh A) avec SOF/LDV/RBV pendant 12 semaines ou avec SOF/LDV pendant 24 semaines en raison de la contre-indication du RBV et du problème de prix, alors qu’il semble que le traitement des patients non cirrhotiques avec SOF/LDV pendant 12 semaines soit acceptable. Dans cette méta-analyse, l’impact des antécédents de traitement (autres que les régimes à base de SOF) sur la réussite du traitement n’a été observé dans aucun des quatre régimes de SOF/LDV. Par conséquent, la sélection de la durée du traitement ou l’ajout de RBV au régime SOF/LDV en fonction des antécédents de traitement antérieur avec PegIFN/RBV ou des régimes contenant des IP n’est pas recommandée.
Dans cette étude, nous avons recueilli les données pour évaluer l’impact des NS5A RAS de base sur la réussite du traitement ; cependant, dans aucune de ces études, les données pour l’évaluation de la résistance n’ont été stratifiées en ce qui concerne le régime de traitement. Par conséquent, les données de tous les bras de chaque étude ont été incluses dans cette méta-analyse. Cette méta-analyse a révélé que les SARs de base du gène NS5A du VHC comme paramètre influençait le taux de réponse au traitement. Il est intéressant de noter que la plupart des patients en échec thérapeutique présentaient des SAR NS5A au moment de l’échec thérapeutique, ce qui montre le rôle majeur des SAR NS5A dans l’échec thérapeutique des patients traités par LDV6,7,19-22. Cependant, l’utilité clinique de l’évaluation des RAS NS5A avant de commencer le traitement n’est pas encore définie peut-être en raison du taux élevé de réponse au traitement par SOF/LDV et de la très faible spécificité de l’évaluation des RAS NS5A pour la prédiction de l’échec du traitement.
L’introduction d’autres DAA et de régimes sans IFN et leur approbation pour le traitement des patients atteints d’une infection par le VHC de génotype 1 se sont poursuivies après l’approbation de SOF/LDV. En décembre 2014, l’association Ombitas-vir/Paritaprevir-r/Dasabuvir (3 antiviraux à action directe ; 3D) pour l’infection par le VHC de génotype 1 avec une efficacité supérieure à 95 % a été approuvée.23 En janvier 2016, le traitement combiné avec Grazoprevir/Elbasvir (GZR/EBR) avec un taux de RVS d’environ 95 % a été approuvé.24 Étant donné, que le SOF a un métabolisme rénal, cet agent antiviral ne peut pas être administré en cas de maladie rénale chronique (clairance de la créatinine 2) et le 3D et le GZR/EBR sont les alternatives pour le traitement des patients atteints de maladie rénale chronique et d’infection par le VHC de génotype 1.25,26. En outre, d’autres combinaisons d’AAD telles que SOF/Daclatasvir (27) et SOF/ Velpatasvir28 ont été disponibles en tant que régimes de traitement pan-génotypiques.
En conclusion, le traitement du génotype 1 du VHC avec la combinaison SOF/LDV entraîne une réponse au traitement élevée (≥ 95 %). La décision d’ajouter le RBV au SOF/LDV et/ou de prolonger le SOF/LDV peut être prise en fonction de la présence d’une cirrhose, de la contre-indication du RBV et de la question du coût. Une meilleure identification des personnes infectées par le VHC et un meilleur accès au traitement pour ces personnes peuvent contribuer à l’élimination du VHC.29 Le prochain objectif dans le domaine du traitement du VHC est le développement de nouveaux schémas thérapeutiques du VHC sans RBV avec une réponse au traitement prometteuse de 100% et sans réaction médicamenteuse.30
Reconnaissance
Contribution des auteurs : Concept et conception de l’étude : Mohammad Saeid Rezaee-Zavareh, Bita Behnava, Seyed Moayed Alavian et Heidar Sharafi ; acquisition des données : Mohammad Saeid Rezaee-Zavareh et Khashayar Hesa-mizadeh ; analyse et interprétation des données : Mohammad Saeid Rezaee-Zavareh, Mohammad Gholami-Fesharaki et Heidar Sharafi ; rédaction du manuscrit : Mohammad Saeid Rezaee-Zavareh, Khashayar Hesamizadeh, Mohammad Gholami-Fesharaki et Heidar Sharafi ; révision critique du manuscrit pour le contenu intellectuel important : Bita Behnava et Seyed Moayed Alavian.
Déclaration des intérêts personnels des auteurs
Aucune déclaration.
Déclaration des intérêts de financement
Aucune déclaration.
.
Laisser un commentaire