Évaluer la santé cellulaire : Viabilité et prolifération
On octobre 11, 2021 by adminPartie I : Tests de viabilité et de prolifération
Viabilité et prolifération
La viabilité et la prolifération sont deux caractéristiques distinctes des cellules. La viabilité est une mesure du nombre de cellules vivantes dans une population alors que la prolifération est une mesure de la division cellulaire. Il convient de noter que toutes les cellules viables ne se divisent pas. Bien que la prolifération puisse facilement être interprétée comme la viabilité, l’absence de prolifération ne doit pas être automatiquement considérée comme un signe de mort cellulaire.
Évaluer la viabilité et la prolifération
1. Perméabilité membranaire
Une caractéristique des cellules mortes et mourantes est la dégradation des membranes cellulaires et nucléaires. De nombreux tests de viabilité utilisent cette caractéristique de la mort cellulaire pour distinguer les cellules viables des cellules non viables.
Les colorants d’acides nucléiques polaires, imperméables aux cellules, comme le DAPI, l’iodure de propidium (PI) et le 7-AAD, colorent les cellules mortes car ces colorants ne peuvent pénétrer que dans les cellules dont les membranes sont compromises. Le PI se lie à la fois à l’ARN et à l’ADN, tandis que le 7-AAD et le DAPI interagissent uniquement avec l’ADN. Ces colorants peuvent être utilisés en combinaison avec des tests qui détectent l’activité enzymatique, comme les substrats d’estérase abordés dans la section suivante, ou avec des indicateurs de viabilité perméables aux cellules pour marquer simultanément les cellules vivantes et mortes. Les dosages PI, DAPI et 7-AAD peuvent être lus à l’aide d’un microscope à fluorescence, d’un cytomètre en flux (figure 1) ou d’un lecteur de microplaques.
A.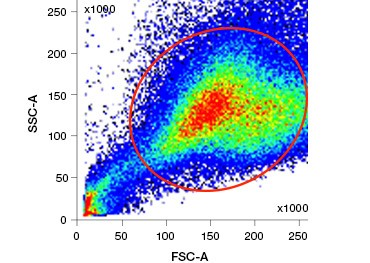
B.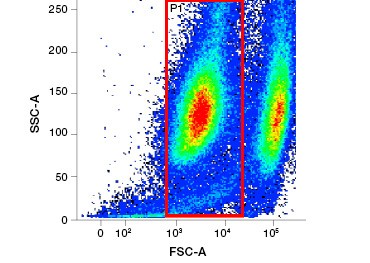
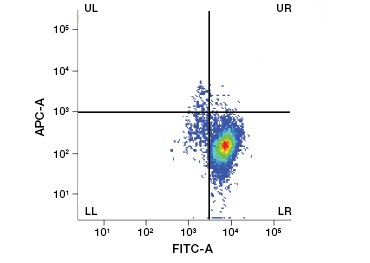
Fig. 1. La coloration à l’iodure de propidium améliore l’identification des cellules d’intérêt. Le calibrage des cellules vivantes à l’aide de la diffusion avant et latérale peut ne pas être suffisant pour éliminer les cellules mortes et une liaison non spécifique peut encore être présente (A). L’utilisation de colorants de viabilité tels que l’iodure de propidium peut aider à éliminer la liaison non spécifique (B). Les macrophages J774 ont été colorés pour CD11b et CD3, le cercle et le rectangle rouges indiquant la stratégie de déclenchement pour les cellules vivantes.
Le timing est critique lors de l’utilisation de ces colorants car la fraction de cellules colorées augmente pendant la coloration, les cellules continuant à mourir. Il convient de noter qu’aucun de ces colorants n’est fixable. Pour les applications qui nécessitent une fixation, les monoazides d’éthidium ou les colorants protéiques réactifs aux amines constituent un excellent choix.
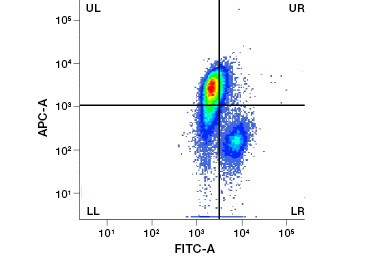
Les colorants protéiques imperméables aux cellules constituent une excellente alternative aux colorants d’acides nucléiques, car ils sont moins toxiques. Les colorants réactifs aux amines existent dans une large gamme de spectres d’excitation et d’émission et permettent donc une plus grande flexibilité dans la conception des panneaux de cytométrie en flux et de microscopie que les colorants ADN. Un autre avantage de ces colorants protéiques est qu’ils sont fixables (figure 2).
A.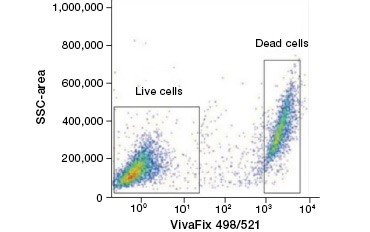
B.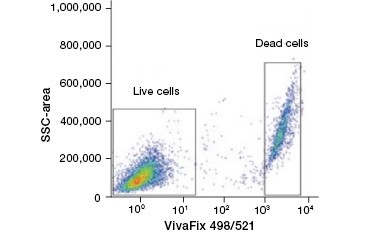
Fig. 2. Les taches protéiques permettent de distinguer les cellules vivantes des cellules mortes. En utilisant les tests de viabilité cellulaire VivaFix™, les populations de cellules vivantes et mortes peuvent être identifiées et ensuite analysées dans des cellules fixées (A) et non fixées (B) en utilisant la cytométrie en flux.
Une considération particulière lors de l’utilisation de la coloration protéique commune bleu trypan est que ce colorant colore les cellules viables au fil du temps d’une manière spécifique à la cellule. Il est donc essentiel d’optimiser les protocoles de bleu trypan pour chaque type de cellule et chaque expérience.
Tous ces colorants peuvent être utilisés sur des cellules et des tissus uniques et évalués en utilisant la microscopie à fluorescence ou la cytométrie en flux, bien que la coloration au bleu trypan soit plus couramment évaluée en comptant les cellules manuellement à l’aide d’un hémocytomètre et d’un microscope.
Contrairement aux colorants d’acides nucléiques imperméables aux cellules, les colorants d’acides nucléiques perméables aux cellules, tels que l’orange acridine, diffusent facilement à travers les membranes cellulaires et colorent ainsi l’ADN des cellules viables. Les cellules non viables ne sont pas colorées efficacement car leurs membranes compromises laissent le colorant se diffuser facilement hors d’elles. L’acridine orange est un colorant à double fluorescence qui émet une fluorescence verte lorsqu’il est lié à l’ADNdb et une fluorescence rouge lorsqu’il est lié à l’ADNs et à l’ARN. Lorsque vous utilisez l’acridine orange comme colorant de liaison à l’ADN, gardez à l’esprit qu’elle ne lie pas efficacement la chromatine condensée. Comme indiqué dans la section 6, ce colorant peut également être utilisé pour évaluer la capacité des cellules à maintenir un pH acide dans les lysosomes, un autre indicateur de la viabilité cellulaire. Les colorants d’acide nucléique perméables aux cellules peuvent être utilisés pour identifier et quantifier les populations de cellules viables par microscopie, cytométrie en flux ou dosage sur microplaque.
Les colorants imperméables et perméables aux cellules peuvent être utilisés en combinaison avec des anticorps marqués par fluorescence contre les protéines d’intérêt, ce qui permet d’inclure facilement des contrôles de viabilité cruciaux dans chaque expérience. Une considération clé lors de l’utilisation de ces colorants pour évaluer l’intégrité des membranes est que différents types de cellules ont des caractéristiques de perméabilité membranaire différentes. Par exemple, certains colorants d’ADN imperméables aux cellules colorent facilement les cellules eucaryotes mortes mais sont incapables de colorer les procaryotes dont la membrane est compromise.
L’intégrité membranaire peut également être évaluée à l’aide de tests enzymatiques. Un choix populaire consiste à évaluer la fuite de l’enzyme cytoplasmique lactate déshydrogénase (LDH) dans le milieu de culture lors de la mort cellulaire. Les tests colorimétriques de la LDH peuvent être réalisés en format microplaque et lus à l’aide d’un lecteur de microplaques ELISA.
La désintégration membranaire peut également être mesurée à l’aide de tests de libération de chrome. Ici, les cellules sont pré-marquées avec 51Cr avant le traitement expérimental. Le chrome se lie aux protéines cellulaires et est libéré dans le milieu de culture lors de la mort cellulaire. En déterminant la quantité de 51Cr libre par rapport à celle liée, à l’aide d’un compteur à scintillation, la mort cellulaire peut être mesurée quantitativement. Les cellules peuvent également être pré-marquées avec des colorants fluorescents. Ces méthodes souffrent parfois d’un bruit de fond élevé en raison de la libération spontanée des marqueurs ; elles ne sont utiles que pour les applications qui permettent le pré-marquage des cellules d’intérêt.
2. activité enzymatique
Une autre distinction clé entre les cellules viables et non viables est que les cellules viables sont actives sur le plan enzymatique. L’activité estérasique, mesurée à l’aide de substrats tels que le diacétate de carboxyfluorescéine (CFDA), est couramment utilisée comme indicateur de l’activité enzymatique globale. Le CFDA est un colorant non fluorescent, perméable aux cellules, qui est hydrolysé pour former la molécule fluorescente carboxyfluorescéine par des estérases intracellulaires non spécifiques présentes uniquement dans les cellules viables. Comme la carboxyfluorescéine est chargée négativement, elle est retenue de manière non covalente dans les cellules viables, ce qui entraîne une fluorescence verte.
Le CFDA-SE est un dérivé du CFDA qui est mieux retenu après hydrolyse. Son produit, le CFSE, possède des groupes esters succinimidyliques qui forment des liaisons covalentes avec les amines primaires des protéines intracellulaires, ce qui permet de suivre à long terme la viabilité des cellules. Comme le CFSE est retenu de manière covalente dans les cellules, il constitue un indicateur plus fiable de la viabilité cellulaire et une mesure populaire de la prolifération cellulaire, car sa fluorescence diminue de moitié à chaque division cellulaire (figure 3). Des améliorations au CFDA-SE ont été apportées avec des colorants de prolifération qui ont une plus grande rétention cellulaire, fournissent une plus grande résolution de la division cellulaire, et sont disponibles dans une large gamme de spectres d’excitation et d’émission pour permettre l’incorporation dans des applications fluorescentes multicolores telles que la cytométrie en flux.
A.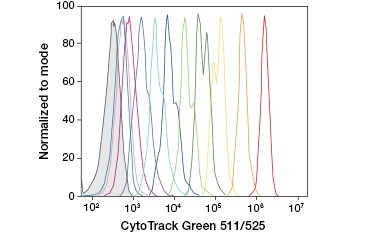
B.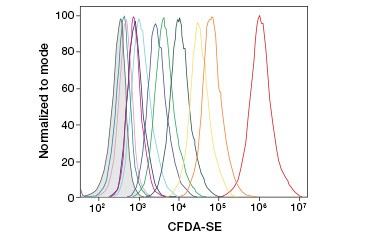
Fig. 3. Suivi des générations cellulaires par cytométrie de flux. Dix générations cellulaires peuvent être résolues en utilisant le test de prolifération cellulaire CytoTrack™ Green 511/525 (A) et jusqu’à huit en utilisant le CFDA-SE (B).
Plusieurs autres substrats fluorescents d’estérase, tels que les dérivés de la calcéine et le BCECF, sont disponibles avec des propriétés variables, notamment des différences dans les spectres d’excitation/émission. Comme la fluorescence du BCECF est sensible au pH, elle peut également suivre les changements de pH cytosolique.
En utilisant des substrats d’estérase perméables aux cellules, la viabilité peut être évaluée par microscopie à fluorescence et cytométrie en flux. Ces substrats peuvent également être appliqués à des échantillons de tissus ou utilisés dans des essais en microplaques à haut débit.
3. Activité métabolique
Une autre mesure courante de la viabilité cellulaire est l’activité métabolique, qui peut être évaluée en utilisant des sondes oxydables et réductibles.
La résazurine est un indicateur d’oxydoréduction (redox) populaire. Ce colorant perméable aux cellules peut être ajouté directement aux milieux de culture cellulaire, ce qui en fait un test rapide et pratique. Dans les cellules métaboliquement actives, la résazurine bleue et faiblement fluorescente est réduite pour former la résorufine, une molécule rose et hautement fluorescente. Ce changement peut être suivi à l’aide de tests fluorescents et colorimétriques. Comme la quantité de fluorescence est directement proportionnelle au nombre de cellules vivantes et respirantes, la résazurine est largement utilisée pour mesurer quantitativement la viabilité des cellules. La résazurine est une alternative pratique, plus sensible, plus stable et non toxique aux autres indicateurs redox tels que les sels de tétrazolium MTT et XTT. Contrairement aux tests à base de sels de tétrazolium, qui sont colorimétriques et ne peuvent être lus qu’à l’aide d’un lecteur de microplaques, les tests de viabilité à la résazurine peuvent être lus à l’aide de la cytométrie en flux ou de la microscopie à fluorescence. La résazurine et les sels de tétrazolium sont particulièrement utiles pour les applications à haut débit car la viabilité peut être évaluée dans des microplaques à l’aide d’un lecteur de microplaques (figure 4). Le XTT est souvent préféré au MTT pour les applications à haut débit car, contrairement au MTT, il produit un colorant soluble dans l’eau, éliminant ainsi l’étape de solubilisation qui est cruciale pour les tests MTT. La résazurine et les sels de tétrazolium sont le plus souvent utilisés pour évaluer la viabilité des cellules adhérentes et des cellules en solution.
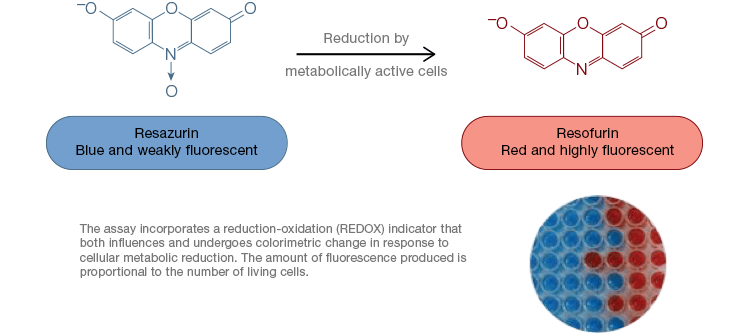
Fig. 4. Les essais d’oxydation de la résazurine non toxiques sont facilement évolutifs pour les applications à haut débit. L’oxydation de l’alamarBlue dans les cellules métaboliquement actives entraîne un changement colorimétrique du bleu au rouge ainsi qu’une augmentation de la fluorescence.
Les dihydrorhodamines, les -calcéines et les -fluorescéines sont des dérivés réduits de la rhodamine, de la -calcéine et de la -fluorescéine qui sont perméables aux cellules et incolores. Ces composés sont facilement oxydés en leur colorant parent fluorescent par les espèces réactives de l’oxygène présentes dans les cellules et les tissus vivants.
Une autre classe de tests de viabilité qui mesurent l’activité métabolique sont les tests ATP luminescents. Ceux-ci quantifient l’ATP libéré par les cellules lors de la lyse. Ils ne nécessitent pas de longues périodes d’incubation, sont extrêmement sensibles et sont généralement lus à l’aide d’un lecteur de microplaques.
Un facteur à prendre en compte lors de l’utilisation de tests qui mesurent l’activité métabolique est que l’activité métabolique peut différer dans différentes conditions de culture cellulaire. Des contrôles appropriés doivent donc être inclus pour tenir compte de ces différences.
4. Synthèse/reproduction de l’ADN
Une autre mesure de la viabilité, et une méthode populaire d’évaluation de la prolifération, est la quantification de l’incorporation de BrdU dans l’ADN nouvellement synthétisé. L’ADN contenant du BrdU est identifié à l’aide d’anticorps BrdU conjugués ou d’anticorps BrdU en combinaison avec un anticorps secondaire conjugué (figure 5). Ces tests permettent une variété de lectures car les anticorps peuvent être couplés à différents types d’indicateurs (fluorophores, peroxydases, etc.). Le marquage par des anticorps de marqueurs cellulaires spécifiques permet également de distinguer des populations proliférantes spécifiques. Les échantillons sont fixés après l’incubation, puis analysés par cytométrie en flux, microscopie à fluorescence, immunohistochimie ou lecteurs de microplaques. La cytométrie en flux permet d’attribuer les cellules à la phase G0/G1, S ou G2/M du cycle cellulaire en fonction de leur contenu en ADN total. L’utilisation de substrats de peroxydase chromogène permet de lire les tests sans fluoromètre. Et en utilisant -TdR au lieu de BrdU, ces essais peuvent être convertis en une lecture radiomarquée.
A.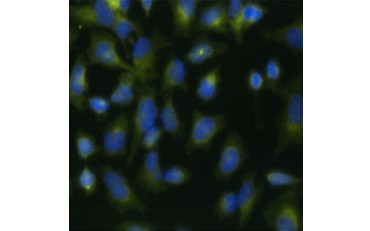
B.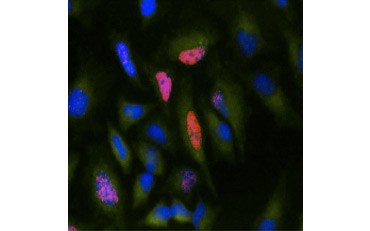
Fig. 5. Visualisation de l’incorporation de BrdU. Les cellules HeLa ont été traitées avec 10 µg de BrdU pendant 1 heure (B) ou laissées non traitées (A). Les cellules ont été colorées avec l’anticorps anti-BrdU de souris, clone Bu20a (MCA2483 ; dilution 1:25) et l’anticorps de chèvre anti-souris IgG (H/L) DyLight 549 conjugué (rouge) (STAR117D549GA ; dilution 1:50) a été utilisé comme anticorps secondaire. Le cytoplasme a été coloré avec l’anticorps anti-GAPDH de lapin (AHP1628 ; dilution 1:100) et l’anticorps conjugué IgG anti-lapin de mouton DyLight 488 (vert) (STAR36D488GA ; dilution 1:50) a été utilisé comme anticorps secondaire. PureBlu™ DAPI (1351303) a été utilisé comme contre-coloration nucléaire.
5. Expression des marqueurs de prolifération
Certaines protéines sont connues pour augmenter leur expression au cours de la prolifération cellulaire. Le Ki-67, par exemple, est exprimé dans le noyau des cellules en division mais n’est pas détectable pendant G0 et G1 (figure 6). De la même manière, la phosphorylation de l’histone H3 peut être utilisée pour identifier les cellules en phase M. D’autres marqueurs de prolifération couramment utilisés comprennent l’antigène nucléaire des cellules proliférantes (PCNA) et le minichromosome de maintenance 2 (MCM2). En utilisant des anticorps contre ceux-ci, d’autres marqueurs de prolifération clés ou des marqueurs de lignage cellulaire peuvent être évalués en utilisant l’ELISA, la cytométrie de flux, l’immunohistochimie, la microscopie à fluorescence et le Western blotting.
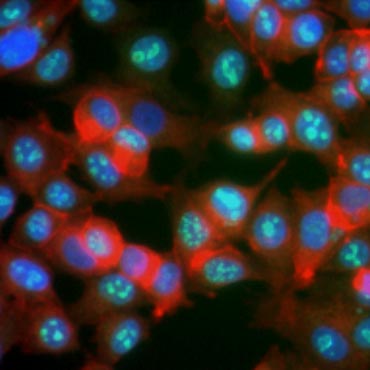
Fig. 6. Les anticorps contre Ki-67 identifient les cellules en prolifération. Coloration de cellules MCF-7 avec un anti Ki-67 humain (HCA006, vert) contre-coloré avec de la phalloïdine (rouge) et du Hoechst (bleu).
6. Potentiel membranaire et pH
Les cellules vivantes maintiennent activement des gradients ioniques à travers leurs membranes, générant des potentiels transmembranaires. Lorsqu’une cellule meurt, ces gradients ioniques sont perturbés. Ceci peut être évalué à l’aide de colorants potentiométriques. Le JC-1 est un colorant potentiométrique couramment utilisé. Dans les cellules saines, le JC-1 se localise dans les mitochondries, où il forme des agrégats fluorescents rouges. Lors de la rupture du potentiel de la membrane mitochondriale, le JC-1 se diffuse dans toute la cellule et existe sous forme de monomère fluorescent vert. Les esters éthyliques de tétraméthylrhodamine (TMRE) et les esters méthyliques de tétraméthylrhodamine (TMRM), comme le JC-1, se localisent dans les mitochondries des cellules saines et dans le cytoplasme des cellules mourantes. Contrairement au JC-1, ces colorants ne présentent pas de décalage dans leur spectre d’émission. Au contraire, la perméabilisation de la membrane externe des mitochondries entraîne une diminution de la fluorescence rouge du TMRM/TMRE.
Les cellules viables sont capables de générer et de maintenir un pH bas dans les organites acides de la cellule, comme le lysosome. Ceci peut être mesuré en utilisant des colorants acidotropes tels que l’orange acridine et le rouge neutre. L’utilisation de l’acridine orange doit tenir compte du fait que ce colorant se lie également à l’ADN et à l’ARN. Lorsqu’il se lie à des nucléotides à brin simple, l’acridine orange émet une fluorescence rouge ; lorsqu’il se lie à de l’ADN à double brin, il émet une fluorescence verte ; et lorsqu’il se lie à de l’ADN dans le lysosome, il émet une fluorescence orange.
Quoi qu’il en soit de la méthode choisie, il est extrêmement important d’inclure des contrôles appropriés lors de la réalisation de l’un des essais décrits ici, car les conditions expérimentales et le type de cellule peuvent modifier les performances de certains essais. Il faut toujours inclure des contrôles positifs et négatifs. Lorsque vous utilisez des sondes dans des solvants, incluez également des contrôles traités par le véhicule pour tenir compte des effets du solvant. Utilisez des contrôles spécifiques à l’application pour contrôler des facteurs tels que l’autofluorescence dans les expériences d’immunofluorescence et de cytométrie en flux et les contrôles de chargement pour le Western blotting.
Pour plus d’informations sur les tests de viabilité cellulaire et de prolifération de Bio-Rad, visitez notre page de gamme de santé cellulaire.
Lisez la partie II Évaluer la santé cellulaire : Apoptose
alamarBlue est une marque de commerce de Trek Diagnostic Systems. DyLight est une marque de commerce de Thermo Fisher Scientific.
Laisser un commentaire