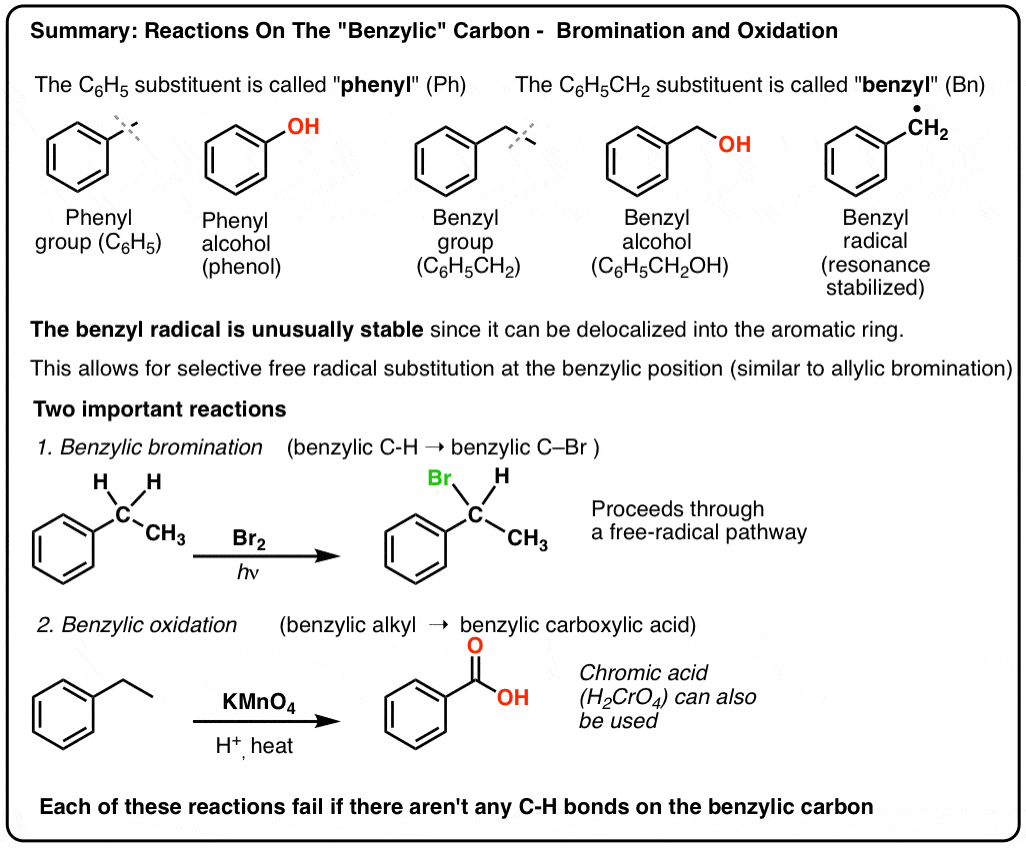
Reaktiot ”bentsyylisellä” hiilellä: brominoituminen ja hapettuminen
On 12 lokakuun, 2021 by adminAromaattisen renkaan vieressä oleva hiili – ”bentsyylinen” hiili – voi osallistua useisiin hyödyllisiin ja mielenkiintoisiin reaktioihin. Tänään annamme esimerkkejä ja mekanismeja kahdesta keskeisestä esimerkistä: bentsyylibromoinnista ja bentsyylihapetuksesta. Tässä lyhyt yhteenveto:
Sisällysluettelo
- Alkyyliryhmät = ”karkeus”
- Bentseenirenkaan vieressä olevissa alkyyliryhmissä on jotain erikoista
- ”Fenyyli” vs ”bentsyyli” : Mikä on ero?
- Benzyl Radicals Are Stabilized By Resonance; Phenyl Radicals Are Not.
- Benzylic (and Allylic) C-H Bonds Are Weak, Relative To Other Alkyl C-H Bonds
- Bentsyylinen brominoituminen
- Milloin ”bentsyylinen brominoituminen” EI toimi?
- Bentsyylisen brominoitumisen sovelluksia
- Bentsyylinen hapetus KMnO4:llä (tai H2CrO4:llä)
- Bentsyylinen hapetus vaatii bentsyylisen C-H-siteen
- Miksi tämä on tärkeää?
- Huomautukset
- Testiä itsellesi!
- (Edistyneempi) Viitteet ja lisälukemisto
Alkyyliryhmät = ”karkearehu”
Ravitsemuksessa ”karkearehu” on se, miksi kutsutte kaikkea selluloosaa ja kuitua, jota esiintyy elintarvikkeissa ja joka vain laukkaa elimistösi läpi tulematta varsinaisesti sulatetuksi.
Tämä kuvaa aika hyvin alkyyliryhmien käyttäytymistä suurimmassa osassa oppimistamme orgaanisen kemian reaktioista. Niiden kemia on ”tylsää”. Ne saattavat muodostaa molekyylin selkärangan ja kokonaisrakenteen, mutta niiden C-H-sidokset ovat inerttejä useimmissa reaktio-olosuhteissa.
Itse asiassa, jos palamista ei lasketa, melkeinpä ainoa alkyyliryhmien reaktio, jota käsittelemme orgaanisen kemian johdantokurssilla, on vapaaradikaalinen substituutio. Ja sekin reaktio on yleensä melko epäselektiivinen, varsinkin jos kyseessä on vapaaradikaalinen klooraus.
Olemme nähneet, että poikkeus tähän ”tylsään” käyttäytymiseen löytyy niin sanottujen ”allylisten” C-H-sidosten vapaaradikaalisesta bromoinnista . ”Allylinen” asema on hiili, joka on vierekkäin kaksoissidoksen kanssa (ei C-H itse kaksoissidoksessa! se on ”vinyyli” C-H).
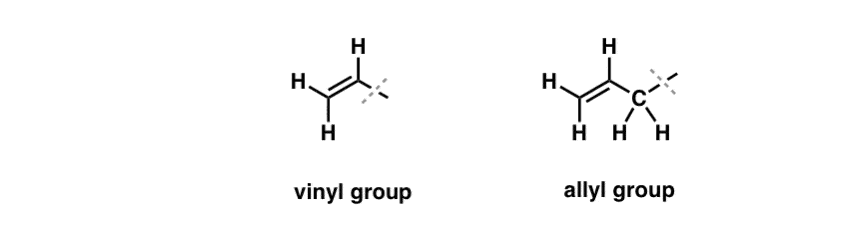
Miksi ”allylinen” asema on niin erityinen? Allyliset radikaalit, karbokationit ja anionit stabiloituvat huomattavasti resonanssin kautta. Allylisen radikaalin, karbokationin tai anionin orbitaali voi kohdistaa itsensä viereisen pi-sidoksen p-orbitaalien kanssa, jolloin syntyy suurempi ”pi-systeemi” ja varaus leviää laajemmalle alueelle.
Bentseenirenkaan vieressä olevissa alkyyliryhmissä on jotain erikoista
Mikä on syynä tähän pieneen muisteluretkeen? No, olemme hiljattain käyneet läpi Friedel-Craftsin alkylaatioreaktiota, enkä halua antaa teille vaikutelmaa, että alkyyliryhmän asettaminen bentseenirenkaaseen on synteettinen umpikuja.
Alkyyliryhmien ei tarvitse olla inerttejä! Kuten allyylihiilet, myös bentseenirenkaiden vieressä olevat alkyyliryhmät ovat erityisen reaktiivisia, ja tällä voi olla kaikenlaisia tärkeitä sovelluksia.
Tässä postauksessa käsittelemme kahta tärkeää reaktiota:
- Bentsyylibrominoituminen – aromaattisen renkaan vieressä olevan alkyyliryhmän vapaaradikaalinen brominoituminen
- Bentsyylihapetus – bentseenin vieressä olevan alkyyliryhmän täydellinen hapettuminen karboksyylihapoksi.
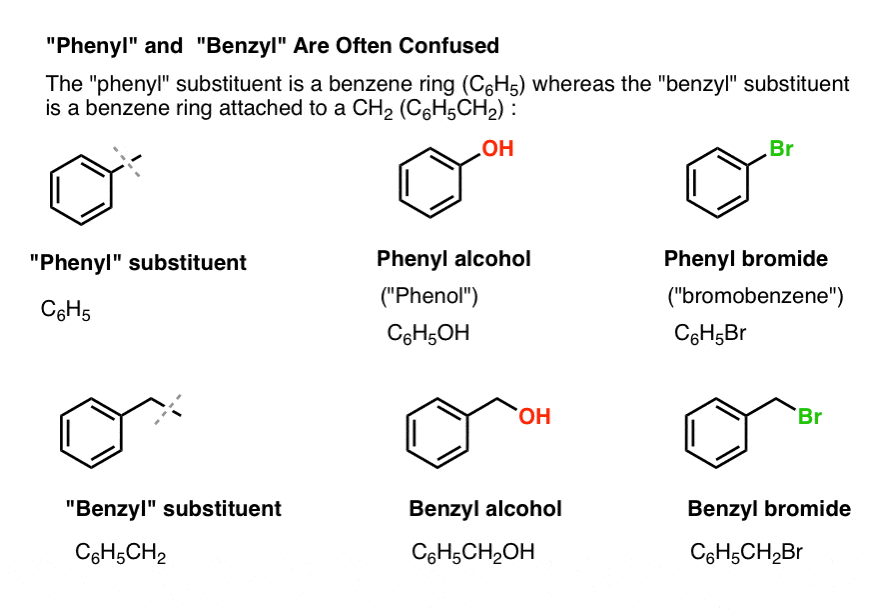
3. ”Fenyyli” vs. ”bentsyyli” : What’s The Difference?
Aluksi yksi nopea asiajärjestys. Hoidetaan pois tieltä muutama tärkeä nimikkeistö, koska ”fenyyli” ja ”bentsyyli” aiheuttavat paljon sekaannusta:
- Fenyyliryhmä (tai fenyylisubstituentti) on bentseeni miinus yksi vety: C6H5 . Renkaan hiilet ovat fenyylihiiliä, ja fenyylihiiliin kiinnittyneet vedyt ovat fenyyli-C-H-sidoksia. Se on analoginen vinyylin kanssa (ks. edellä).
- Bentsyyliryhmä on metyylibentseeni miinus vety: C6H5CH2 . Renkaan vieressä oleva hiili on bentsyylihiili, ja bentsyylihiileen kiinnittyneitä vetyjä kutsutaan bentsyylihydrogeeneiksi. Se on analoginen allyylille (yllä).
4. Bentsyyliradikaalit stabiloituvat resonanssin avulla; fenyyliradikaalit eivät.
Fenyylin ja vinyylin ja bentsyylin ja allyylin analogia ulottuu myös niiden radikaalien (sekä niiden karbokationien ja anionien) stabiilisuuteen.
- Fenyyliradikaaleja ei stabiloi resonanssi, koska radikaalin sisältävä orbitaali on suorassa kulmassa pi-systeemin orbitaaleihin nähden, eikä niiden välillä ole päällekkäisyyttä. Sp2-hybridisoituneilla hiilillä olevat radikaalit ovat yleensä vähemmän stabiileja kuin alkyylihiilillä olevat radikaalit. (Ks. viesti: Kolme tekijää, jotka horjuttavat vapaita radikaaleja )
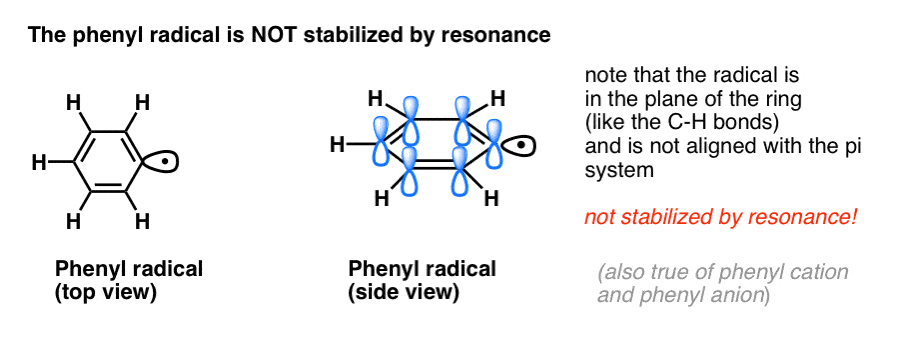
- Bentsyyliradikaalit ovat epätavallisen stabiileja, koska radikaalin sisältävä orbitaali voi olla linjassa bentseenirenkaan pi-järjestelmän kanssa, aivan kuten niiden allyyliserkuilla (tämä pätee myös bentsyylikationeihin ja anioneihin).
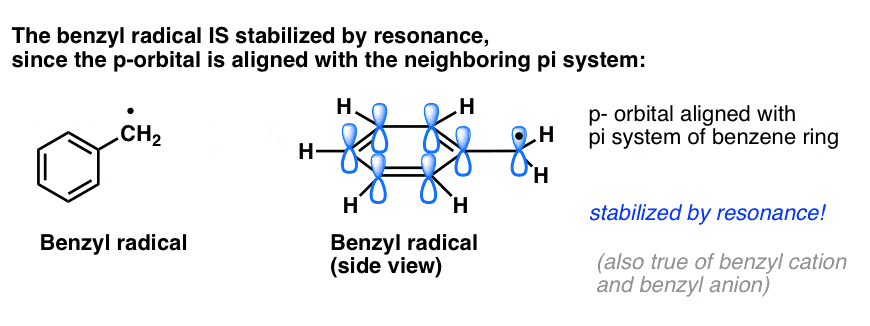
Bentsyylien (ja allyylien) C-H-sidokset ovat heikkoja suhteessa muihin alkyylien C-H-sidoksiin
Bentsyylien C-H-sidoksilla on sidoslujuudet (alias BDE:t, tai sidoksen dissosiaatioenergiat) ovat noin 90 kcal/mol, mikä on huomattavasti heikompi kuin tertiääristen C-H-sidosten (sidoslujuus 93 kcal/mol), sekundääristen C-H-sidosten (96 kcal/mol) ja primaaristen C-H-sidosten (100 kcal/mol). (Fenyyli-C-H-sidosten vahvuus on noin 113 kcal/mol, mikä taas heijastaa fenyyliradikaalien epävakautta ).
Koska sidoksen dissokaatioenergiat heijastavat C-H-sidoksen homolyyttisen pilkkomisen helppoutta (eli sitä, kuinka helppoa on dissosioida sidos kahdeksi vapaaksi radikaaliksi), tämä on toinen tapa sanoa, että bentsyyliradikaalit ovat erityisen helppoja muodostua suhteessa muihin alkyyliradikaaleihin.
Olemmekin aiemmin nähneet, että sama pätee myös allyylien C-H-sidoksiin . ’Allyylisessä brominoinnissa’ yksi kaksoissidoksen vieressä olevan alkyyliryhmän C-H-sidoksista muutetaan C-Br-sidokseksi käyttäen N-bromosukkinimidiä (NBS) ja valoa (hν) :
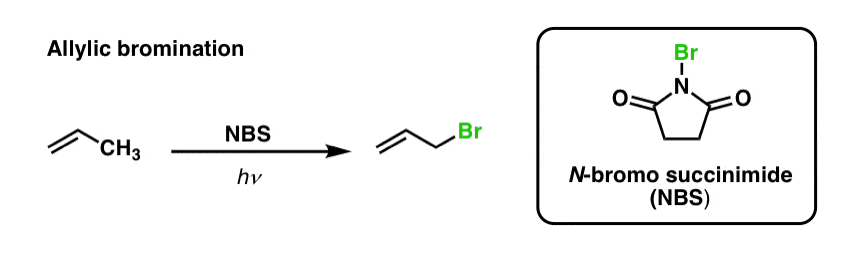
Reaktio on selektiivinen allyyliselle C-H:lle primaaristen, sekundaaristen ja tertiääristen C-H-sidosten läsnäollessa heikomman allylisen C-H-sidoksen voimakkuuden (89 kcal/mol) vuoksi.
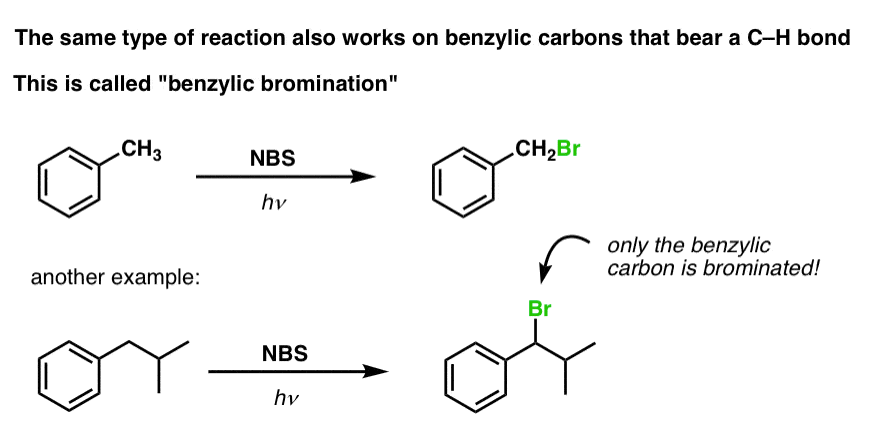
Bentsyylinen brominoituminen
Kaltainen prosessi toimii ”bentsyylisille” hiilille. Voimme käyttää NBS:ää (kuten edellä) tai yksinkertaisesti vain Br2:ta, koska aromaattiset renkaat eivät ole läheskään niin reaktiivisia Br2:n kanssa kuin kaksoissidokset ovat.
Kun se on muodostunut (”lämmön” tai ”valon” vaikutuksesta, joka käynnistää reaktion Br-Br:n homolyyttisen dissosiaation kautta), bromiradikaali Br- voi rikkoa heikommat bentsyyliset C-H-sidokset koskematta vahvempiin alkyyli-C-H-sidoksiin.
Tässä ovat esimerkiksi sen reaktiotuotteet tolueenin ja myös isopropyylibentseenin kanssa. Huomaa, että AINOASTAAN bentsyylihiili on bromattu. Kaikki muu jätetään rauhaan!
Bentsyylibrominoitumisen mekanismi on olennaisesti identtinen allyylibrominoitumisen kanssa, ja siinä on aloitus-, etenemis- ja lopetusvaiheet. (Klikkaa tästä nähdäksesi ponnahdusikkunakuvan mekanismista.)
(Lisää keskustelua, katso tämä viesti: Allyylinen brominoituminen )
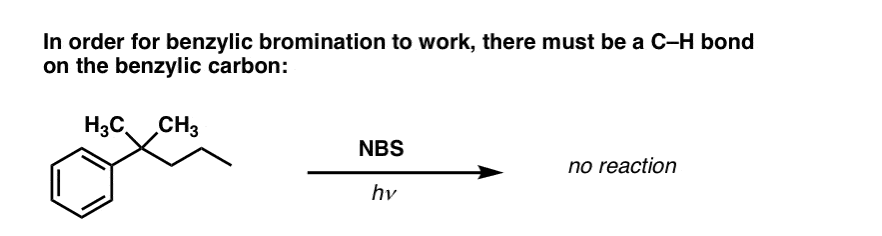
Milloin ”bentsyylibrominoituminen” EI toimi?
Koska tämän reaktion avain on (suhteellisen stabiilin) bentsyyliradikaalin muodostuminen, bentsyylibrominoituminen epäonnistuu substraateissa, joissa tämän radikaalin synnyttäminen C-H-sidoksen katkaisun kautta on mahdotonta.
Katsokaa esimerkiksi seuraavaa esimerkkiä. Miten bentsyyliradikaali voi mahdollisesti syntyä, kun bentsyylihiileen on kiinnittynyt kolme alkyyliryhmää? Se ei voi – ja reaktio epäonnistuu.
Bentsyylibromimoinnin sovelluksia
Miksi bentsyylibromimoinnista voisi siis olla hyötyä?
Noh, sen avulla voimme käyttää kaikkia alkyylihalogenidien reaktioita, joita käsittelimme Org 1:ssä – enimmäkseen substituutio- ja eliminaatioreaktioita – saadaksemme aikaan sellaisia tuotteita, joita olisi hankala sijoittaa suoraan aromaattiseen rengasrakenteeseen Friedel-Crafts-reaktioiden avulla.
Voidaan esimerkiksi käyttää bentsyylibrominointia SN2-reaktion käynnistämiseen esimerkiksi Friedel-Crafts-alkyloinnin jälkeen:
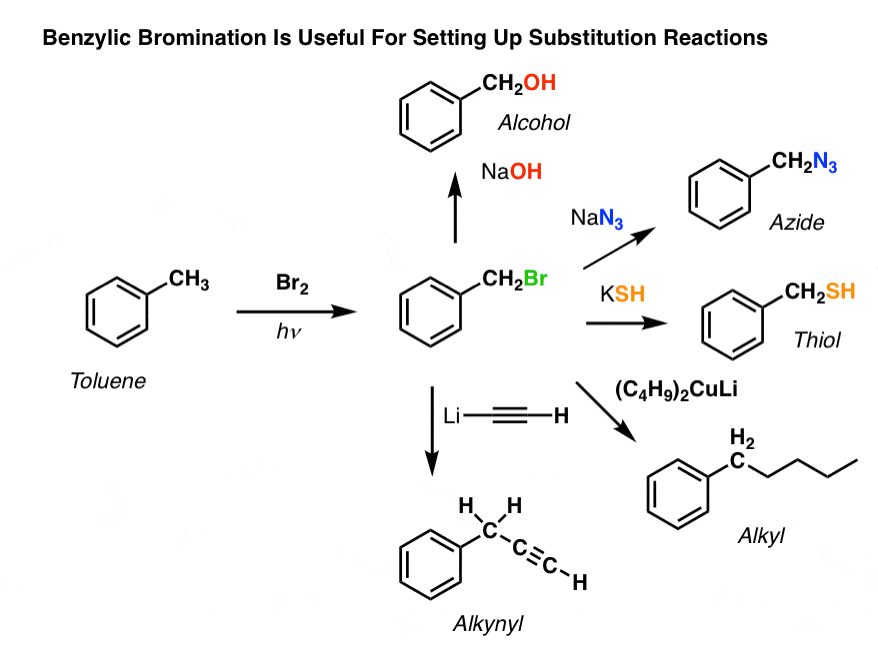
Näettekö, kuinka hyvän poistuvan ryhmän asentaminen bentsyylipositioon antaa meille kaikenlaisia vaihtoehtoja erilaisten funktionaalisten ryhmien asentamiseen?
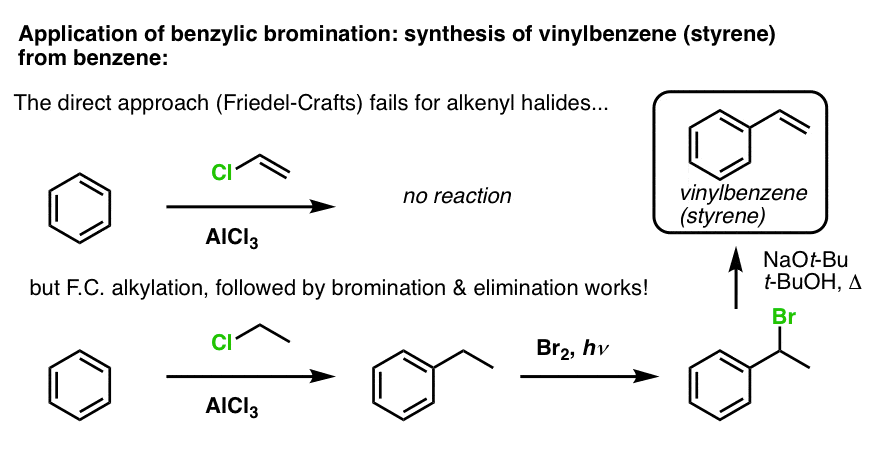
Toinen esimerkki on styreenin synteesi bentseenistä. Ensisilmäyksellä suorin lähestymistapa saattaa vaikuttaa olevan vinyylikloridin Friedel-Crafts-reaktio bentseenin kanssa. Mutta Friedel-Crafts ei toimi alkenyylihalogenideille (eli vinyylihalogenideille)! (vinyylikarbokationit ovat vähemmän stabiileja kuin alkyylikarbokationit).
Voidaan kiertää tämä este suorittamalla Friedel-Crafts-alkylointi etyylikloridilla, jonka jälkeen suoritetaan bentsyylibromointi ja sen jälkeen eliminointi (E2:n kautta, jollain NaOtBu/t-BuOH:lla), jolloin saadaan alkeeni:
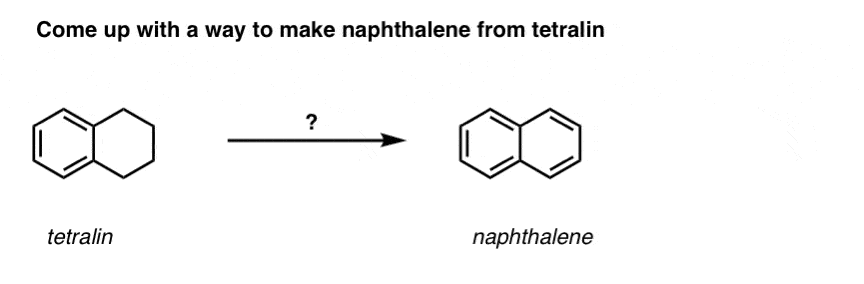
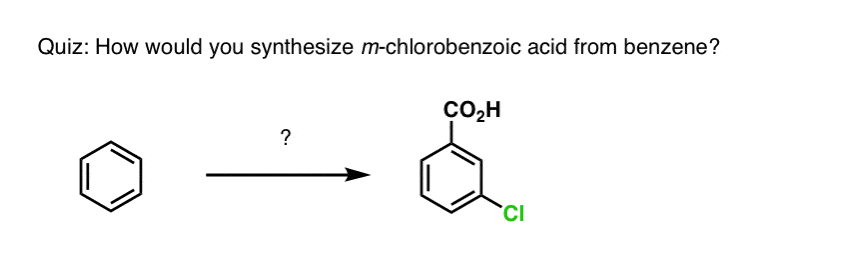
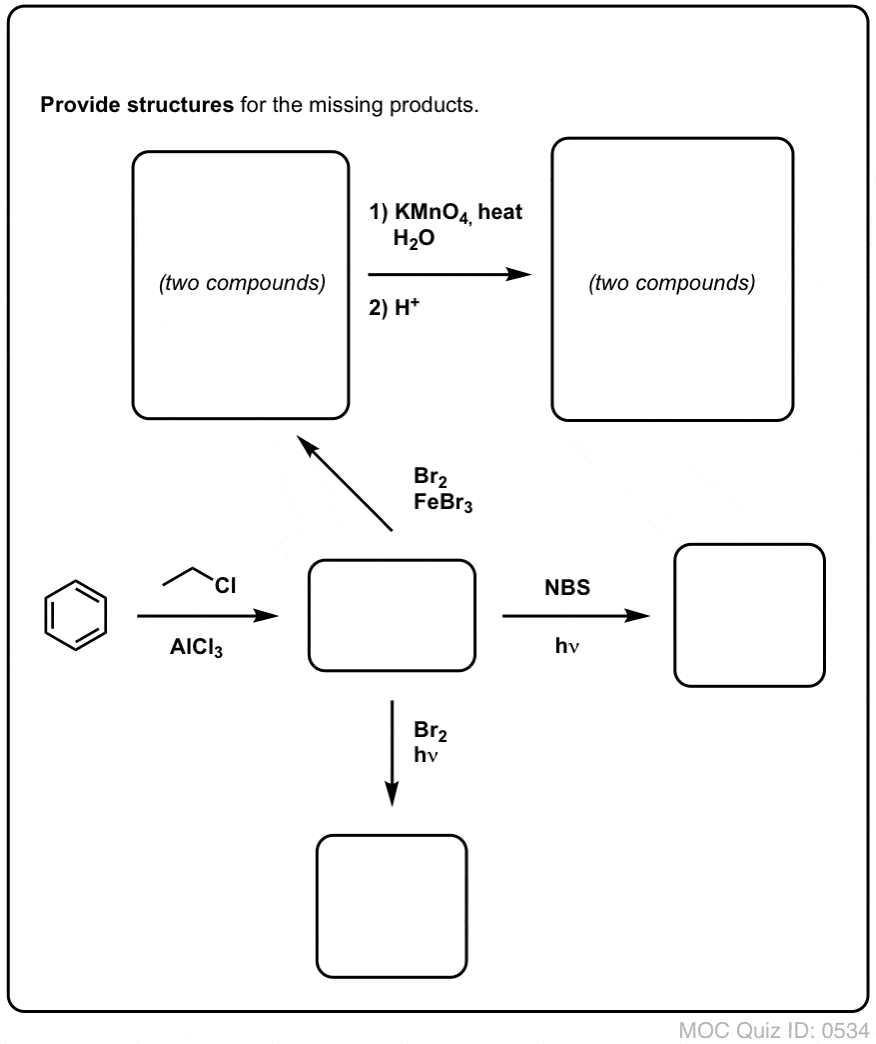
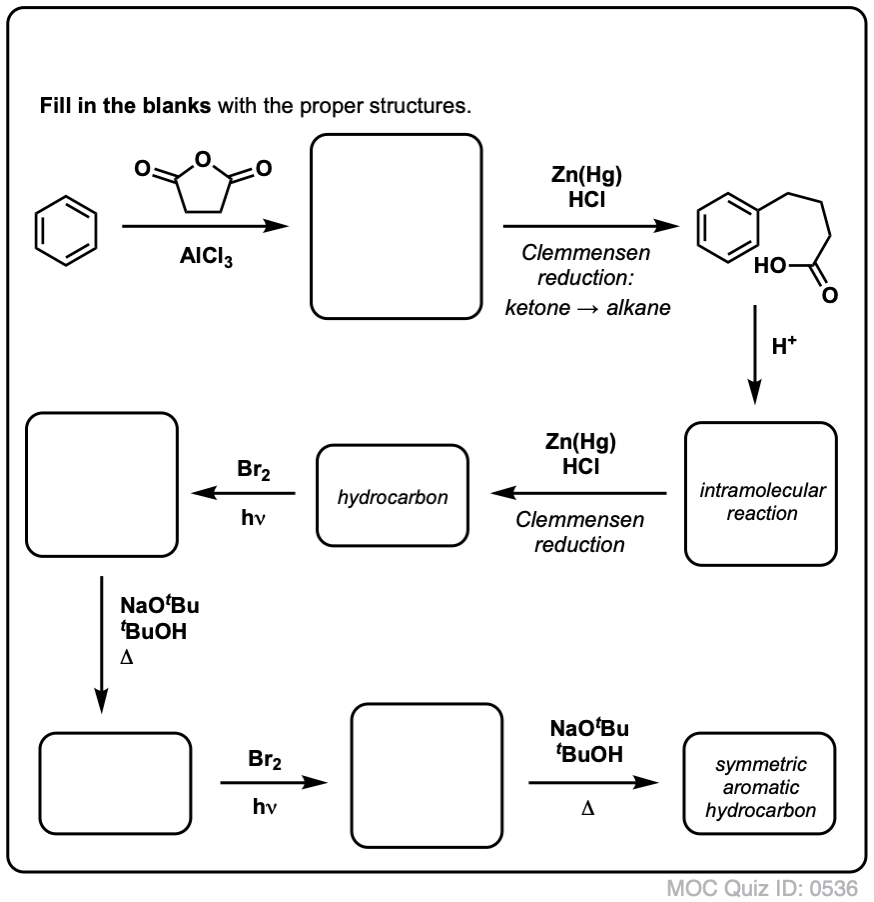
Yllämainitun perusteella tässä nopea tietokilpailu sinulle. Miten voisit muuntaa tetraliinin (alla vasemmalla) naftaleeniksi (alla oikealla)? Vastaa alaviitteissä.
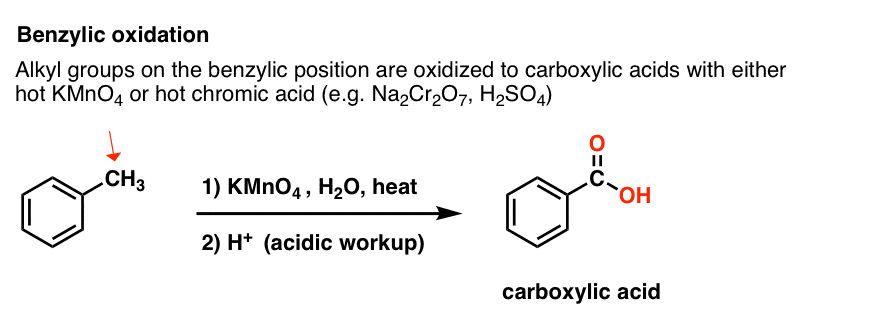
9. Minkälainen se on? Bentsyylihapetus KMnO4:llä (tai H2CrO4:llä)
Koska bentsyylien C-H-sidos on suhteellisen heikko, voit oikeutetusti kysyä, voidaanko tässä asemassa suorittaa muunlaisia reaktioita (brominoitumisen lisäksi).
Varmasti voidaan! Erinomainen esimerkki on bentsyylinen hapetus – jossa bentsyylinen C-H-sidos katkeaa ja muodostuu bentsyylinen C-O-sidos.
Nyt: bentsyyliseen hapetukseen on olemassa melko hellävaraisia reagensseja, jotka ovat kemiallinen vastine sille, että C-H-sidettä kutitellaan pois höyhenellä, jolloin tuloksena on bentsyylinen aldehydi tai ketoiini .
Tällaista bentsyylihapetusta ei käsitellä tyypillisellä orgaanisen kemian johdantokurssilla!
Sen sijaan bentsyylihapetuksen tärkein reagenssi, jota käsitellään useimmissa johdantokirjoissa, on kuuma kaliumpermanganaatti (KMnO4). Kuumaa kromihappoa (H2CrO4, joka muodostuu yhdistämällä dikromaattisuola, kuten Na2Cr2O7, ja vahva happo, kuten H2SO4) voidaan myös käyttää näihin tarkoituksiin.
KMnO4 ei ole hienovarainen. KMnO4 ei ole lempeä. KMnO4 ei ole lempeä.
Kuumaa KMnO4-liuosta on kuin pussi täynnä vihaisia piranjoja, jotka repivät molekyylistäsi kaiken lihan irti ja jättävät jäljelle vain luut. (Tarkemmin ajatellen se on vähän kuin maksasi! )
Kuuma KMnO4 katkaisee jokaisen bentsyylien C-H-sidoksen ja muuttaa sen C-O-sidokseksi. Esimerkiksi tolueenista saadaan tuotteeksi bentsoehappoa (karboksyylihappo).
Mutta se ei katkaise vain bentsyylien C-H-sidoksia. Voi ei. Se menee myös C-C-sidosten kimppuun; ainakin niiden, jotka eivät ole suoraan kiinni fenyylirenkaassa. Esimerkiksi para-dietyylibentseeni muuttuu para-bentseenidikarboksyylihapoksi.
Huomaa, että alkyyli-C-C-sidoksen on oltava irti, jotta tämä hapettuminen voi tapahtua! (se hapettuu todennäköisesti kokonaan CO2-kaasuksi).
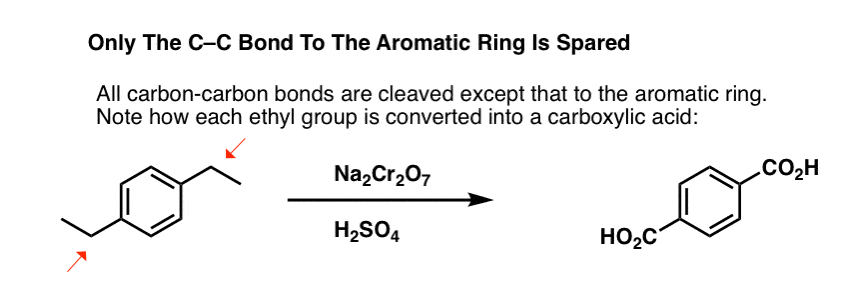
Mielenkiintoinen muunnos on syklisellä molekyylillä, kuten tetraliinilla; tuloksena on dikarboksyylihappo.
Tämä dikarboksyylihappo on nimeltään ftaalihappo.
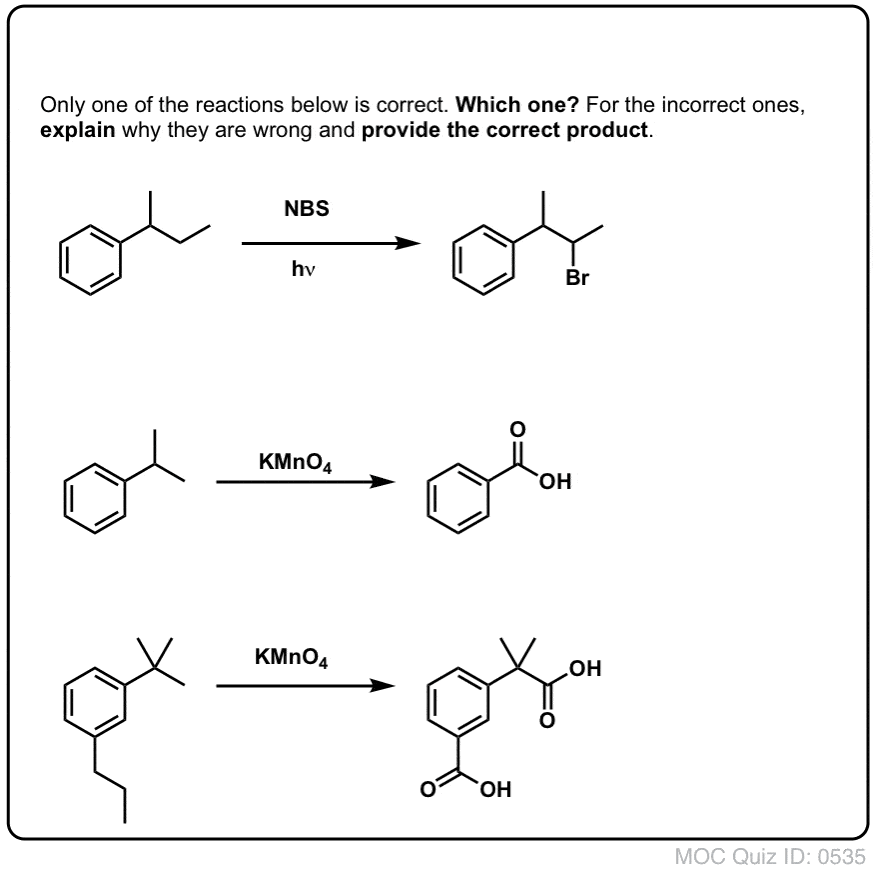
10. Bentsyylihapetus vaatii bentsyylisen C-H-sidoksen
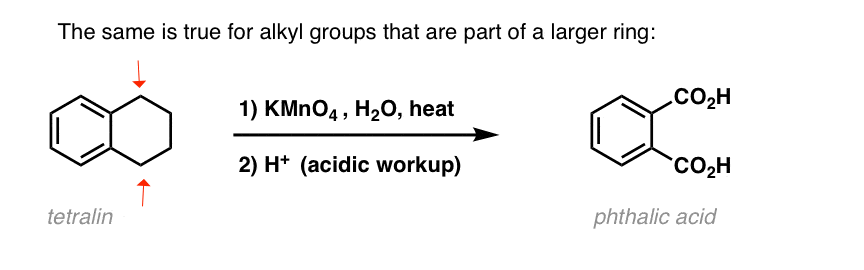
Kuten bentsyylibromoinnissa, reaktiota ei tapahdu, jos bentsyyliasemassa ei ole C-H-sidosta. Esimerkiksi t-butyylibentseenin kanssa reaktio epäonnistuu kokonaan:
Bentsyylihapetuksen täydellinen mekanismi on liian monimutkainen, pitkä ja epävarma esitettäväksi tässä, mutta ensimmäinen vaihe on lähes varmasti C-H-sidoksen homolyyttinen pilkkominen Mn=O:n toimesta, jolloin muodostuu bentsyyliradikaali.
Miksi tämä on tärkeää?
Bentsyylihapetus KMnO4:llä on raju reaktio, mutta siitä voi olla hyötyä. Se toimii parhaiten yksinkertaisten molekyylien kanssa, joissa ei ole herkkiä funktionaalisia ryhmiä ja jotka kestävät hyvin karkeaa käsittelyä.
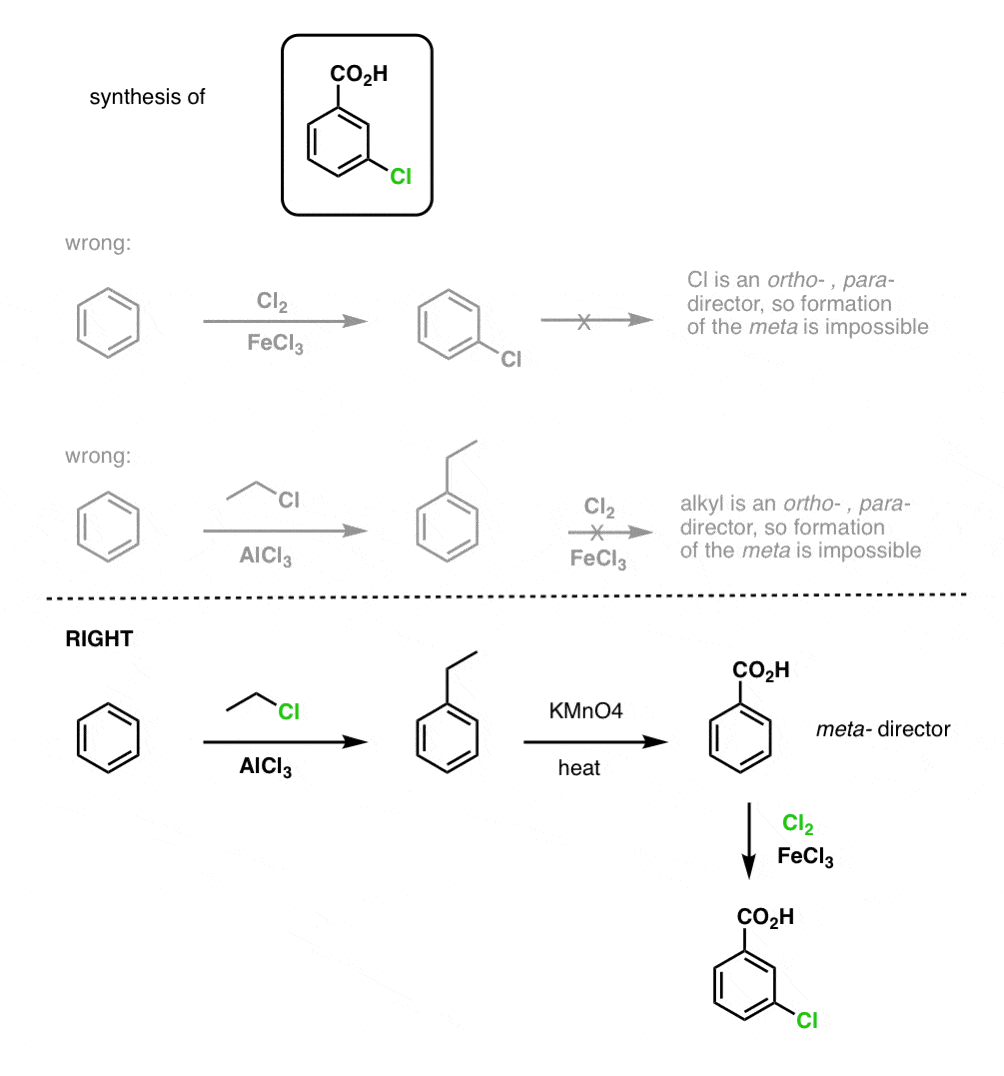
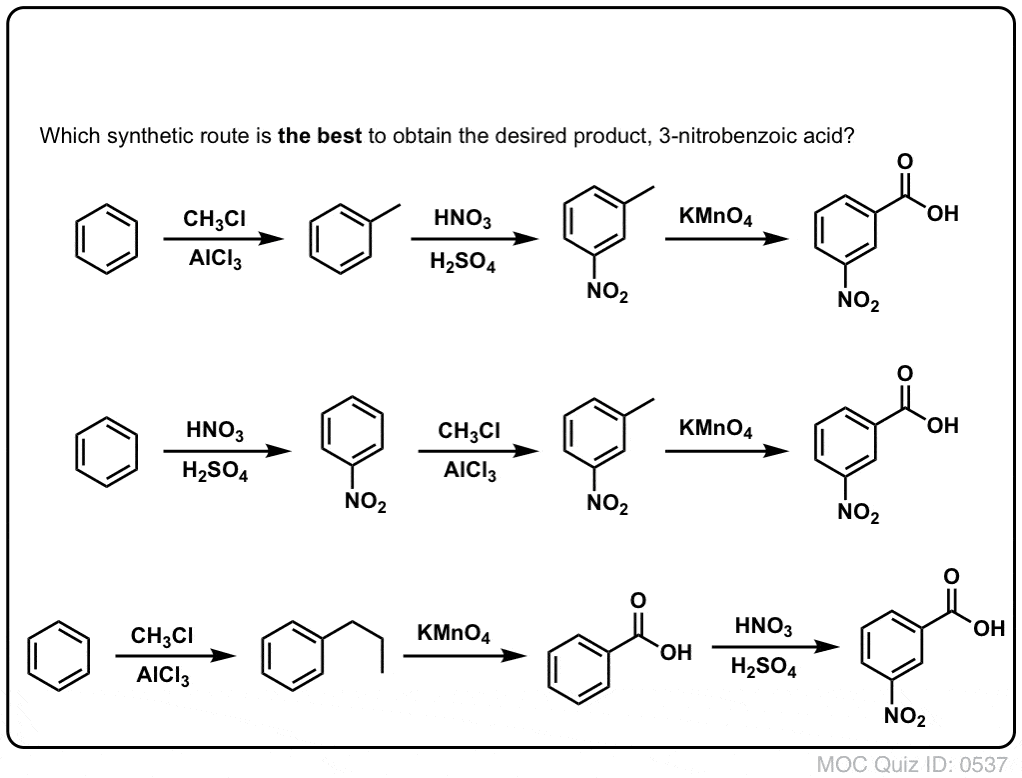
Huomioitavaa on ensinnäkin se, että karboksyylihappoja ei voi sijoittaa suoraan bentseenirenkaalle Friedel-Crafts-asylaation kautta, joten alkylointi ja sitä seuraava hapetus on käyttökelpoinen kiertotie.
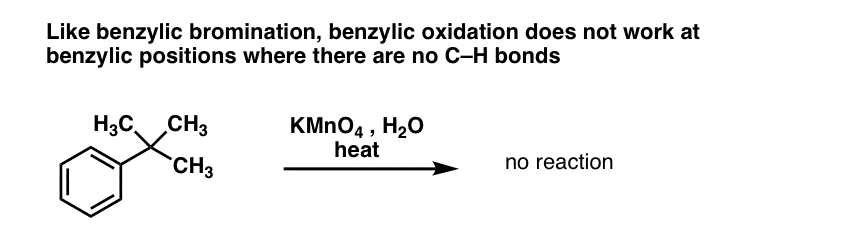
Toinen hyödyllinen toiminto synteesissä on se, että bentsyylihapetus muuttaa o- p- ohjaimen (alkyyliryhmä) metaohjaimeksi.
Vaikkapa seuraavan molekyylin synteesin edessä, miten menetellään? (vihje: siihen liittyy jossain vaiheessa bentsyylihapetus).
Aromaattisten yhdisteiden synteesistä kerromme vielä paljon lisää muutamassa postauksessa.
Jatkossa: Bentsyylikarbonyylien pelkistäminen – Clemmensenin ja Wolff-Kishnerin pelkistykset
Huomautuksia
”Kaalia” voidaan käyttää myös slangisanana kemiassa ”kaikesta siitä molekyylissä olevasta tavarasta, jonka voi jostain syystä turvallisesti sivuuttaa”. Esimerkiksi brystatiini on molekyylin peto, joka on lupaava syöpälääkkeenä. Ongelma on se, että tarvitaan tonneittain harvinaista bryozoaa, jotta saataisiin kunnollinen määrä bryostatiinia, eikä se riitä kliiniseen tutkimukseen ihmisillä. Niinpä useat ryhmät ovat pyrkineet valmistamaan yksinkertaisempia ja helpommin syntetisoitavia ”bryologeja”, joissa on poistettu se ”kaali”, joka ei ole olennaista kasvainvastaisen aktiivisuuden kannalta.
Br2 ei yleensä reagoi aromaattisten renkaiden kanssa ilman Lewishappokatalyyttiä. Kuitenkin jos läsnä on voimakas aktivoiva ryhmä (kuten OH, NR2 jne.), rengasta voi tapahtua jonkin verran brominoitumista, erityisesti kohotetuissa lämpötiloissa.
Hauska fakta: ”Bentsyylihapetus” on vastaus arvoitukseen, miksi metyylibentseeni (tolueeni) ei ole läheskään yhtä voimakas karsinogeeni kuin bentseeni. Tämä johtuu siitä, että maksassasi on sytokromi p450 -entsyymejä (jotka sisältävät korkeassa hapetusasteessa olevia rautalajeja), jotka voivat hapettaa bentsyyli-CH3-ryhmän vesiliukoisemmaksi karboksyylihapoksi, jolloin munuaiset voivat poistaa sen.
Tämä vaatii kaksi hapetusta ja kaksi poistoa. Varovainen tapa tehdä se on hapettaa (eli brominoida) kerran ja sitten eliminoida, jolloin saadaan alkeeni. Alkeeni voitaisiin sitten bromata uudelleen (käyttäen NBS:ää, jotta vältettäisiin kaksoissidoksen bromaantuminen), jolloin saataisiin toinen bromaus (tässä esitetty bentsyylibromaustuote, mutta myös allyyli on mahdollinen), joka voitaisiin käsitellä emäksellä, jolloin saataisiin aromaattista naftaleenia.
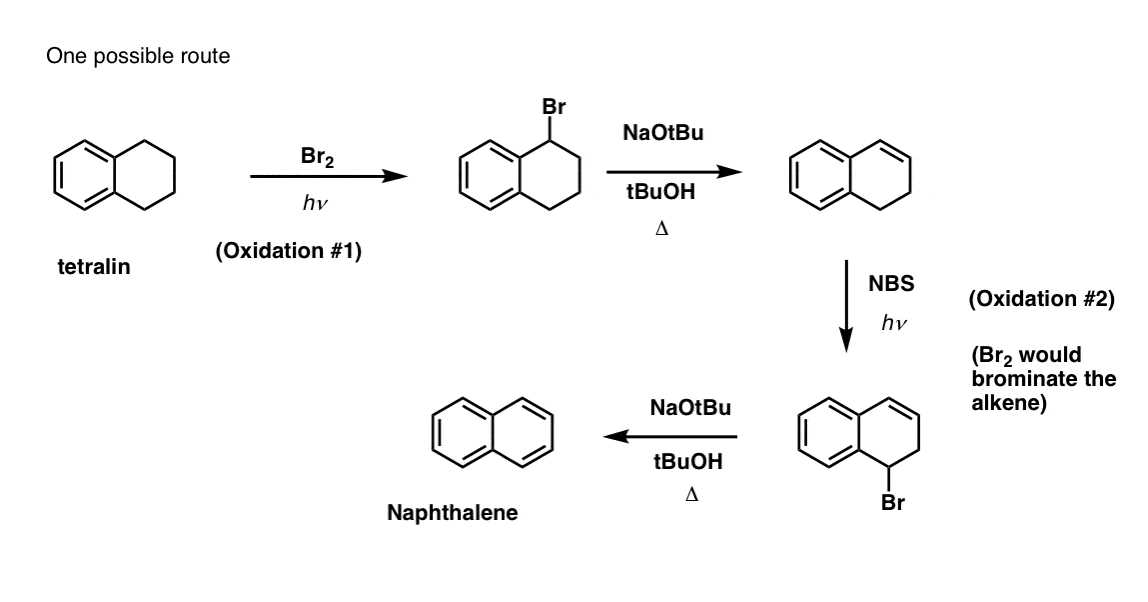
(Käytännössä kävi ilmi, että kumpikin bromaus voidaan tehdä samanaikaisesti käyttäen Br2:ta korkeassa lämpötilassa. Käsittelemällä emäksellä saadaan sitten naftaleenia).
Vastaus visailukysymykseen 2.
Visaa itseäsi!
 Click to Flip
Click to Flip 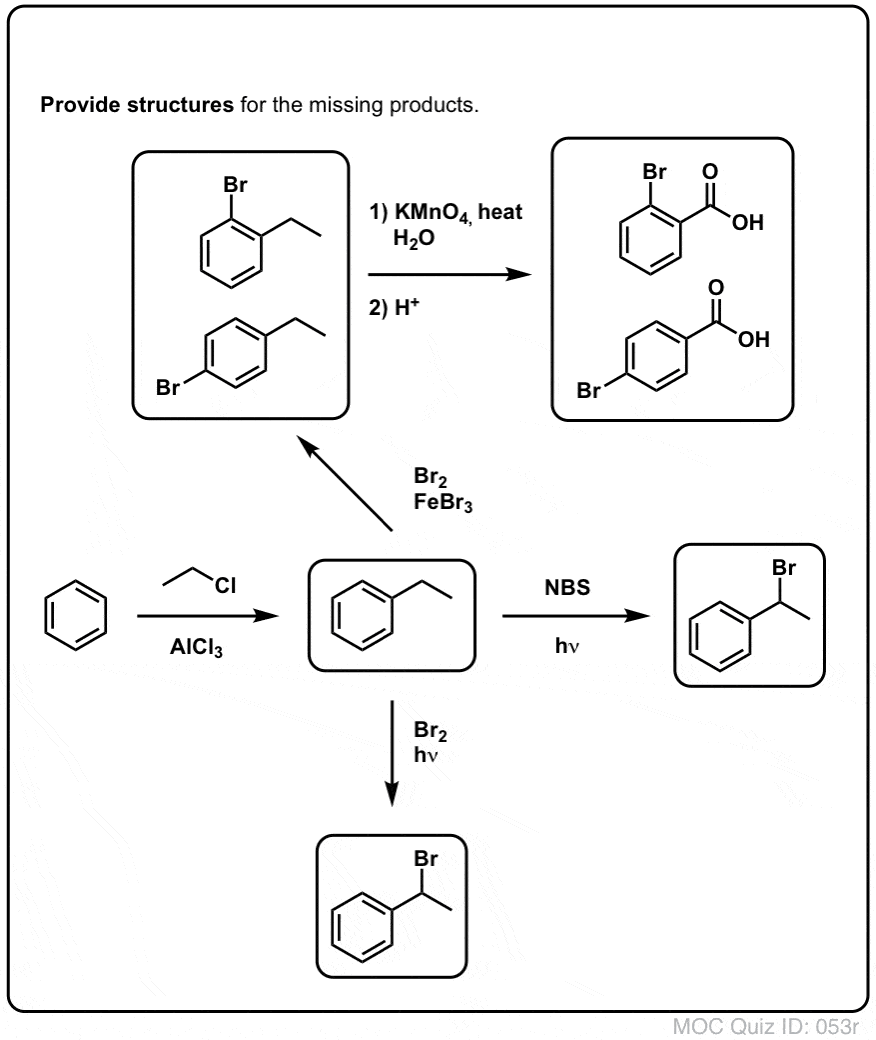
 Click to Flip
Click to Flip 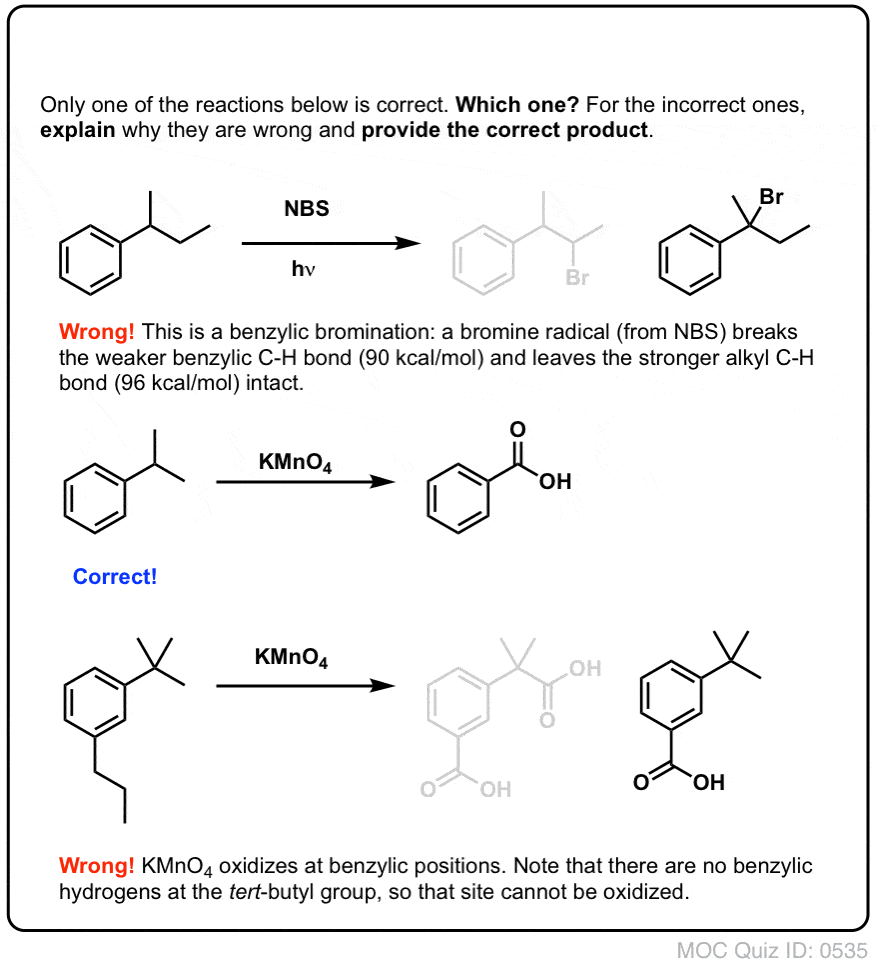
 Click to Flip
Click to Flip 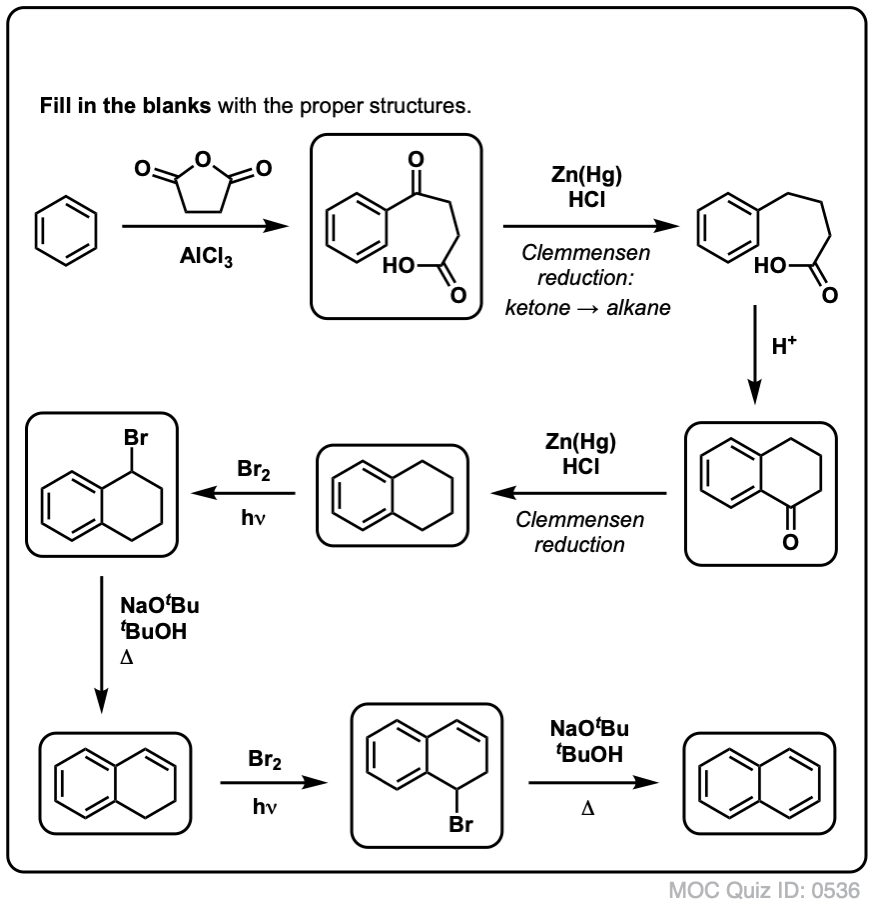
 Click to Flip
Click to Flip 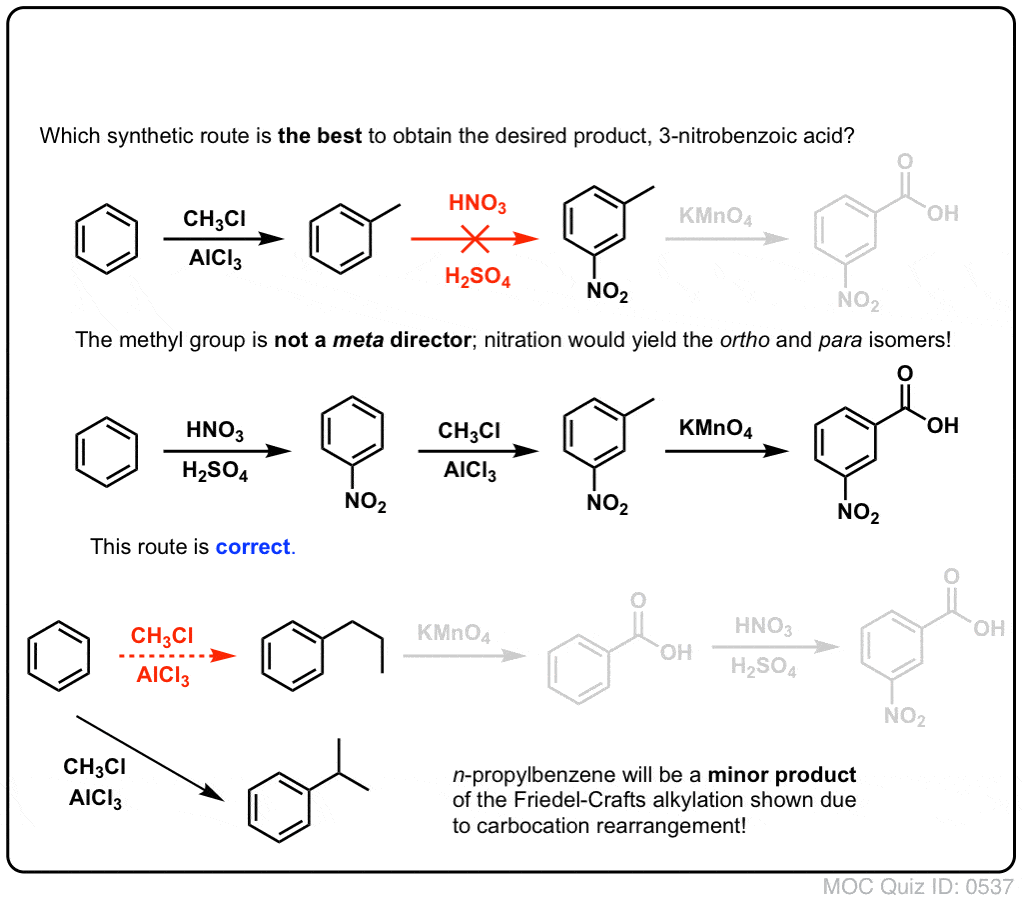
(Edistyneempi) Viitteet ja lisälukemisto
Bentsyylinen bromointi:
Tämä reaktio tunnetaan myös nimellä Wohl-Zieglerin reaktio.
- Bromierung ungesättigter Verbindungen mit N-Brom-acetamid, ein Beitrag zur Lehre vom Verlauf chemischer Vorgänge
Wohl
Chem. Ber. 1919, 52 (1), 51-63
DOI: 10.1002/cber.19190520109 - Die Halogenierung ungesättigter Substanzen in der Allylstellung
Ziegler, A. Späth, E. Schaaf, W. Schumann, E. Winkelmann
Just. Lieb. Ann. Chem. 1942, 551 (1), 80-119
DOI: 10.1002/jlac.19425510103
Kaksi ensimmäistä julkaisua tästä reaktiosta. Wohl käytti bromausaineena N-bromiasetamidia, ei NBS:ää. Ziegler suoritti sitten yksityiskohtaisen tutkimuksen ja raportoi, että NBS:ää voidaan käyttää kätevänä bromoivana aineena allyylien bromoinnissa. - Dibensosyklookteeni: Géraldine Franck, Marcel Brill ja Günter Helmchen
Org. Synth. 2012, 89, 55-65
DOI: 10.15227/orgsyn.089.0055 - Bentsyylibromiyhdistelmät N-bromosukkinimidillä (trifluorimetyyli)bentseenissä
Diana Suarez, Gilles Laval, Shang-Min Tu, Dong Jiang, Claire L. Robinson, Richard Scott, Bernard T. Golding
Synthesis 2009 (11): 1807-1810
DOI: 1055/s-0029-1216793
Viitteessä 3 on tyypillinen bentsyylibromaus käyttäen NBS:ää CCl4:ssä, joka on suurelta osin poistettu käytöstä myrkyllisyyshuolien vuoksi. Viite #4 osoittaa, että PhCF3:a voidaan käyttää liuottimena CCl4:n sijasta bentsyylibromoinnissa. - Brominations with N-Bromosuccinimide and Related Compounds. The Wohl-Ziegler Reaction.
Carl Djerassi
Chemical Reviews 1948, 43 (2), 271-317
DOI: 10.1021/cr60135a004
Vanha katsaus tähän reaktioon tunnetulta kemistiltä Carl Djerassilta, jonka merkittävä panos maailmanlaajuiseen terveydenhuoltoon oli noretindronin – ensimmäisen naisten ehkäisyvälineen – kehittäminen. - N-Bromosuccinimide. III. Bentsyylibrominoitumisen stereokemiallinen kulku
H. J. Dauben Jr. ja Layton L. McCoy
Journal of the American Chemical Society 1959, 81 (20), 5404-5409
DOI: 10.1021/ja01529a038
Mekanistinen tutkimus bentsyylibromimoinnin stereokemiasta. Havainnoimalla raseemisten bentsyylibromidien muodostumista prokiraalisista substraateista vahvistetaan entisestään radikaalien välityskykyä tässä reaktiossa.Samat viittaukset allyylibrominoitumisesta voidaan käyttää uudelleen tässä: - Mechanisms of Benzylic Bromination
Glen A. Russell, Charles. DeBoer ja Kathleen M. Desmond
Journal of the American Chemical Society 1963 85 (3), 365-366
DOI: 1021/ja00886a040
Bentsyylinen brominoituminen noudattaa samaa mekanismia kuin allylinen brominoituminen, kuten tässä artikkelissa kerrotaan.NBS (N-Bromosukkinimidi) on kätevä reagenssi vapaaradikaaliseen bromitukseen, ja seuraavat artikkelit ovat mekanistisia tutkimuksia, joissa käytetään NBS:ää: - The Mechanism of Benzylic Bromination with N-Bromosuccinimide
R. E. Pearson ja J. C. Martin
Journal of the American Chemical Society 1963 85 (3), 354-355
DOI: 10.1021/ja00886a029
Nämä professori J. C. Martinin (UIUC) artikkelit olivat hänen uransa alkuvaiheessa, ennen kuin hän teki työtä, josta hänet tunnetaan parhaiten (tutkimukset ”hypervalenttisista” molekyyleistä, mukaan luettuna ”Dess-Martin Periodinane”-molekyylin kehittäminen). - The Identity of the Chain-Carrying Species in Brominations with N-Bromosuccinimide: The Identity of the Chain-Carrying Species in Brominations with N-Bromosuccinimide: Selectivity of Substituted N-Bromosuccinimides towards Substituted Toluenes
R. E. Pearson ja J. C. Martin
Journal of the American Chemical Society 1963, 85 (20), 3142-3146
DOI: 10.1021/ja00903a021 - N-bromosukkinimidi. Allyylibromoinnin ja siihen liittyvien reaktioiden mekanismit
J. H. Incremona ja James Cullen Martin
Journal of the American Chemical Society 1970, 92 (3), 627-634
DOI: 10.1021/ja00706a034 - Succinimidyyliradikaali ketjun kantajana. Allyylibromoinnin mekanismi
J. C. Day, M. J. Lindstrom ja P. S. Skell
Journal of the American Chemical Society 1974, 96 (17), 5616-5617
DOI: 10.1021/ja00824a074 - Radical Bromination of Cyclohexene in CCl4 by Bromine: Additio vs. substituutio
D. W. McMillen ja John B. Grutzner
The Journal of Organic Chemistry 1994, 59 (16), 4516-4528
DOI: 10.1021/jo00095a029
Tässä artikkelissa kuvataan huolellisia kineettisiä tutkimuksia, jotka osoittavat, että pieni Br2-konsentraatio (kuten epäpuhtaan NBS:n tarjoama) suosii radikaalisubstituutiota polaarisen additioreaktion sijasta. - o-XYLYLEENIDIBROMIDI
Emily F. M. Stephenson
Org. Synth. Vol. 34, s.100 (1954)
DOI: 10.15227/orgsyn.034.0100
A reliable procedure for benzylic bromination with Br2 in Organic Syntheses. - Tetraliinin bromaus. Lyhyt ja tehokas 1,4-Dibromonaftaleenin synteesi
Osman Çakmak, Ismail Kahveci, Íbrahim Demirtaş, Tuncer Hökelek ja Keith Smith
Tšekki. Chem. Commun. 2000, 65, 1791-1804
DOI: 10.1135/cccccc20001791
Käytännöllinen 1,4-dibromonaftaleenin synteesi tetraliinista bentsyylisen bromimoinnin kautta.Bentsyylinen hapetus:
Bentsyyliseen hapetukseen on olemassa paljon strategioita, mukaan lukien KMnO4:n konsentroitujen liuosten tai kromihapon käyttö. - Kineettiset tutkimukset aromaattisten yhdisteiden hapettamisesta kaliumpermanganaatilla. Osa IV. n- ja isopropyylibentseeni
C. F. Cullis ja J. W. Ladbury
J. Chem. Soc. 1955, 4186-4190
DOI: 10.1039/JR9550004186 - PIPERIDINE DERIVATIVES X. THE PHENYLPIPERIDYLCARBINOLS
Kenneth E. Crook and S. M. McElvain
Journal of the American Chemical Society 1930, 52 (10), 4006-4011
DOI: 1021/ja01373a035
Jos bentsyyliasemassa on toinen substituentti, hapettamalla saadaan karboksyylihapon sijasta ketoni. - Heterogeeniset permanganaattihapot. 7. Alifaattisten sivuketjujen hapettuminen
Nazih A. Noureldin, Dongyuan Zhao ja Donald G. Lee
The Journal of Organic Chemistry 1997, 62 (25), 8767-8772
DOI: 1021/jo971168e
Reagensseja voidaan adsorboida kiinteille alustoille reaktioiden helpommaksi toteuttamiseksi ja jätteiden vähentämiseksi. Tässä tapauksessa tekemällä KMnO4-reagenssi heterogeeniseksi reaktiivisuus muuttuu hieman, ja tätä voidaan hyödyntää joissakin kemoselektiivisissä hapetuksissa.Bentsyylien hapetukseen voidaan käyttää paljon muitakin reagensseja, tässä on valikoima: - Selektiivinen hapetus aromaattisten systeemien vieressä olevalla hiilellä IBX:llä
K. C. Nicolaou, Phil S. Baran ja Yong-Li Zhong
Journal of the American Chemical Society 2001, 123 (13), 3183-3185
DOI: 10.1021/ja004218x
Journal of the American Chemical Society 2001, 123 (13), 3183-3185
DOI: 10.1021/ja004218x
Varhaisaikainen julkaisu, jonka on tehnyt (nykyisin totaalisen synteesin rocktähtenä tunnettu) professori Phil Baran (The Scripps Research Institute, La Jolla, Kalifornia) ollessaan vielä tohtoriksi asti opiskelemassaan professori Nicolãoun työryhmässä. Tässä käytetään IBX:ää (hypervalentti I(V)-reagenssi) bentsyylihapetuksiin, jotka tapahtuvat radikaalimekanismin kautta. Tämä on hyödyllinen reaktio, jolla on laaja substraattialue, kuten artikkelin 25 esimerkkiä osoittavat. - Alkyyliareenien suora ja selektiivinen bentsyylioksidaatio C-H-abstraktion avulla alkalimetallibromideja käyttäen
Katsuhiko Moriyama, Misato Takemura ja Hideo Togo
Organic Letters 2012, 14 (9), 2414-2417
DOI: 10.1021/ol300853z
Tässä käytetään oksonia päätehapettimena bentsyylien hapetuksessa. - Synthesis of Benzylic Alcohols by C-H Oxidation
Lalita Tanwar, Jonas Börgel, and Tobias Ritter
J. Am. Chem. Soc. 2019, 141, 17983-17988
DOI: 10.1021/jacs.9b09496
Tässä käytetään mesyyliperoksidia hapettimena bentsyyliasemien selektiiviseen hapettamiseen alkoholeiksi. Syntyy bentsyylimesylaattia, joka voidaan hydrolysoida alkoholiksi. - C-H-sidosten sähkökemiallinen bentsyylihapetus
Jason A. Marko, Anthony Durgham, Stacey Lowery Bretz ja Wei Liu
Chem. Commun, 2019, 55, 937-940
DOI: 10.1039/C8CC08768G
Bentsyylien hapetus voidaan toteuttaa myös sähkökemian avulla. - Allyylien ja bentsyylien hapetusreaktiot natriumkloriitilla
Samuel M. Silvestre, Jorge A. R. Salvador
Tetrahedron 2007, 63 (11), 2439-2445
DOI: 10.1016/j.tet.2007.01.012
NaClO2 on edullinen ja sitä voidaan käyttää myös hapettimena.
Vastaa