Ledipasviirin ja sofosbuviirin yhdistelmä hepatiitti C -viruksen genotyypin 1 infektion hoidossa: Systematic Review and Meta-Analysis | Annals of Hepatology
On 20 tammikuun, 2022 by adminIntroduction
Maailman noin 80 miljoonasta kroonista hepatiitti C -virusinfektiota (HCV-infektio) sairastavasta noin 46 %:lla on HCV:n genotyypin 1 infektio, jota on vaikeinta hoitaa interferonipohjaisilla hoitomuodoilla.1 Koska pegyloidun interferonin (PegIFN) ja ribaviriinin (RBV) hoito HCV-infektoituneiden potilaiden hoidossa onnistuu huonosti ja koska sivuvaikutuksia on odotettavissa, on pyritty kehittämään IFN:ää sisältämättömiä hoito-ohjelmia.2,3
Proteaasinestäjiä (PI) sisältävät hoito-ohjelmat HCV:n genotyypin 1 infektiota sairastaville potilaille otettiin käyttöön vuonna 2011. PI:tä sisältäviin hoito-ohjelmiin on kuitenkin liittynyt joitakin lääkeaineinteraktioita, ja lisäksi niitä on käytettävä PegIFN:n kanssa, ja niillä on ollut monia sivuvaikutuksia.4 HCV:n genotyypin 1 infektiota sairastavien potilaiden hoito on mullistunut, kun käyttöön on otettu viimeaikaisia suoravaikutteisia viruslääkkeitä (DAA), mukaan lukien sofosbuviiri (SOF), joka on HCV:n NS5B-polymeraasin uridiininukleotidi-analogi -inhibiittori, ja ledipasviiri (LDV), joka on HCV:n koodaaman NS5A-proteiinin inhibiittori5,6. Paras hoitovaihtoehto on se, jolla saavutetaan korkein pysyvän virologisen vasteen (SVR) osuus mahdollisimman vähäisin haittavaikutuksin ja lyhimmän hoitojakson aikana. SOF/LDV:n yhdistelmähoito 12 tai 24 viikon ajan yhdessä RBV:n kanssa tai ilman RBV:tä on parantanut SVR-astetta jopa 95-100 prosenttiin hoitoa saaneilla ja IFN-kokemattomilla potilailla, joilla on HCV:n genotyypin 1 infektio.7 Tarkka SVR-aste on määriteltävä hoidossa, jota annetaan SOF/LDV:llä yhdistelmähoitona yhdessä RBV:n kanssa tai ilman RBV:tä, kun hoito on kestoltaan 12- tai 24 viikkoa. Lisäksi olisi arvioitava joidenkin tekijöiden, kuten kirroosin, aikaisemman hoitohistorian ja NS5A-resistenssiin liittyvien substituutioiden (RAS) vaikutusta SVR-asteeseen mainituilla hoito-ohjelmilla.
Tällä hetkellä saatavilla olevien tutkimusten meta-analyysi tehtiin tarkoituksena arvioida SOF/LDV-yhdistelmähoidon antiviraalista tehoa 12- tai 24-viikkoisella yhdistelmähoidolla yhdessä RBV:n kanssa tai ilman RBV:tä potilailla, joilla on HCV:n genotyypin 1 infektio.
Materiaali ja menetelmätTietolähteet ja hakustrategiat
Tässä meta-analyysissä tehtiin kattava ja järjestelmällinen haku sähköisistä tietokannoista, mukaan lukien PubMed, Scopus, Science Direct ja Web of Science, käyttäen kullekin tietokannalle sopivia hakustrategioita. Hakustrategioissamme hakusanat keskittyivät hoitoprotokolliin; SOF, LDV ja niiden asianmukaiset vaihtoehdot. Lisäksi mahdollisten olemassa olevien harmaiden kirjallisuuslähteiden löytämiseksi teimme haun Google scholar -palvelusta ja jatkoimme hakua siihen liittyvien otsikoiden löytämisen jälkeen, kunnes löysimme 200 toisiinsa liittymätöntä sarjanimikettä. Lisäksi haettujen julkaisujen viitteitä etsittiin myös mahdollisten sähköisessä haussa unohdettujen julkaisujen tunnistamiseksi. Viimeinen haku tehtiin 2. syyskuuta 2015, eikä kielirajoituksia otettu huomioon. Hakua päivitettiin 16. maaliskuuta 2016.
Kelpoisuuskriteerit
Tähän meta-analyysiin otettiin mukaan kaikki julkaisut, joissa arvioitiin SOF/LDV:n ja RBV:n tai ilman RBV:tä 12 tai 24 viikon ajan toteutetun SOF/LDV-yhdistelmähoidon vaikutusta SVR:ään 12 viikkoa hoidon lopettamisen jälkeen (SVR12) HCV:n genotyypin 1 infektiota sairastavien potilaiden keskuudessa. Mukaan otettiin tutkimukset, joissa oli tiedot intention-to-treat-analyysia varten, muutoin tutkimus jätettiin pois. Poissulkukriteereinä pidettiin seuraavia seikkoja: hemodialyysipotilaat, potilaat, jotka ovat aiemmin saaneet SOF-pohjaista hoitoa, potilaat, joilla on samanaikainen infektio ihmisen immuunikatoviruksen (HIV) kanssa, potilaat, joilla on dekompensoitunut kirroosi (Child-Pugh B- ja C8-luokitus), ja potilaat, joilla on aiemmin ollut maksa- tai munuaissiirto.
Tutkimusten valinta, laadunarviointi ja tietojen poiminta
Systemaattisen katsauksen raportointia koskevan PRISMA-ohjeen9 perusteella kaksi henkilöä (MSR-Z ja KH) tarkisti hakutulosten kaikki artikkelit riippumattomasti kullakin seulontatasolla (otsikko, tiivistelmä ja kokoteksti). Kunkin seulontatason päätteeksi näiden kahden kirjoittajan väliset erimielisyydet ratkaistiin keskinäisellä keskustelulla. Jäljelle jääneet erimielisyydet ratkaistiin kuitenkin yhteisymmärryksessä ja keskustelemalla muiden kollegojen (BB, SMA ja HS) kanssa.
Cochranen risk of bias -arviointityökalua käytettiin kunkin mukaan otetun artikkelin10 laadunarvioinnissa, ja seuraavat harhan riskit arvioitiin; satunnaissekvenssin muodostaminen (valintaharha), allokaation peittäminen (valintaharha), osallistujan ja henkilökunnan sokeuttaminen (suoritusharha), lopputulosten arvioinnin sokeuttaminen (havaitsemisharha), samanaikaiset interventiot, epätäydelliset lopputuloksia kuvaavat tiedot (hukkatutkimus), valikoiva raportointitapa (raportointivirhe), aikomus hoidon suorittamiseen -analyysi (intention-to-treat analysis), ryhmien samankaltaisuus lähtökohtakohdanäytteessä (group similarity at baseline), vaatimustenmukaisuus (compliance), lopputulosarviointien ajoitus (timing of outcome assessments) ja muita harhan aiheita. Tämän arvioinnin perusteella kunkin artikkelin harhaisuusriski arvioitiin korkeaksi, epäselväksi ja matalaksi. Korkea ja epäselvä riski arvioitiin nollaksi ja matala riski yhdeksi. Artikkelit, joiden pistemäärä oli yli 6, luokiteltiin matalan riskin tutkimuksiksi. Jälleen kaikki erimielisyydet tai erimielisyydet ratkaistiin keskinäisellä keskustelulla.
Sisällytetyistä tutkimuksista poimittiin seuraavat tiedot osallistujista kustakin tutkimushaarasta; sukupuoli, HCV-genotyyppi, kirroosi, polymorfismit lähellä IFNL3:a (rs12979860), aiempi hoitohistoria, hoidon kesto, ikä, painoindeksi (BMI) ja HCV:n RNA-taso ennen hoitoa. Lisäksi kerättiin joitakin tietoja kustakin tutkimuksesta, mukaan lukien julkaisuvuosi, otoskoko ja maan nimi.
Tietojen analysointi
Varmuusväli (CI) SVR-asteelle kussakin tutkimuksessa laskettiin Jeffreysin menetelmän perusteella, ja CI:n ylä- ja alarajojen keskimääräistä summaa pidettiin SVR:n piste-estimaattina.11 Heterogeenisuustesti suoritettiin χ2:lla ja I-kvadraatilla (vaihteluväli 0 %:sta 100 %:iin). P-arvoa alle 0,1 pidettiin tilastollisesti merkitsevänä χ2:n osalta. Heterogeenisuustestin tuloksen mukaan käytimme kiinteän tai satunnaisvaikutuksen malleja yhdistetyn SVR:n12 , 95 prosentin luottamusvälin ja P-arvon määrittämiseksi. Trim and fill -menetelmää sovellettiin mahdollisten olemassa olevien julkaisuvirheiden poistamiseksi.12 STATA 10 -ohjelmaa käytettiin kaikkien tietojen analysoinnin osien suorittamiseen.
TuloksetTutkimusten seulonta
Tietokantahaun avulla tunnistettiin yhteensä 606 artikkelia. Kun päällekkäisyydet oli poistettu, jäljelle jäi 459 artikkelia seulontaa varten. Kuvassa 1 esitetään paperien lukumäärä kullakin seulontatasolla. Kaksi muuta asiakirjaa löytyi myös päivittämällä hakua. Kaksikymmentä kokotekstiartikkelia arvioitiin kelpoisuuden kannalta, ja lopulta kymmenen artikkelia otettiin mukaan kvantitatiiviseen synteesiin (meta-analyysi).
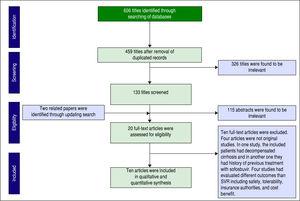
Artikkeleiden seulonta PRISMA-lausunnon perusteella.
Väärinkäytösriskin arviointi
Taulukon 1 perusteella kaikki mukaan otetut tutkimukset luokiteltiin matalan riskin tutkimuksiksi (ottamalla pistemäärä yli 7), ja näin ollen yhtään tutkimusta ei suljettu pois laadunarvioinnin perusteella.
Sisältyneiden tutkimusten harhaisuusriskin arviointi.
| Ensimmäinen kirjoittaja (Viite) | Sekvenssin tuottaminen sattumanvaraisesti (Valintavirhe) | Valintavirhe (Valintavirhe) | Valintavirhe (Valintavirhe) | Sokkoutuminen osallistujan ja henkilökunnan sidonnaisuus (Perfomance bias) | Tulosten arvioinnin sidonnaisuus (Detection bias) | Puutteelliset tulostiedot (Attrition) | Valikoiva raportointi (Reporting bias) | Co-interventiot | Intention to treat -analyysi | Ryhmien samankaltaisuus lähtötilanteessa | Soveltuvuus | Tulosten arvioinnin ajoitus | Muut harhat | Pistemäärät | Tulos | Johtopäätökset |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Afdhal, N.31 | ? | ? | + | + | – | – | – | – | – | – | – | – | – | 8 | Low | |
| Afdhal, N. 7 | ? | ? | + | + | – | – | – | – | – | – | – | – | – | 8 | Low | |
| Gane, E.J.13 | + | ? | + | + | – | – | – | – | – | – | – | – | – | – | 8 | Low |
| Lawitz, E.19 | – | – | + | + | – | – | – | + | – | – | – | – | – | – | 9 | Low |
| Kowdley, K.6 | ? | ? | + | + | – | – | – | – | – | – | – | – | – | 8 | Low | |
| Bourliere, M.21 | – | – | – | – | – | – | – | + | – | – | – | – | – | 11 | Low | |
| Mizokami, M.20 | – | – | + | + | – | – | – | – | – | – | – | – | – | 10 | Low | |
| Stedman, C.A.M.14 | + | + | + | + | – | – | – | – | – | – | – | – | – | 8 | Low | |
| Kohli, M.15 | ? | ? | + | + | – | – | – | – | – | – | – | – | – | – | 8 | Low |
| Chuang W.L.22 | ? | ? | + | + | – | – | – | – | – | – | – | – | 8 | Low |
Sisäänotettujen tutkimusten ominaispiirteet
Tutkimuksen tavoitteen perusteella, esittelimme mukaan otettujen tutkimusten kunkin haaran ominaisuudet taulukossa 2 (SOF/LDV-yhdistelmä) ja taulukossa 3 (SOF/ LDV/RBV-yhdistelmä).
Sofosbuviirin ja ledipasviirin yhdistelmää koskevien mukaan otettujen tutkimusten ominaisuudet.
| Ensimmäinen kirjoittaja (viite) | Historia aiemmasta hoidosta | Julkaisuvuosi | Valtio | Maa | Otoksen koko | Keski-ikä (SD tai vaihteluväli) | Miesten sukupuoli (%) | Keskimääräinen painoindeksi (SD tai vaihteluväli) | Hoidon kesto (Wks) | Keskimääräinen HCV RNA, Log IU/ml (SD) | Kirroosi (%) | rs12979860 CC/CT+TTa | HCV genotyyppi 1a/1bb |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Afdhal, N.31 | TE | 2014 | USA | 109 | 56 (24-67) | 74 (68) | 29 (19-47) | 12 | 6.5 (0.44) | 22 (20) | 0.1 | 3.73 | |
| Afdhal, N.7 | TN | 2014 | USA | 214 | 52 (18-75) | 127 (59) | 27 (18-41) | 12 | 6.4 (0.69) | 34 (16) | 0.34 | 2.18 | |
| Gane, E.J.13 | TE | 2014 | Uusi-Seelanti | 10 | 61 (4.9) | 10 (100) | 31 (6.8) | 12 | 6.5 (0.6) | 10 (100) | 0.11 | 4 | |
| Kowdley, K.6 | TN | 2014 | USA | 216 | 53 (20-71) | 128 (59) | 28 (19-45) | 12 | 6.4 (0.8) | 0 (0) | 0.35 | 3.9 | |
| Lawitz, E.19 | TN | 2014 | USA | 19 | 46 (11.6) | 11 (58) | 28.1 (5.8) | 12 | 6.1 (0.8) | 0 (0) | 0.05 | 8.5 | |
| Lawitz, E.19 | TE | 2014 | USA | 19 | 54 (6.6) | 15 (79) | 31.4 (4.7) | 12 | 6.3 (0.5) | 11 (58) | 0.11 | 18 | |
| Kohli, A.15 | TN | 2015 | USA | 20 | 57 (8) | 14 (70) | 25 (4) | 12 | NA | jopa 20 %:iin asti | 0.33 | 1.22 | |
| Mizokami, M.20 | MIX | 2015 | Japani | 171 | 60 (9.2) | 69 (40) | 23.3 (3.6) | 12 | 6.6 (0.5) | 41 (24) | 1.011 | 0.042 | |
| Chuang, W.L.22 | TN | 2016 | Taiwan | 42 | 54 (30-75) | 13 (31) | 24 (19-36) | 12 | 6.6 (0.68) | 5 (12) | 5 | 0.10 | |
| Chuang, W.L.22 | TE | 2016 | Taiwan | 43 | 55 (33-7) | 23 (55) | 24 (20-30) | 12 | 6.6 (0.55) | 4 (9) | 1.26 | 0.16 | |
| Afdhal, N.31 | TE | 2014 | USA | 109 | 56 (25-68) | 74 (68) | 28 (19-41) | 24 | 6.4 (0.57) | 22 (20) | 0.17 | 3.54 | |
| Afdhal, N.7 | TN | 2014 | USA | 217 | 53 (22-80) | 139 (64) | 27 (18-48) | 24 | 6.3 (0.68) | 33 (15) | 0.31 | 2.14 | |
| Bourliere, M.21 | TE | 2015 | Ranska | 78 | 57 (10.7) | 56 (72) | 26.3 (4.2) | 24 | 6.5 (0.6) | 77 (100) | 0.08 | 1.85 |
Taulukko 3.
Tutkimuksiin sisältyneiden tutkimusten ominaispiirteet, jotka koskivat yhdistelmähoitoa, jossa yhdistelmähoitona käytettiin sofosbuviiria sekä ledipasviiriä ja ribaviriinia.
| Ensimmäinen kirjoittaja (viite) | Edellisen hoidon historia | Julkaisuvuosi | Maa | . | Otoksen koko | Keski-ikä (SD tai vaihteluväli) | Miesten sukupuoli (%) | Keskimääräinen painoindeksi (SD tai vaihteluväli) | Hoidon kesto (Wks) | Keskimääräinen HCV RNA, Log IU/ml (SD) | Kirroosi (%) | rs12979860 CC/CT+TT* | HCV genotyyppi 1a/1b** |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Afdhal,N.31 | TE | 2014 | USA | 111 | 57 (27-75) | 71 (64) | 28 (19-45) | 12 | 6.4 (0.54) | 22 (20) | 0.11 | 3.82 | |
| Afdhal,N.7 | TN | 2014 | USA | 217 | 52 (18-78) | 128 (59) | 27 (18-42) | 12 | 6.4 (0.64) | 33 (15) | 0.53 | 2.55 | |
| Gane, E.J.13 | TN | 2014 | Uusi-Seelanti | 25 | 45 (9.2) | 8 (32) | 25.2 (4.3) | 12 | 5.9 (0.9) | 0 (0) | 0.56 | 4 | |
| Gane, E.J.13 | TE | 2014 | Uusi-Seelanti | 9 | 50 (13) | 7 (78) | 25.6 (2.3) | 12 | 25.6 (2.3) | 0 (0) | 0 | 8 | |
| Gane, E.J.13 | TE | 2014 | Uusi-Seelanti | 9 | 57 (5.2) | 8 (89) | 27.3 (0.5) | 12 | 27.3 (0.5) | 9 (100) | 0.2 | 3.5 | |
| Lawitz, E.19 | TE | 2014 | USA | 21 | 52 (9.8) | 14 (67) | 31.5 (7.3) | 12 | 6.2 (0.4) | 11 (52) | 0.05 | 3.2 | |
| Mizokami, M.20 | MIX | 2015 | Japani | 170 | 59 (9.5) | 73 (43) | 23.3 (3.1) | 12 | 6.6 (0.5) | 35 (21) | 0.86 | 0.024 | |
| Stedman, C.A.M.14 | MIX | 2015 | Uusi-Seelanti | 14 | 54 (NA) | 12 (86) | 27 (34-20) | 12 | 6.5 (5.6-7.5) | 1 (7) | 0.4 | 2.5 | |
| Bourliere, M.21 | TE | 2015 | Ranska | 77 | 56 (7.4) | 58 (75) | 27.9 (5.5) | 12 | 6.5 (0.5) | 76 (98.7) | 0.05 | 1.71 | |
| Afdhal, N.31 | TE | 2014 | USA | 111 | 55 (28-70) | 68 (61) | 29 (19-50) | 24 | 6.5 (0.60) | 22 (20) | 0.19 | 3.82 | |
| Afdhal, N.7 | TN | 2014 | USA | 217 | 53 (24-77) | 119 (54) | 26 (18-48) | 24 | 6.3 (0.65) | 36 (17) | 0.5 | 2.01 |
Hoitotulosten arviointi
Laskimme yhdistetyn SVR12:n neljälle HCV-hoitoasetelmalle, joihin kuuluivat 12 viikon SOF/LDV (A), 24 viikon SOF/LDV (B), 12 viikon SOF/LDV/RBV (C) ja 24 viikon SOF/LDV/RBV (D). Yhteenveto näiden meta-analyysien tuloksista on esitetty taulukossa 4.
- –
Hoitojärjestely A (12 viikon sofosbuviiri plus ledipasviiri). Kahdeksasta tutkimuksesta löytyi kymmenen haaraa, joissa arvioitiin hoitoohjelmaa A (taulukko 2). Tutkimushaarojen tulosten välillä oli merkittävää heterogeenisuutta (χ2 = 35,01, P Kuva 2A). Sekä Beggin testi (P = 0,074) että Eggerin lineaarinen regressiotesti (P
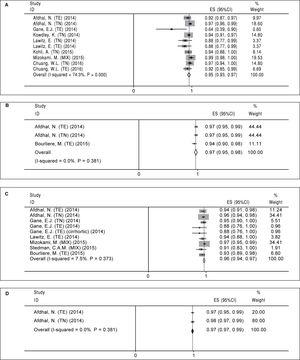 Kuvio 2. Vertailuanalyysit.
Kuvio 2. Vertailuanalyysit.Sofosbuviiri plus ledipasviiri -hoitojärjestelyn poolattu SVR12 hoidon keston ja ribaviriinin lisäämisen mukaan. A. Sofosbuviirilla plus ledipasviirilla 12 viikkoa kestäneen hoidon yhdistetty SVR12. B. Yhdistetty SVR12 24 viikon hoidon aikana sofosbuviirilla ja ledipasviirilla. C. Yhteenlaskettu SVR12 12 viikon hoidossa sofosbuviirilla sekä ledipasviirilla ja ribaviriinilla. D. Yhdistetty SVR12 24 viikon hoidossa sofosbuviirilla, ledipasviirilla ja ribaviriinilla. TE: hoitokokemus. TN: treatment naïve.
(0.39MB).- –
Hoitojärjestely B (24 viikkoa sofosbuviiria plus ledipasviiriä). Hoito-ohjelman B osalta löysimme vain kolme käsivartta kolmesta artikkelista (taulukko 2). Tähän hoito-ohjelmaan liittyvien tutkimusten osalta ei havaittu merkittävää heterogeenisuutta (χ2 = 1,92, P = 0,38, I-neliö = 0 %). Kiinteän vaikutuksen mallin perusteella yhdistetty SVR12 hoitomuodon B osalta oli 97 % (95 %CI = 95 %-98 %) (kuva 2B). Koska mukana olleiden tutkimusten määrä oli pieni (n = 3), emme suorittaneet asiaan liittyviä testejä julkaisuharhan varalta.
- –
Hoitojärjestely C (12 viikkoa sofosbuviiria sekä ledipasviiria ja ribaviriinia). Tämäntyyppiselle hoito-ohjelmalle löytyi yhdeksän tutkimusvartta seitsemässä julkaisussa (taulukko 3). Koska merkittävää heterogeenisuutta ei havaittu (χ2 = 8,64, P = 0,37, I-neliö = 7,5 %), käytettiin kiinteän vaikutuksen mallia ja laskettiin, että yhdistetty SVR12 oli 96 % (95 %CI = 94 %-97 %) (kuva 2C). Sekä Beggin (P = 0,009) että Eggerin lineaarisen regression (P = 0,001) testien perusteella havaittiin julkaisuharhaa. Trim and fill -menetelmän perusteella yhdistetyksi SVR12:ksi laskettiin 96 % (95 %CI = 94 %-97 %).
- –
Hoitojärjestely D (24 viikkoa sofosbuviiria sekä ledipasviiria ja ribaviriinia). Kuten taulukosta 3 käy ilmi, tätä hoitoa varten oli kaksi tutkimushaaraa kahdessa julkaisussa. Näiden kahden tutkimuksen tuloksissa ei ollut merkittävää heterogeenisuutta (χ2 = 0,77, P = 0,38, I-neliö = 0 %), ja kiinteän vaikutuksen mallin mukaan yhdistetyn SVR12-arvon laskettiin olevan 98 % (95 %CI = 97 %-99 %) (kuva 2D). Mukaan otettujen tutkimusten pienen määrän (n = 2) vuoksi emme voineet suorittaa niihin liittyviä testejä julkaisuharhan varalta.
Taulukko 4.Yhteenveto meta-analyyseistä, jotka koskivat sofosbuviirin ja ledipasviirin yhdistelmällä saavutettua pysyvää virologista vastetta.
Regiimi Ribaviriinin käyttö Hoidon kesto (Wks) . SVR-aste (%) 95%CI (%) A Ei 12 95 93-97 B Ei 24 97 95-98 C Kyllä 12 96 94-97 D Kyllä 24 98 97-99 SVR: Kestävä virologinen vaste. CI: luottamusväli.Lähtötason parametrien vaikutus pysyvään virologiseen vasteeseen
- –
Kirroosi. Useimmissa tutkimushaaroissa näissä neljässä mainitussa hoitomuodossa kaikki potilaat olivat kirroottisia tai ei-kirroottisia, joten emme voineet tehdä meta-analyysiä kertoimien suhteesta (OR). Yhdistimme kuitenkin kutakin hoito-ohjelmaa koskevat tiedot ja laskimme lopulta Peto-menetelmää käyttäen OR:n kirroosin vaikutuksesta SVR12:een. Kun otetaan huomioon kuva 3A, vain hoito-ohjelmassa A kirroosilla oli merkittävä vaikutus SVR12:een (OR = 0,21, 95 %CI = 0,07-0,66).
 Kuva 3. Hoito-ohjelma.
Kuva 3. Hoito-ohjelma.Kirroosin ja aikaisemman hoitohistorian vaikutus kestävään virologiseen vasteeseen sofosbuviiri- plus ledipasviirihoidon yhteydessä. A. Kirroosin vaikutus kestävään virologiseen vasteeseen. B. Aiemman hoitohistorian vaikutus kestävään virologiseen vasteeseen.
(0.17MB).- –
Aiempi hoitohistoria. Arvioimme aikaisemman hoitohistorian vaikutusta SVR12:een. Kuviossa 3B esitetään kuhunkin hoito-ohjelmaan liittyvät yhdistetyt tiedot ja aikaisemman hoitohistorian vaikutukseen liittyvät OR:t (Peto-menetelmän mukaan). Tämän analyysin perusteella aiemmalla hoitohistorialla ei ollut merkittävää vaikutusta SVR12:een kaikissa hoito-ohjelmissa.
- –
NS5A-resistenssiin liittyvät substituutiot. NS5A RAS:ia koskevat tiedot poimittiin mukaan otetuista tutkimuksista, joissa arvioitiin RAS:ia lähtötilanteessa. Koska tätä asiaa koskevia tietoja ei ollut saatavilla kunkin hoitomuodon (A, B, C ja D) arvioimiseksi, tutkimme väistämättä RAS:ien vaikutusta päähoitomuodon SOF/ LDV:n kanssa tai ilman RBV:tä 12 tai 24 viikon ajan. Tähän analyysiin ei otettu mukaan tietoja kolmesta julkaisusta: Gane ym.13:sta, koska kahdessa tutkimusvaiheessa SOF/LDV-hoitoon lisättiin toinen lääke (GS-9669), Stedman ym.14:stä, koska RAS:ien vaikutusta SVR:ään ei ollut saatavilla, ja Kohli ym.15:stä, koska SVR:n saavien potilaiden lukumäärää ja NS5A RAS:ia koskevat tiedot olivat puutteellisia. Lisäksi Kowdley ja työtoverit6 arvioivat SOF/LDV:n vaikutusta 8 viikon ajan tutkimuksensa yhdessä haarassa, ja koska emme voineet erottaa NS5A RAS:ia ja SVR:ää koskevia tietoja tästä haarasta, poimimme kaikki tiedot tästä tutkimuksesta ja sisällytimme ne tähän meta-analyysiin. Kuvion 4 mukaan NS5A RAS:illa oli merkittävä SVR:ää vähentävä vaikutus SOF/LDV-hoidossa (OR = 0,31, 95 % CI = 0,2-0,5). Tutkimusten tuloksissa ei ollut heterogeenisuutta NS5A RAS:ien havaitsemisessa lähtötilanteessa ja hoitovasteessa. Beggin (P = 0,65) ja Eggerin (P = 0,67) testien perusteella ei myöskään havaittu julkaisuharhaa.
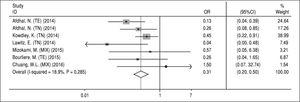 Kuvio 4. Julkaisuharha.
Kuvio 4. Julkaisuharha.NS5A-resistenssiin liittyvien substituutioiden vaikutus sofosbuviiria ja ledipasviiria sisältävän hoidon kestävään virologiseen vasteeseen.
(0.12MB).Keskustelu
Tämä meta-analyysi osoitti SOF/LDV-yhdistelmähoidon suuren tehon kroonista C-hepatiitin genotyypin 1 infektiota sairastavilla potilailla. HCV:n genotyypin 1 infektion aiempi hoitostandardi oli PegIFN ja RBV, joiden SVR-osuus oli alle 60 % HCV:n genotyypin 1 infektiota sairastavilla potilailla, ja hoitoon liittyi monia sivuvaikutuksia.16
HCV:n replikaatiokierrossa olevien avainproteiinien tunnistaminen tarjosi tilaisuuden kohdistaa hoito näihin proteiineihin ja estää virionien tuotanto.17 HCV:n hoito-ohjelmat ovat kulkeneet pitkää matkaa IFN-pohjaisista IFN-vapaisiin hoitoihin. Näin saatiin aikaan hoitomuoto, jossa SVR-aste on korkea, hoidon kesto lyhyt ja haittavaikutusten määrä vähäinen. Tavoite IFN-vapaasta hoito-ohjelmasta HCV:n genotyypin 1 infektioon saavutettiin, kun SOF/LDV-hoito-ohjelma otettiin käyttöön ja hyväksyttiin vuonna 2014.18
SOF/LDV:tä voidaan käyttää RBV:n kanssa tai ilman RBV:tä ja eri hoitoaikoina (12 tai 24 viikkoa).7 Sopivan hoito-ohjelman valinnassa voidaan ottaa huomioon joitakin tärkeitä tekijöitä, kuten kirroosin ja RBV:n vasta-aiheisuuden olemassaolo. Hoidon kustannukset ovat kuitenkin toinen merkittävä tekijä hoidon keston valinnassa. Mielenkiintoista on, että tässä tutkimuksessa osoitettiin, että SVR kaikissa 12 tai 24 viikkoa kestävissä hoidoissa RBV:n kanssa tai ilman RBV:tä oli yhtä suuri ja yli 95 prosenttia, mukaan lukien 95 prosenttia 12 viikkoa kestäneessä SOF/LDV-hoidossa, 97 prosenttia 24 viikkoa kestäneessä SOF/LDV-hoidossa, 96 prosenttia 12 viikkoa kestäneessä SOF/LDV/RBV-hoidossa ja 98 prosenttia 24 viikkoa kestäneessä SOF/LDV/RBV-hoidossa. On totta, että RBV:n lisääminen SOF/LDV:hen tai SOF/LDV:n pidentäminen 24 viikkoon voi johtaa SVR12-arvon lievään nousuun 95 prosentista 96 prosenttiin, mutta tässä tutkimuksessa havaittiin, että kirroosi (Child-Pugh A) voi vaikuttaa (OR = 0,21) SVR12-arvoon vain 12 viikon SOF/LDV-hoitoohjelmassa. Tämän vuoksi suosittelemme kirroottisten potilaiden (Child-Pugh A) hoitoa SOF/LDV/RBV:llä 12 viikon ajan tai SOF/LDV:llä 24 viikon ajan RBV:n vasta-aiheisuuden ja hintakysymyksen perusteella, kun taas muiden kuin kirroottisten potilaiden hoito SOF/LDV:llä 12 viikon ajan näyttää olevan hyväksyttävää. Tässä meta-analyysissä ei havaittu aikaisemman hoitohistorian (muut kuin SOF-pohjaiset hoitomuodot) vaikutusta hoidon onnistumiseen missään neljästä SOF/LDV-hoitomuodosta. Näin ollen hoidon keston valintaa tai RBV:n lisäämistä SOF/LDV-hoito-ohjelmaan aikaisemman PegIFN/RBV- tai PI:tä sisältävien hoitojen historian perusteella ei suositella.
Tässä tutkimuksessa kerättiin tietoja, joiden avulla voitiin arvioida lähtötilanteen NS5A RAS-arvojen vaikutusta hoidon onnistumiseen, mutta yhdessäkään tutkimuksessa ei kuitenkaan stratifioitu resistenssin arviointia varten tarvittavia tietoja hoito-ohjelman suhteen. Tämän vuoksi tähän meta-analyysiin sisällytettiin kunkin tutkimuksen kaikkien tutkimushaarojen tiedot. Tässä meta-analyysissä todettiin, että HCV:n NS5A-geenin perustason RAS-arvot vaikuttivat hoitovasteeseen. On syytä huomata, että suurimmalla osalla potilaista, joiden hoito epäonnistui, oli NS5A RAS:ia hoidon epäonnistumisen aikaan, mikä osoittaa NS5A RAS:ien tärkeän roolin LDV:llä hoidettujen potilaiden hoidon epäonnistumisessa.6,7,19-22. NS5A RAS:ien arvioinnin kliinistä hyödyllisyyttä ennen hoidon aloittamista ei kuitenkaan ole vielä määritelty, mikä saattaa johtua SOF/LDV:n korkeasta hoitovasteesta ja NS5A RAS:ien arvioinnin hyvin alhaisesta spesifisyydestä hoidon epäonnistumisen ennustamisessa.
SoF/LDV:n hyväksymisen jälkeen otettiin käyttöön muita DAA-lääkkeitä ja IFN-vapaita hoito-ohjelmia ja hyväksyttiin ne HCV:n genotyypin 1 infektiota sairastavien potilaiden hoitoon. Joulukuussa 2014 hyväksyttiin HCV-genotyypin 1 infektion hoitoon Ombitas-viiri/Paritapreviiri-r/Dasabuviiri-yhdistelmä (3 suoravaikutteista antiviiriä; 3D), jonka teho oli yli 95 %.23 Tammikuussa 2016 hyväksyttiin grazopreviiri/Elbasviiri-yhdistelmähoito (Grazoprevir/Elbasvir, GZR/EBR), jonka SVR-aste oli noin 95 %.24 Koska SOF:llä on munuaismetabolia, tätä viruslääkettä ei voida antaa kroonisessa munuaissairaudessa (kreatiniinipuhdistuma 2), ja 3D ja GZR/EBR ovat vaihtoehtoja kroonista munuaissairautta ja HCV-genotyypin 1 infektiota sairastavien potilaiden hoidossa.25,26 Lisäksi muita DAA-lääkkeiden yhdistelmiä, kuten SOF/Daklatasviiri (27) ja SOF/velpatasviiri28 , on ollut saatavilla pangenotyyppisinä hoito-ohjelmina.
Johtopäätöksenä voidaan todeta, että HCV:n genotyypin 1 hoito SOF/LDV-yhdistelmällä johtaa korkeaan (≥ 95 %) hoitovasteeseen. Päätös RBV:n lisäämisestä SOF/LDV:hen ja/tai SOF/LDV:n pidentämisestä voidaan tehdä kirroosin esiintymisen, RBV:n vasta-aiheisuuden ja kustannuskysymyksen perusteella. HCV-tartunnan saaneiden ihmisten tunnistamisen lisääminen ja hoidon saatavuuden parantaminen heille voi auttaa HCV:n hävittämisessä.29 Seuraava tavoite HCV:n hoidossa on kehittää uusia HCV-hoitoohjelmia ilman RBV:tä, joilla on lupaava 100 prosentin hoitovaste ja joissa ei esiinny lääkeaine-lääke-reaktioita.30
Kiitokset
Tekijöiden osuus: Tutkimuskonsepti ja -suunnittelu: Mohammad Saeid Rezaee-Zavareh, Bita Behnava, Seyed Moayed Alavian ja Heidar Sharafi; tietojen hankinta: Mohammad Saeid Rezaee-Zavareh ja Khashayar Hesa-mizadeh; tietojen analysointi ja tulkinta: Mohammad Saeid Rezaee-Zavareh, Mohammad Gholami-Fesharaki ja Heidar Sharafi; käsikirjoituksen laatiminen: Mohammad Saeid Rezaee-Zavareh, Khashayar Hesamizadeh, Mohammad Gholami-Fesharaki ja Heidar Sharafi; käsikirjoituksen kriittinen tarkistaminen tärkeän sisällön osalta: Bita Behnava ja Seyed Moayed Alavian.
Tekijöiden ilmoitus henkilökohtaisista etunäkökohdista
Ei ole ilmoitettu.
Julkilausuma rahoitukseen liittyvistä etunäkökohdista
Ei ole ilmoitettu.
Ei ole ilmoitettu.
- –
- –
Vastaa