Assessing Cell Health: Viability and Proliferation | Bioradiations Assessing Cell Health: Elinkelpoisuus ja proliferaatio
On 11 lokakuun, 2021 by adminPart I: Viability and Proliferation Assays
Viabiliteetti ja proliferaatio
Viabiliteetti ja proliferaatio ovat kaksi erillistä solujen ominaisuutta. Elinkelpoisuus mittaa elävien solujen määrää populaatiossa, kun taas proliferaatio mittaa solujen jakautumista. On huomattava, että kaikki elinkelpoiset solut eivät jakaudu. Vaikka proliferaatio voidaan helposti tulkita elinkelpoisuudeksi, proliferaation puuttumista ei pidä automaattisesti pitää merkkinä solukuolemasta.
Elinkelpoisuuden ja proliferaation arvioiminen
1. Kalvojen läpäisevyys
Kuolleiden ja kuolevien solujen tunnusmerkki on solu- ja ydinkalvojen hajoaminen. Monet elävyysmääritykset käyttävät tätä solukuoleman ominaisuutta erottaakseen elinkelpoiset solut elinkelvottomista soluista.
Polaariset, soluja läpäisemättömät nukleiinihappovärjäykset, kuten DAPI, propidiumjodidi (PI) ja 7-AAD, värjäävät kuolleita soluja, koska nämä värjäykset pääsevät sisään vain soluihin, joiden kalvot ovat vaurioituneet. PI sitoo sekä RNA:ta että DNA:ta, kun taas 7-AAD ja DAPI ovat vuorovaikutuksessa vain DNA:n kanssa. Näitä väriaineita voidaan käyttää yhdessä entsymaattista aktiivisuutta osoittavien määritysten, kuten seuraavassa jaksossa käsiteltyjen esteraasisubstraattien, kanssa tai solun läpäisevien elinkelpoisuusindikaattorien kanssa elävien ja kuolleiden solujen merkitsemiseksi samanaikaisesti. PI-, DAPI- ja 7-AAD-määritykset voidaan lukea fluoresenssimikroskoopilla, virtaussytometrillä (kuva 1) tai mikrolevylukijalla.
A.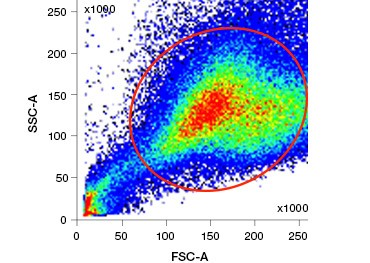
B.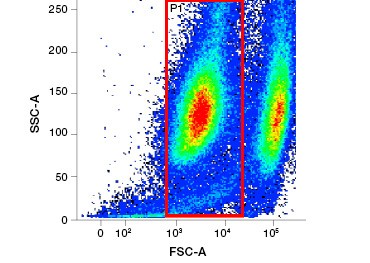

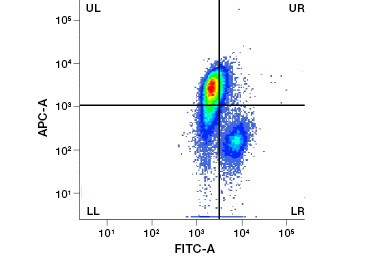
Kuva 1. PI-, DAPI- ja 7-AAD-määritykset. Propidiumjodidivärjäys parantaa kiinnostavien solujen tunnistamista. Elävien solujen rajaus eteenpäin- ja sivusironnan avulla ei välttämättä riitä poistamaan kuolleita soluja, ja epäspesifistä sitoutumista voi edelleen esiintyä (A). Elävyysväriaineiden, kuten propidiumjodidin, käyttö voi auttaa poistamaan epäspesifisen sitoutumisen (B). J774-makrofagit värjättiin CD11b:n ja CD3:n suhteen, ja punainen ympyrä ja suorakulmio osoittavat elävien solujen porttistrategian.
Ajoitus on kriittinen käytettäessä näitä väriaineita, koska värjäytyneiden solujen osuus kasvaa värjäyksen aikana solujen kuollessa edelleen. On huomattava, että mikään näistä väriaineista ei ole kiinnittyvä. Sovelluksiin, jotka edellyttävät fiksaatiota, etidiummonoatsidit tai amiinireaktiiviset proteiinivärjäykset ovat erinomainen valinta.
Soluja läpäisemättömät proteiinivärjäykset ovat hyvä vaihtoehto nukleiinihappovärjäyksille, koska ne ovat vähemmän myrkyllisiä. Amiinireaktiivisissa väriaineissa on laaja valikoima heräte- ja emissiospektrejä, joten ne mahdollistavat DNA-väriaineita suuremman joustavuuden virtaussytometria- ja mikroskooppipaneelien suunnittelussa. Toinen näiden proteiinivärjäysten etu on, että ne ovat kiinnittyviä (kuva 2).
A.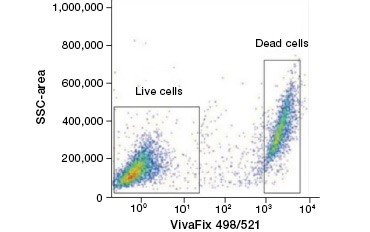
B.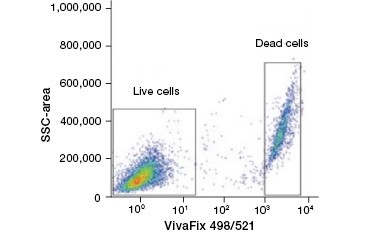
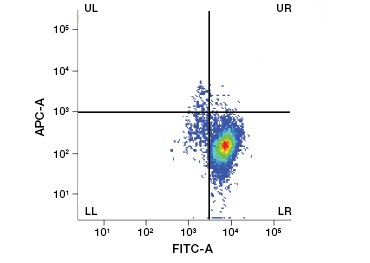
Kuva 2. Proteiinivärjäykset. Proteiinivärjäykset erottavat elävät ja kuolleet solut toisistaan. VivaFix™ Cell Viability Assays -testien avulla elävät ja kuolleet solupopulaatiot voidaan tunnistaa ja sen jälkeen analysoida fiksoiduista (A) ja fiksoimattomista (B) soluista virtaussytometriaa käyttäen.
Yleistä proteiinivärjäystä trypaninsinistä käytettäessä on otettava huomioon erityisesti se, että tämä väriaine värjää elinkelpoiset solut ajan mittaan solukohtaisesti. Sen vuoksi on ratkaisevan tärkeää optimoida trypaninsiniprotokollat kutakin solutyyppiä ja koetta varten.
Kaikkia näitä väriaineita voidaan käyttää yksittäisiin soluihin ja kudoksiin ja arvioida fluoresenssimikroskopialla tai virtaussytometrialla, vaikka trypaninsinivärjäystä arvioidaankin yleisemmin laskemalla solut manuaalisesti hemosytometrillä ja mikroskoopilla.
Toisin kuin soluja läpäisemättömät nukleiinihappovärjäykset, soluja läpäisevät nukleiinihappovärjäykset, kuten akridiinioranssi, diffundoituvat helposti solukalvojen läpi ja värjäävät siten elinkelpoisten solujen DNA:ta. Elinkyvyttömät solut eivät värjäydy tehokkaasti, koska niiden vahingoittuneet kalvot päästävät väriaineen helposti diffundoitumaan niistä ulos. Akridiinioranssi on kaksoisfluoresenssivärjäys, joka säteilee vihreää fluoresenssia sitoutuessaan dsDNA:han ja punaista fluoresenssia sitoutuessaan ssDNA:han ja RNA:han. Kun käytät akridiinioranssia DNA:ta sitovana väriaineena, muista, että se ei sido tehokkaasti tiivistettyä kromatiinia. Kuten kohdassa 6 käsitellään, tätä väriainetta voidaan käyttää myös arvioimaan solujen kykyä ylläpitää hapanta pH:ta lysosomeissa, mikä on toinen solujen elinkelpoisuuden indikaattori. Solun läpäiseviä nukleiinihappovärjäyksiä voidaan käyttää elinkelpoisten solupopulaatioiden tunnistamiseen ja kvantifiointiin mikroskoopilla, virtaussytometrialla tai mikrolevymäärityksellä.
Solun läpäisemättömiä ja läpäiseviä väriaineita voidaan käyttää yhdessä fluoresoivasti leimattujen, kiinnostavia proteiineja vastaan suunnattujen vasta-aineiden kanssa, mikä tekee elinkelpoisuuden ratkaisevan tärkeiden kontrollointien sisällyttämisestä jokaiseen kokeeseen helppoa. Kun näitä väriaineita käytetään kalvojen eheyden arviointiin, on tärkeää ottaa huomioon, että eri solutyypeillä on erilaiset kalvojen läpäisevyysominaisuudet. Esimerkiksi jotkin soluja läpäisemättömät DNA-värjäysvärit värjäävät helposti kuolleita eukaryoottisoluja, mutta eivät pysty värjäämään prokaryootteja, joiden kalvot ovat vaurioituneet.
Kalvojen eheyttä voidaan arvioida myös entsymaattisilla määrityksillä. Suosittu vaihtoehto on arvioida sytoplasman laktaattidehydrogenaasientsyymin (LDH) vuotoa elatusaineeseen solukuoleman yhteydessä. LDH:n kolorimetriset määritykset voidaan suorittaa mikrolevymuodossa ja lukea ELISA-mikrolevylukijalla.
Kalvon hajoamista voidaan mitata myös kromin vapautumisen määrityksillä. Tällöin solut merkitään etukäteen 51Cr:llä ennen kokeellista käsittelyä. Kromi sitoutuu solun proteiineihin ja vapautuu elatusaineeseen solun kuollessa. Solukuolema voidaan mitata kvantitatiivisesti määrittämällä vapaan ja sitoutuneen 51Cr:n määrä käyttäen tuikeuslaskuria. Solut voidaan myös merkitä valmiiksi fluoresoivilla väriaineilla. Nämä menetelmät kärsivät joskus suuresta taustasta, koska leimoja vapautuu spontaanisti; ne ovat käyttökelpoisia vain sovelluksissa, jotka mahdollistavat kiinnostavien solujen esileimauksen.
2. Entsymaattinen aktiivisuus
Toinen keskeinen ero elinkelpoisten ja elinkyvyttömien solujen välillä on se, että elinkelpoiset solut ovat entsymaattisesti aktiivisia. Esteraasiaktiivisuutta, jota mitataan käyttämällä substraatteja, kuten karboksifluoresceiinidiasetaattia (CFDA), käytetään yleisesti yleisen entsymaattisen aktiivisuuden indikaattorina. CFDA on fluoresoimaton, solun läpäisevä väriaine, joka hydrolysoituu fluoresoivaksi molekyyliksi karboksifluoresceiiniksi epäspesifisten solunsisäisten esteraasien vaikutuksesta, joita esiintyy vain elinkelpoisissa soluissa. Koska karboksifluoresceiini on negatiivisesti varautunutta, se säilyy ei-kovalenttisesti elinkelpoisissa soluissa, mikä johtaa vihreään fluoresenssiin.
CFDA-SE on CFDA:n johdannainen, joka säilyy paremmin hydrolyysin jälkeen. Sen tuotteessa, CFSE:ssä, on succinimidyyliesteriryhmiä, jotka muodostavat kovalenttisia sidoksia solunsisäisten proteiinien primääriamiinien kanssa, mikä mahdollistaa solujen elinkelpoisuuden pitkäaikaisen seurannan. Koska CFSE säilyy kovalenttisesti soluissa, se on luotettavampi solujen elinkelpoisuuden indikaattori ja suosittu solujen lisääntymisen mittari, koska sen fluoresenssi puolittuu jokaisen solun jakautumisen yhteydessä (kuva 3). CFDA-SE:hen on tehty parannuksia proliferaatioväriaineilla, joilla on suurempi soluretentio, jotka tarjoavat paremman resoluution solunjakautumisen suhteen ja joita on saatavana laajalla valikoimalla heräte- ja emissiospektrejä, jotta ne voidaan sisällyttää monivärisiin fluoresenssisovelluksiin, kuten virtaussytometriaan.
A.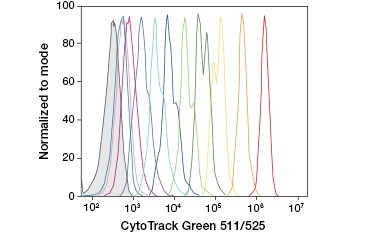
B.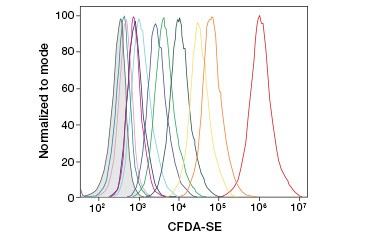
Kuvio 3. CFDA-SE:tä ja CFSE:tä. Solusukupolvien seuranta virtaussytometrialla. Kymmenen solusukupolvea voidaan erottaa käyttämällä CytoTrack™ Green 511/525 Cell Proliferation Assay -testiä (A) ja jopa kahdeksan solusukupolvea käyttämällä CFDA-SE:tä (B).
Monia muita fluoresoivia esteraasisubstraatteja, kuten kalseiinijohdannaisia ja BCECF:ää, on saatavana ominaisuuksiltaan vaihtelevina, mukaan lukien eroja eksitaatio-/emissiospektreissä. Koska BCECF:n fluoresenssi on pH-herkkä, sillä voidaan seurata myös sytosolisen pH:n muutoksia.
Käyttämällä soluja läpäiseviä esteraasisubstraatteja elinkelpoisuus voidaan arvioida fluoresenssimikroskopialla ja virtaussytometrialla. Näitä substraatteja voidaan käyttää myös kudosnäytteisiin tai niitä voidaan käyttää korkean läpimenon mikrolevymäärityksissä.
3. Metabolinen aktiivisuus
Toinen yleinen solujen elinkelpoisuuden mittari on metabolinen aktiivisuus, jota voidaan arvioida hapettavien ja pelkistettävien koettimien avulla.
Resatsuriini on suosittu hapettumis-pelkistymis- (redox) indikaattori. Tämä soluja läpäisevä väriaine voidaan lisätä suoraan soluviljelyaineeseen, mikä tekee siitä nopean ja kätevän määrityksen. Metabolisesti aktiivisissa soluissa sininen ja heikosti fluoresoiva resatsuriini pelkistyy muodostaen resorufiinia, vaaleanpunaista ja voimakkaasti fluoresoivaa molekyyliä. Tätä muutosta voidaan seurata sekä fluoresoivilla että kolorimetrisillä määrityksillä. Koska fluoresenssin määrä on suoraan verrannollinen elävien, hengittävien solujen määrään, resatsuriinia käytetään yleisesti solujen elinkelpoisuuden kvantitatiiviseen mittaamiseen. Resatsuriini on kätevä, herkempi ja vakaampi sekä myrkytön vaihtoehto muille redox-indikaattoreille, kuten tetratsoliumsuoloille MTT ja XTT. Toisin kuin tetratsoliumsuoloihin perustuvat määritykset, jotka ovat kolorimetrisiä ja jotka voidaan lukea vain mikrolevylukijalla, resatsuriinin elinkelpoisuusmääritykset voidaan lukea virtaussytometrialla tai fluoresenssimikroskopialla. Resatsuriini ja tetratsoliumsuolat ovat erityisen käyttökelpoisia korkean läpimenon sovelluksissa, koska elinkyky voidaan arvioida mikrolevyissä mikrolevylukijalla (kuva 4). XTT valitaan usein MTT:n sijasta suurempia läpimenoja vaativiin sovelluksiin, koska se tuottaa MTT:stä poiketen vesiliukoista väriainetta, jolloin MTT:n määrityksissä ratkaiseva liuotusvaihe jää pois. Resatsuriini- ja tetratsoliumsuoloja käytetään yleisimmin tarttuvien solujen ja liuoksessa olevien solujen elinkelpoisuuden arviointiin.
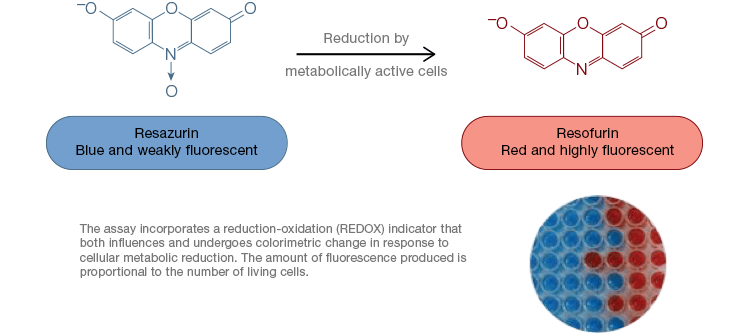
Kuva 4. Myrkyttömät resatsuriinin hapetusmääritykset ovat helposti skaalattavissa korkean läpimenon sovelluksia varten. AlamarBluen hapettuminen metabolisesti aktiivisissa soluissa johtaa kolorimetriseen muutokseen sinisestä punaiseksi sekä fluoresenssin lisääntymiseen.
Dihydrorhodamiinit, -kalseiinit ja -fluoresceiinit ovat pelkistettyjä rodamiini-, -kalseiini- ja -fluoresceiinijohdannaisia, jotka ovat soluja läpäiseviä ja värittömiä. Elävissä soluissa ja kudoksissa esiintyvät reaktiiviset happilajit hapettavat nämä yhdisteet helposti fluoresoivaksi emoväriaineekseen.
Toinen elinkelpoisuusmääritysten luokka, joka mittaa metabolista aktiivisuutta, ovat luminesenssi-ATP-määritykset. Näillä mitataan solujen lyysin yhteydessä vapauttamaa ATP:tä. Ne eivät vaadi pitkiä inkubaatioaikoja, ovat erittäin herkkiä ja ne luetaan yleisesti mikrolevylukijalla.
Yksi tekijä, joka on otettava huomioon käytettäessä metabolista aktiivisuutta mittaavia määrityksiä, on se, että metabolinen aktiivisuus voi vaihdella eri soluviljelyolosuhteissa. Näin ollen on sisällytettävä asianmukaiset kontrollit näiden erojen huomioon ottamiseksi.
4. DNA-synteesi/replikaatio
Toinen elinkelpoisuuden mittari ja suosittu menetelmä proliferaation arvioimiseksi on BrdU:n sisällyttämisen kvantitatiivinen määrittäminen vastasyntetisoituun DNA:han. BrdU:ta sisältävä DNA tunnistetaan käyttämällä konjugoituja BrdU-vasta-aineita tai BrdU-vasta-aineita yhdessä konjugoidun sekundaarivasta-aineen kanssa (kuva 5). Nämä määritykset mahdollistavat monenlaisia lukemia, koska vasta-aineet voidaan liittää erityyppisiin indikaattoreihin (fluorofooreihin, peroksidaaseihin jne.). Spesifisten solumarkkereiden vasta-ainemerkinnät mahdollistavat myös spesifisten proliferoivien populaatioiden erottamisen toisistaan. Näytteet kiinnitetään inkuboinnin jälkeen, minkä jälkeen ne analysoidaan virtaussytometrialla, fluoresenssimikroskopialla, immunohistokemialla tai mikrolevylukijoilla. Virtaussytometrian avulla solut voidaan luokitella solusyklin G0/G1-, S- tai G2/M-vaiheeseen DNA:n kokonaispitoisuuden perusteella. Kromogeenisten peroksidaasisubstraattien käyttö mahdollistaa määritysten lukemisen ilman fluorometriä. Käyttämällä BrdU:n sijasta -TdR:ää nämä määritykset voidaan muuntaa radiolabelilukemiksi.
A.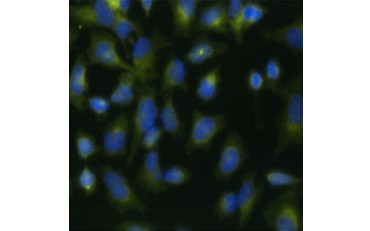
B.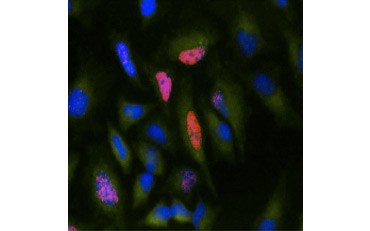
Kuva 5. A.
B.
B. BrdU:n sisällyttämisen visualisointi. HeLa-soluja käsiteltiin 10 µg BrdU:lla 1 tunnin ajan (B) tai jätettiin käsittelemättä (A). Solut värjättiin hiiren Anti-BrdU-vasta-aineella, klooni Bu20a (MCA2483; laimennos 1:25) ja toissijaisena vasta-aineena käytettiin vuohen Anti-hiiri IgG (H/L) DyLight 549-konjugoitua vasta-ainetta (punainen) (STAR117D549GA; laimennos 1:50). Sytoplasma värjättiin kanin Anti-GAPDH-vasta-aineella (AHP1628; laimennos 1:100) ja sekundäärivasta-aineena käytettiin lampaan Anti-Kani IgG DyLight 488 konjugoitua vasta-ainetta (vihreä) (STAR36D488GA; laimennos 1:50). PureBlu™ DAPI:tä (1351303) käytettiin ydinvärin vasta-aineena.
5. Proliferaatiomarkkereiden ilmentyminen
Tietyiden proteiinien tiedetään lisääntyvän solujen proliferaation aikana. Esimerkiksi Ki-67 ilmentyy jakautuvien solujen ytimessä, mutta sitä ei ole havaittavissa G0- ja G1-aikana (kuva 6). Vastaavasti histoni H3:n fosforylaatiota voidaan käyttää M-vaiheessa olevien solujen tunnistamiseen. Muita yleisesti käytettyjä proliferaatiomarkkereita ovat proliferoivan solun ydinantigeeni (PCNA) ja minikromosomin ylläpito 2 (MCM2). Käyttämällä vasta-aineita näitä, muita keskeisiä proliferaatiomarkkereita tai solulinjan merkkiaineita vastaan voidaan arvioida ELISA:lla, virtaussytometrialla, immunohistokemialla, fluoresenssimikroskopialla ja Western blotting -menetelmällä.
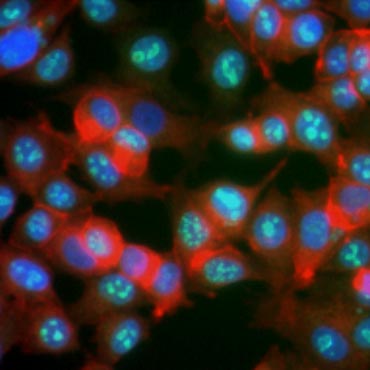
Kuva 6. Ki-67-vasta-aineet tunnistavat proliferoivat solut. MCF-7-solujen värjäys ihmisen Ki-67-vasta-aineella (HCA006, vihreä), joka on vastavärjätty falloidiinilla (punainen) ja Hoechstillä (sininen).
6. Membraanipotentiaali ja pH
Elävät solut ylläpitävät aktiivisesti ionigradienttiaan kalvojensa poikki, mikä synnyttää transmembraanipotentiaalia. Solun kuollessa nämä ionigradientit häiriintyvät. Tätä voidaan arvioida potentiometristen väriaineiden avulla. JC-1 on yleisesti käytetty potentiometrinen väriaine. Terveissä soluissa JC-1 paikallistuu mitokondrioihin, joissa se muodostaa punaisia fluoresoivia aggregaatteja. Kun mitokondrioiden kalvopotentiaali hajoaa, JC-1 diffundoituu koko soluun ja esiintyy vihreänä fluoresoivana monomeerinä. Tetrametyylirodamiinietyyliesterit (TMRE) ja tetrametyylirodamiinimetyyliesterit (TMRM), kuten JC-1, paikallistuvat terveissä soluissa mitokondrioihin ja kuolevissa soluissa sytoplasmaan. Toisin kuin JC-1:ssä, näiden väriaineiden emissiospektri ei muutu. Sen sijaan mitokondrioiden ulkokalvon permeabilisaatio johtaa TMRM:n/TMRE:n punaisen fluoresenssin vähenemiseen.
Vialliset solut pystyvät tuottamaan ja ylläpitämään matalaa pH:ta solun happamissa organelleissa, kuten lysosomissa. Tämä voidaan mitata käyttämällä happotrooppisia värjäyksiä, kuten akridiinioranssia ja neutraalipunaa. Akridiinioranssia käytettäessä on otettava huomioon, että tämä väriaine sitoo myös DNA:ta ja RNA:ta. Yksisäikeisiin nukleotideihin sitoutuneena akridiinioranssi fluoresoi punaisena, kaksisäikeiseen DNA:han sitoutuneena se fluoresoi vihreänä ja lysosomissa olevaan DNA:han sitoutuneena se fluoresoi oranssina.
Valitsemastasi menetelmästä riippumatta on erittäin tärkeää ottaa mukaan asianmukaiset kontrollit, kun tehdään mitä tahansa tässä kuvattua määritystä, sillä koeolosuhteet ja solutyyppi voivat muuttaa joidenkin määritysten suorituskykyä. Ota aina mukaan positiiviset ja negatiiviset kontrollit. Kun käytetään koettimia liuottimissa, mukaan on otettava myös ajoneuvokäsitellyt kontrollit liuottimen vaikutusten huomioon ottamiseksi. Käytä sovelluskohtaisia kontrolleja sellaisten tekijöiden kontrolloimiseksi kuin autofluoresenssi immunofluoresenssi- ja virtaussytometriakokeissa ja lastauskontrollit Western blottingissa.
Lisätietoja Bio-Radin solujen elinkelpoisuus- ja proliferaatiomäärityksistä saat soluterveysvalikoiman sivulta.
Lue osa II Soluterveyden arviointi: Apoptosis
alamarBlue on Trek Diagnostic Systemsin tavaramerkki. DyLight on Thermo Fisher Scientificin tavaramerkki.
Vastaa