Un meta-análisis de metronidazol y vancomicina para el tratamiento de la infección por Clostridium difficile, estratificado por la gravedad de la enfermedad | La Revista Brasileña de Enfermedades Infecciosas
On enero 20, 2022 by adminIntroducción
La infección por Clostridium difficile (ICD) es prevalente en el ámbito de la asistencia sanitaria en todo el mundo desarrollado1 y puede dar lugar a complicaciones graves, una mayor estancia hospitalaria y costes médicos adicionales.2 En los u’ ltimos 15 an˜ os se ha producido un notable aumento de la incidencia y la tasa de mortalidad de la ICD en Europa, Canada’ y Estados Unidos. El aumento se atribuye principalmente a la aparición de una nueva cepa hipervirulenta de BI/NAP1/027, que surgió en 2003 en Norteamérica y en 2005 en Europa, respectivamente. Los datos de 28 hospitales comunitarios del sur de los Estados Unidos sugirieron que C. difficile había sustituido al Staphylococcus aureus resistente a la meticilina como la etiología más común de las infecciones asociadas a la atención sanitaria.3 El metronidazol y la vancomicina son los antibióticos más utilizados para la CDI, que históricamente se consideraban de eficacia similar.4,5 En 1995, los Centros para el Control y la Prevencio’ n de Enfermedades de Estados Unidos recomendaron reducir el uso de la vancomicina en los hospitales porque podı’a contribuir a aumentar la prevalencia del Enterococo resistente a la vancomicina (ERV).6 Desde entonces, el metronidazol se habı’a utilizado habitualmente como tratamiento de primera lı’nea para la CDI. Con la aparición y la prevalencia de la cepa hipervirulenta de C. difficile (BI/NAP1/027), las infecciones se han vuelto más graves y se reevaluó la comparación del metronidazol y la vancomicina,7,8 especialmente cuando se utiliza para tratar a los pacientes con CDI grave. Zar et al. llevaron a cabo el primer ensayo prospectivo, aleatorizado, doble ciego, controlado con placebo y monocéntrico que comparaba el metronidazol y la vancomicina para la ICD. Los resultados mostraron que el metronidazol y la vancomicina eran igualmente eficaces, pero que la vancomicina era superior para los pacientes con CDI grave.9 Sus hallazgos fueron de enorme importancia e hicieron sugerencias para actualizar las guías de práctica clínica. La guía recomendaba que el metronidazol se utilizara para la ICD de leve a moderada y la vancomicina para la ICD grave, que se determinaba por la gravedad de los síntomas.10-13 Sin embargo, en un estudio de Zar et al, 22 participantes fueron excluidos del análisis y mediante un análisis ITT estricto de los 82 pacientes asignados al azar con enfermedad grave, la tasa de curación inicial no fue significativamente diferente entre vancomicina y metronidazol (79% frente a 66%, p=0,22).3,14 A continuación, Le et al. informaron de una mayor tasa de respuesta clínica en pacientes con enfermedad grave con vancomicina, pero sólo una minoría de pacientes había recibido vancomicina (n=8).15 Recientemente, Johnson et al. informaron de tasas similares de éxito clínico en pacientes con CDI grave en pacientes tratados con vancomicina o metronidazol, pero el metronidazol fue inferior a la vancomicina para todos los pacientes con CDI.16 Además, Pepin et al. sugirieron que la pérdida de la superioridad de la vancomicina sobre el metronidazol coincidió con la aparición del NAP1/027.17 Por lo tanto, realizamos un metanálisis estratificando a los pacientes según la gravedad de la enfermedad, para investigar la eficacia del metronidazol en comparación con la vancomicina, y para investigar qué agente era superior para tratar la enfermedad leve o grave.
Materiales y métodosFuentes de datos
Se realizó una búsqueda sistemática de la literatura en MEDLINE a través de Pubmed (1978 hasta el 31 de octubre de 2014), Embase (1978 hasta el 31 de octubre de 2014) y el Registro Cochrane Central de Ensayos Controlados (Cochrane library) para identificar los estudios pertinentes. Los términos de búsqueda clave fueron «metronidazole and vancomycin and clostridium difficile»; «metronidazole and vancomycin and pseudomembrannous colitis»; «metronidazole and vancomycin and antibiotic associated diarrhea». Se realizaron búsquedas manuales y se revisaron todas las referencias de los artículos identificados inicialmente, incluidos los artículos de revisión pertinentes. No se buscaron los resúmenes presentados en congresos científicos que no estaban disponibles.
Selección de estudios
Dos revisores (X.ZH.D y N.B.) buscaron de forma independiente los artículos y examinaron los estudios pertinentes para su posterior evaluación. Se consideró que un estudio era elegible si era un ECA o un estudio de cohortes prospectivo, si involucraba a pacientes adultos con ICD, incluida la enfermedad leve y/o grave; si estudiaba la seguridad o la eficacia del metronidazol y la vancomicina; si informaba datos específicos sobre la curación clínica y microbiológica, la mortalidad y los eventos adversos. Se incluyeron estudios ciegos o no ciegos y diseños aleatorios o no aleatorios. Se excluyeron los estudios experimentales basados en variables farmacocinéticas o farmacodinámicas. También se excluyeron los ensayos clínicos que incluían un tratamiento combinado de fármacos.
Evaluación cualitativa
La evaluación de la calidad metodológica de los ECA y los estudios de cohortes incluidos en el metanálisis fue realizada de forma independiente por dos revisores (X.ZH.D y N.B.) según la lista de comprobación desarrollada por Downs y Black.18 Esta herramienta evaluó tanto los estudios aleatorizados como los no aleatorizados, proporcionando tanto una puntuación global de la calidad del estudio como un perfil de puntuaciones para evaluar la calidad del informe, la validez externa, la validez interna (sesgo, confusión) y la potencia. Los estudios de alta calidad obtuvieron 15 o más puntos, mientras que los de baja calidad obtuvieron 14 o menos puntos.
Extracción de datos
Dos revisores extrajeron de forma independiente los datos de cada estudio con un formulario de revisión prediseñado. En caso de desacuerdo entre los dos revisores, un tercer revisor extrajo los datos hasta llegar a un consenso. Los datos extraídos de cada estudio fueron: (i) año de publicación; (ii) población de pacientes; (iii) número de pacientes; (iv) agentes antimicrobianos y dosis utilizadas; (v) resultados clínicos y microbiológicos; y (vi) mortalidad por todas las causas. Se utilizó el análisis ITT, definido como la inclusión de todos los pacientes asignados al azar.
Resultados analizados
La curación clínica inicial, la curación sostenida, la curación microbiológica, la recurrencia y la mortalidad por todas las causas se utilizaron como medidas de resultado para este metanálisis. Se utilizó la definición de curación clínica inicial y de recidiva comunicada en los estudios individuales y se registraron las diferencias entre los estudios. También se analizaron los resultados en función de las siguientes poblaciones (i) todos los pacientes, incluida la ICD leve y grave; (ii) los pacientes con ICD leve; (iii) los pacientes con ICD grave; y (iv) los pacientes con colitis pseudomembranosa (CPM).
Análisis de datos y métodos estadísticos
Los análisis estadísticos se realizaron con el programa Review Manager, versión 5.2 (Cochrane Collaboration). La heterogeneidad entre los estudios se evaluó mediante la prueba χ2 de heterogeneidad (se definió p
0,05 para indicar una heterogeneidad significativa) y la medida I2 de inconsistencia. Las razones de riesgo (RR) agrupadas y los intervalos de confianza (IC) del 95% para los resultados se calcularon mediante el modelo de efectos fijos (MEF) si no había heterogeneidad estadísticamente significativa entre los estudios incluidos. En caso contrario, se utilizó el modelo de efectos aleatorios (MEF). Se realizaron análisis de subgrupos en función de la gravedad de la enfermedad.ResultadosEstudios clínicos seleccionados
El diagrama de flujo (Fig. 1) muestra el proceso detallado de cribado y selección de los estudios incluidos en este metanálisis. La búsqueda bibliográfica identificó 2945 resúmenes. Se obtuvieron 47 artículos completos para su evaluación detallada. De los 41 estudios excluidos, tres artículos se excluyeron porque eran partes de ECAs ya incluidos en este metaanálisis, un ensayo se excluyó porque era un estudio farmacocinético,19 otros estudios se excluyeron debido a los diferentes diseños del estudio, como la falta de régimen de control, la combinación con otros antibióticos,20,21 diferentes resultados,22 o diferente tipo de pacientes,23 etc. Así, finalmente se incluyeron seis estudios en este metaanálisis: dos estudios de cohortes15,24 y cuatro ECAs.4,5,9,16
Diagrama de flujo de los estudios incluidos.
Características de los estudios
Las principales características de los estudios analizados se muestran en la Tabla 1. Los estudios incluidos fueron de alta calidad (dos ECA tuvieron una puntuación de 23, dos una puntuación de 20 y dos estudios de cohortes una puntuación de 17). Dos ECA se llevaron a cabo utilizando diseños aleatorios, doble ciego y con control de placebo,9,16 mientras que los otros dos utilizando sólo la aleatorización.4,5 Tres estudios se llevaron a cabo en los Estados Unidos,4,9,15 dos estudios se llevaron a cabo en Austria,5,24 mientras que un único estudio que incluía dos ECA se llevó a cabo en los Estados Unidos y Europa, respectivamente.16 La definición de ICD, la curación clínica inicial y la recurrencia se muestran en la Tabla 1 suplementaria. La definicio’ n de ICD incluı’a invariablemente una prueba de toxina de C. difficile, microorganismos o CMP combinada con diarrea. Sin embargo, las definiciones de diarrea variaron ligeramente, pero la mayor parte de los estudios se refirieron a la diarrea como heces no formadas al menos tres veces en un periodo de 24 horas.5,9,15,16 Los resultados de la curación clínica inicial y la recurrencia se informaron en todos los estudios con definiciones ligeramente diferentes. Por ejemplo, cinco estudios4,5,9,15,16 consideraron la curación clínica inicial si la diarrea se resolvía en un plazo de 6-8 días de tratamiento, mientras que Zar9 y Wenisch5 incorporan un resultado negativo de una medición de la toxina de C. difficile o de la proteína C reactiva. La mayoría consideró la recurrencia cuando los síntomas reaparecían y/o se confirmaban los resultados positivos de las pruebas microbiológicas durante el seguimiento de 21-30 días después de la resolución inicial de los síntomas.4,5,9,15,16 La curación sostenida se definió como la curación clínica en ausencia de cualquier recurrencia durante el seguimiento, que se calculó como la curación clínica inicial menos las recurrencias. La recuperacio’ n reportada por Wenisch24 fue considerada como curacio’ n sostenida. Los pacientes con ICD moderada en el estudio de Johnson et al. se consideraron como enfermedad grave, mientras que todos los pacientes incluidos en el estudio de Wenisch et al. se consideraron como enfermedad leve sobre la base de la evaluación de la gravedad de la ICD utilizada en los estudios de Zar9 y las directrices.11 Además, Wenisch et al. no indicaron la asignación de tratamiento de siete abandonos de todos los grupos,5 Johnson et al. informaron que el análisis incluyó a todos los pacientes aleatorizados que recibieron al menos una dosis de antibióticos y tuvieron alguna evaluación posterior a la dosis,16 lo que podría haber influido en los resultados ITT.
La tabla complementaria relacionada con este artículo puede encontrarse, en la versión online, en http://dx.doi.org/10.1016/j.bjid.2015.03.006.
Cura clínica inicial
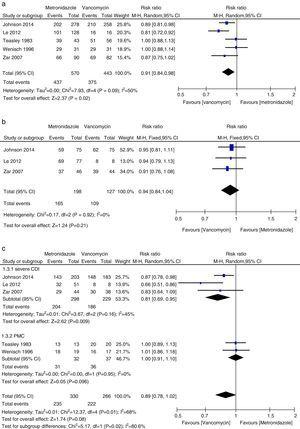
Metaanálisis de las tasas de curación clínica inicial comparando metronidazol con vancomicina para todas las CDI, CDI leve, CDI grave y PMC.
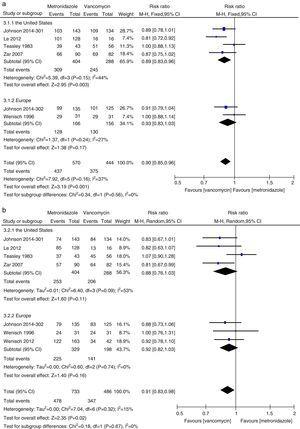
Metaanálisis de las tasas de curación clínica inicial y de curación sostenida comparando metronidazol con vancomicina para todos los pacientes con CDI de Estados Unidos y Europa.
Cura sostenida Tasa de recurrencia Cura microbiológica
Dos ECA relevantes proporcionaron tasas de curación microbiológica, definidas como resultados negativos del cultivo de heces de seguimiento posterior al tratamiento y del ensayo de citotoxina para C. difficile en pacientes tratados sin síntomas clínicos.4,5 En cuanto a la curación microbiológica, el tratamiento con metronidazol fue tan eficaz como el tratamiento con vancomicina (161 pacientes, MEF, RR=0,88, IC del 95%=0,64-1,21, p=0,43, Fig. 6).

Metaanálisis de la curación microbiológica que compara metronidazol con vancomicina para la ICD.
Tasa de mortalidad por todas las causas
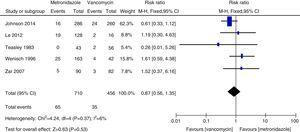
Metaanálisis de la tasa de mortalidad por todas las causas que compara el metronidazol con la vancomicina para la CDI.
Discusión
La CDI es un problema grave en el sistema sanitario con una incidencia creciente en todo el mundo que puede causar una morbilidad y mortalidad significativas.25 Las tasas de mortalidad notificadas para los pacientes con CDI grave oscilan entre el 9% y el 25%; más de la mitad de estas muertes están relacionadas con la CDI.14,26 Es especialmente importante tratar a los pacientes con CDI grave mediante el uso de una terapia antimicrobiana adecuada.
En este metaanálisis encontramos que la vancomicina fue superior al metronidazol en términos de curación clínica inicial y curación sostenida en pacientes con CDI. Las tasas de curación microbiológica, fue numéricamente menor con la terapia de metronidazol que con vancomicina, aunque la diferencia no fue significativa. Los autores de un documento de posición de 2011 en su análisis agrupado encontraron tasas equivalentes de curación clínica inicial con metronidazol y vancomicina, los agentes más comúnmente utilizados.27,28 Esta inconsistencia se debió principalmente a los diferentes estudios incluidos en cada revisión sistemática. Se incluyeron tres estudios más en el metanálisis actual.15,16,24 Cuando se analizaron los datos según la gravedad de la ICD, el tratamiento con vancomicina o metronidazol no difirió para los pacientes con enfermedad leve. Sin embargo, las tasas de curación clínica y de curación sostenida con vancomicina en los pacientes con ICD grave fueron significativamente mayores que esas tasas en el grupo de metronidazol. No se encontraron pruebas suficientes de que la vancomicina y el metronidazol fueran igualmente efectivos en los pacientes con CMP, debido al pequeño número de pacientes evaluados. La CMP se ha utilizado como marcador de enfermedad grave.12 Cuando los pacientes con CDI grave incluyeron a los pacientes con CMP, no se encontraron diferencias significativas entre el tratamiento con metronidazol y vancomicina. Aunque no se observó ninguna diferencia estadística, se observó una fuerte tendencia hacia una mayor curación clínica inicial y tasas de curación sostenida en el grupo de vancomicina, mientras que fue lo mismo para los pacientes con CDI leve. Así, para los pacientes con ICD grave, la vancomicina fue superior al metronidazol. Venugopal et al. demostraron que los pacientes con ICD grave eran más propensos a cambiar a vancomicina, lo que sugiere que estos pacientes respondían mal al metronidazol.29 Estos resultados se confirmaron en el presente metanálisis. Los resultados del tratamiento con metronidazol fueron deficientes porque el flujo sanguíneo al colon en los pacientes con enfermedad grave podría haber disminuido, lo que habría provocado una menor transudación del metronidazol al lumen.30,31 Además, la fidaxomicina fue aprobada recientemente para el tratamiento de la ICD y puede utilizarse como agente secundario en caso de fracaso de la vancomicina o el metronidazol, ya que la fidaxomicina permaneció detectable en las muestras de heces recogidas hasta cinco días después de una única dosis.32 En un estudio de meta-análisis, la fidaxomicina demostró tasas de curación clínica similares a las de la vancomicina con una disminución significativa de la tasa de recurrencia tanto en pacientes con CDI grave como no grave.33 Por lo tanto, para el tratamiento inicial de la CDI grave, la vancomicina oral es el fármaco de primera línea; alternativamente, puede utilizarse fidaxomicina oral.
Las tasas de recurrencia de la vancomicina y el metronidazol coincidieron en general con los datos anteriores y no se encontraron diferencias significativas.27,28 Sin embargo, la vancomicina se asoció con tasas de recurrencia más bajas que el metronidazol tanto en todos los pacientes con ICD como en aquellos con ICD grave. Nuestro estudio sugiere que la tasa de mortalidad por todas las causas no fue significativamente diferente entre la vancomicina y el metronidazol en todos los pacientes con ICD. La tasa de mortalidad por todas las causas de todos los pacientes con ICD fue de 100/1166 (8,5%), lo que es inferior a un estudio europeo que mostró una tasa de mortalidad para todos los casos de 101/455 (22%) después de tres meses.1
Los hallazgos del presente metaanálisis deben considerarse en el contexto de las limitaciones potenciales. En primer lugar, la epidemiologi’a de C. difficile ha cambiado ra’pidamente con una gran proporcio’n de casos graves y recurrentes que se producen en estos pai’ses de lo que se habi’a informado anteriormente.1 Esto podri’a dar lugar a diferencias de las poblaciones de estudio. En segundo lugar, durante la u’ ltima dı’a han surgido nuevos métodos para el diagno’ stico de la CDI. El uso de pruebas ma’s sensibles y ra’pidas para el diagno’ stico de la CDI es cri’tico para el manejo clı’nico de los pacientes. Aunque los criterios de diagno’ stico no fueron tan estrictos en algunos casos, la respuesta al tratamiento no difiere sustancialmente dentro de un mismo re’gimen farmacolo’ gico o entre fa’rmacos.4 En tercer lugar, como este meta’nalisis incluyo’ un nu’ mero relativamente pequen˜o de estudios, especialmente ECA, la precisio’ n de las estimaciones puede haberse visto comprometida. En cuarto lugar, los investigadores no estaban cegados a la asignación del tratamiento en los cuatro estudios, lo que puede haber introducido un sesgo en los resultados de eficacia comunicados. En quinto lugar, la mayoría de los estudios incluidos no se aseguraron de que todos los casos de diarrea de los pacientes incluidos fueran causados por C. difficile, ya que éstos no excluyeron la presencia de otros patógenos en las heces como causa de la diarrea.4,5 En sexto lugar, la puntuación de gravedad todavía no está validada ni es suficientemente científica, y es necesario mejorarla no sólo para la estandarización de futuros estudios, sino también para su uso en la práctica clínica.27,34 Por lo tanto, los resultados actuales deben confirmarse aún más.
En conclusión, a pesar de las limitaciones del meta-análisis actual, estos análisis indican que la vancomicina ofrece beneficios significativos en el tratamiento de la ICD en comparación con el metronidazol. Los pacientes toleraron bien los dos fármacos y las tasas de recaída fueron similares. Para los pacientes con ICD leve, el tratamiento con metronidazol fue tan clínicamente eficaz como la vancomicina; para los pacientes con ICD grave, la vancomicina fue más eficaz que el metronidazol. Esta diferencia de eficacia fue más evidente en el subgrupo de ICD grave y apoyó las recientes recomendaciones de utilizar vancomicina como tratamiento de primera línea para la ICD grave.
Conflictos de intereses
Los autores declaran no tener conflictos de intereses.
Financiación
Este estudio fue apoyado por los Principales Proyectos Nacionales Especiales de Ciencia y Tecnología para Nuevos Medicamentos (nº 2012ZX09303004) y la Fundación Municipal de Ciencias Naturales de Beijing (nº 7132168).
Deja una respuesta