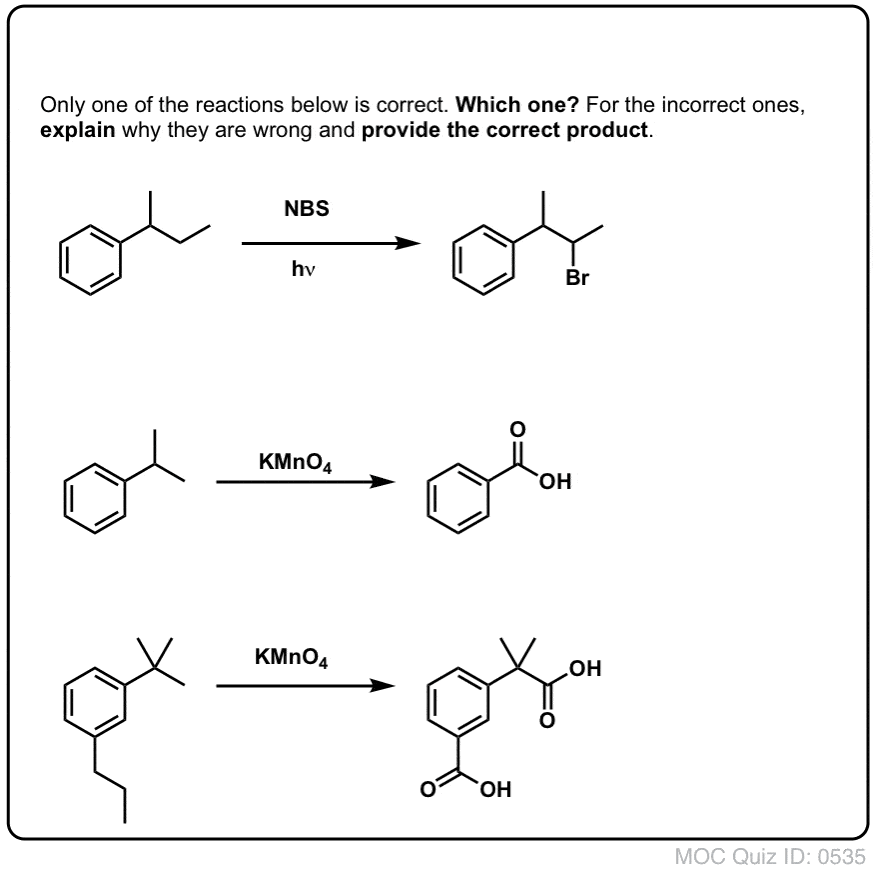
Reacciones en el carbono «bencílico»: bromación y oxidación
On octubre 12, 2021 by adminEl carbono adyacente a un anillo aromático -el carbono «bencílico»- puede participar en varias reacciones útiles e interesantes. Hoy daremos ejemplos y mecanismos para dos ejemplos clave: la bromación benzílica y la oxidación benzílica. Aquí está el resumen rápido:
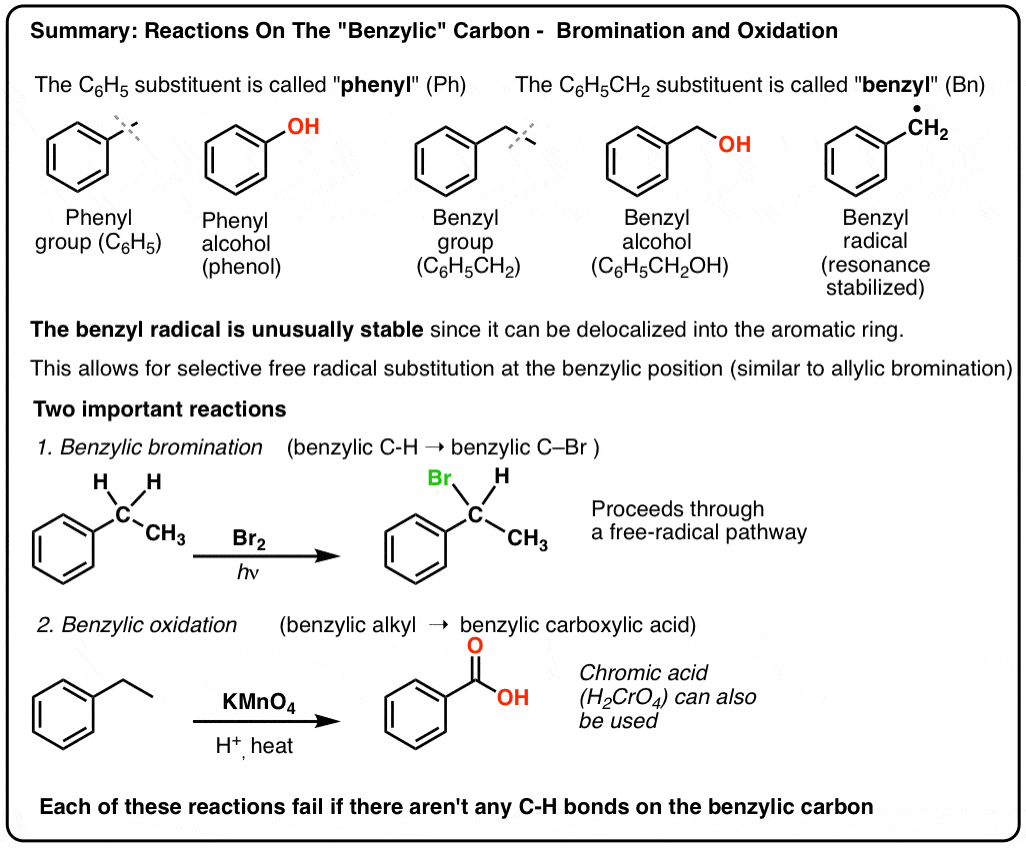
Tabla de contenidos
- Grupos alquílicos = «Roughage»
- Hay algo especial acerca de los grupos alquílicos adyacentes a un anillo de benceno
- «Fenil» vs «Benzyl» : ¿Cuál es la diferencia?
- Los radicales bencílicos se estabilizan por resonancia; los radicales fenílicos no.
- Los enlaces C-H bencílicos (y alílicos) son débiles, en relación con otros enlaces C-H alquílicos
- La bromación bencílica
- ¿Cuándo NO funciona la «bromación bencílica»?
- Aplicaciones de la bromación benzílica
- Oxidación benzílica con KMnO4 (o H2CrO4)
- La oxidación benzílica requiere un enlace C-H benzílico
- ¿Por qué es importante?
- Notas
- ¡Consúltese a sí mismo!
- (Avanzado) Referencias y Lecturas Adicionales
Grupos Alquilo = «Roughage»
En nutrición, «roughage» es como se llama a toda la celulosa y la fibra presente en los alimentos que simplemente pasan por el cuerpo sin ser realmente digeridos.
Eso describe más o menos el comportamiento de los grupos alquilo en la gran mayoría de las reacciones de química orgánica que hemos aprendido. Su química es «aburrida». Pueden constituir la columna vertebral y la estructura general de la molécula, pero sus enlaces C-H son inertes a la mayoría de las condiciones de reacción.
De hecho, si no se cuenta la combustión, casi la única reacción de los grupos alquilo que cubrimos en la química orgánica introductoria es la sustitución libre-radical. E incluso esa reacción tiende a ser bastante poco selectiva, particularmente si se trata de la cloración de radicales libres.
Hemos visto que una excepción a este comportamiento «aburrido» se puede encontrar en la bromación por radicales libres de los llamados enlaces C-H «alílicos» . La posición «alílica» es un carbono adyacente a un doble enlace (¡no un C-H en el propio doble enlace! eso es un C-H «vinílico»).
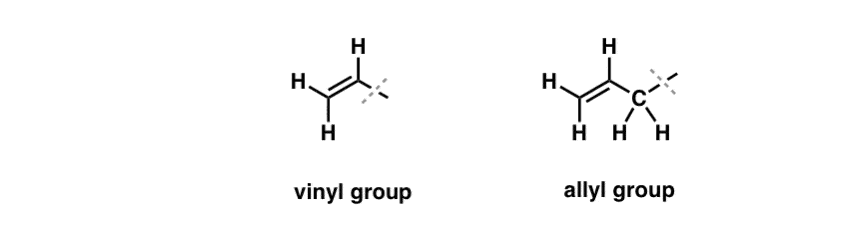
¿Qué hace que la posición «alílica» sea tan especial? Los radicales alílicos, los carbocationes y los aniones se estabilizan considerablemente a través de la resonancia. El orbital del radical alílico, carbocation, o anión puede alinearse con los orbitales p en el enlace pi adyacente, resultando en un «sistema pi» más grande y repartiendo la carga sobre un área mayor.
Hay algo especial en los grupos alquilo adyacentes a un anillo de benceno
¿Cuál es la razón de este pequeño viaje a la memoria? Bueno, recientemente hemos pasado un rato repasando la reacción de alquilación de Friedel-Crafts, y no quiero darles la impresión de que poner un grupo alquilo en un anillo de benceno es un callejón sin salida sintético.
¡Los grupos alquilo no tienen por qué ser inertes! Al igual que los carbonos alílicos, los grupos alquilo que son adyacentes a los anillos de benceno son particularmente reactivos, y esto puede tener todo tipo de aplicaciones importantes.
Hay dos reacciones importantes que cubriremos en este post:
- Bromación bencílica – bromación por radicales libres del grupo alquilo adyacente a un anillo aromático
- Oxidación bencílica – oxidación completa de un grupo alquilo adyacente al benceno a un ácido carboxílico.
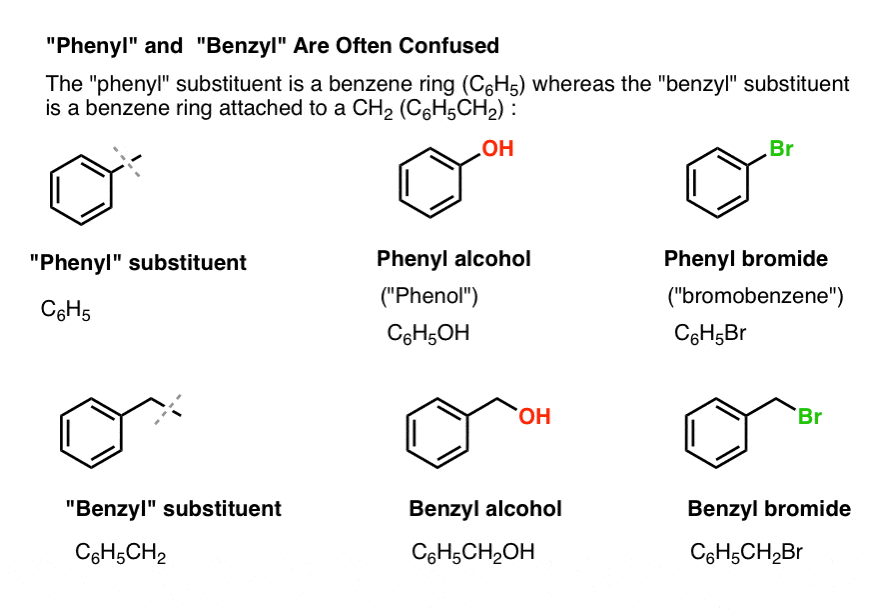
3. «Fenilo» vs «Benceno» : ¿Cuál es la diferencia?
Primero, una orden rápida de negocios. Saquemos algo de nomenclatura importante, porque «fenilo» y «bencilo» causan mucha confusión:
- Un grupo fenilo (o sustituto del fenilo) es el benceno menos un hidrógeno: C6H5 . Los carbonos del anillo son carbonos de fenilo, y los hidrógenos unidos a los carbonos de fenilo son enlaces C-H de fenilo. Es análogo al vinilo (ver arriba).
- Un grupo bencílico es metilbenceno menos un hidrógeno: C6H5CH2 . El carbono adyacente al anillo es el carbono bencílico, y los hidrógenos unidos al carbono bencílico se llaman hidrógenos bencílicos. Es análogo al alilo (arriba).
4. Los radicales bencílicos se estabilizan por resonancia; los fenílicos no.
La analogía del fenilo con el vinilo y del bencilo con el alilo se extiende también a la estabilidad de sus radicales (así como de sus carbocationes y aniones).
- Los radicales de fenilo no se estabilizan por resonancia, ya que el orbital que contiene el radical está en ángulo recto con los orbitales del sistema pi, y no hay solapamiento entre ellos. Los radicales sobre carbonos hibridados sp2 suelen ser menos estables que los radicales sobre carbonos alquílicos. (Ver post: tres factores que desestabilizan los radicales libres )
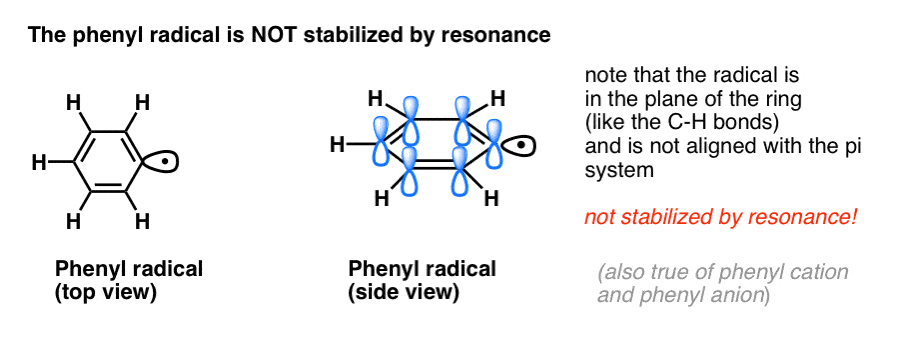
- Los radicales bencílicos son inusualmente estables ya que el orbital que contiene el radical puede alinearse con el sistema pi del anillo bencénico, al igual que en sus primos alílicos (esto también es cierto para los cationes y aniones bencílicos).
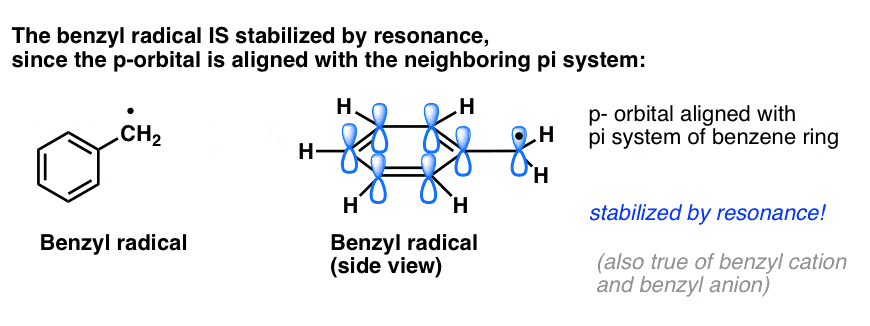
Los enlaces C-H bencílicos (y alílicos) son débiles, en relación con otros enlaces C-H alquílicos
Los enlaces C-H bencílicos tienen fuerzas de enlace (también conocidas como BDE, o energías de disociación de enlaces) de aproximadamente 90 kcal/mol, que es considerablemente más débil que los enlaces C-H terciarios (fuerza de enlace 93 kcal/mol) C-H secundarios (96 kcal/mol) y C-H primarios (100 kcal/mol). (Los enlaces C-H del fenilo son de aproximadamente 113 kcal/mol, lo que refleja de nuevo la inestabilidad de los radicales de fenilo ).
Dado que las energías de disociación de enlaces reflejan la facilidad de escisión homolítica del enlace C-H (es decir, lo fácil que es disociar el enlace en dos radicales libres) esta es otra forma de decir que los radicales benzílicos son particularmente fáciles de formar, en relación con otros radicales alquílicos.
Hemos visto previamente que lo mismo es cierto para los enlaces C-H alílicos . En la «bromación alílica», uno de los enlaces C-H del grupo alquilo adyacente a un doble enlace se convierte en un enlace C-Br, utilizando N-bromosuccinimida (NBS) y luz (hν) :
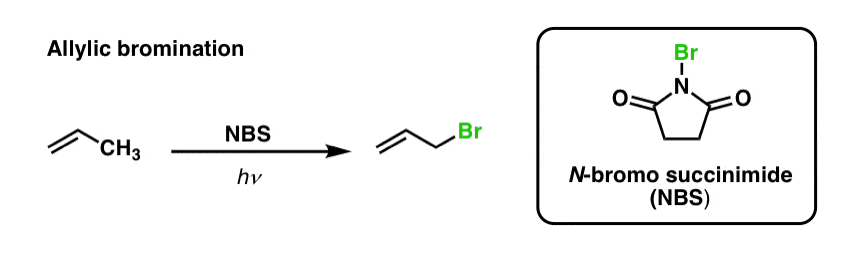
La reacción es selectiva para los C-H alílicos en presencia de enlaces C-H primarios, secundarios y terciarios debido a la menor fuerza del enlace C-H alílico (89 kcal/mol).
Bromación benzílica
Un proceso similar funciona para los carbonos «benzílicos». Podemos usar NBS (como arriba) o simplemente Br2, ya que los anillos aromáticos no son casi tan reactivos con el Br2 como los dobles enlaces.
Una vez formado (a través del «calor» o la «luz», que inicia la reacción a través de la disociación homolítica del Br-Br), el radical de bromo, Br- puede romper los enlaces C-H bencílicos más débiles sin tocar los enlaces C-H alquílicos más fuertes.
Por ejemplo, aquí están los productos de su reacción con tolueno, y también con isopropilbenceno. Nótese que SÓLO el carbono bencílico está bromado. El mecanismo de la bromación benzílica es esencialmente idéntico al de la bromación alílica, con pasos de iniciación, propagación y terminación. (Haga clic aquí para ver una imagen emergente del mecanismo.)
(Para más discusión, vea este post: Bromación alílica )
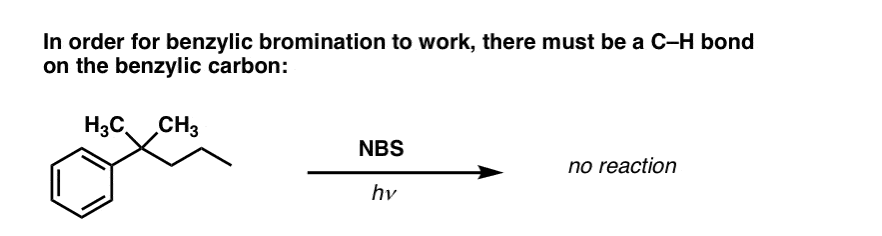
¿Cuándo NO funciona la «bromación benzílica»?
Dado que la clave de esta reacción es la formación del radical bencílico (relativamente estable), la bromación bencílica fallará en sustratos en los que la generación de este radical a través de la ruptura de un enlace C-H sea imposible.
Por ejemplo, observe el siguiente ejemplo. ¿Cómo es posible que se genere un radical bencílico cuando el carbono bencílico tiene tres grupos alquilos unidos? No puede – y la reacción falla.
Aplicaciones de la bromación bencílica
Entonces, ¿por qué podría ser útil la bromación bencílica?
Bueno, nos permite emplear todas las reacciones de los haluros de alquilo que cubrimos de nuevo en Org 1 -sobre todo la sustitución y la eliminación- para proporcionar productos que serían difíciles de instalar directamente en un anillo aromático a través de reacciones de Friedel-Crafts.
Por ejemplo, se puede utilizar la bromación bencílica para establecer una reacción SN2, por ejemplo, después de una alquilación de Friedel-Crafts:
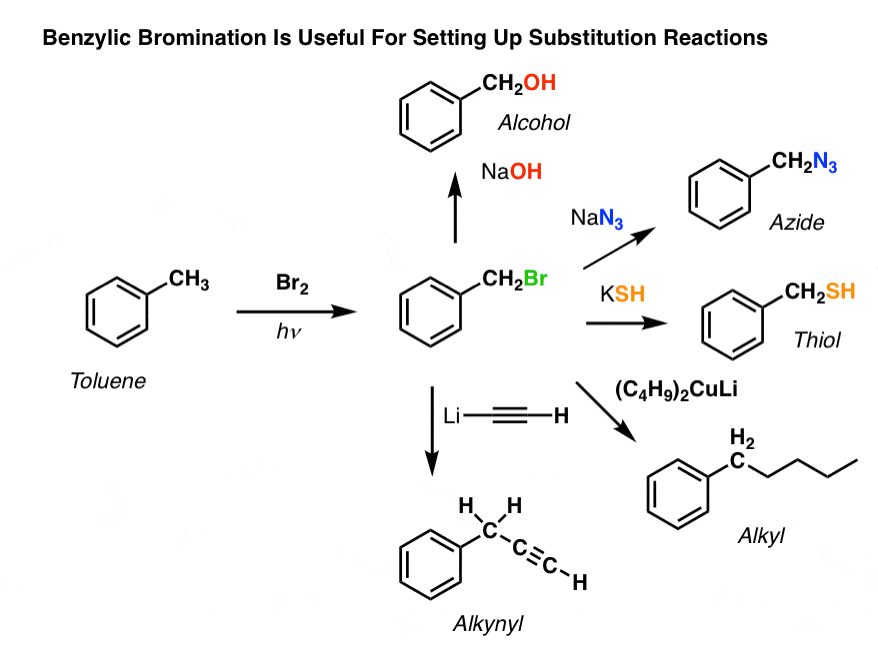
¿Veis cómo la instalación de un buen grupo saliente en la posición bencílica nos da todo tipo de opciones para instalar varios grupos funcionales?
Otro ejemplo es la síntesis del estireno a partir del benceno. A primera vista, el enfoque más directo podría parecer la reacción de Friedel-Crafts del cloruro de vinilo con el benceno. Pero la Friedel-Crafts no funciona para los haluros de alquenilo (también conocidos como haluros de vinilo). (los carbocationes de vinilo son menos estables que los carbocationes de alquilo).
Podemos sortear este obstáculo realizando una alquilación de Friedel-Crafts con cloruro de etilo, seguida de una bromación bencílica y luego una eliminación (vía E2, con algo como NaOtBu/t-BuOH) para dar el alqueno:
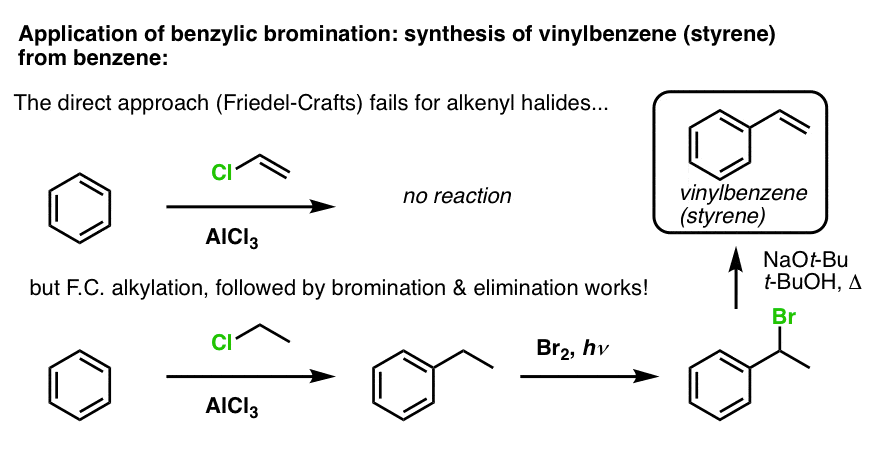
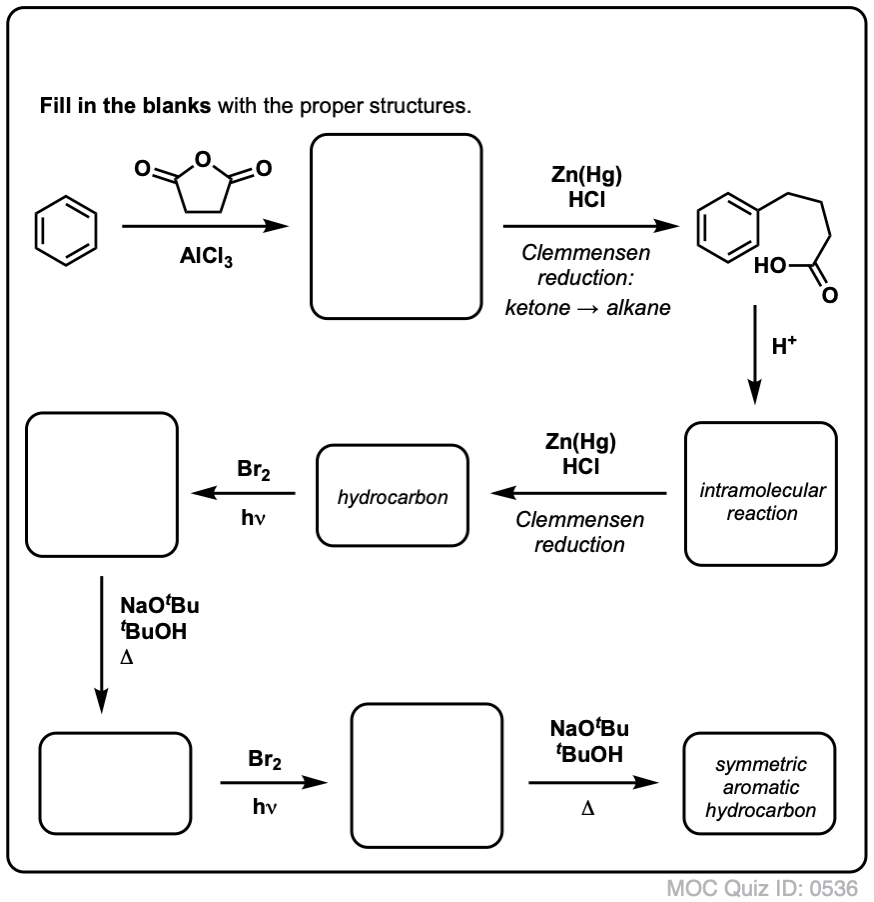
Basado en lo anterior, he aquí un rápido cuestionario para ti. ¿Cómo podrías convertir la tetralina (abajo a la izquierda) en naftaleno (abajo a la derecha)? Responde en las notas a pie de página.
9. Oxidación bencílica Con KMnO4 (o H2CrO4)
Dado que el enlace C-H bencílico es relativamente débil, podría preguntarse, con razón, si pueden realizarse otros tipos de reacciones (además de la bromación) en esta posición.
¡Ciertamente pueden! Un ejemplo excelente es la oxidación bencílica – en la que se rompe un enlace C-H bencílico y se forma un enlace C-O bencílico.
Ahora bien: existen reactivos bastante suaves para la oxidación bencílica que son el equivalente químico de hacer cosquillas al enlace C-H con una pluma, dando como resultado un aldehído o una cetona bencílica .
¡Ese no es el tipo de oxidación benzílica que se cubre en un curso típico de introducción a la química orgánica!
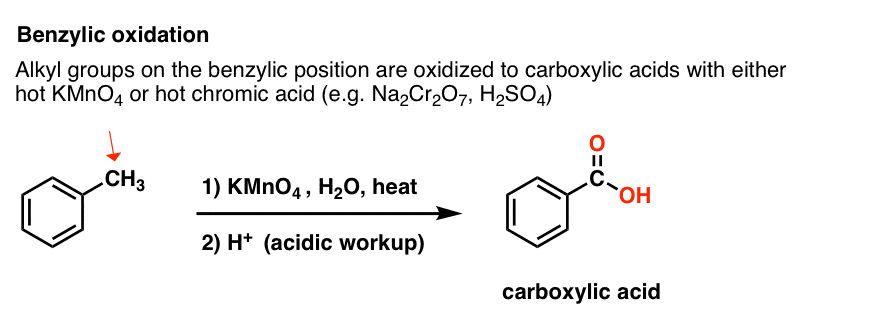
En cambio, el reactivo principal para la oxidación benzílica que se cubre en la mayoría de los libros de texto de introducción es permanganato de potasio caliente (KMnO4). El ácido crómico caliente (H2CrO4, que se forma combinando una sal de dicromato como el Na2Cr2O7 con un ácido fuerte como el H2SO4) también se puede utilizar para estos fines.
KMnO4 no es sutil. KMnO4 no es suave. KMnO4 no es amable.
Una solución de KMnO4 caliente es como una bolsa llena de pirañas furiosas que arrancarán toda la carne de tu molécula y dejarán sólo los huesos. (Ahora que lo pienso, ¡es como tu hígado! )
El KMnO4 caliente romperá cada enlace C-H bencílico y lo convertirá en un enlace C-O. Del tolueno, por ejemplo, el producto es el ácido benzoico (un ácido carboxílico).
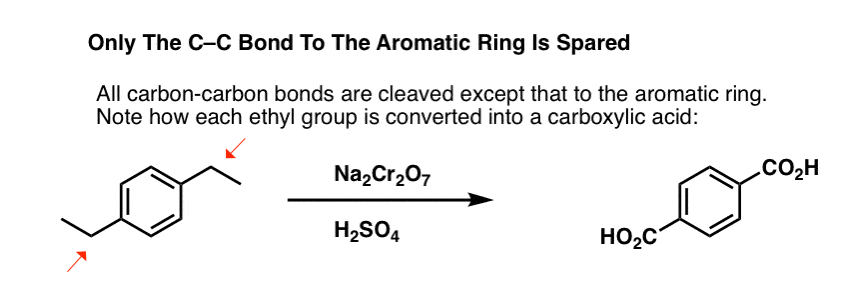
Pero no sólo rompe los enlaces C-H bencílicos. Oh no. También va tras los enlaces C-C; al menos los que no están directamente unidos a un anillo de fenilo. Por ejemplo, el para-dietilbenceno se convierte en ácido para-benceno-dicarboxílico.
¡Nótese que el enlace alquilo C-C tiene que ser escindido para que esta oxidación ocurra! (es probable que se oxide hasta el gas CO2).
Una variación interesante es en una molécula cíclica como la tetralina; el resultado es el ácido dicarboxílico.
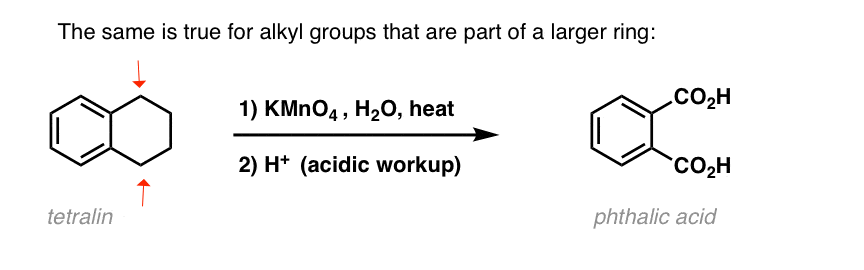
Este ácido dicarboxílico se llama ácido ftálico.
10. La oxidación bencílica requiere un enlace C-H bencílico
Al igual que con la bromación bencílica, no se produce ninguna reacción si no hay un enlace C-H en la posición bencílica. Por ejemplo, la reacción falla completamente con el t-butilbenceno:
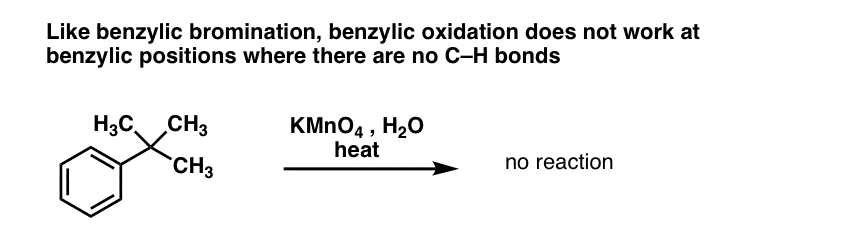
El mecanismo completo de la oxidación benzílica es demasiado complejo, largo e incierto para mostrarlo aquí, pero el primer paso es, casi con toda seguridad, la escisión homolítica del enlace C-H por el Mn=O para formar el radical benzílico.
¿Por qué es importante?
La oxidación benzílica con KMnO4 es una reacción dura, pero puede tener sus usos. Funciona mejor con moléculas simples que no tienen grupos funcionales delicados y que pueden soportar un tratamiento muy duro.
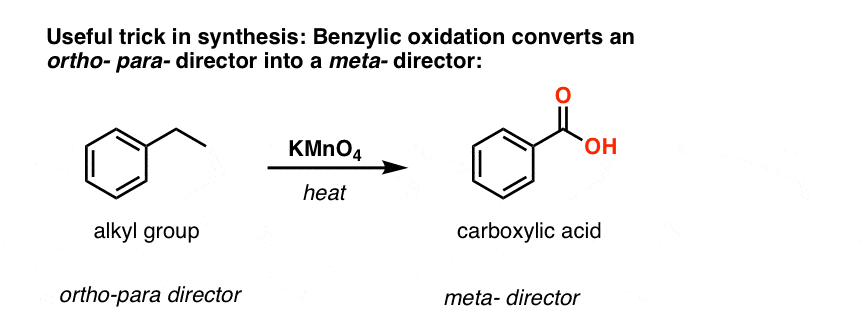
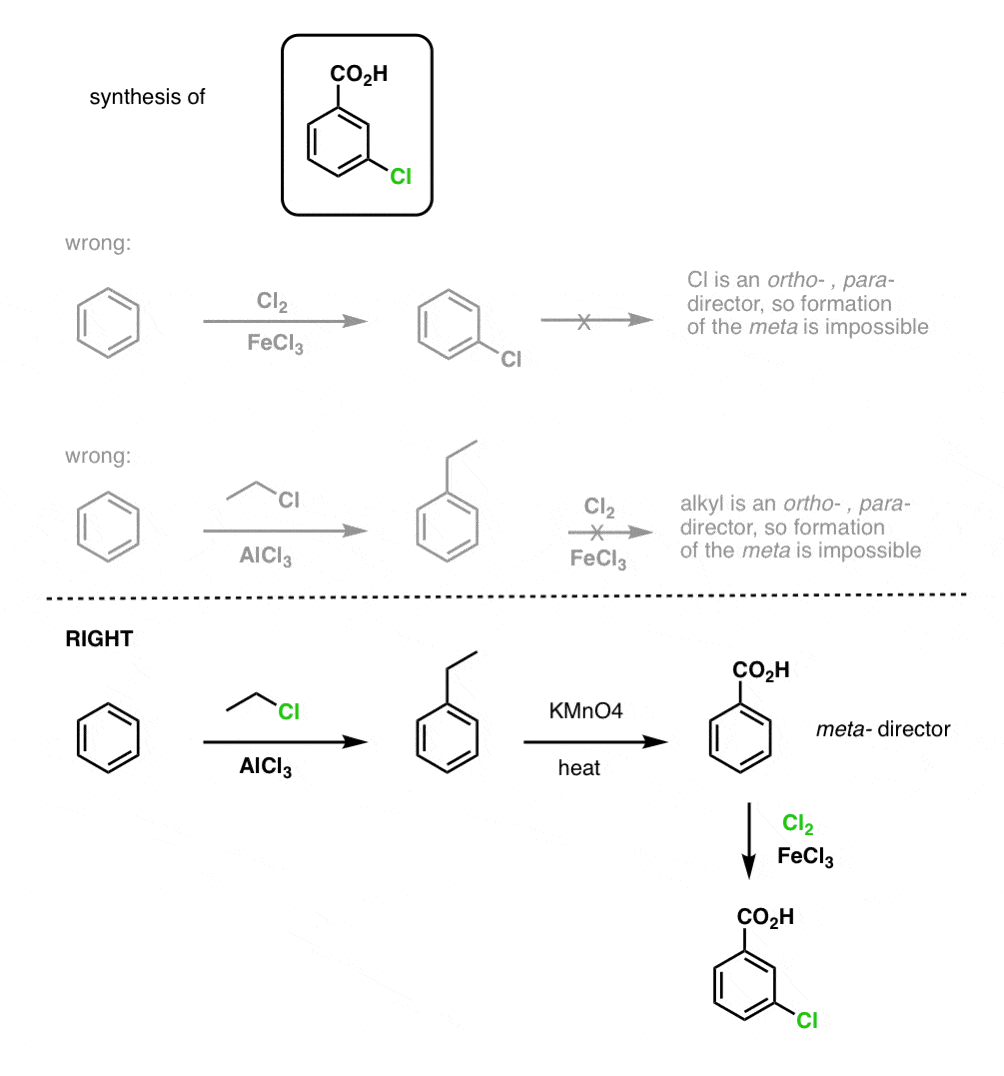
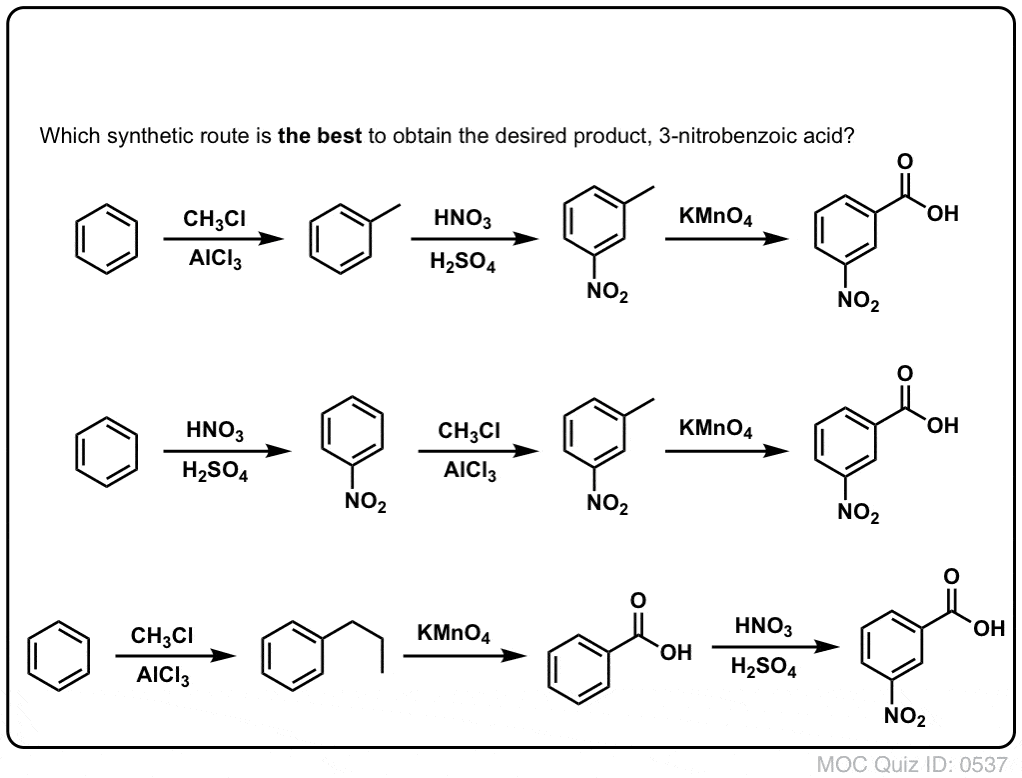
Lo primero que hay que tener en cuenta es que los ácidos carboxílicos no pueden colocarse directamente en un anillo de benceno mediante la acilación de Friedel-Crafts, por lo que la alquilación seguida de la oxidación es una solución útil.
La segunda función útil en la síntesis es el hecho de que la oxidación benzílica convierte un director o- p- (un grupo alquilo) en un metadirector.
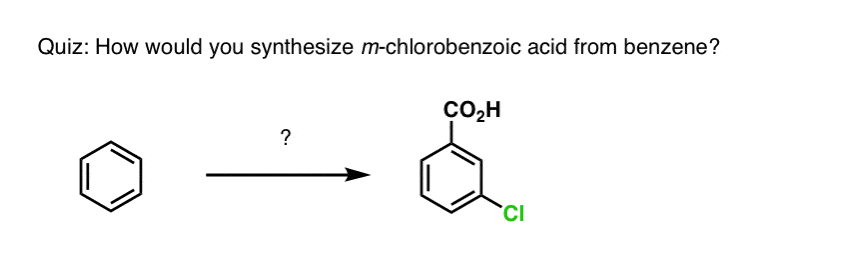
Por ejemplo, ante la síntesis de la siguiente molécula, ¿cómo se procede? (pista: implica una oxidación bencílica en algún momento).
Tendremos mucho más que decir sobre la síntesis de compuestos aromáticos en unos cuantos posts más.
Siguiente: Reducción de carbonilos bencílicos – las reducciones de Clemmensen y Wolff-Kishner
Notas
«Col» también se puede utilizar como término de argot en química para «todo eso que hay en la molécula y que se puede ignorar con seguridad» por cualquier motivo. Por ejemplo, la brioestatina es una bestia de molécula que se muestra prometedora como agente anticancerígeno. El problema es que se necesita una tonelada de un raro briozoo para obtener una cantidad decente de brioestatina, y eso no es suficiente para un ensayo clínico en humanos. Así que varios grupos han estado trabajando en la fabricación de «bryologs» más simples y fáciles de sintetizar en los que se deshacen de la «col» que no es esencial para la actividad antitumoral.
El Br2 generalmente no reacciona con anillos aromáticos sin un catalizador de ácido de Lewis. Sin embargo, si hay un grupo activador fuerte (como OH, NR2, etc.) puede producirse alguna bromación del anillo, especialmente a temperaturas elevadas.
Dato curioso: la «oxidación benzílica» es la respuesta al enigma de por qué el metilbenceno (tolueno) no es un carcinógeno tan potente como el benceno. Eso es porque su hígado tiene enzimas del citocromo p450 (que contienen especies de hierro de alto estado de oxidación) que pueden oxidar el grupo CH3 bencílico al ácido carboxílico más soluble en agua, lo que permite que sea eliminado por sus riñones.
Esto requiere dos oxidaciones y dos eliminaciones. Una manera prudente de hacerlo es oxidar (es decir, bromar) una vez, y luego eliminar para dar un alqueno. El alqueno podría someterse entonces a una nueva bromación (utilizando NBS, para evitar la bromación del doble enlace) para dar otra bromación (el producto de la bromación bencílica se muestra aquí, pero la alílica también es factible) que podría tratarse con base para dar naftaleno aromático.
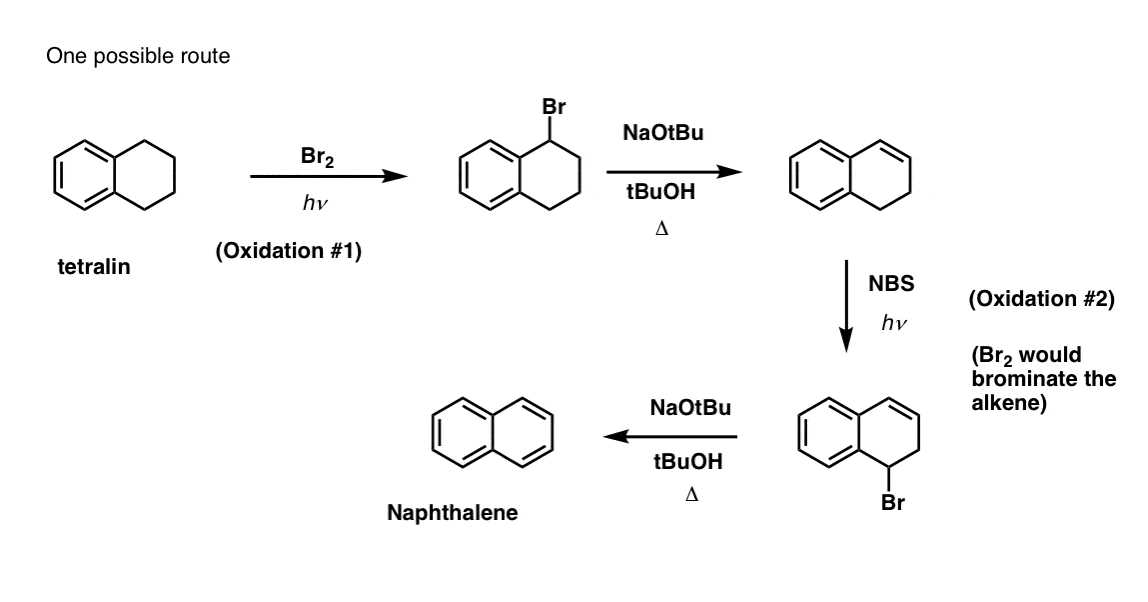
(en la práctica, resulta que ambas bromaciones pueden hacerse al mismo tiempo utilizando Br2 a alta temperatura. El tratamiento con base puede entonces dar lugar a naftaleno).
Respuesta a la pregunta 2 del cuestionario.
¡Asegúrate!
 Click to Flip
Click to Flip 
 Haga clic para voltear
Haga clic para voltear 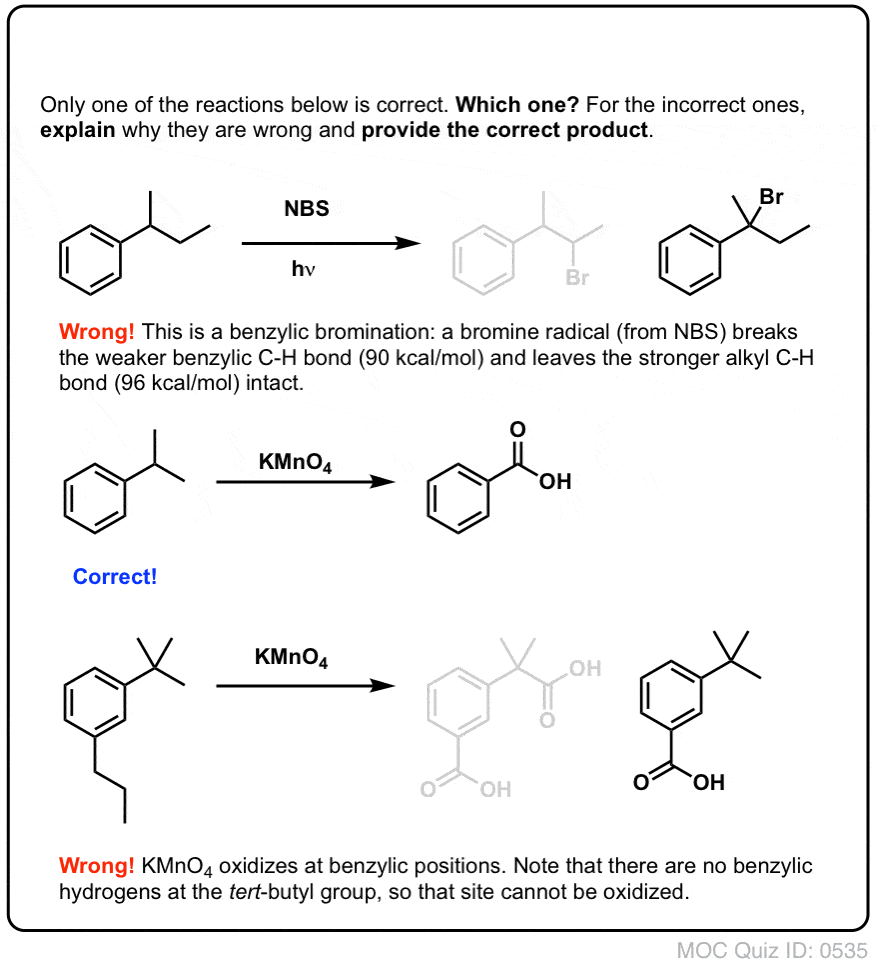
 Haga clic para voltear
Haga clic para voltear 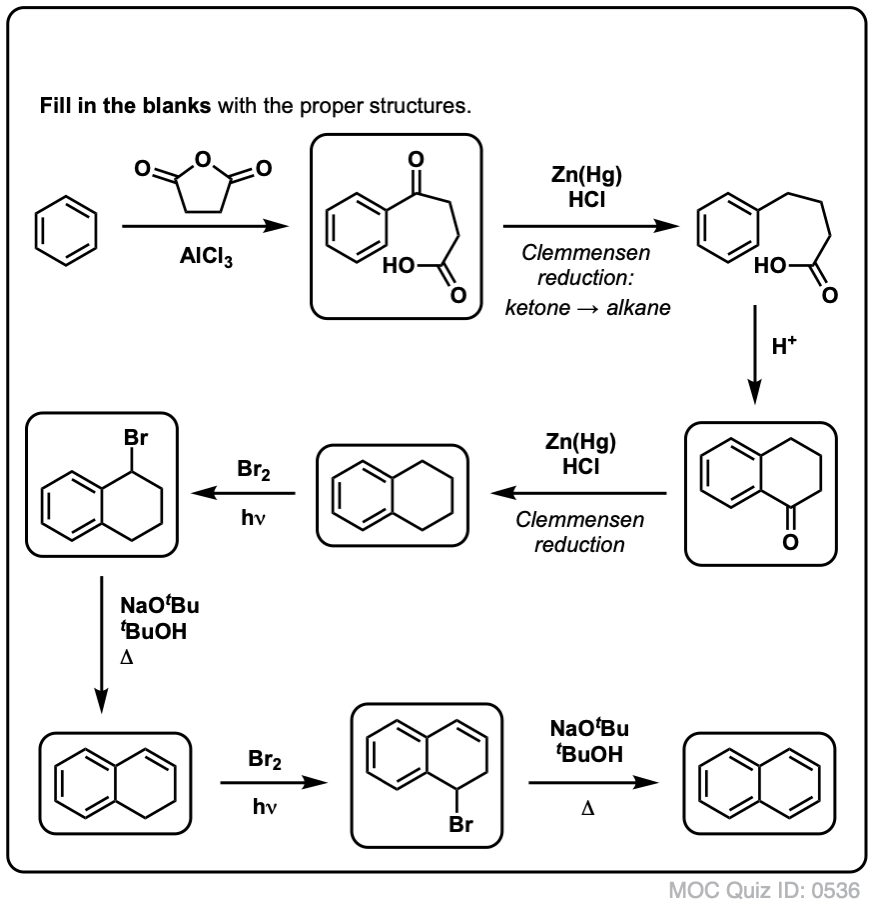
 Haga clic para voltear
Haga clic para voltear 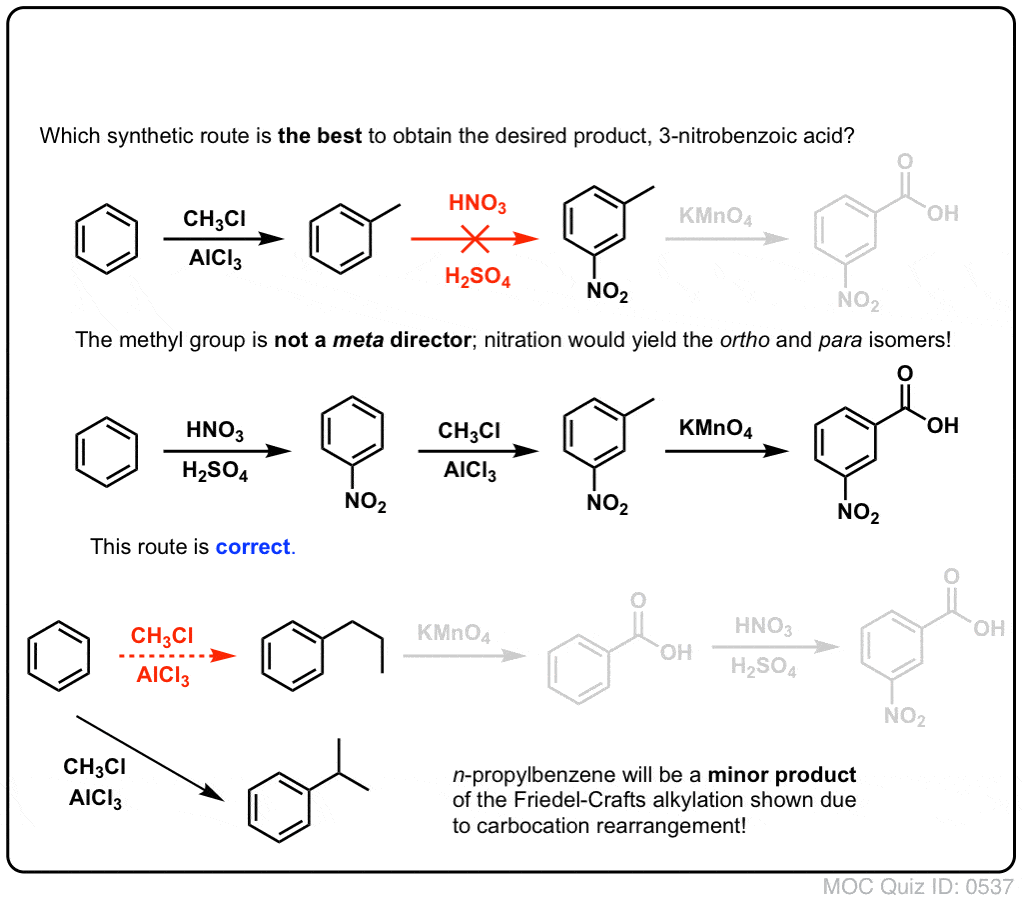
(Avanzado) Referencias y lecturas adicionales
Bromación bencílica:
Esta reacción se conoce también como reacción de Wohl-Ziegler.
- Bromierung ungesättigter Verbindungen mit N-Brom-acetamid, ein Beitrag zur Lehre vom Verlauf chemischer Vorgänge
Wohl
Chem. Ber. 1919, 52 (1), 51-63
DOI: 10.1002/cber.19190520109 - Die Halogenierung ungesättigter Substanzen in der Allylstellung
Ziegler, A. Späth, E. Schaaf, W. Schumann, E. Winkelmann
Just. Lieb. Ann. Chem. 1942, 551 (1), 80-119
DOI: 10.1002/jlac.19425510103
Las dos primeras publicaciones sobre esta reacción. Wohl utilizó N-bromoacetamida como agente bromante, no NBS. Ziegler realizó entonces un estudio detallado e informó de que el NBS podía utilizarse como agente bromante conveniente para la bromación alílica. - Dibenzocicloocteno: Síntesis multigramo de un ligando bidentado
Géraldine Franck, Marcel Brill y Günter Helmchen
Org. Synth. 2012, 89, 55-65
DOI: 10.15227/orgsyn.089.0055 - Brominaciones benzílicas con N-Bromosuccinimida en (Trifluorometil)benceno
Diana Suárez, Gilles Laval, Shang-Min Tu, Dong Jiang, Claire L. Robinson, Richard Scott, Bernard T. Golding
Synthesis 2009 (11): 1807-1810
DOI: 1055/s-0029-1216793
La referencia #3 muestra una bromación bencílica típica utilizando NBS en CCl4, que se ha eliminado en gran medida debido a la preocupación por la toxicidad. La referencia #4 muestra que el PhCF3 puede utilizarse como disolvente en lugar del CCl4 para la bromación bencílica. - Brominaciones con N-Bromosuccinimida y compuestos relacionados. La reacción de Wohl-Ziegler.
Carl Djerassi
Chemical Reviews 1948, 43 (2), 271-317
DOI: 10.1021/cr60135a004
Una antigua revisión sobre esta reacción realizada por el célebre químico Carl Djerassi, cuya mayor contribución a la salud mundial fue el desarrollo de la noretindrona, el primer anticonceptivo femenino. - N-Bromosuccinimida. III. Curso estereoquímico de la bromación bencílica
H. J. Dauben Jr. y Layton L. McCoy
Journal of the American Chemical Society 1959, 81 (20), 5404-5409
DOI: 10.1021/ja01529a038
Un estudio mecanístico sobre la estereoquímica de la bromación bencílica. Al observar la formación de bromuros benzílicos racémicos a partir de sustratos proquirales, se refuerza aún más la intermediación de los radicales en esta reacción.Las mismas referencias de la bromación alílica pueden reutilizarse aquí: - Mecanismos de la bromación benzílica
Glen A. Russell, Charles. DeBoer, y Kathleen M. Desmond
Journal of the American Chemical Society 1963 85 (3), 365-366
DOI: 1021/ja00886a040
La bromación bencílica sigue el mismo mecanismo que la bromación alílica, como explica este artículo.La NBS (N-Bromosuccinimida) es un reactivo conveniente para la bromación por radicales libres, y los siguientes artículos son estudios mecanísticos que implican a la NBS: - El mecanismo de la bromación bencílica con N-Bromosuccinimida
R. E. Pearson y J. C. Martin
Journal of the American Chemical Society 1963 85 (3), 354-355
DOI: 10.1021/ja00886a029
Estos trabajos del profesor J. C. Martin (UIUC) fueron al principio de su carrera, antes de que realizara el trabajo por el que es más conocido (estudios sobre moléculas «hipervalentes», incluido el desarrollo del «Dess-Martin Periodinane»). - La identidad de las especies portadoras de cadena en las brominaciones con N-Bromosuccinimida: Selectividad de las N-Bromosuccinimidas sustituidas hacia los toluenos sustituidos
R. E. Pearson y J. C. Martin
Journal of the American Chemical Society 1963, 85 (20), 3142-3146
DOI: 10.1021/ja00903a021 - N-bromosuccinimida. Mecanismos de la bromación alílica y reacciones relacionadas
J. H. Incremona y James Cullen Martin
Journal of the American Chemical Society 1970, 92 (3), 627-634
DOI: 10.1021/ja00706a034 - El radical succinimidilo como portador de cadena. Mecanismo de bromación alílica
J. C. Day, M. J. Lindstrom, y P. S. Skell
Journal of the American Chemical Society 1974, 96 (17), 5616-5617
DOI: 10.1021/ja00824a074 - Bromación radical del ciclohexeno en CCl4 por bromo: Adición versus Sustitución
D. W. McMillen y John B. Grutzner
The Journal of Organic Chemistry 1994, 59 (16), 4516-4528
DOI: 10.1021/jo00095a029
Este artículo describe cuidadosos estudios cinéticos que demuestran que una baja concentración de Br2 (como la proporcionada por el NBS impuro) favorecerá la sustitución radical frente a una reacción de adición polar. - Dibromuro de o-xilileno
Emily F. M. Stephenson
Org. Synth. Vol. 34, p.100 (1954)
DOI: 10.15227/orgsyn.034.0100
Un procedimiento fiable para la bromación bencílica con Br2 en Organic Syntheses. - Bromación de la tetralina. Síntesis corta y eficiente de 1,4-dibromonaftaleno
Osman Çakmak, Ismail Kahveci, Íbrahim Demirtaş, Tuncer Hökelek y Keith Smith
Czech. Chem. Commun. 2000, 65, 1791-1804
DOI: 10.1135/cccc20001791
Una conveniente síntesis de 1,4-dibromonaftaleno a partir de tetralina, vía bromación benzílica.Oxidación benzílica:
Existen muchas estrategias para la oxidación benzílica, incluyendo el uso de soluciones concentradas de KMnO4 o ácido crómico. - Estudios cinéticos de la oxidación de compuestos aromáticos por permanganato potásico. Parte IV. n- e isopropilbenceno
C. F. Cullis y J. W. Ladbury
J. Chem. Soc. 1955, 4186-4190
DOI: 10.1039/JR9550004186 - DERIVADOS DE LA PIPERIDINA X. LOS FENILPIPERIDALCARBINOLES
Kenneth E. Crook y S. M. McElvain
Journal of the American Chemical Society 1930, 52 (10), 4006-4011
DOI: 1021/ja01373a035
Si hay otro sustituyente en la posición bencílica, entonces la oxidación con da una cetona en lugar de un ácido carboxílico. - Oxidaciones heterogéneas con permanganato. 7. La oxidación de cadenas laterales alifáticas
Nazih A. Noureldin, Dongyuan Zhao, y Donald G. Lee
The Journal of Organic Chemistry 1997, 62 (25), 8767-8772
DOI: 1021/jo971168e
Los reactivos pueden adsorberse en soportes sólidos para facilitar las reacciones y reducir los residuos. En este caso, al hacer que el reactivo KMnO4 sea heterogéneo, la reactividad cambia ligeramente, y esto puede aprovecharse para algunas oxidaciones quimioselectivas.Se pueden utilizar muchos otros reactivos para la oxidación benzílica, aquí hay una selección: - Oxidación selectiva en carbono adyacente a sistemas aromáticos con IBX
K. C. Nicolaou, Phil S. Baran, y Yong-Li Zhong
Journal of the American Chemical Society 2001, 123 (13), 3183-3185
DOI: 10.1021/ja004218x
Un primer artículo del (ahora rockstar de la síntesis total) Prof. Phil Baran (The Scripps Research Institute, La Jolla, CA) cuando todavía era estudiante de doctorado en el grupo del Prof. Nicolaou. Utiliza el IBX (un reactivo I(V) hipervalente) para realizar oxidaciones bencílicas, que se producen a través de un mecanismo radical. Se trata de una reacción útil con un amplio alcance de sustratos, como se ejemplifica con 25 ejemplos en el artículo. - Oxidación bencílica directa y selectiva de alquilarenos mediante la abstracción de C-H utilizando bromuros de metales alcalinos
Katsuhiko Moriyama, Misato Takemura, y Hideo Togo
Organic Letters 2012, 14 (9), 2414-2417
DOI: 10.1021/ol300853z
Se utiliza oxona como oxidante terminal para la oxidación benzílica. - Síntesis de alcoholes bencílicos por oxidación C-H
Lalita Tanwar, Jonas Börgel, y Tobias Ritter
J. Am. Chem. Soc. 2019, 141, 17983-17988
DOI: 10.1021/jacs.9b09496
Se utiliza peróxido de mesilo como oxidante para la oxidación selectiva de posiciones bencílicas a alcoholes. Se forma el mesilato de bencilo, que puede ser hidrolizado al alcohol. - Oxidación electroquímica bencílica de enlaces C-H
Jason A. Marko, Anthony Durgham, Stacey Lowery Bretz, y Wei Liu
Chem. Commun, 2019, 55, 937-940
DOI: 10.1039/C8CC08768G
La oxidación bencílica también puede efectuarse mediante electroquímica. - Reacciones de oxidación alílica y bencílica con clorito sódico
Samuel M. Silvestre, Jorge A. R. Salvador
Tetrahedron 2007, 63 (11), 2439-2445
DOI: 10.1016/j.tet.2007.01.012
El NaClO2 es barato y también puede utilizarse como oxidante.
Deja una respuesta