Inmunología de las células T: Las matemáticas de la memoria
On enero 20, 2022 by adminLa memoria inmunológica -la capacidad del organismo de «recordar» y combatir patógenos previamente encontrados- constituye la base de la vacunación, que es uno de los descubrimientos más importantes de la historia de la medicina. Sin embargo, a pesar del enorme éxito de la vacunación, todavía no entendemos del todo cómo el cuerpo mantiene la memoria inmunológica a largo plazo, y esta laguna en nuestro conocimiento está obstaculizando los intentos de desarrollar «vacunas de nueva generación» y los esfuerzos para desplegar las células inmunes llamadas células T contra el cáncer.
El sistema inmunológico contiene muchos tipos diferentes de células. Algunas de estas células pueden reconocer agentes patógenos sin haberlos encontrado nunca. Sin embargo, otras células inmunitarias -incluidas las células T- «aprenden sobre la marcha»: al encontrarse por primera vez con un patógeno, estas células responden con relativa lentitud, pero más tarde forman una «memoria» para responder con mayor eficacia. Para entender mejor cómo se mantiene la memoria inmunológica a largo plazo, necesitamos saber más sobre la dinámica de las células T de memoria. En particular, será necesario comprender la contribución relativa de los siguientes procesos: el reclutamiento de nuevas células T (que se conocen como células T ingenuas) en el conjunto de células T de memoria; la renovación de las células T de memoria mediante la división celular; y la supervivencia de las células T de memoria individuales. Sin embargo, cuantificar estos procesos es un reto.
Investigaciones anteriores con datos de pacientes con cáncer indicaban que las células T de memoria tienen una vida relativamente corta (Michie et al., 1992). Posteriormente, hace casi 20 años, las técnicas de etiquetado del ADN supusieron un gran avance en el estudio de la dinámica de las células T al permitir a los investigadores realizar un seguimiento de la rapidez con la que se dividen y mueren las células T (Hellerstein et al., 1999). Estos métodos se utilizaron posteriormente para confirmar que las células T de memoria viven seis meses o menos en humanos sanos (Westera et al., 2013), mientras que las células T ingenuas pueden vivir hasta nueve años (Vrisekoop et al., 2008). Por lo tanto, una larga vida no es una característica clave de las células T de memoria. En cambio, la memoria inmunológica, que puede durar toda la vida (Crotty y Ahmed, 2004), es mantenida por células de vida relativamente corta. Sin embargo, sigue sin estar claro hasta qué punto el conjunto de células T de memoria se mantiene mediante la división de las células T de memoria existentes o mediante el reclutamiento de células T ingenuas al conjunto. Se cree que este último proceso desempeña sólo un papel menor porque las células T ingenuas son muy variables, y la probabilidad de que una determinada célula T ingenua entre en el pool de células T de memoria es por tanto extremadamente baja.
Ahora, en eLife, inmunólogos de la Universidad de Glasgow, la Escuela de Medicina Icahn del Monte Sinaí y el Royal Free Hospital -Graeme Gossel, Thea Hogan, Daniel Cownden, Benedict Seddon y Andrew Yates- informan de cómo han utilizado dos enfoques independientes para estudiar cómo se mantiene la memoria de las células T (Gossel et al, 2017). En una técnica denominada «mapeo temporal del destino», Gossel et al. utilizaron el fármaco oncológico busulfán para eliminar las células madre hematopoyéticas (es decir, las células madre que se convierten en células sanguíneas como las células T) en la médula ósea de los ratones, dejando intactas sus reservas periféricas de células T. A continuación, trasplantaron células de la médula ósea de ratones donantes, que maduraron hasta convertirse en células T que sólo difieren en un marcador proteico (CD45) expresado en su superficie. Así, en estos ratones, los investigadores fueron capaces de distinguir las células T recién formadas de las células T originales, y de rastrear qué células estaban siendo reemplazadas y medir su dinámica (Figura 1A).
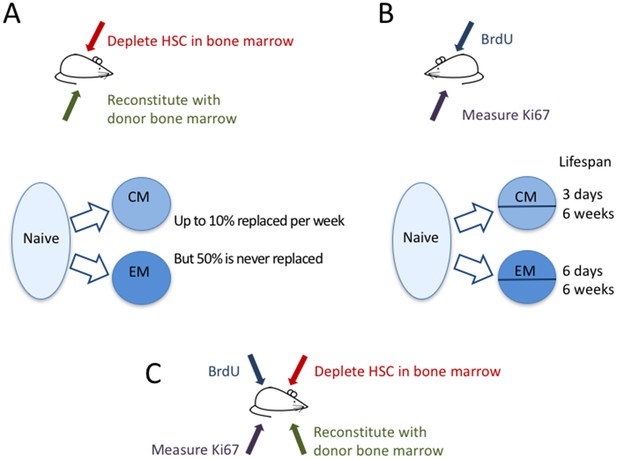
La dinámica de las células T de memoria.
Gossel et al. utilizaron dos enfoques experimentales para estudiar la dinámica de las células T de memoria en ratones. (A) Para cuantificar la afluencia de células T ingenuas al conjunto de células T de memoria existentes, utilizaron el fármaco busulfán para matar selectivamente las células madre hematopoyéticas (HSC) en la médula ósea de ratones CD45.1+ (flecha roja), y luego añadieron nuevas células derivadas de la médula ósea de ratones CD45.2+ (flecha verde). Las células T ingenuas (burbuja azul claro) reemplazaron alrededor del 10% de las células T de memoria central (CM) y alrededor del 6% de las células T de memoria efectoras (EM) por semana (flechas azules). Aproximadamente la mitad de la población de células T de memoria residentes nunca fue reemplazada. (B) En un segundo experimento, se marcó el ADN de las células T de memoria con el marcador BrdU para medir la rapidez con la que se dividen y mueren las células de las diferentes subpoblaciones de células T de memoria. Midiendo el marcador Ki67 (flecha púrpura), pudieron clasificar las células del CM y del EM en células recientemente divididas (Ki67+) y no recientemente divididas (Ki67-). Tanto el grupo de CM como el de EM contenían células con una dinámica rápida y lenta: las células de vida corta vivían alrededor de tres y seis días, respectivamente, mientras que las células de vida larga vivían alrededor de seis semanas en ambas subpoblaciones. (C) En el futuro, podría ser útil combinar estos dos enfoques para comparar la división celular y la muerte de las células T de memoria recientemente reclutadas (CD45.2+) y preexistentes (CD45.1+).
© 2007, Seans Potato Business, Wikimedia Commons, Creative Commons Attribution-Share Alike 3.0 Unported. El ratón utilizado en la Figura 1 partes A-C se reproduce con el permiso de Seans Potato Business.
Aunque los ratones no tenían ninguna infección que activara las células T ingenuas, parecía haber una gran afluencia constante de células T ingenuas en el grupo de células T de memoria. El conjunto de células T de memoria tiene diferentes subpoblaciones, incluidas las células T de memoria central y las células T de memoria efectoras, que pueden distinguirse por los diferentes marcadores proteicos que se encuentran en su superficie. Gossel et al. descubrieron que las células T ingenuas reemplazaban alrededor del 10% de las células T de memoria central cada semana. En el caso de las células T de memoria efectoras, esta cifra era de alrededor del 6% por semana en los adultos jóvenes y del 1% por semana en los ratones más viejos. Es importante destacar que demostraron que, al no tener en cuenta este gran flujo desde el conjunto de células T ingenuas al conjunto de memoria, los estudios anteriores pueden haber sobrestimado significativamente la vida útil de las células T de memoria.
A pesar de esta rápida sustitución de las células T de memoria por nuevas células T ingenuas, alrededor del 50% del conjunto de células T de memoria que se había formado antes de que los ratones tuvieran ocho semanas de edad nunca fue sustituido por nuevas células T ingenuas. Así pues, aunque una fracción sustancial del conjunto de células T de memoria se sustituye a un ritmo elevado a lo largo de la vida, una proporción igualmente grande se mantiene desde una edad temprana. La cuestión sigue siendo si estas células T «originales» simplemente tienen una larga vida útil o se mantienen a través de la división celular.
Para comprender mejor la dinámica de las diferentes subpoblaciones de células T, Gossel et al. etiquetaron el ADN de las células en proceso de división celular y midieron la proteína Ki67, que las células expresan de forma natural durante la división (Figura 1B). El marcador Ki67 se utilizó entonces como un «sello de tiempo» que marcaba las células que se habían dividido recientemente, mientras que el etiquetado del ADN se utilizó para rastrear la dinámica de las células «selladas» y «no selladas». Gossel et al. muestran por primera vez que tanto el grupo de células T de memoria central como el de memoria efectoras están compuestos por subconjuntos de células T con dinámicas intrínsecamente diferentes. En ambos grupos, alrededor de la mitad de las células viven durante unos pocos días, mientras que la otra mitad, por término medio, vive durante unas seis semanas.
Este estudio combina maravillosamente los experimentos cuantitativos detallados con los modelos matemáticos, y por lo tanto revela importantes conocimientos sobre el mantenimiento a largo plazo de las células T de memoria. Sin embargo, el trabajo también plantea muchos interrogantes. Por ejemplo, recientemente se ha demostrado que el conjunto de células T de memoria de los ratones de laboratorio se parece más al de los bebés humanos que al de los adultos humanos (Beura et al., 2016). Si las nuevas células T ingenuas sustituyen hasta el 10% del pool de células T de memoria por semana, incluso en entornos limpios de laboratorio, cabe preguntarse cuánto reemplazarían en humanos, que están continuamente expuestos a patógenos.
Tampoco está claro qué es lo que impulsa a estas células a entrar en el pool de células T de memoria y si las infecciones crónicas latentes reclutan continuamente nuevas células T ingenuas en el pool de memoria. No obstante, una fracción sustancial del conjunto de células T de memoria parece ser resistente y no puede ser sustituida por nuevas células del conjunto de células T ingenuas. La investigación futura debería abordar qué hace que estas células T sean resistentes y si no pueden ser reemplazadas incluso durante las infecciones. Por último, pero no por ello menos importante, cabe preguntarse cuál es el beneficio de combinar un pool de células T de memoria que nunca se reemplaza con uno que se reemplaza rápida y continuamente?
Deja una respuesta