Evaluación de la salud celular: Viabilidad y proliferación
On octubre 11, 2021 by adminParte I: Ensayos de viabilidad y proliferación
Viabilidad y proliferación
La viabilidad y la proliferación son dos características distintas de las células. La viabilidad es una medida del número de células vivas en una población, mientras que la proliferación es una medida de la división celular. Hay que tener en cuenta que no todas las células viables se dividen. Aunque la proliferación puede interpretarse fácilmente como viabilidad, la ausencia de proliferación no debe tomarse automáticamente como un signo de muerte celular.
Evaluación de la viabilidad y la proliferación
1. Permeabilidad de la membrana
Una característica de las células muertas y moribundas es la ruptura de las membranas celulares y nucleares. Muchos ensayos de viabilidad utilizan esta característica de la muerte celular para distinguir las células viables de las no viables.
Las tinciones de ácidos nucleicos polares e impermeables a las células, como el DAPI, el yoduro de propidio (PI) y el 7-AAD, tiñen las células muertas, ya que estas tinciones sólo pueden entrar en las células con membranas comprometidas. El PI se une tanto al ARN como al ADN, mientras que el 7-AAD y el DAPI sólo interactúan con el ADN. Estas tinciones pueden utilizarse en combinación con ensayos que detectan la actividad enzimática, como los sustratos de esterasas que se comentan en la siguiente sección, o con indicadores de viabilidad permeables a las células para etiquetar células vivas y muertas simultáneamente. Los ensayos de PI, DAPI y 7-AAD pueden leerse utilizando un microscopio de fluorescencia, un citómetro de flujo (Figura 1) o un lector de microplacas.
A.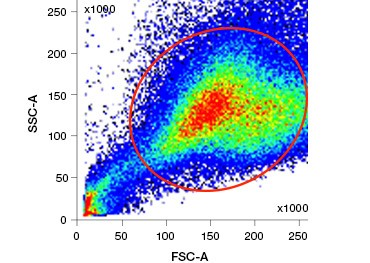
B.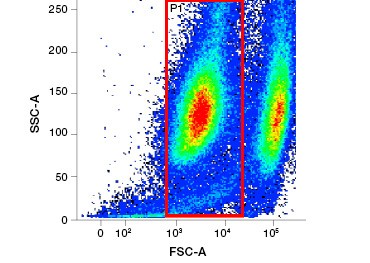
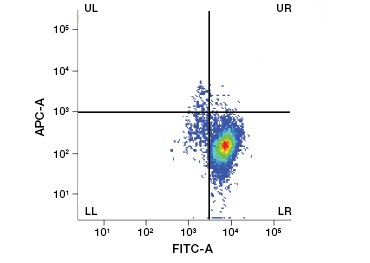
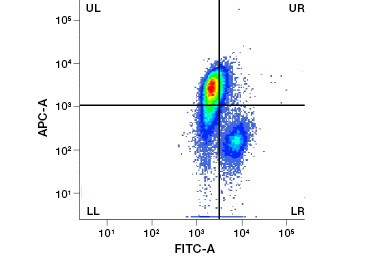
Fig. 1. La tinción con yoduro de propidio mejora la identificación de las células de interés. La separación de las células vivas mediante la dispersión frontal y lateral puede no ser suficiente para eliminar las células muertas y la unión no específica puede seguir estando presente (A). El uso de colorantes de viabilidad como el yoduro de propidio puede ayudar a eliminar la unión no específica (B). Los macrófagos J774 se tiñeron para CD11b y CD3, con el círculo y el rectángulo rojos indicando la estrategia de separación para las células vivas.
El tiempo es crítico cuando se utilizan estos tintes porque la fracción de células teñidas aumenta durante la tinción a medida que las células siguen muriendo. Debe tenerse en cuenta que ninguno de estos colorantes es fijable. Para las aplicaciones que requieren fijación, las monoazidas de etidio o las tinciones de proteínas reactivas a la amina son una excelente opción.
Las tinciones de proteínas impermeables a las células son una gran alternativa a las tinciones de ácidos nucleicos, ya que son menos tóxicas. Los colorantes reactivos a la amina se presentan en una amplia gama de espectros de excitación y emisión, por lo que permiten una mayor flexibilidad en el diseño de paneles de citometría de flujo y microscopía que los colorantes de ADN. Otra ventaja de estas tinciones de proteínas es que son fijables (Figura 2).
A.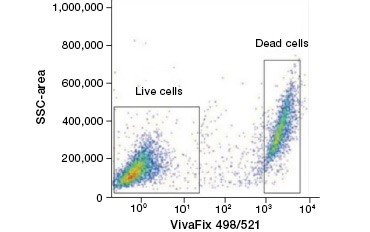
B.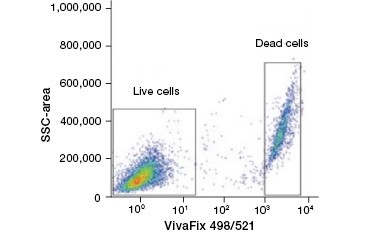
Fig. 2. Las tinciones de proteínas distinguen las células vivas de las muertas. Utilizando los ensayos de viabilidad celular VivaFix™, las poblaciones de células vivas y muertas pueden identificarse y analizarse posteriormente en células fijadas (A) y no fijadas (B) utilizando la citometría de flujo.
Una consideración especial cuando se utiliza la tinción proteica común de azul tripán es que este colorante teñirá las células viables a lo largo del tiempo de forma específica para cada célula. Por lo tanto, es fundamental optimizar los protocolos de azul tripán para cada tipo de célula y experimento.
Todos estos colorantes pueden utilizarse en células y tejidos individuales y evaluarse mediante microscopía de fluorescencia o citometría de flujo, aunque la tinción con azul tripán se evalúa más comúnmente contando las células manualmente mediante un hemocitómetro y un microscopio.
A diferencia de las tinciones de ácidos nucleicos impermeables a las células, las tinciones de ácidos nucleicos permeables a las células, como el naranja de acridina, se difunden fácilmente a través de las membranas celulares y, por tanto, tiñen el ADN de las células viables. Las células no viables no se tiñen eficazmente, ya que sus membranas comprometidas permiten que el colorante se difunda fácilmente fuera de ellas. El naranja de acridina es una tinción de doble fluorescencia que emite fluorescencia verde cuando se une al ADNd y fluorescencia roja cuando se une al ADNs y al ARN. Al utilizar el naranja de acridina como colorante de unión al ADN, hay que tener en cuenta que no se une eficazmente a la cromatina condensada. Como se comenta en la sección 6, este colorante también puede utilizarse para evaluar la capacidad de las células para mantener el pH ácido en los lisosomas, otro indicador de la viabilidad celular. Las tinciones de ácidos nucleicos permeables a las células pueden utilizarse para identificar y cuantificar las poblaciones de células viables mediante microscopía, citometría de flujo o ensayo en microplaca.
Los tintes impermeables y permeables a las células pueden utilizarse en combinación con anticuerpos marcados con fluorescencia contra proteínas de interés, lo que facilita la inclusión de controles de viabilidad cruciales en cada experimento. Una consideración clave cuando se utilizan estos colorantes para evaluar la integridad de la membrana es que los diferentes tipos de células tienen diferentes características de permeabilidad de la membrana. Por ejemplo, algunos colorantes de ADN impermeables a las células teñirán fácilmente las células eucariotas muertas, pero no podrán teñir las procariotas con membranas comprometidas.
La integridad de la membrana también puede evaluarse mediante ensayos enzimáticos. Una opción popular es la evaluación de la fuga de la enzima citoplasmática lactato deshidrogenasa (LDH) en el medio de cultivo al morir la célula. Los ensayos colorimétricos de LDH pueden llevarse a cabo en formato de microplaca y leerse utilizando un lector de microplacas ELISA.
La desintegración de la membrana también puede medirse utilizando ensayos de liberación de cromo. En este caso, las células se preetiquetan con 51Cr antes del tratamiento experimental. El cromo se une a las proteínas celulares y se libera en el medio de cultivo tras la muerte celular. Al determinar la cantidad de 51Cr libre frente a la ligada, utilizando un contador de centelleo, se puede medir cuantitativamente la muerte celular. Las células también pueden ser preetiquetadas con colorantes fluorescentes. Estos métodos a veces sufren de un alto fondo debido a la liberación espontánea de las etiquetas; son útiles sólo para aplicaciones que permiten el pre-etiquetado de las células de interés.
2. Actividad enzimática
Otra distinción clave entre las células viables y no viables es que las células viables son enzimáticamente activas. La actividad de la esterasa, medida con sustratos como el diacetato de carboxifluoresceína (CFDA), se utiliza habitualmente como indicador de la actividad enzimática global. El CFDA es un colorante no fluorescente y permeable a las células que se hidroliza para formar la molécula fluorescente carboxifluoresceína por medio de esterasas intracelulares no específicas presentes sólo en las células viables. Como la carboxifluoresceína tiene carga negativa, se retiene de forma no covalente en las células viables, lo que da lugar a una fluorescencia verde.
CFDA-SE es un derivado de CFDA que se retiene mejor tras la hidrólisis. Su producto, la CFSE, tiene grupos ésteres de succinimidilo que forman enlaces covalentes con las aminas primarias de las proteínas intracelulares, lo que permite el seguimiento a largo plazo de la viabilidad celular. Dado que la CFSE se retiene covalentemente en las células, es un indicador más fiable de la viabilidad celular y una medida popular de la proliferación celular, ya que su fluorescencia se reduce a la mitad con cada división celular (Figura 3). Se han introducido mejoras en la CFDA-SE con tintes de proliferación que tienen una mayor retención celular, proporcionan una mayor resolución de la división celular y están disponibles en una amplia gama de espectros de excitación y emisión para permitir su incorporación en aplicaciones fluorescentes multicolor como la citometría de flujo.
A.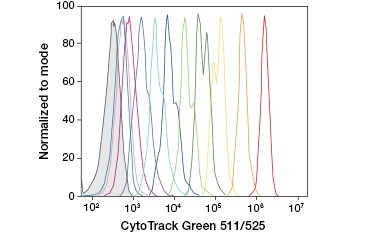
B.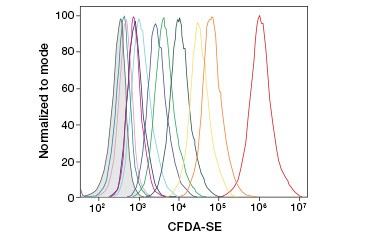
Fig. 3. Seguimiento de las generaciones celulares por citometría de flujo. Pueden resolverse diez generaciones celulares utilizando el ensayo de proliferación celular CytoTrack™ Green 511/525 (A) y hasta ocho utilizando CFDA-SE (B).
Se dispone de muchos otros sustratos fluorescentes de esterasa, como los derivados de la calceína y el BCECF, con propiedades variables, incluyendo diferencias en los espectros de excitación/emisión. Dado que la fluorescencia del BCECF es sensible al pH, también puede rastrear cambios en el pH citosólico.
Usando sustratos de esterasas permeables a las células, la viabilidad puede evaluarse mediante microscopía de fluorescencia y citometría de flujo. Estos sustratos también pueden aplicarse a muestras de tejido o utilizarse en ensayos de microplacas de alto rendimiento.
3. Actividad metabólica
Otra medida común de la viabilidad celular es la actividad metabólica, que puede evaluarse utilizando sondas oxidables y reducibles.
La resazurina es un popular indicador de oxidación-reducción (redox). Este colorante permeable a las células puede añadirse directamente al medio de cultivo celular, lo que lo convierte en un ensayo rápido y cómodo. En las células metabólicamente activas, la resazurina azul y débilmente fluorescente se reduce para formar resorufina, una molécula rosa y altamente fluorescente. Este cambio puede controlarse mediante ensayos fluorescentes y colorimétricos. Dado que la cantidad de fluorescencia es directamente proporcional al número de células vivas que respiran, la resazurina se utiliza ampliamente para medir cuantitativamente la viabilidad celular. La resazurina es una alternativa conveniente, más sensible y estable, y no tóxica, a otros indicadores redox como las sales de tetrazolio MTT y XTT. A diferencia de los ensayos basados en la sal de tetrazolio, que son colorimétricos y sólo pueden leerse utilizando un lector de microplacas, los ensayos de viabilidad con resazurina pueden leerse utilizando citometría de flujo o microscopía de fluorescencia. La resazurina y las sales de tetrazolio son particularmente útiles para las aplicaciones de alto rendimiento porque la viabilidad puede evaluarse en microplacas utilizando un lector de microplacas (Figura 4). A menudo se elige el XTT en lugar del MTT para aplicaciones de alto rendimiento porque, a diferencia del MTT, produce un colorante soluble en agua, eliminando así un paso de solubilización que es crucial para los ensayos de MTT. La resazurina y las sales de tetrazolio son las más utilizadas para evaluar la viabilidad de las células adherentes y las células en solución.
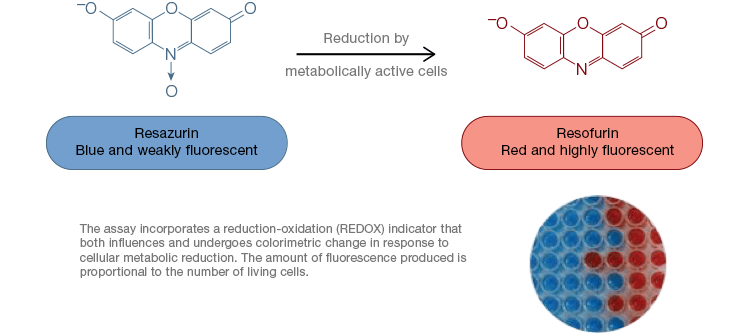
Fig. 4. Los ensayos de oxidación de resazurina no tóxicos son fácilmente escalables para aplicaciones de alto rendimiento. La oxidación de alamarBlue en células metabólicamente activas produce un cambio colorimétrico de azul a rojo, así como un aumento de la fluorescencia.
Las dihidrorodaminas, -calceínas y -fluoresceínas son derivados reducidos de la rodamina, la -calceína y la -fluoresceína que son permeables a las células e incoloros. Estos compuestos se oxidan fácilmente a su tinte madre fluorescente por las especies reactivas de oxígeno presentes en las células y tejidos vivos.
Otra clase de ensayos de viabilidad que miden la actividad metabólica son los ensayos de ATP luminiscente. Estos cuantifican el ATP liberado por las células durante la lisis. No requieren largos periodos de incubación, son extremadamente sensibles y suelen leerse utilizando un lector de microplacas.
Un factor a tener en cuenta cuando se utilizan ensayos que miden la actividad metabólica es que la actividad metabólica puede diferir bajo diferentes condiciones de cultivo celular. Por lo tanto, es necesario incluir controles adecuados para tener en cuenta estas diferencias.
4. Síntesis/replicación del ADN
Otra medida de viabilidad, y un método popular para evaluar la proliferación, es la cuantificación de la incorporación de BrdU en el ADN recién sintetizado. El ADN que contiene BrdU se identifica utilizando anticuerpos de BrdU conjugados o anticuerpos de BrdU en combinación con un anticuerpo secundario conjugado (Figura 5). Estos ensayos permiten una variedad de lecturas ya que los anticuerpos pueden acoplarse a diferentes tipos de indicadores (fluoróforos, peroxidasas, etc.). El marcado con anticuerpos de marcadores celulares específicos también permite distinguir poblaciones proliferantes específicas. Las muestras se fijan después de la incubación y luego se analizan mediante citometría de flujo, microscopía de fluorescencia, inmunohistoquímica o lectores de microplacas. Mediante la citometría de flujo, las células pueden atribuirse a la fase G0/G1, S o G2/M del ciclo celular en función de su contenido total de ADN. El uso de sustratos cromogénicos de peroxidasa permite leer los ensayos sin necesidad de un fluorímetro. Y utilizando -TdR en lugar de BrdU estos ensayos pueden convertirse en una lectura de radiomarcaje.
A.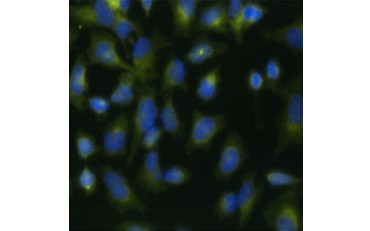
B.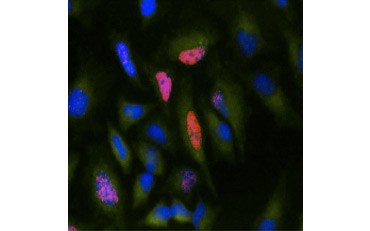
Fig. 5. Visualización de la incorporación de BrdU. Las células HeLa se trataron con 10 µg de BrdU durante 1 hora (B) o se dejaron sin tratar (A). Las células se tiñeron con el anticuerpo de ratón anti-BrdU, clon Bu20a (MCA2483; dilución 1:25) y se utilizó el anticuerpo de cabra anti-IgG de ratón (H/L) conjugado con DyLight 549 (rojo) (STAR117D549GA; dilución 1:50) como anticuerpo secundario. El citoplasma se tiñó con el anticuerpo anti-GAPDH de conejo (AHP1628; dilución 1:100) y se utilizó como anticuerpo secundario el anticuerpo IgG de conejo de oveja conjugado con DyLight 488 (verde) (STAR36D488GA; dilución 1:50). Se utilizó PureBlu™ DAPI (1351303) como contratinción nuclear.
5. Expresión de marcadores de proliferación
Se sabe que ciertas proteínas aumentan su expresión durante la proliferación celular. Ki-67, por ejemplo, se expresa en el núcleo de las células en división pero no es detectable durante G0 y G1 (Figura 6). Del mismo modo, la fosforilación de la histona H3 puede utilizarse para identificar las células en fase M. Otros marcadores de proliferación utilizados habitualmente son el antígeno nuclear de células proliferantes (PCNA) y el minicromosoma de mantenimiento 2 (MCM2). Utilizando anticuerpos contra éstos, pueden evaluarse otros marcadores de proliferación clave o marcadores de linaje celular mediante ELISA, citometría de flujo, inmunohistoquímica, microscopía de fluorescencia y Western blot.
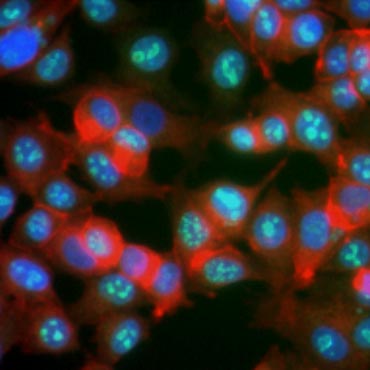
Fig. 6. Los anticuerpos contra Ki-67 identifican las células proliferantes. Tinción de células MCF-7 con anticuerpos humanos contra el Ki-67 (HCA006, verde) teñidos con faloidina (rojo) y Hoechst (azul).
6. Potencial de membrana y pH
Las células vivas mantienen activamente gradientes de iones a través de sus membranas, generando potenciales transmembrana. Cuando una célula muere, estos gradientes iónicos se interrumpen. Esto puede evaluarse utilizando tintes potenciométricos. El JC-1 es un colorante potenciométrico comúnmente utilizado. En las células sanas, el JC-1 se localiza en las mitocondrias, donde forma agregados fluorescentes rojos. Cuando se rompe el potencial de la membrana mitocondrial, el JC-1 se difunde por toda la célula y existe como monómero verde fluorescente. Los ésteres etílicos de tetrametilrhodamina (TMRE) y los ésteres metílicos de tetrametilrhodamina (TMRM), al igual que el JC-1, se localizan en las mitocondrias de las células sanas y en el citoplasma de las células moribundas. A diferencia del JC-1, estos colorantes no muestran un cambio en sus espectros de emisión. En cambio, la permeabilización de la membrana externa mitocondrial provoca una disminución de la fluorescencia roja de TMRM/TMRE.
Las células sanas son capaces de generar y mantener un pH bajo en los orgánulos ácidos de la célula, como el lisosoma. Esto puede medirse utilizando tinciones acidotrópicas como el naranja de acridina y el rojo neutro. Una consideración cuando se utiliza el naranja de acridina es que este colorante también se une al ADN y al ARN. Cuando se une a nucleótidos de una sola hebra, el naranja de acridina es fluorescente en rojo; cuando se une a ADN de doble hebra, es fluorescente en verde; y cuando se une a ADN en el lisosoma, es fluorescente en naranja.
Independientemente del método elegido, es de vital importancia incluir controles apropiados al realizar cualquiera de los ensayos descritos aquí, ya que las condiciones experimentales y el tipo de célula pueden alterar el rendimiento de algunos ensayos. Incluya siempre controles positivos y negativos. Cuando utilice sondas en disolventes, incluya también controles tratados con vehículo para tener en cuenta los efectos del disolvente. Utilice controles específicos de la aplicación para controlar factores como la autofluorescencia en experimentos de inmunofluorescencia y citometría de flujo y controles de carga para Western blotting.
Para obtener información sobre los ensayos de viabilidad y proliferación celular de Bio-Rad, visite nuestra página de la gama de salud celular.
Lea la Parte II Evaluación de la salud celular: Apoptosis
alamarBlue es una marca comercial de Trek Diagnostic Systems. DyLight es una marca comercial de Thermo Fisher Scientific.
Deja una respuesta