Combinación de Ledipasvir y Sofosbuvir para el tratamiento de la infección por el virus de la hepatitis C de genotipo 1: Revisión sistemática y metaanálisis | Annals of Hepatology
On enero 20, 2022 by adminIntroducción
Entre los aproximadamente 80 millones de individuos en el mundo con infección crónica por el virus de la hepatitis C (VHC), alrededor del 46% están infectados con el genotipo 1 del VHC, el más difícil de tratar con regímenes basados en interferón.1 Debido a la baja tasa de éxito del tratamiento y a los efectos secundarios esperados del interferón pegilado (PegIFN) y la ribavirina (RBV) para el tratamiento de los pacientes infectados por el VHC, se han realizado esfuerzos para desarrollar regímenes de tratamiento sin IFN.2,3
Los regímenes que contienen inhibidores de la proteasa (IP) para pacientes con infección por el genotipo 1 del VHC se introdujeron en 2011. Sin embargo, se han producido algunas interacciones farmacológicas asociadas a los regímenes que contienen IP y, además, deben utilizarse con PegIFN y tienen muchos efectos secundarios.4 El tratamiento de los pacientes con infección por el genotipo 1 del VHC se ha revolucionado con la introducción de los recientes agentes antivirales de acción directa (AAD), entre los que se incluyen Sofosbuvir (SOF), un inhibidor de la polimerasa NS5B del VHC análogo a los nucleótidos de uridina, y Ledipasvir (LDV), un inhibidor de la proteína NS5A codificada por el VHC.5,6 La mejor opción de tratamiento es la que presenta la mayor tasa de respuesta virológica sostenida (RVS) con mínimos efectos adversos en la menor duración del tratamiento. La combinación de SOF/LDV durante 12 ó 24 semanas, con o sin RBV, ha mejorado la tasa de RVS hasta un 95%-100% en pacientes sin tratamiento y con experiencia en IFN con infección por el genotipo 1 del VHC.7 Es necesario determinar la tasa exacta de RVS para el tratamiento con SOF/LDV en combinación con o sin RBV con una duración de 12 ó 24 semanas. Además, debe evaluarse el efecto de algunos factores como la cirrosis, los antecedentes de tratamiento y las sustituciones asociadas a la resistencia NS5A (RAS) en la tasa de RVS con el régimen mencionado.
Se llevó a cabo un metanálisis de los estudios actualmente disponibles con el objetivo de evaluar la eficacia antiviral del tratamiento combinado SOF/LDV durante 12 o 24 semanas con o sin RBV en pacientes con infección por el genotipo 1 del VHC.
Material y métodosRecursos de datos y estrategias de búsqueda
En este metanálisis, se realizaron búsquedas exhaustivas y sistemáticas en las bases de datos electrónicas, incluyendo PubMed, Scopus, Science Direct y Web of Science, utilizando estrategias de búsqueda adecuadas para cada base de datos. Las palabras clave de nuestras estrategias de búsqueda se centraron en los protocolos de tratamiento; SOF, LDV y sus alternativas apropiadas. Además, para encontrar cualquier posible literatura gris existente, realizamos una búsqueda en Google scholar y, tras encontrar títulos relacionados, continuamos nuestra búsqueda hasta encontrar 200 títulos seriados no relacionados. Además, también se buscaron las referencias de las publicaciones recuperadas para identificar cualquier posible publicación perdida en la búsqueda electrónica. Nuestra última búsqueda se realizó el 2 de septiembre de 2015 y no se consideró ninguna limitación de idioma. Se realizó una actualización en nuestra búsqueda el 16 de marzo de 2016.
Criterios de elegibilidad
Se incluyeron en este metaanálisis todos los trabajos que evaluaron el efecto del tratamiento combinado con SOF/LDV con o sin RBV durante 12 o 24 semanas sobre la RVS, 12 semanas después de la finalización del tratamiento (RVS12) entre los pacientes con infección por el genotipo 1 del VHC. Se incluyeron los estudios con los datos para el análisis por intención de tratar, de lo contrario se excluyó el trabajo. Se consideraron como criterios de exclusión los siguientes: pacientes en hemodiálisis, pacientes con antecedentes de tratamiento basado en SOF, pacientes con infección simultánea por el virus de la inmunodeficiencia humana (VIH), pacientes con cirrosis descompensada (Child-Pugh B y C8) y antecedentes de trasplante hepático o renal.
Selección de estudios, evaluación de la calidad y extracción de datos
En base a la guía PRISMA para la presentación de informes de revisiones sistemáticas,9 todos los artículos de los resultados de la búsqueda fueron revisados de forma independiente por dos personas (MSR-Z y KH) en cada nivel de cribado (título, resumen y texto completo). Al final de cada nivel de revisión, los desacuerdos entre estos dos autores se resolvieron mediante discusión mutua. Sin embargo, los desacuerdos restantes se resolvieron por consenso y discusión con otros colegas (BB, SMA y HS).
Se utilizó la herramienta de evaluación del riesgo de sesgo de Cochrane para la evaluación de la calidad de cada artículo incluido10 y se evaluaron los siguientes riesgos de sesgo: generación de secuencias aleatorias (sesgo de selección), ocultación de la asignación (sesgo de selección), cegamiento de los participantes y del personal (sesgo de desempeño), cegamiento de la evaluación de resultados (sesgo de detección), cointervenciones, datos de resultados incompletos (desgaste), información selectiva (sesgo de información), análisis por intención de tratar, similitud de los grupos al inicio del estudio, cumplimiento, momento de las evaluaciones de resultados y otros sesgos. Sobre la base de esta evaluación, cada riesgo de sesgo para cada artículo se calificó como alto, poco claro y bajo. Los riesgos altos y poco claros se calificaron como cero y el riesgo bajo como uno. Los artículos con una puntuación superior a 6 se clasificaron como estudios de bajo riesgo. De nuevo, cualquier diferencia o desacuerdo se resolvió mediante discusión mutua.
Se extrajeron los siguientes datos de los participantes de cada brazo de los estudios incluidos; sexo, genotipo del VHC, cirrosis, polimorfismos cerca de IFNL3 (rs12979860), antecedentes de tratamiento previo, duración del tratamiento, edad, índice de masa corporal (IMC) y nivel de ARN del VHC antes del tratamiento. Además, se recopilaron algunos datos de cada estudio, como el año de publicación, el tamaño de la muestra y el nombre del país.
Análisis de datos
El intervalo de confianza (IC) para la tasa de RVS en cada estudio se calculó según el método de Jeffreys y la cantidad media de los límites superior e inferior del IC se consideró una estimación puntual para la RVS.11 Se realizó la prueba de heterogeneidad mediante χ2 e I-cuadrado (rangos de 0% a 100%). El valor de p inferior a 0,1 se consideró estadísticamente significativo para χ2. Según el resultado de la prueba de heterogeneidad, se utilizaron modelos de efectos fijos o aleatorios para determinar la RVS12 agrupada, el intervalo de confianza del 95% y el valor P. Se aplicó el método de recorte y relleno para superar el posible sesgo de publicación existente.12 Se utilizó STATA 10 para realizar todas las partes del análisis de datos.
ResultadosSelección de estudios
Se identificó un total de 606 artículos mediante la búsqueda en la base de datos. Tras eliminar los duplicados, quedaron 459 trabajos para el cribado. La figura 1 muestra el número de trabajos en cada nivel de cribado. También se encontraron otros dos artículos mediante la actualización de la búsqueda. Se evaluó la elegibilidad de 20 de los artículos a texto completo y, finalmente, se incluyeron diez artículos en nuestra síntesis cuantitativa (metaanálisis).
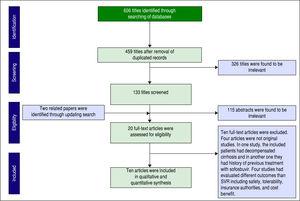
Selección de artículos en base a la declaración PRISMA.
Evaluación del riesgo de sesgo
Considerando la tabla 1, todos los estudios incluidos fueron categorizados como de bajo riesgo (con la toma de una puntuación superior a 7) y, por tanto, no se excluyó ningún estudio en base a la evaluación de la calidad.
Evaluación del riesgo de sesgo para los estudios incluidos.
| Primer autor (Referencia) | Generación aleatoria de la secuencia (Sesgo de selección) | Ocultación de la asignación (Sesgo de selección) | Cierre de participante y del personal (Sesgo de rendimiento) | Cierre de la evaluación de resultados (Sesgo de detección) | Datos de resultados incompletos (Desgaste) | Información selectiva (Sesgo de información) | Co-intervenciones | Análisis por intención de tratar | Similitud de grupos al inicio del estudio | Cumplimiento | Tiempo de las evaluaciones de resultados | Otros sesgos | Puntuación | Conclusión |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Afdhal, N.31 | ? | ? | + | + | – | – | – | – | – | – | – | – | 8 | Low |
| Afdhal, N. 7 | ? | ? | + | + | – | – | – | – | – | – | – | – | 8 | Low |
| Gane, E.J.13 | + | ? | + | + | – | – | – | – | – | – | – | – | 8 | Low |
| Lawitz, E.19 | – | – | + | + | – | – | – | + | – | – | – | – | 9 | Low |
| Kowdley, K.6 | ? | ? | + | + | – | – | – | – | – | – | – | – | 8 | Low |
| Bourliere, M.21 | – | – | – | – | – | – | – | + | – | – | – | – | 11 | Low |
| Mizokami, M.20 | – | – | + | + | – | – | – | – | – | – | – | – | 10 | Low |
| Stedman, C.A.M.14 | + | + | + | + | – | – | – | – | – | – | – | – | 8 | Low |
| Kohli, M.15 | ? | ? | + | + | – | – | – | – | – | – | – | – | 8 | Bajo |
| Chuang W.L.22 | ? | ? | + | + | – | – | – | – | – | – | – | – | 8 | Bajo |
Características de los estudios incluidos
En base al objetivo de este estudio, mostramos las características de cada brazo de los trabajos incluidos en la tabla 2 (combinación de SOF/LDV) y en la tabla 3 (combinación de SOF/ LDV/RBV).
Características de los estudios incluidos para la combinación de Sofosbuvir más Ledipasvir.
| Primer autor (referencia) | Historia del tratamiento previo | Año de publicación | País | Tamaño de la muestra | Edad media (DE o rango) | Género masculino (%) | Medio del IMC (DE o rango) | Duración del tratamiento (semanas) | Medio del ARN del VHC, Log IU/mL (SD) | Cirrosis (%) | rs12979860 CC/CT+TTa | Genotipo del VHC 1a/1bb |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Afdhal, N.31 | TE | 2014 | EEUU | 109 | 56 (24-67) | 74 (68) | 29 (19-47) | 12 | 6.5 (0,44) | 22 (20) | 0,1 | 3,73 |
| Afdhal, N.7 | TN | 2014 | USA | 214 | 52 (18-75) | 127 (59) | 27 (18-41) | 12 | 6.4 (0,69) | 34 (16) | 0,34 | 2,18 |
| Gane, E.J.13 | TE | 2014 | Nueva Zelanda | 10 | 61 (4,9) | 10 (100) | 31 (6.8) | 12 | 6,5 (0,6) | 10 (100) | 0,11 | 4 |
| Kowdley, K.6 | TN | 2014 | USA | 216 | 53 (20-71) | 128 (59) | 28 (19-45) | 12 | 6.4 (0,8) | 0 (0) | 0,35 | 3,9 |
| Lawitz, E.19 | TN | 2014 | EEUU | 19 | 46 (11,6) | 11 (58) | 28,1 (5.8) | 12 | 6,1 (0,8) | 0 (0) | 0,05 | 8,5 |
| Lawitz, E.19 | TE | 2014 | EEUU | 19 | 54 (6,6) | 15 (79) | 31,4 (4.7) | 12 | 6,3 (0,5) | 11 (58) | 0,11 | 18 |
| Kohli, A.15 | TN | 2015 | USA | 20 | 57 (8) | 14 (70) | 25 (4) | 12 | NA | hasta el 20% | 0.33 | 1,22 |
| Mizokami, M.20 | MIX | 2015 | Japón | 171 | 60 (9,2) | 69 (40) | 23,3 (3.6) | 12 | 6,6 (0,5) | 41 (24) | 1,011 | 0,042 |
| Chuang, W.L.22 | TN | 2016 | Taiwán | 42 | 54 (30-75) | 13 (31) | 24 (19-36) | 12 | 6.6 (0,68) | 5 (12) | 5 | 0,10 |
| Chuang, W.L.22 | TE | 2016 | Taiwán | 43 | 55 (33-7) | 23 (55) | 24 (20-30) | 12 | 6.6 (0,55) | 4 (9) | 1,26 | 0,16 |
| Afdhal, N.31 | TE | 2014 | EEUU | 109 | 56 (25-68) | 74 (68) | 28 (19-41) | 24 | 6.4 (0,57) | 22 (20) | 0,17 | 3,54 |
| Afdhal, N.7 | TN | 2014 | USA | 217 | 53 (22-80) | 139 (64) | 27 (18-48) | 24 | 6.3 (0,68) | 33 (15) | 0,31 | 2,14 |
| Bourliere, M.21 | TE | 2015 | Francia | 78 | 57 (10,7) | 56 (72) | 26,3 (4.2) | 24 | 6,5 (0,6) | 77 (100) | 0,08 | 1,85 |
Características de los estudios incluidos para la combinación de sofosbuvir más ledipasvir y ribavirina.
| Primer autor (referencia) | Historia del tratamiento previo | Año de publicación | País | Tamaño de la muestra | Edad media (DE o rango) | Género masculino (%) | Medio del IMC (DE o rango) | Duración del tratamiento (semanas) | Medio del ARN del VHC, Log IU/mL (SD) | Cirrosis (%) | rs12979860 CC/CT+TT* | Genotipo del VHC 1a/1b** |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Afdhal,N.31 | TE | 2014 | EEUU | 111 | 57 (27-75) | 71 (64) | 28 (19-45) | 12 | 6.4 (0,54) | 22 (20) | 0,11 | 3,82 |
| Afdhal,N.7 | TN | 2014 | USA | 217 | 52 (18-78) | 128 (59) | 27 (18-42) | 12 | 6.4 (0,64) | 33 (15) | 0,53 | 2,55 |
| Gane, E.J.13 | TN | 2014 | Nueva Zelanda | 25 | 45 (9,2) | 8 (32) | 25.2 (4,3) | 12 | 5,9 (0,9) | 0 (0) | 0,56 | 4 |
| Gane, E.J.13 | TE | 2014 | Nueva Zelanda | 9 | 50 (13) | 7 (78) | 25.6 (2,3) | 12 | 25,6 (2,3) | 0 (0) | 0 | 8 |
| Gane, E.J.13 | TE | 2014 | Nueva Zelanda | 9 | 57 (5,2) | 8 (89) | 27,3 (0.5) | 12 | 27,3 (0,5) | 9 (100) | 0,2 | 3,5 |
| Lawitz, E.19 | TE | 2014 | EEUU | 21 | 52 (9,8) | 14 (67) | 31,5 (7.3) | 12 | 6,2 (0,4) | 11 (52) | 0,05 | 3,2 |
| Mizokami, M.20 | MIX | 2015 | Japón | 170 | 59 (9,5) | 73 (43) | 23,3 (3.1) | 12 | 6,6 (0,5) | 35 (21) | 0,86 | 0,024 |
| Stedman, C.A.M.14 | MIX | 2015 | Nueva Zelanda | 14 | 54 (NA) | 12 (86) | 27 (34-20) | 12 | 6.5 (5,6-7,5) | 1 (7) | 0,4 | 2,5 |
| Bourliere, M.21 | TE | 2015 | Francia | 77 | 56 (7,4) | 58 (75) | 27,9 (5.5) | 12 | 6,5 (0,5) | 76 (98,7) | 0,05 | 1,71 |
| Afdhal, N.31 | TE | 2014 | EEUU | 111 | 55 (28-70) | 68 (61) | 29 (19-50) | 24 | 6.5 (0,60) | 22 (20) | 0,19 | 3,82 |
| Afdhal, N.7 | TN | 2014 | USA | 217 | 53 (24-77) | 119 (54) | 26 (18-48) | 24 | 6.3 (0,65) | 36 (17) | 0,5 | 2,01 |
Evaluación del resultado del tratamiento
Calculamos la RVS12 agrupada para cuatro regímenes de tratamiento del VHC, incluyendo 12 semanas de SOF/LDV (A), 24 semanas de SOF/LDV (B), 12 semanas de SOF/LDV/RBV (C) y 24 semanas de SOF/LDV/RBV (D). El resumen de los resultados de estos metanálisis se muestra en la tabla 4.
- –
Régimen de tratamiento A (12 semanas de sofosbuvir más ledipasvir). Se encontraron diez brazos en ocho estudios que evaluaron el régimen A (Tabla 2). Hubo una heterogeneidad significativa entre los resultados de los brazos del estudio (χ2 = 35,01, P Figura 2A). Tanto la prueba de Begg (P = 0,074) como la prueba de regresión lineal de Egger (P
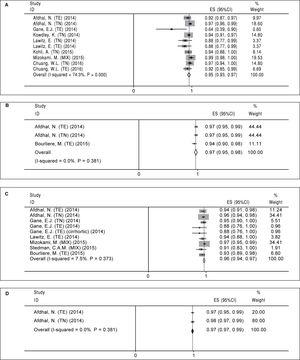 Figura 2.
Figura 2.RVS12 agrupada para el régimen de Sofosbuvir más Ledipasvir según la duración del tratamiento y la adición de Ribavirina. A. RVS12 agrupada para 12 semanas de tratamiento con sofosbuvir más ledipasvir. B. RVS12 agrupada para 24 semanas de tratamiento con sofosbuvir más ledipasvir. C. RVS12 agrupada durante 12 semanas de tratamiento con sofosbuvir más ledipasvir y ribavirina. D. RVS12 agrupada durante 24 semanas de tratamiento con sofosbuvir más ledipasvir y ribavirina. TE: experiencia en el tratamiento. TN: tratamiento naïve.
(0,39MB). - –
Régimen de tratamiento B (24 semanas de sofosbuvir más ledipasvir). Para el régimen de tratamiento B sólo se encontraron tres brazos en tres artículos (Tabla 2). No se encontró heterogeneidad significativa con respecto a los estudios relacionados con este régimen (χ2 = 1,92, P = 0,38, I-cuadrado = 0%). Según un modelo de efectos fijos, la RVS12 agrupada para el régimen B fue del 97% (IC del 95% = 95%-98%) (Figura 2B). Dado que el número de estudios incluidos fue pequeño (n = 3) no se realizaron pruebas relacionadas con el sesgo de publicación.
- –
Régimen de tratamiento C (12 semanas de sofosbuvir más ledipasvir y ribavirina). Se encontraron nueve brazos de estudio en siete artículos para este tipo de régimen (Tabla 3). Como no se encontró heterogeneidad significativa (χ2 = 8,64, P = 0,37, I-cuadrado = 7,5%), se utilizó el modelo de efectos fijos y se calculó que la RVS12 agrupada era del 96% (IC del 95% = 94%-97%) (Figura 2C). Hubo sesgo de publicación según las pruebas de Begg (p = 0,009) y de regresión lineal de Egger (p = 0,001). Según el método de recorte y relleno, la RVS12 agrupada se calculó en un 96% (IC del 95% = 94%-97%).
- –
Régimen de tratamiento D (24 semanas de sofosbuvir más ledipasvir y ribavirina). Como muestra la tabla 3, hubo dos brazos de estudio en dos artículos para este régimen. No hubo heterogeneidad significativa con respecto a los resultados de estos dos estudios (χ2 = 0,77, P = 0,38, I-cuadrado = 0%) y según el modelo de efectos fijos, la RVS12 agrupada se calculó en un 98% (IC del 95% = 97%-99%) (Figura 2D). Debido al escaso número de estudios incluidos (n = 2) no se pudieron realizar las pruebas relacionadas con el sesgo de publicación.
Resumen de los metanálisis de la tasa de respuesta virológica sostenida para la combinación de sofosbuvir y ledipasvir.
| Régimen | Uso de ribavirina | Duración del tratamiento (semanas) | Tasa de RVS (%) | 95%CI (%) |
|---|---|---|---|---|
| A | No | 12 | 95 | 93-97 |
| B | No | 24 | 97 | 95-98 |
| C | Sí | 12 | 96 | 94-97 |
| D | Sí | 24 | 98 | 97-99 |
Efecto de los parámetros basales en la respuesta virológica sostenida
- –
Cirrosis. En la mayoría de los brazos del estudio para estos cuatro regímenes de tratamiento mencionados, la totalidad de los pacientes eran cirróticos o no cirróticos y, por lo tanto, no pudimos realizar un metaanálisis de odds ratio (OR). Sin embargo, combinamos los datos de cada brazo relacionados con cada régimen de tratamiento y finalmente calculamos la OR para el efecto de la cirrosis en la RVS12 utilizando el método de Peto. Teniendo en cuenta la Figura 3A, sólo en el régimen de tratamiento A, la cirrosis tuvo un efecto significativo sobre la RVS12 (OR = 0,21, IC del 95% = 0,07-0,66).
 Figura 3.
Figura 3.Efecto de la cirrosis y de los antecedentes de tratamiento en la respuesta virológica sostenida para el régimen de sofosbuvir más ledipasvir. A. Efecto de la cirrosis en la respuesta virológica sostenida. B. Efecto de los antecedentes de tratamiento previo sobre la respuesta virológica sostenida.
(0.17MB). - –
Antecedentes de tratamiento previo. Se evaluó el efecto de los antecedentes de tratamiento en la RVS12. La figura 3B muestra los datos combinados relacionados con cada régimen de tratamiento y las OR (según el método de Peto) relacionadas con el efecto de los antecedentes de tratamiento. Según este análisis, los antecedentes de tratamiento no tuvieron un efecto significativo sobre la RVS12 en todos los regímenes.
- –
Sustituciones asociadas a la resistencia de NS5A. Los datos relativos a las SRA de NS5A se extrajeron de los estudios incluidos que evaluaron las SRA al inicio. Dado que los datos sobre esta cuestión no estaban disponibles para la evaluación de cada régimen (A, B, C y D), inevitablemente se investigó el efecto de las SRA en el régimen principal SOF/ LDV con o sin RBV durante 12 o 24 semanas. Los datos de tres artículos no se incluyeron en este análisis; Gane, et al.13 por añadir otra medicación (GS-9669) al régimen SOF/LDV en dos brazos del estudio, Stedman, et al.14 por no disponer de datos de evaluación de las SRA en la RV y Kohli, et al.15 por informar de datos inadecuados sobre el número de pacientes con RVS y SRA NS5A. Además, Kowdley y colaboradores6 evaluaron el efecto de SOF/LDV durante 8 semanas en un brazo de su estudio y, como no pudimos separar los datos informados sobre las SRA de NS5A y la RVS de este brazo, extrajimos todos los datos de este estudio y los incluimos en este metanálisis. Según la figura 4, los SRA de NS5A tuvieron un efecto reductor significativo sobre la RVS en el régimen SOF/LDV (OR = 0,31; IC del 95% = 0,2-0,5). No hubo heterogeneidad entre los resultados de los estudios con respecto a la detección de los SRA de NS5A al inicio y la respuesta al tratamiento. Además, según las pruebas de Begg (P = 0,65) y Egger (P = 0,67), no se encontró sesgo de publicación.
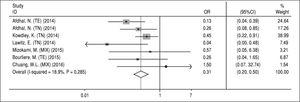 Figura 4.
Figura 4.Efecto de las sustituciones asociadas a la resistencia NS5A en la respuesta virológica sostenida para el régimen de sofosbuvir más ledipasvir.
(0,12MB).
Discusión
El actual meta-análisis mostró la alta eficacia de la terapia combinada SOF/LDV en pacientes con infección crónica por hepatitis C genotipo 1. El tratamiento estándar anterior para la infección por el genotipo 1 del VHC era PegIFN y RBV, con una tasa de RVS inferior al 60% en los pacientes con infección por el genotipo 1 del VHC, y el tratamiento iba acompañado de muchos efectos secundarios.16
El reconocimiento de las proteínas clave en el ciclo de replicación del VHC proporcionó la oportunidad de dirigirse a estas proteínas e inhibir la producción de viriones.17 Los regímenes de tratamiento del VHC han tenido una larga historia, desde los basados en IFN hasta los libres de IFN. Esto proporcionó un régimen de tratamiento con una alta tasa de RVS, una corta duración del tratamiento y un pequeño número de eventos adversos. El objetivo de disponer de un régimen de tratamiento sin IFN para la infección por el genotipo 1 del VHC se logró con la introducción y aprobación del régimen SOF/LDV en 2014.18
El SOF/LDV puede utilizarse con o sin RBV y en diferentes duraciones de tratamiento (12 o 24 semanas).7 Pueden considerarse algunos factores importantes para elegir el régimen adecuado, como la existencia de cirrosis y la contraindicación de la RBV. Sin embargo, el coste de este régimen es otro factor considerable para elegir la duración del tratamiento. Curiosamente, en el presente estudio, se ha demostrado que la RVS en todos los regímenes de 12 o 24 semanas con o sin RBV fue igual y superior al 95%, incluyendo; 95% para 12 semanas de tratamiento con SOF/LDV, 97% para 24 semanas de tratamiento con SOF/LDV, 96% para 12 semanas de tratamiento con SOF/LDV/RBV y 98% para 24 semanas de tratamiento con SOF/LDV/RBV. Es cierto que la adición de RBV a SOF/LDV o la prolongación de SOF/LDV a 24 semanas puede dar lugar a un ligero aumento de la RV12 del 95% al 96%; sin embargo, en el presente estudio, se observó que la cirrosis (Child-Pugh A) puede repercutir (OR = 0,21) en la RV12 sólo en el régimen de 12 semanas de tratamiento con SOF/LDV. En consecuencia, se recomienda tratar a los pacientes cirróticos (Child-Pugh A) con SOF/LDV/RBV durante 12 semanas o con SOF/LDV durante 24 semanas, basándose en la contraindicación de la RBV y el problema del precio, mientras que parece que el tratamiento de los pacientes no cirróticos con SOF/LDV durante 12 semanas es aceptable. En este metanálisis, se observó el impacto de los antecedentes de tratamiento (distintos de los regímenes basados en SOF) en el éxito del tratamiento en ninguno de los cuatro regímenes de SOF/LDV. Como resultado, no se recomienda la selección de la duración del tratamiento o la adición de RBV al régimen de SOF/LDV en función de los antecedentes de tratamiento previo con PegIFN/RBV o regímenes que contengan IP.
En este estudio, se recopilaron los datos para la evaluación del impacto de los SRA de NS5A de referencia en el éxito del tratamiento, sin embargo, en ninguno de estos estudios los datos para la evaluación de la resistencia se estratificaron con respecto al régimen de tratamiento. En consecuencia, se incluyeron en este metanálisis los datos de todos los brazos de cada estudio. Este meta-análisis encontró que las RASs de base del gen NS5A del VHC como parámetro impactaron en la tasa de respuesta al tratamiento. Cabe destacar que la mayoría de los pacientes con fracaso del tratamiento albergaban SRAs NS5A en el momento del fracaso del tratamiento, lo que demuestra el papel principal de los SRAs NS5A en el fracaso del tratamiento de los pacientes tratados con LDV.6,7,19-22 Sin embargo, la utilidad clínica de la evaluación de los SRA del NS5A antes de iniciar el tratamiento aún no está definida, tal vez debido a la elevada tasa de respuesta al tratamiento con SOF/LDV y a la muy baja especificidad de la evaluación de los SRA del NS5A para predecir el fracaso del tratamiento.
La introducción de otros AAD y regímenes sin IFN y su aprobación para el tratamiento de pacientes con infección por el genotipo 1 del VHC continuó tras la aprobación de SOF/LDV. En diciembre de 2014, se aprobó la combinación de Ombitas-vir/Paritaprevir-r/Dasabuvir (3 antivirales de acción directa; 3D) para la infección por el genotipo 1 del VHC con una eficacia superior al 95%.23 En enero de 2016, se aprobó la terapia combinada con Grazoprevir/Elbasvir (GZR/EBR) con una tasa de RVS cercana al 95%.24 Dado, SOF tiene metabolismo renal, este agente antiviral no puede administrarse en la enfermedad renal crónica (aclaramiento de creatinina 2) y el 3D y GZR/EBR son las alternativas para el tratamiento de los pacientes con enfermedad renal crónica e infección por el genotipo 1 del VHC.25,26 Además, otras combinaciones de AAD como SOF/Daclatasvir (27) y SOF/Velpatasvir28 han estado disponibles como regímenes de tratamiento pangenotípico.
En conclusión, el tratamiento del genotipo 1 del VHC con la combinación SOF/LDV da lugar a una respuesta al tratamiento elevada (≥ 95%). La decisión de añadir RBV a SOF/LDV y/o la prolongación de SOF/LDV puede tomarse en función de la presencia de cirrosis, la contraindicación de RBV y la cuestión del coste. Una mayor identificación de las personas infectadas por el VHC y un mayor acceso al tratamiento para ellas puede ayudar a la eliminación del VHC.29 El próximo objetivo en el campo del tratamiento del VHC es el desarrollo de nuevos regímenes terapéuticos para el VHC sin RBV con una prometedora respuesta al tratamiento del 100% y sin reacciones al fármaco.30
Agradecimientos
Contribución de los autores: Concepto y diseño del estudio: Mohammad Saeid Rezaee-Zavareh, Bita Behnava, Seyed Moayed Alavian y Heidar Sharafi; adquisición de datos: Mohammad Saeid Rezaee-Zavareh y Khashayar Hesa-mizadeh; análisis e interpretación de los datos: Mohammad Saeid Rezaee-Zavareh, Mohammad Gholami-Fesharaki y Heidar Sharafi; redacción del manuscrito: Mohammad Saeid Rezaee-Zavareh, Khashayar Hesamizadeh, Mohammad Gholami-Fesharaki y Heidar Sharafi; revisión crítica del manuscrito en busca de contenido intelectual importante: Bita Behnava y Seyed Moayed Alavian.
Declaración de intereses personales de los autores
Ninguno declarado.
Declaración de intereses de financiación
Ninguno declarado.
Deja una respuesta